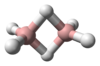أمونيا
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Ammonia[1]
| |||
| اسم أيوپاك النظامي
Azane | |||
| أسماء أخرى
نيتريد الهيدروجين
R-717, R717 (refrigerant) | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| مرجع بايلستاين | 3587154 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| رقم EC |
| ||
| مرجع Gmelin | 79 | ||
| KEGG | |||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 1005 | ||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | NH3 | ||
| كتلة مولية | 17.031 ج/مول | ||
| المظهر | Colourless gas | ||
| الرائحة | رائحة نفاذة قوية | ||
| الكثافة | 0.86 كج/م3 (1.013 بار عند نقطة الغليان) 0.769 كج/م3 (STP)[2] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 47% w/w (0 °C) 31% w/w (25 °C) 18% w/w (50 °C)[5] | ||
| قابلية الذوبان | قابل للذوبان في الكلوروفورم، الإثير، الإيثانول، الميثانول | ||
| ضغط البخار | 857.3 kPa | ||
| الحموضة (pKa) | 32.5 (−33 °س)،[6] 9.24 (الأمونيوم) | ||
| القاعدية (pKb) | 4.75 | ||
| القابلية المغناطيسية | −18.0·10−6 سم3/مول | ||
| معامل الانكسار (nD) | 1.3327 | ||
| اللزوجة |
| ||
| البنية | |||
| الشكل الجزيئي | هرم ثلاثي السطوح | ||
| Dipole moment | 1.42 د | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−46 ك.جول·مول−1[8] | ||
| Standard molar entropy S |
193 J·mol−1·K−1[8] | ||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 0414 (anhydrous) | ||
| ن.م.ع. مخطط تصويري |    
| ||
| ن.م.ع. كلمة الاشارة | Danger | ||
| H280, H314, H331, H410 | |||
| P260, P273, P280, P303+P361+P353, P304+P340+P311, P305+P351+P338+P310 | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 132 °C (270 °F; 405 K) | ||
| 651 °C (1،204 °F; 924 K) | |||
| حدود الانفجار | 15,0–33,6% | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
0.015 مل/كج (البشر، عن طريق الفم) | ||
LC50 (التركيز الأوسط)
|
40,300 ppm (الجرذان، 10 دقائق) 28,595 ppm (الجرذان، 20 دقيقة) 20,300 ppm (الجرذان، 40 دقيقة) 11,590 ppm (الجرذان، 1 ساعة) 7338 ppm (الجرذان، 1 ساعة) 4837 ppm (الجرذان، 1 ساعة) 9859 ppm (الفئران، 1 ساعة) 9859 ppm (القطط، 1 ساعة) 2000 ppm (الجرذان، 4 ساعة) 4230 ppm (الجرذان، 1 ساعة)[9] | ||
LCLo (المنشورة الأقل)
|
5000 ppm (الثدييات، 5 دقائق) 5000 ppm (البشر، 5 دقائق)[9] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH):[11] | |||
PEL (المسموح)
|
50 ppm (25 ppm ACGIH- TLV; 35 ppm STEL) | ||
REL (الموصى به)
|
TWA 25 ppm (18 mg/m3) ST 35 ppm (27 mg/m3) | ||
IDLH (خطر عاجل)
|
300 ppm | ||
| مركبات ذا علاقة | |||
كاتيونات أخرى
|
فوسفين Arsine Stibine Bismuthine | ||
هيدريدات النيتروجين ذات العلاقة
|
هيدرازين Hydrazoic acid | ||
مركـّبات ذات علاقة
|
هيدروكسيد الأمونيوم | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
النشادر كما يدعى أيضاً بـ الأمونياك أو الأمونيا هو غاز له الرمز الكيمائي لها NH3 وتحضر بتقطير الفحم او بعض المواد النيتروجينية وتستعمل عادة مادة التبريد الأمونياك في آلات ومصانع الثلج الكبيرة ولا تـُستعمل في الوقت الحاضر أبداً لأغراض تكييف الهواء كما كان يحدث قديماً. كهيدريد ثنائي ثابت، وأبسط هيدريد پنيكتوجين، الأمونيا هي غاز عديم اللون ذو رائحة نفاذة مميزة. من الناحية الحيوية، فهي عبارة عن نفايات نيتروجينية شائعة، لا سيما تلك الناتجة عن العضيات المائية، وتساهم بشكل كبير في الاحتياجات الغذائية للعضيات البرية من خلال مادة طليعية لـ45% من أغذية[12] وأسمدة العالم. يستخدم حوالي 70% من الأمونيا لصنع الأسمدة[13] بأشكال وتركيبات مختلفة، مثل اليوريا وثنائي فوسفات الأمونيوم. كما تضاف الأمونيا في شكلها النقي مباشرة إلى التربة.
الأمونيا، بشكل مباشر أو غير مباشر، هي أيضًا لبنة لصناعة العديد من المنتجات الصيدلانية وتستخدم في العديد من منتجات التنظيف التجارية. تُجمع بشكل أساسي عن طريق الإزاحة الهبوطية لكل من الهواء والماء.
على الرغم من شيوعها في الطبيعة - سواء على الأرض أو في كواكب المجموعة الشمسية الأخرى- وفي الاستخدام الموسع، فإن الأمونيا هي في نفس الوقت مادة كاوية وخطرة في شكلها المركز. تُصنف الأمونيا في العديد من البلدان كمادة شديدة الخطورة، وتخضع لمتطلبات الإبلاغ الصارمة من قبل المنشآت التي تنتجها أو تخزنها أو تستخدمها بكميات كبيرة.[14]
عام 2018، بلغ الإنتاج الصناعي العالمي من الأمونيا 175 مليون طن،[15] مع عدم وجود تغير كبير بالنسبة للإنتاج الصناعي العالمي لعام 2013 البالغ 175 مليون طن.[16] عام 2021 كان الإنتاج العالمي من الأمونيا 235 مليون طن.[17][18] تُباع الأمونيا الصناعية إما على شكل محلول (عادة 28% أمونيا في الماء) أو أمونيا سائلة لا مائية مضغوطة أو مبردة تُنقل في عربات أو أسطوانات صهريجية.[19]
لأسباب أساسية، فإن إنتاج الأمونيا من عنصري الهيدروجين والنيتروجين أمر صعب، ويتطلب ضغطًا ودرجة حرارة عالية. في بداية القرن العشرين، اخترعت عملية هابر التي أتاحت إمكانية الإنتاج الصناعي للأمونيا، مما أحدث ثورة في الزراعة.
تبلغ نقطة غليان الأمونيا 33.34 °م عند ضغط 1 وحدة جوية، لذلك يجب تخزين السائل تحت ضغط أو عند درجة حرارة منخفضة. الأمونيا المنزلية أو هيدروكسيد الأمونيوم عبارة عن محلول أمنيا ذائب في الماء. يقاس تركيز هذه المحاليل بوحدات مقياس بوميه (الكثافة)، حيث يكون التركيز التجاري النموذجي للمحلول عند قياس 26 درجة بوميه (حوالي 30% من الأمونيا بحسب الوزن عند درجة حرارة 15.5 °س).[20]
التسمية
في الجزء الحادي والثلاثين من كتابه التاريخ الطبيعي، أشار پلني إلى ملح يسمى hammoniacum، الذي سمي بهذا الاسم لقربه من معبد جوپيتر آمون (باليونانية Ἄμμων آمون) في مقاطعة برقة الرومانية.[21] ومع ذلك، فإن الوصف الذي يقدمه پلني للملح لا يتوافق مع خصائص كلوريد الأمونيوم. وفقًا لتعليق هربرت هوڤر في ترجمته الإنجليزية لكتاب "De re metallica" لجورجيوس أگريكولا، فمن المحتمل أن يكون ملح البحر الشائع.[22] على أي حال ، أعطى هذا الملح اسم "الأمونيا" والأمونيوم للمركبات. جمع الزوار الرومان لمعبد آمون في واحة سيوة مادة بلورية بيضاء من السقف والجدران بسبب ملوثات مختلفة. كان هذا الملح البلوري الأبيض يسمى "ملح آمون" (ملح النشادر). لاحظ جوسف پريستلي أنه عندما يتفاعل هذا الملح مع الجير، ينطلق بخار أطلق عليه اسم الأمونيا.[23]
التواجد الطبيعي
الأمونيا هي مادة كيميائية توجد بكميات ضئيلة على الأرض، وتُنتج من مادة نيتروجينية حيوانية ونباتية. عُثر على الأمونيا وأملاح الأمونيوم أيضًا بكميات صغيرة في مياه الأمطار، بينما يوجد كلوريد الأمونيوم (ملح النشادر) وكبريتات الأمونيوم في المناطق البركانية. عُثر على بلورات بيكربونات الأمونيوم في ذرق پتاگونيا.[24]
توجد الأمونيا أيضًا في جميع أنحاء النظام الشمسي على المريخ والمشتري وزحل وأورانوس ونپتون وپلوتو، من بين أماكن أخرى: على أجرام جليدية أصغر مثل پلوتو، يمكن أن تعمل الأمونيا كمضاد تجمد هام من الناحية الجيولوجية، حيث يمكن أن يكون لمزيج الماء والأمونيا نقطة انصهار تصل إلى -100°س إذ أن تركيز الأمونيا يكون مرتفع بدرجة كافية، وبالتالي يسمح لمثل هذه الأجسام بالاحتفاظ بالمحيطات الداخلية والجيولوجيا النشطة عند درجة حرارة أقل بكثير مما يمكن أن يكون ممكنًا مع الماء وحده.[25][26] المواد التي تحتوي على الأمونيا، أو تلك التي تشبهها، تسمى "ammoniacal".
الخصائص
الأمونيا هو غاز عديم اللون يمتيز برائحته النفاذة. وهو أخف من الهواء، وتبلغ كثافته 0.589 ضعف كثافة الهواء. يتم تسييله بسهولة بسبب الرابطة الهيدروجينية القوية بين الجزيئات. تتحول الأمونيا الغازية إلى سائل عديم اللون والذي يغلي عند -33.1°س، ويتجمد إلى بلورات عديمة اللون[24] عند −77.7 °س. تتوفر القليل من البيانات عن الأمونيا في درجات حرارة وضغوط عالية جدًا، مثل الظروف فوق الحرجة.[27]
الحالة الصلبة
التناظر البلوري للأمونيا يكون مكعب، رمز پيرسون cP16، الزمرة الفراغية P213 رقم 198، ثابت الشبكة البلورية 0.5125 ن.م..[28]
الأمونيا السائلة
تتمتع الأمونيا السائلة بقوى ايونية قوية تعكس ثابت العزل الكهربي (ε) المرتفع الذي يبلغ 22. لدى الأمونيا السائلة نسبة عالية جدًا من تغير المحتوى الحراري القياسي للتبخر (23.35 كيلوجول/مول، مقارنة بالماء 40 كيلوجول/مول، الميثان 8.19 كيلوجول/مول، الفوسفين 14.6 كيلوجول/مول) ومن ثم يمكن استخدامها في المعامل داخل أوعية غير معزولة بدون تبريد إضافي. راجع الأمونيا السائلة كمذيب.
خصائص المذيب
تنحل الأمونيا بسهولة في الماء في المحلول المائي، يمكن التخلص من الأمونيا بالغليان. المحلول المائي للأمونيا هو محلول قاعدي. أقصى تركيز للأمونيا في الماء (محلول مشبع) تبلغ كثافته 0.880 كم/سم³ وعادة ما يُعرف باسم '.880 أمونيا'.
الانحلال
عند درجة حرارة عالية وفي وجود محفز مناسب أو في وعاء مضغوط بحجم ثابت ودرجة حرارة عالية (على سبيل المثال 1.100 ° م)، تنحل الأمونيا إلى عناصرها المكونة.[29] انحلال الأمونيا هو عملية ماصة للحرارة قليلاً تتطلب 23 كيلو جول/مول (5.5 كيلو كالوري/مول) من الأمونيا، وتنتج الهيدروجين والنيتروجين. يمكن أيضًا استخدام الأمونيا كمصدر للهيدروجين في خلايا الوقود الحمضية إذا كان من الممكن إزالة الأمونيا غير المتفاعلة. وُجد أن محفزات الروثينيوم والپلاتين هي الأكثر نشاط، بينما كانت المحفزات المدعومة بالنيكل أقل نشاطًا.
"الأمونيا الخضراء" هو اسم للأمونيا المنتجة من الهيدروجين الذي ينتج بدوره من مصادر خالية من الكربون مثل التحليل الكهربائي للماء. يمكن استخدام الأمونيا من هذا المصدر كوقود سائل لا يؤثر على التغير المناخي العالمي.
جدول للخصائص الحرارية والفيزيائية للأمونيا السائلة المشبعة:[30][31]
| درجة الحرارة (°س) | الكثافة (كج/م³) | الحرارة النوعية (kJ/(kg·K)) | اللزوجة التحريكية (م²/ث) | الموصلية الحرارية (W/(m·K)) | الانتشارية الحرارية (م²/ث) | عدد پرانتل | معامل الحجم (K-1) |
| -50 | 703.69 | 4.463 | 4.35×10−7 | 0.547 | 1.74×10−7 | 2.6 | |
| -40 | 691.68 | 4.467 | 4.06×10−7 | 0.547 | 1.78×10−7 | 2.28 | |
| -30 | 679.34 | 4.476 | 3.87×10−7 | 0.549 | 1.80×10−7 | 2.15 | |
| -20 | 666.69 | 4.509 | 3.81×10−7 | 0.547 | 1.82×10−7 | 2.09 | |
| -10 | 653.55 | 4.564 | 3.78×10−7 | 0.543 | 1.83×10−7 | 2.07 | |
| 0 | 640.1 | 4.635 | 3.73×10−7 | 0.54 | 1.82×10−7 | 2.05 | |
| 10 | 626.16 | 4.714 | 3.68×10−7 | 0.531 | 1.80×10−7 | 2.04 | |
| 20 | 611.75 | 4.798 | 3.59×10−7 | 0.521 | 1.78×10−7 | 2.02 | 2.45×10−3 |
| 30 | 596.37 | 4.89 | 3.49×10−7 | 0.507 | 1.74×10−7 | 2.01 | |
| 40 | 580.99 | 4.999 | 3.40×10−7 | 0.493 | 1.70×10−7 | 2 | |
| 50 | 564.33 | 5.116 | 3.30×10−7 | 0.476 | 1.65×10−7 | 1.99 |
جدول الخصائص الحرارية والطبيعية للأمونيا (NH
3) عند ضغط الغلاف الجوي:[30][31]
| درجة الحرارة (K) | الكثافة (كج/م³) | الحرارة النوعية (kJ/(kg·K)) | اللزوجة الديناميكية (كج/(م·ث)) | اللزوجة التحريكية (م²/ث) | الموصلية الحرارية (W/(m·K)) | الانتشارية الحرارية (مث/s) | عدد پرانتل |
| 273 | 0.7929 | 2.177 | 9.35×10−6 | 1.18×10−5 | 0.022 | 1.31×10−5 | 0.9 |
| 323 | 0.6487 | 2.177 | 1.10×10−5 | 1.70×10−5 | 0.027 | 1.92×10−5 | 0.88 |
| 373 | 0.559 | 2.236 | 1.29×10−5 | 1.30×10−5 | 0.0327 | 2.62×10−5 | 0.87 |
| 423 | 0.4934 | 2.315 | 1.47×10−5 | 2.97×10−5 | 0.0391 | 3.43×10−5 | 0.87 |
| 473 | 0.4405 | 2.395 | 1.65×10−5 | 3.74×10−5 | 0.0467 | 4.42×10−5 | 0.84 |
| 480 | 0.4273 | 2.43 | 1.67×10−5 | 3.90×10−5 | 0.0492 | 4.74×10−5 | 0.822 |
| 500 | 0.4101 | 2.467 | 1.73×10−5 | 4.22×10−5 | 0.0525 | 5.19×10−5 | 0.813 |
| 520 | 0.3942 | 2.504 | 1.80×10−5 | 4.57×10−5 | 0.0545 | 5.52×10−5 | 0.827 |
| 540 | 0.3795 | 2.54 | 1.87×10−5 | 4.91×10−5 | 0.0575 | 5.97×10−5 | 0.824 |
| 560 | 0.3708 | 2.577 | 1.93×10−5 | 5.20×10−6 | 0.0606 | 6.34×10−5 | 0.827 |
| 580 | 0.3533 | 2.613 | 2.00×10−5 | 5.65×10−5 | 0.0638 | 6.91×10−5 | 0.817 |
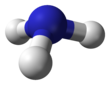
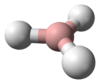
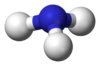
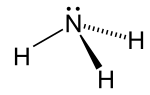
البنية
يتميز جزيء الأمونيا بشكله الهرمي ثلاثي الزوايا كما تنبأت به نظرية تنافر أزواج إلكترونات غلاف التكافؤ (نظرية VSEPR) بزاوية رابطة محددة تجريبياً قدرها 106.7°.[32] تحتوي ذرة النيتروجين المركزية على خمسة إلكترونات خارجية مع إلكترون إضافي من كل ذرة هيدروجين. هذا يعطي ما مجموعه ثمانية إلكترونات، أو أربعة أزواج إلكترونية مرتبة رباعي الأسطح. ثلاثة من أزواج الإلكترون هذه تُستخدم كأزواج روابط، مما يترك زوج غير رابط من الإلكترونات. يتنافر الزوج الغير رابط بقوة أكبر من الأزواج الرابطة، وبالتالي فإن زاوية الرابطة ليست 109.5 °، كما هو متوقع لترتيب رباعي الاسطح منتظم، ولكن 106.8 °.[32] يعطي هذا الشكل الجزيء لحظة ثنائي القطب ويجعله جزيء قطبي. إن قطبية الجزيء ، وخاصة قدرته على تكوين الرابطة الهيدروجينية مما يجعل الأمونيا شديدة الامتزاج بالماء. يجعل الزوج الغير رابط الأمونيا قاعدة، متقبلة للپروتون. الأمونيا قاعيدة بشكل معتدل؛ محلول مائي يبلغ أسمه الهيدروجيني = 11.6، وإذا أضيف حمض قوي إلى مثل هذا المحلول حتى يصبح المحلول متعادلًا (الأس الهيدروجيني = 7)، 99.4٪ من جزيئات الأمونيا هي پروتونات. تؤثر درجة الحرارة والملوحة أيضًا على نسبة الأمونيوم [NH
4]+
. لهذا الأخير شكل رباعي الأسطح المنتظم وهو متساوي إلكترونياً مع الميثان.
يخضع جزيء الأمونيا بسهولة للانعكاس النيتروجيني في درجة حرارة الغرفة؛ ما يشبه المظلة المقلوبة رأسا على عقب تحت الريح القوية. حاجز الطاقة لهذا الانعكاس هي 24.7 كيلوجول/مول، وتردد الرنين هو 23.79 جيجاجرتز، المقابلة لإشعاع الميكروويف بطول موجي 1.260 سم. كان الامتصاص عند هذا التردد هو أول طيف ميكروويف يتم رصده[33] واستخدم في أول ميزر.
التذبذب (الأمفوتيرية)
من أكثر الخصائص المميزة للأمونيا القاعدية. تعتبر الأمونيا قاعدة ضعيفة. تتحد مع الأحماض لتشكيل ملح الأمونيوم؛ ومع حمض الهيدروكلوريك لتشكل [[كلوريد الأمونيوم]؛ ومع حمض النيتريك، نترات الأمونيوم، إلخ. لن يتحد غاز الأمونيا الجاف تمامًا مع كلوريد الهيدروجين الجاف تمامًا؛ الرطوبة ضرورية لإحداث التفاعل.[34][35]
كتجربة توضيحية تحت الهواء مع الرطوبة المحيطة، تنتج الزجاجات المفتوحة من الأمونيا المركزة وحمض الهيدروكلوريك سحابة من كلوريد الأمونيوم، والتي تبدو وكأنها "من لا شيء" على شكل رذاذ الملح حيث تلتقي السحب المنتشرة من الكواشف بين الزجاجتين.
- NH
3 + HCl → [NH
4]Cl
تنتج الأملاح بتفاعل الأمونية على الأحماض المعروفة بأملاح الأمونيوم والتي تحتوي جميعها على أيون الأمونيوم ([NH
4]+
).[34]
على الرغم من أن الأمونيا معروفة كقاعدة ضعيفة، إلا أنها يمكن أن تعمل أيضًا كحمض ضعيف للغاية. وهي مادة پروتينية وقادرة على تكوين الأميدات (التي تحتوي على أيون NH−
2). على سبيل المثال ، يذوب الليثيوم في الأمونيا السائلة لتكوين محلول أزرق (الإلكترون المنحل) من أميد الليثيوم:
- 2 Li + 2 NH
3 → 2 LiNH
2 + H
2
الانحلال الذاتي
مثل الماء، تخضع الأمونيا السائلة للتأين الذاتي الجزيئي لتشكيل مرافقات حمضية وقاعدية:
- 2 NH
3 ⇌ NH+
4 + NH−
2
غالبًا ما تعمل الأمونيا كقاعدة ضعيفة، تتمتع ببعض القدرة التنظيمية. ستؤدي التحولات في الأس الهيدروجيني إلى وجود عدد أكبر أو أقل من كاتيونات الأمونيوم (NH+
4) و الأنيونات الأميدية (NH−
2) الموجود في المحلول. عند الضغط ودرجة الحرارة القياسية،
- K = [NH+
4] × [NH−
2] = 10−30.
الاحتراق
لا تحترق الأمونيا بسهولة ولا تحافظ على الاحتراق، إلا في ظل مزيج محدود من الوقود إلى الهواء بنسبة 15-25% من الهواء من حيث الحجم.[36] عند مزجها مع الأكسجين، تحترق الأمونيا بلهب أخضر مصفر شاحب. يحدث الاشتعال عندما ينتقل الكلور إلى الأمونيا مكونًا النيتروجين وكلوريد الهيدروجين؛ في حالة وجود الكلور بكميات زائدة، يتم أيضًا تكوين مادة ثلاثي كلوريد النيتروجين (NCl
3) شديدة الانفجار.
احتراق الأمونيا لتكوين النيتروجين والماء هو تفاعل طارد للحرارة:
- 4 NH
3 + 3 O
2 → 2 N
2 + 6 H
2O(g)، ΔH°r = −1267.20 kJ (أو −316.8 كيلوجول/مول معبراً عنه لكل مول NH
3)
تغير المحتوى الحراري القياسي للاحتراق، ΔH°c، معبراً عنه لكل مول من الأمونيا مع تكثف الماء المتتكون، هو −382.81 كيلوجول/مول.
إزالة النتيتروجين هو المنتج الديناميكي الحراري للاحتراق: جميع أكاسيد النيتروجين تكون غير مستقر بالنسبة إلى N
2 وO
2، وهو المبدأ الكامن وراء المحولات التحفيزية. يمكن تكوين أكاسيد النيتروجين على شكل نواتج حركية في وجود محفزات مناسبة، وهو تفاعل ذو أهمية صناعية كبيرة في إنتاج حمض النيتريك:
- 4 NH
3 + 5 O
2 → 4 NO + 6 H
2O
يؤدي التفاعل اللاحق إلى NO
2:
- 2 NO + O
2 → 2 NO
2
يعد احتراق الأمونيا في الهواء أمرًا صعبًا للغاية في حالة عدم وجود محفز (مثل شاش الپلاتين أو شاش أكسيد الكروم الثلاثي الدافئ)، بسبب الانخفاض النسبي لحرارة الاحتراق، وسرعة الاحتراق الرقائقية المنخفضة، وارتفاع درجة حرارة الاشتعال الذاتي، وارتفاع حرارة التبخر، ونطاق القابلية للاشتعال. مع ذلك، فقد أظهرت الدراسات الحديثة أن الاحتراق الفعال والمستقر للأمونيا يمكن تحقيقه باستخدام أجهزة الاحتراق الدوامة، وبالتالي إحياء الاهتمام البحثي بالأمونيا كوقود لإنتاج الطاقة الحرارية.[37]
تتراوح نسبة الأمونيا القابلة للاشتعال في الهواء الجاف من 15.15 إلى 27.35٪ وفي الهواء الرطب نسبياً بنسبة 100٪ يتراوح بين 15.95 و26.55٪.[38]قالب:Cln
لدراسة حركية احتراق الأمونيا، يلزم معرفة آلية تفاعل موثوقة ومفصلة، لكن الحصول على هذا كان أمرًا صعبًا.[39]
تكوين مركبات أخرى
الأمونيا هي مركب طليعي مباشر أو غير مباشر لمعظم المركبات المصنعة المحتوية على النيتروجين.
في الكيمياء العضوية، يمكن أن تعمل الأمونيا باعتبارها محبة النواة في تفاعلات الاستبدال. يمكن تكوين أمين عن طريق تفاعل الأمونيا مع هاليد الألكيل أو مع الكحول. مجموعة NH
2 الناتجة هي أيضًا محبة للنواة، لذلك غالبًا ما تتكون الأمينات الثانوية والثالثية. عندما يكون هذا الاستبدال المتعدد غير مرغوب فيه، فإن فائض الأمونيا يساعد في تقليله. على سبيل المثال، يُحضر الميثيل أمين عن طريق تفاعل الأمونيا مع الكلوروميثان أو مع الميثانول. في كلتا الحالتين، يُنتج ثنائي الميثيل أمين وثلاثي الميثيل أمين بشكل مشترك. يُحضر الإيثانول أمين عن طريق تفاعل فتح الحلقة مع أكسيد الإيثيلين، وعندما يُسمح للتفاعل بالمضي قدمًا فإنه ينتج ثنائي الإيثانول أمين وثلاثي الإيثانول أمين. استخدم تفاعل الأمونيا مع حمض 2-بروموبروبانويك لتحضير ألانين راسيمي في yield 70٪.
يمكن تحضير الأميدات بتفاعل الأمونيا مع مشتقات حمض الكربوكسيل. على سبيل المثال، تتفاعل الأمونيا مع حمض الفورميك (HCOOH) لإنتاج الفورماميد (HCONH
2) عند تسخينها. كلوريدات الأسيل هي الأكثر تفاعلًا، لكن يجب أن تكون الأمونيا موجودة في زيادة مضاعفة على الأقل لتحييد كلوريد الهيدروجين المتكون. تتفاعل الإسترات والأنهيدريدات أيضًا مع الأمونيا لتكوين الأميدات. يمكن لأملاح الأمونيوم للأحماض الكربوكسيلية المجففة أن تتحول إلى أميدات بالتسخين إلى 150-200 درجة مئوية طالما لا توجد مجموعات حساسة حراريًا.
الهيدروجين في الأمونيا عرضة للاستبدال بعدد لا يحصى من البدائل. عندما يسخن غاز الأمونيا الجاف باستخدام معدن الصوديوم فإنه يتحول إلى سوداميد، NaNH
2.[34] مع الكلور، يتشمل الكلور أحادي الأمين.
تُعرف الأمونيا خماسية التكافؤ باسم λ5-أمين، أو الاسم الأكثر شهرة، هيدريد الأمونيوم [NH
4]+
H−
. هذه المادة الصلبة البلورية تكون مستقرة فقط تحت ضغط مرتفع وتتحلل مرة أخرى إلى أمونيا ثلاثية التكافؤ (λ3-amine) وغاز الهيدروجين في الظروف العادية. عام 1966 اختبرت هذه المادة مرة واحدة كوقود صاروخي صلب محتمل.[40]
الأمونيا كربيطة
يمكن أن تعمل الأمونيا كربيطة في المعقدات التناسقية الفلزية الانتقالية. وهي متبرع-σ خالص، في منتصف سلسلة الطيف الكيميائي، ويظهر سلوك صلب-لين متوسط (انظر أيضًا نموذج ECW). يمكن توضيح القوة النسبية للمانح تجاه سلسلة من الأحماض، مقابل قواعد لويس الأخرى، من خلال مخططات C-B.[41][42] لأسباب تاريخية، سُميت الأمونيا أمين في نظام تسمية المعقدات التساندية. ومن أشهر معقدات الأمين tetraamminediaquacopper(II) ([Cu(NH
3)
4(H
2O)
2]2+)، معقد أزرق داكن يتشكل بإضافة الأمونيا لمحلول أملاح النحاس الثنائية. يُعرف هيدروكسيد Tetraamminediaquacopper(II) باسم كاشف شڤايزر، وتتمتع بقدرة ملحوظة على حل السليولوز. Diamminesilver(I) ([Ag(NH
3)
2]+
)
هي نوع نشط في كاشف تولنس. يمكن أن يساعد تكوين هذا المركب أيضًا في التمييز بين رواسب هاليدات الفضة المختلفة: كلوريد الفضة (AgCl) قابل للذوبان في محلول الأمونيا المخفف (2 M)، بروميد الفضة (AgBr) قابل للذوبان فقط في محلول الأمونيا المركز، بينما يوديد الفضة (AgI) غير قابل للذوبان في الأمونيا المائية.
في أواخر القرن التاسع عشر عُرِفَت مجمعات الأمين من الكروم(الثلاثي)، وشكلت أساس نظرية ألفرد ڤرنر الثورية حول بنية المركبات التساندية. لاحظ ڤرنرأنه يمكن تكوين اثنين فقط من المتزامرات (fac- and mer-) للمركب [CrCl
3(NH
3)
3]، وخلص إلى أن الربيطات يجب أن يتم ترتيبها حول أيون الفلز عند رؤوس من ثماني الأسطح. تأكد هذا الاقتراح منذ ذلك الحين بواسطة دراسة البلورات بالأشعة السينية.
تعتبر ربيطة الأمين المرتبطة بأيون فلزي أكثر حمضية بشكل ملحوظ من جزيء الأمونيا الحر، على الرغم من أن نزع الپروتون في محلول مائي لا يزال نادرًا. أحد الأمثلة على ذلك هو تفاعل كلوريد الزئبق الثنائي مع الأمونيا (تفاعل كالوميل) حيث يكون الناتج أميدوكلوريد الزئبق الغير قابل للذوبان بدرجة كبيرة.
- HgCl
2 + 2 NH
3 → HgCl(NH
2) + [NH
4]Cl
تشكل الأمونيا 1:1 نواتج إضافة مع مجموعة متنوعة من أحماض لويس مثل I
2، الفينول، وAl(CH
3)
3. الأمونية هي قاعدة صلبة (HSAB theory) ومتغيراتE & C الخاصة بها هيEB = 2.31 و CB = 2.04. يمكن توضيح قوتها كمانح نسبي تجاه سلسلة من الأحماض، مقابل قواعد لويس الأخرى بواسطة خرائط C-B.
الكشف والتحكم
الأمونيا في المحاليل
يمكن الكشف عن أملاح الأمونيا والأمونيوم بسهولة، بآثار دقيقة جدًا، عن طريق إضافة محلول نسلر، الذي يعطي لونًا أصفر مميزًا في وجود أقل أثر للأمونيا أو أملاح الأمونيوم. يمكن تقدير كمية الأمونيا في أملاح الأمونيوم كميًا عن طريق تقطير الأملاح باستخدام لصوديوم (هيدروكسيد الصوديوم) أو هيدروكسيد البوتاسيوم (KOH)، حيث يتم امتصاص الأمونيا المتصاعدة في حجم معروف من معيار حمض الكبريتيك والحمض الزائد يتم تحديدهما بعد ذلك حجمياً؛ أو يمكن امتصاص الأمونيا في حمض الهيدروكلوريك وكلوريد الأمونيوم المتشكل على هذا النحو يترسب في سداسي كلورو پلاتينات الأمونيوم، [NH
4]
2[PtCl
6].[43]
الأمونيا الغازية
يتم حرق عصي الكبريت لاكتشاف التسربات الصغيرة في أنظمة تبريد الأمونيا الصناعية. يمكن الكشف عن الكميات الأكبر عن طريق تسخين الأملاح بقلويات كاوية أو باستخدام الجير الحي، حيث تظهر الرائحة المميزة للأمونيا في الحال.[43] الأمونيا هي مادة مهيجة ويزداد ذلك مع التركيز. حد التعرض المسموح به هو 25 ppm؛ حد التعرض المميت أعلى من 500 ppm.[44]قالب:Cln يُكشف عن التركيزات الأعلى بالكاد بواسطة أجهزة الكشف التقليدية، يتم اختيار نوع الكاشف وفقًا للحساسية المطلوبة (على سبيل المثال، أشباه الموصلات، المحفزات، المواد الكهروكيميائية). اقترحت أجهزة استشعار ثلاثية الأبعاد للكشف عن التركيزات التي تصل إلى 12.5٪ في الحجم.[45]
النيتروجين النشادري (NH3-N)
النيتروجين النشادري (NH3-N) هو مقياس شائع الاستخدام لاختبار كمية أيونات الأمونيوم، المشتقة بشكل طبيعي من الأمونيا، وإعادتها إلى أمونيا عبر العمليات العضوية، في الماء أو سوائل الفضلات. وهو مقياس يستخدم بشكل أساسي لتحديد القيم في أنظمة معالجة النفايات وتنقية المياه، فضلاً عن قياس صحة احتياطيات المياه الطبيعية والمياه الاصطناعية. يقاس النيتروجين النشادري بوحدات مليجرام/لتر (مليجرام لكل لتر).
التاريخ


ذكر المؤرخ اليوناني القديم هيرودوت أنه كان هناك منكشفات صخرية ملحية في إحدى مناطق ليبيا كان يسكنها شعب يُدعى "العمونيون" (واحة سيوة في شمال غرب مصر حالياً، حيث لا تزال بحيرات الملح موجودة).[46][47] كما أشار الجغرافي اليوناني سترابو إلى وجود الملح في هذه المنطقة. ومع ذلك، وصف المؤلفون القدامى ديوسقوريدس، أپيشيوس، آريانوس، سينيسيوس، وآيتوس الأميدي هذا الملح بأنه يشكل بلورات صافية يمكن أن تستخدم في الطهي والتي كانت في الأساس ملح صخري.[48] ظهر Hammoniacus sal في كتابات پلني،[49] على الرغم من أنه من غير المعروف ما إذا كان المصطلح متطابقًا مع مصطلح sal ammoniac الأكثر حداثة (كلوريد الأمونيوم).[24][50][51]
تخمر البول بواسطة البكتيريا ينتج محلول الأمونيا؛ ومن ثم فقد استخدم البول المخمر في العصور القديمة لغسل الملابس والأنسجة، وإزالة الشعر من الجلود استعدادًا للدباغة، ولتكون بمثابة مرسخ لوني للأقمشة المصبوغة، ولإزالة الصدأ من الحديد.[52] كما كان يستخدمه أطباء الأسنان القدماء لغسل الأسنان.[53][54][55]
على شكل أملاح الأمونيا، (النشادر)، كانت الأمونيا مادة هامة لدى الخيميائيين المسلمين. أشير إليها في كتاب الأحجار الذي ألفه جابر بن حيان في القرن التاسع.[56] كانت هامة أيضًا بالنسبة إلى الخيميائيين الأوروبيين في القرن الثالث عشر، حيث ذكرها ألبرتوس ماگنس.[24] كما استخدمها الصباغون في العصور الوسطى على شكل بول مخمر لتغيير لون الأصباغ النباتية. في القرن الخامس عشر، أظهر باسيليوس ڤالنتتينوس أنه يمكن الحصول على الأمونيا بتأثير القلويات على ملح الأمونيا.[57] في فترة لاحقة، عندما تم الحصول على ملح الأمونيا عن طريق تقطير حوافر وقرون الثيران وتحييد الكربونات الناتجة باستخدام حمض الهيدروكلوريك، أطلق على الأمونيا اسم "روح هارتشورن".[24][58]
عُزلت الأمونيا الغازية لأول مرة بواسطة جوسف بلاك عام 1756 عن طريق تفاعل sal ammoniac (كلوريد الأمونيوم) مع calcined magnesia (أكسيد المغنسيوم).[59][60] وعُزلت مرة أخرى بواسطة پيتر وولف عام 1767،[61][62] وبواسطة كارل ڤيلهلم شيله عام 1770[63] وبواسطة جوسف پريستلي عام 1773 الذي أطلق عليها اسم "الهواء القلوي".[24][64] بعد أحد عشر عامًا في عام 1785، تأكد كلود لوي برتوليه من تكوينها.[65][24]
تم تطوير عملية هابر-بوش لإنتاج الأمونيا من النيتروجين الموجود في الهواء بواسطة فريتز هابر وكارل بوش عام 1909 وتم تسجيل براءة اختراعها عام 1910. وقد استخدمت لأول مرة على نطاق صناعي في ألمانيا أثناء الحرب العالمية الأولى،[66] في أعقاب حصار الحلفاء الذي قطع إمدادات النترات عن تشيلي. استخدمت الأمونيا لإنتاج المتفجرات لدعم المجهودات الحربية.[67]
قبل توافر الغاز الطبيعي، كان الهيدروجين بمثابة مركب طليعي لإنتاج الأمونيا عن طريق التحليل الكهربائي للمياه أو باستخدام عملية الكلور القلوي.
مع ظهور صناعة الصلب في القرن العشرين، أصبحت الأمونيا منتجًا ثانويًا لإنتاج فحم الكوك.
وقد استخدم تواتر اهتزاز ذرة الآزوت في جزيء النشادر بين موضعيها المتناظرين بالنسبة إلى قاعدة الهرم التي تقع في رؤوسها الثلاثة ذرات الهيدروجين - البالغ 2.3786× 1010 هرتز - لتعيين معيار الزمن في الساعات الذرية.[68]
التطبيقات
كمذيب
الأمونيا السائلة هي المذيب المؤين اللا مائي الأكثر شهرة والأكثر دراسة. أكثر خصائصه وضوحاً هي قدرته على إذابة الفلزات القلوية لتشكيل محاليل عالية الألوان موصلة للكهرباء تحتوي على إلكترونات منحلة. بصرف النظر عن هذه المحاليل الشهيرة، يمكن تصنيف الكثير من الكيمياء في الأمونيا السائلة عن طريق القياس مع التفاعلات ذات الصلة في المحاليل المائية. مقارنة الخواص الفيزيائية لـ NH
3 بخصائص تظهر NH
3 درجة انصهار أقل، نقطة غليان، كثافة، لزوجة، ثابت عازل وتوصيل كهربائي؛ يرجع هذا جزئياً على الأقل إلى الترابط الهيدروجيني الأضعف في NH
3 ولأن مثل هذا الترابط لا يمكن أن يشكل شبكات متشابكة، نظرًا لأن كل جزيء NH
3 يحتوي على زوج واحد فقط من الإلكترونات مقارنة مع اثنان لكل جزيء NH
3. الذاتي الأيوني - ثابت التفكك لـ NH
3 السائلة عند -50 درجة مئوية حوالي 10−33.
قابلية الذوبان في الأملاح
| القابلية للذوبان (ج ملح لكل 1 ج NH 3 سائل) | |
|---|---|
| أسيتات الأمونيوم | 253.2 |
| نترات الأمونيوم | 389.6 |
| نترات الليثيوم | 243.7 |
| نترات الصوديوم | 97.6 |
| نترات البوتاسيوم | 10.4 |
| فلوريد الصوديوم | 0.35 |
| كلوريد الصوديوم | 157.0 |
| بروميد الصوديوم | 138.0 |
| يوديد الصوديوم | 161.9 |
| ثيوسيانات الصوديوم | 205.5 |
الأمونيا السائلة مذيب مؤين، على الرغم من أنها أقل من الماء، وتذيب مجموعة من المركبات الأيونية، بما في ذلك العديد من النترات، النتريت، السيانيدات، الثيوسيانات، مركبات السيكلوبنتاديينيل الفلزية وmetal bis(trimethylsilyl)amide.[30] معظم أملاح الأمونيوم قابلة للذوبان وتعمل كأحماض في محاليل الأمونيا السائلة. تزداد قابلية ذوبان أملاح الهاليدات من الفلوريد إلى اليوديد. يحتوي محلول مشبع من نترات الأمونيوم ("محلول دايڤرز"، الذي يحمل اسم إدوارد دايڤرز) على 0.83 جزيء محلول لكل مول من الأمونيا ويحتوي على ضغط البخار أقل من 1 بار؛ حتى تحت درجة حرارة 25 مئوية.
محاليل الفلزات
تذوب الأمونيا السائلة جميع الفلزات القلوية والكهرإيجابية مثل الكالسيوم،[69] السترونتيوم، الباريوم، الأوروپيوم، الإتربيوم، (أيضًا المغنسيوم باستخدام عملية التحليل الكهربائي[31]). بتركيزات منخفضة (<0.06 مول/ل)، تتشكل المحاليل الزرقاء العميقة: تحتوي على كاتيونات فلزية وإلكترونات منحلة وإلكترونات حرة محاطة بقفص من جزيئات الأمونيا.
هذه المحاليل مفيدة للغاية كعوامل اختزال قوية. في التركيزات الأعلى، تكون المحاليل معدنية في المظهر وفي التوصيل الكهربائي. في درجات الحرارة المنخفضة، يمكن أن يتعايش نوعان من المحلول على مراحل غير قابلة للامتزاج.
خصائص الأكسدة والاختزال للأمونيا السائلة
| E° (V، أمونيا) | E° (V، ماء) | |
|---|---|---|
| Li+ + e− ⇌ Li |
−2.24 | −3.04 |
| K+ + e− ⇌ K |
−1.98 | −2.93 |
| Na+ + e− ⇌ Na |
−1.85 | −2.71 |
| Zn2+ + 2 e− ⇌ Zn |
−0.53 | −0.76 |
| 2 [NH 4]+ + 2 e− ⇌ H 2 + 2 NH 3 |
0.00 | — |
| Cu2+ + 2 e− ⇌ Cu |
+0.43 | +0.34 |
| Ag+ + e− ⇌ Ag |
+0.83 | +0.80 |
نطاق الثبات الديناميكي الحراري لمحاليل الأمونيا السائلة ضيق للغاية، مثل احتمال أكسدة ثنائي النيتروجين، E° (N
2 + 6 [NH
4]+
+ 6 e−
⇌ 8 NH
3)، هو فقط +0.04 V. عملياً، تكون كل من الأكسدة إلى إزالة النيتروجين والاختزال لثنائي الهيدروجين بطيئين. هذا صحيح بشكل خاص لمحاليل الاختزال: محاليل الفلزات القلوية المذكورة أعلاه مستقرة لعدة أيام، وتتحلل ببطء إلى أميد فلزي وثنائي الهيدروجين. تتم معظم الدراسات التي تتضمن محاليل الأمونيا السائلة في ظروف الاختزال؛ على الرغم من أن أكسدة الأمونيا السائلة عادة ما تكون بطيئة، لا يزال هناك خطر حدوث انفجار، خاصة إذا كانت أيونات المعادن الانتقالية موجودة كمحفزات محتملة.
كسماد
في الولايات المتحدة اعتبارًا من عام 2019، استخدم ما يقرب من 88% من الأمونيا كأسمدة إما كأملاح أو محاليل أو لا مائية.[15] عند تطبيقه على التربة، فإنه يساعد على توفير غلات متزايدة من المحاصيل مثل الذرة والقمح.[70] 30% من النيتروجين الزراعي المطبق في الولايات المتحدة على شكل أمونيا لا مائية ويستخدم 110 مليون طن سنويًا في جميع أنحاء العالم.[71]
مركب طليعي لمركبات النيتروجين
الأمونيا هي مركب طليعي مباشر أو غير مباشر لمعظم المركبات المحتوية على النيتروجين. تقريبا جميع مركبات النيتروجين الاصطناعية مشتقة من الأمونيا. هناك مشتق هام هو حمض النيتريك. تتكون هذه المادة الرئيسية عبر عملية أوستوالد عن طريق أكسدة الأمونيا مع الهواء فوق محفز پلاتيني عند درجة حرارة 700-850 °س، ≈9 atm. وسيط في هذا التحويل هو أكسيد النيتريك:[72]
- NH
3 + 2 O
2 → HNO
3 + H
2O
يستخدم أكسيد النيتريج لإنتاج الأسمدة والمتفجرات، والكثير من المركبات النيتروجينية العضوية.
كما تستخدم الأمونيا لصنع المركبات التالية:
- الهيدرازين، في عملية أولين راشيگ وعملية الپيروكسيد
- سيانيد الهيدروجين، في عملية BMA وعملية أندروسو
- الهيدروكسيلامين وكربونات الأمونيوم ، في عملية راشينگ
- الفينول، في عملية راشينگ-هوكر
- اليوريا في عملية بوش-مايزر يوريا وفي تخليق ڤوهلر
- الأحماض الأمينية، باستخدام تخليق ستركر الحمض الأميني
- الأكريلونتريلن في عملية سوهيو
يمكن أيضًا استخدام الأمونيا لصنع مركبات في تفاعلات لم يتم تسميتها على وجه التحديد. من أمثلة هذه المركبات: فوق كلورات الأمونيوم، نترات الأمونيوم، الفورماميد، رباعي أكسيد النيتروجين، الألبرازولام، الإيثانولامين ، كاربامات الإيثيل وسداسي ميثيلين رباعي الأمين وكربونات الأمونيوم.
كعامل تنظيف
"الأمونيا" المنزلية هي محلول NH
3 في الماء، وتستخدم كمنظف للأغراض العامة للعديد من الأسطح. نظرًا لأن الأمونيا تنتج لمعانًا خاليًا من الخطوط نسبيًا، فإن أحد استخداماتها الأكثر شيوعًا هو تنظيف الزجاج والخزف والفولاذ المقاوم للصدأ. كما أنها تستخدم بشكل شائع لتنظيف الأفران ونقع العناصر لتخفيف الأوساخ الناتجة عن الخبز. يتراوح تركيز الأمونيا المنزلية بالوزن من 5٪ إلى 10٪ أمونيا.[73] يُطلب من الشركات الأمريكية المصنعة لمنتجات التنظيف تقديم صحيفة بيانات سلامة المواد الخاصة بالمنتج والتي تسرد التركيز المستخدم.[74]
تستخدم محاليل الأمونيا (5-10٪ من الوزن) كمنظفات منزلية، خاصة للزجاج. هذه المحاليل تسبب تهيجاً للعين والأغشية المخاطية (الجهاز التنفسي والجهاز الهضمي)، وبدرجة أقل الجلد. ينصح الخبراء بتوخي الحذر لضمان عدم خلط المادة الكيميائية في أي سائل يحتوي على المبيض، بسبب خطر تكوين غاز الكلور السام. الخلط مع المنتجات المحتوية على الكلور أو المؤكسدات القوية، مثل المبيض المنزلي، يمكن أن يولد أبخرة الكلورامين السامة.[75]
يحذر الخبراء أيضًا من استخدام المنظفات التي تحتوي على الأمونيا (مثل منظفات الزجاج أو النوافذ) على شاشات لمس السيارة، نظرًا لخطر تلف الطلاء المضاد للوهج وبصمات الأصابع.[76]
التخمر
تستخدم محاليل الأمونيا التي يتراوح تركيزها من 16٪ إلى 25٪ في صناعة التخمر كمصدر لنيتروجين العضيات الدقيقة ولضبط درجة الحموضة أثناء التخمر.[77]
كعامل مضاد للميكروبات للمنتجات الغذائية
في وقت مبكر من عام 1895، كان معروفًا أن الأمونيا "مادة مطهرة قوية ... تتطلب 1.4 جرام لكل لتر لحفظ [[مرق|مرق اللحم البقري".[78]
في إحدى الدراسات، دمرت الأمونيا اللامائية 99.999٪ من الجراثيم حيوانية المنشأ في 3 أنواع من علف الحيوانات، ما عدا السيلاج.[79][80] تُستخدم الأمونيا اللامائية حاليًا تجاريًا لتقليل التلوث الجرثومي أو القضاء عليها في اللحم البقري.[81][82] لحم البقر قليل الدهن (المعروف باسم "الطين الوردي") في صناعة اللحم البقري مصنوع من beef trimmings الدهني (حوالي 50-70٪ دهن) عن طريق إزالة الدهون باستخدام الحرارة والطرد المركزي، ثم معالجته بالأمونيا لقتل الإشريشيا المعوية. اعتبرت وزارة الزراعة الأمريكية هذه العملية فعالة وآمنة بناءً على دراسة وجدت أن العلاج يقلل من الإشريشيا المعوية إلى مستويات لا يمكن اكتشافها.[83] كانت هناك مخاوف تتعلق بالسلامة بشأن هذه العملية وكذلك شكاوى المستهلكين حول طعم ورائحة لحم البقر المعالج بالأمونيا.[84]
الوقود
تبلغ كثافة الطاقة الخام للأمونيا السائلة 11.5 ميجا جول/لتر،[85] وهي حوالي ثلث مثيلها في وقود الديزل. هناك فرصة لتحويل الأمونيا مرة أخرى إلى هيدروجين، حيث يمكن استخدامها لتشغيل خلايا وقود الهيدروجين، أو يمكن استخدامها مباشرة داخل الأكسيد الصلب المباشر لخلايا وقود الأمونيا لتوفير كفاءة مصادر الطاقة التي لا تنبعث منها غازات الدفيئة.[86][87]
تحويل الأمونيا إلى هيدروجين عبر عملية أميد الصوديوم،[88] إما للاحتراق أو كوقود لخلية وقود غشاء تبادل الپروتون،[85] يمكن استخدام طريقة أخرى هي التحلل التحفيزي للأمونيا باستخدام محفزات صلبة.[89] سيسمح التحويل إلى الهيدروجين بتخزين الهيدروجين عند 18 تقريبًا wt% مقارنة بـ 5% للهيدروجين الغازي تحت الضغط.
كما اقترحت واستخدمت في بعض الأحيان محركات الأمونيا أو محركات الأمونيا، التي تستخدم الأمونيا كمانع تشغيل.[90] المبدأ مشابه للمبدأ المستخدم في fireless locomotive، لكن مع الأمونيا كمانع تشغيل، بدلاً من البخار أو الهواء المضغوط. استخدمت محركات الأمونيا بشكل تجريبي في القرن التاسع عشر بواسطة گولدورثي گرني في المملكة المتحدة وترام جادة سانت تشارلز في نيو أورلينز في سبعينيات وثمانينيات القرن التاسع عشر،[91] وأثناء الحرب العالمية الأولى استخدمت الأمونيا كوقود للحافلات في بلجيكا.[92]
تُقترح الأمونيا أحيانًا كبديل عملي للوقود الأحفوري في محركات الاحتراق الداخلي.[92][93][94][95]
برقم أوكتان مرتفع يبلغ 120،[96] ودرجة حرارة منخفضة[97] يسمح وقود الأمونيا باستخدام نسب ضغط عالية دون إنتاج أكاسيد النيتروجين. بما أن الأمونيا لا تحتوي على الكربون، فإن احتراقها لا يمكن أن ينتج ثاني أكسيد الكربون، أول أكسيد الكربون، الهيدروكربونات، أو السخام.
يشارك إنتاج الأمونيا حاليًا بنسبة 1.8٪ من انبعاثات ثاني أكسيد الكربون العالمية. "الأمونيا الخضراء" هي الأمونيا التي تنتج باستخدام الهيدروجين الأخضر (الهيدروجين المنتج عن طريق التحليل الكهربائي)، بينما "الأمونيا الزرقاء" هي أمونيا تنتج باستخدام الهيدروجين الأزرق (الهيدروجين الناتج عن إصلاح الميثان بالبخار حيث يتم التقاط ثاني أكسيد الكربون وتخزينه).[98]
ومع ذلك، لا يمكن استخدام الأمونيا بسهولة في محركات دورة أوتو الحالية نظرًا لضيق نطاق نطاق قابلية الاشتعال. على الرغم من ذلك، أجريت العديد من الاختبارات.[99][100][101]
بالمقارنة مع الهيدروجين كوقود، تعتبر الأمونيا أكثر كفاءة في استخدام الطاقة، ويمكن إنتاجها وتخزينها وتسليمها بتكلفة أقل بكثير من الهيدروجين، الذي يجب أن يظل مضغوطًا أو سائلًا مبردًا.[85][102]
المحركات الصاروخية تستخدم الأمونيا كوقود أيضاً. محرك الصاروخ ريأكشن موتورز XLR99 الذي شغّل طائرة الأبحاث التي تفوق سرعتها سرعة الصوت إكس-15 استخدم الأمونيا السائلة. على الرغم من أنها ليست قوية مثل أنواع الوقود الأخرى، إلا أنها لم تترك أي سخام في محرك الصاروخ القابل لإعادة الاستخدام، وكثافته تتطابق تقريبًا مع كثافة المؤكسد، الأكسجين السائل، مما سهل تصميم الطائرة.
في أوائل أغسطس 2018، أعلن علماء من منظمة الكومنولث للبحوث العلمية والصناعية الأسترالية أن نجاح تطوير عملية لإطلاق الهيدروجين من الأمونيا وحصاد ذلك بنقاوة عالية جدًا كوقود للسيارات. يستخدم هذا الوقود غشاء خاص. هناك سيارتان تعملان بخلايا الوقود استخدمت هذه التكنولوجيا، هيونداي نيكسو وتويوتا ميراي.[103]
عام 2020، شحنت السعودية 40 طن متري من "الأمونيا الزرقاء" السائلة إلى اليابان لاستخدامها كوقود.[104] تم إنتاجه كمنتج ثانوي عن الصناعات البتروكيماوية، ويمكن حرقه دون إفراز غازات الدفيئة. كثافة طاقتها من حيث الحجم تقارب ضعف كثافة الهيدروجين السائل. إذا كان من الممكن توسيع نطاق عملية إنشائها من خلال موارد متجددة بحتة، وإنتاج الأمونيا الخضراء، فيمكن أن تحدث فرقًا كبيرًا في تجنب تغير المناخ.[105] أعلنت شركة أكوا پاور ومدينة نيوم عن إنشاء مصنع أخضر للهيدروجين والأمونيا عام 2020.[106]
تعتبر الأمونيا الخضراء وقودًا محتملاً لسفن الحاويات المستقبلية. عام 2020، أعلنت شركة DSME وإم إيه إن لحلول الطاقة عن بناء سفينة تعمل بوقود الأمونيا، وتخطط DSME لتسويقها بحلول عام 2025.[107] كما يجري استكشاف استخدام الأمونيا كوقود بديل محتمل للمحركات النفاثة للطائرات.[108]
تعتزم اليابان تنفيذ خطة لتطوير تكنولوجيا الحرق المشترك للأمونيا التي يمكن أن تزيد من استخدام الأمونيا في توليد الطاقة، كجزء من الجهود المبذولة لمساعدة المرافق المحلية وغيرها من المرافق الآسيوية لتسريع انتقالها إلى حياد الكربون.[109] في أكتوبر 2021، عُقد أول مؤتمر دولي حول وقود الأمونيا.[110][111]
في يونيو 2022، نجحت شركة آي إتش آي في تقليل الغازات المسببة للاحتباس الحراري بنسبة تزيد عن 99% أثناء احتراق الأمونيا السائلة في توربين غازي بقدرة 2000 كيلووات، مما أدى إلى توليد طاقة خالية من ثاني أكسيد الكربون.[112]
في يوليو 2022، وافقت دول الحوار الرباعي؛ اليابان والولايات المتحدة وأستراليا والهند، على تعزيز التطوير التكنولوجي لحرق الهيدروجين والأمونيا كوقود في أول اجتماع للطاقة للتجمع الأمني.[113] اعتباراً من عام 2022، أُنتجت كميات كبيرة من NO
x.[114] قد يشكل أيضاً أكسيد النيتروز مشكلة.[115]
أخرى
معالجة الانبعاثات الغازية
تستخدم الأمونيا لمعالجة ثاني أكسيد الكبريت الناتج عن حرق الوقود الأحفوري، ويتم تحويل المنتج الناتج إلى كبريتات الأمونيوم لاستخدامها كسماد. تعمل الأمونيا على تحييد ملوثات أكسيد النيتروجين (NO
x) المنبعثة من محركات الديزل. هذه التقنية، المسماة SCR (الاختزال التحفيزي الانتقائي، تعتمد على محفزات معتمدة على الڤاناديا.[116]
يمكن استخدام الأمونيا للتخفيف من التسربات الغازية للفوسجين.[117]
كحامل للهيدروجين
نظرًا لخصائصها، كونها سائلة في درجة الحرارة المحيطة تحت ضغط البخار الخاص بها ولها كثافة طاقة عالية الحجم والجاذبية، تعتبر الأمونيا ناقلًا مناسبًا للهيدروجين،[118] وقد تكون أرخص من النقل المباشر للهيدروجين السائل.[119]
التبريد– R717
بسبب خصائص التبخير التي تتتمع بها الأمونيا، فهي تعتبر مبرداً مفيداً.[66] كانت استخدم بشكل شائع قبل تعميم مركبات الكربون الكلورية فلورية (الفريونات). تستخدم الأمونيا اللامائية على نطاق واسع في تطبيقات التبريد الصناعي وحلبات الهوكي بسبب ارتفاع كفاءة الطاقة وانخفاض تكلفتها. تعاني الأمونيا من مساوئ السمية، وتتطلب مكونات مقاومة للتآكل، مما يقيد استخدامها في التطبيقات المنزلية وعلى النطاقات المحدودة. إلى جانب استخدامها في التبريد بضغط البخار تستخدم الأمونيا في خليط مع الهيدروجين والماء في ثلاجة الامتصاص. دورة كالينا، التي تزداد أهمية لمحطات الطاقة الحرارية الأرضية، تعتمد على مدى غليان خليط الماء والأمونيا. يستخدم مبرد الأمونيا أيضًا في المبرد S1 على متن محطة الفضاء الدولية في حلقتين تستخدمان لتنظيم درجة الحرارة الداخلية وتمكين التجارب المعتمدة على درجة الحرارة.[120][121]
ازدادت الأهمية المحتملة للأمونيا كمبرد مع اكتشاف أن مركبات الكربون الكلورية فلورية ومركبات الكربون الهيدروفلورية من غازات الاحتباس الحراري شديدة الفعالية والمستقرة.[122]
كمنشط
الأمونيا اللامائية هي سماد زراعي شائع وهي أيضًا عنصر هام في صنع المثامفتامين. عام 2005، استخدمت ولاية أيوا أموال المنح لتوفير آلاف الأقفال لمنع المجرمين من الوصول إلى خزانات الأمونيا المائية.[123] الأمونيا، كبخار منبعث من كربونات النشادر، وجدت استخدامًا كبيرًا كمنشط للجهاز التنفسي. تستخدم الأمونيا بشكل شائع في التصنيع غير القانوني للمثامفتامين من خلال اختزال برتش.[124] تعتبر طريقة برتش لصنع المثامفيتامين خطيرة لأن المعدن القلوي والأمونيا السائلة كلاهما شديد التفاعل، ودرجة حرارة الأمونيا السائلة تجعلها عرضة للغليان المتفجر عند إضافة المواد المتفاعلة.[125]
صناعة النسيج
تستخدم الأمونيا السائلة لمعالجة المواد القطنية، مع إعطاء خصائص مثل المرسرة، باستخدام القلويات. على وجه الخصوص، تستخدم للغسيل المسبق للصوف.[126]
كغاز رافع
عند درجة الحرارة والضغط القياسيين، تكون الأمونيا أقل كثافة من الغلاف الجوي ولديها ما يقرب من 45-48% من قوة رفع الهيدروجين أو الهليوم. استخدمت الأمونيا أحيانًا لملء البالونات كغاز رافع. بسبب نقطة غليانها المرتفعة نسبيًا (مقارنة بالهيليوم والهيدروجين)، يمكن تبريد الأمونيا وتسييلها على متن المنطاد لتقليل الرفع وإضافة الصابورة (وإعادتها إلى الغاز لإضافة قوة الرفع وتقليل الصابورة).[127]
Fuming
تستخدم الأمونيا لإعطاء البلوط الأبيض لوناً داكناً في الفنون والحرف اليدوية والأثاث على طراز المهمة. تتفاعل أبخرة الأمونيا مع التانين الطبيعي في الخشب وتتسبب في تغيير لونه.[128]
السلامة
حددت إدارة السلامة والصحة المهنية الأمريكية حدًا للتعرض لمدة 15 دقيقة للأمونيا الغازية يبلغ 35 جزءًا في المليون من حيث الحجم في الهواء البيئي وحد تعرض يبلغ 8 ساعات يبلغ 25 جزءًا في المليون بالصوت.[130]
خفض المعهد الوطني للسلامة والصحة المهنية مؤخرًا IDLH (الذي يمثل خطرًا مباشرًا على الحياة والصحة، وهو المستوى الذي يمكن أن يتعرض له العامل السليم لمدة 30 دقيقة دون أن يعاني من آثار صحية لا رجعة فيها) من 500 إلى 300 استنادًا إلى تفسيرات أكثر تحفظًا مؤخرًا للبحث الأصلي عام 1943. المنظمات الأخرى لديها مستويات تعرض متفاوتة. معايير البحرية الأمريكية، [مكتب السفن الأمريكي 1962]، التركيزات القصوى المسموح بها (MAC): للتعرض المستمر (60 يومًا) هي 25 جزء في المليون؛ للتعرض لمدة ساعة 400 جزء في المليون.[131]
يتميز بخار الأمونيا برائحة حادة ومزعجة ونفاذة تعمل على التحذير من التعرض الذي يحتمل أن يكون خطيرًا. متوسط عتبة استنشاق هو 5 جزء في المليون ، وهو أقل بكثير من أي خطر أو ضرر. يمكن أن يؤدي التعرض لتركيزات عالية جدًا من الأمونيا الغازية إلى تلف الرئة والوفاة. يتطلب تصريح سلامة خطرة عند نقله بكميات أكبر من 3،500 غالون أمريكي (13،000 L; 2،900 imp gal).[132]
الأمونيا السائلة خطرة لأنها مادة استرطابية ولأنها يمكن أن تسبب حروق كاوية.
السمية
لا تسبب سمية محاليل الأمونيا عادة مشاكل للإنسان والثدييات الأخرى، حيث توجد آلية محددة لمنع تراكمها في مجرى الدم. تتحول الأمونيا إلى فوسفات الكربامويل عن طريق إنزيم فوسفات الكربامويل سينثتاز، ثم تدخل دورة اليوريا لدمجها إما في الأحماض الأمينية أو إفرازها في البول.[133] تفتقر الأسماك والبرمائيات إلى هذه الآلية، حيث يمكنها عادة التخلص من الأمونيا من أجسامها عن طريق الإخراج المباشر. الأمونيا، حتى في التركيزات المخففة، شديدة السمية للحيوانات المائية، ولهذا السبب فهي مصنفة على أنها "خطرة على البيئة". تلعب الأمونيا الجوية دورًا رئيسيًا في تكوين الجسيمات الدقيقة.[134]
الأمونيا أحد مكونات تبغ التدخين.[135]
مياه صرف فحم الكوك
توجد الأمونيا في تيارات مياه صرف فحم الكوك، كمنتج ثانوي سائل لإنتاج فحم الكوك من الفحم.[136]
في بعض الحالات، يتم تصريف الأمونيا إلى البيئة البحرية حيث تعمل كمواد ملوثة. تعتبر ويالا للصلب في جنوب أستراليا أحد الأمثلة على منشآت إنتاج فحم الكوك التي تصرف الأمونيا في المياه البحرية.[137]
تربية الأحياء المائية
يُعتقد أن سمية الأمونيا هي سبب الخسائر غير المبررة في المزارع السمكية. قد تتراكم الأمونيا الزائدة وتسبب تغيرًا في الايض أو زيادة في درجة حموضة جسم العضيات. يختلف تحمل الأمونيا بين أنواع الأسماك.[138] بتركيزات منخفضة، حوالي 0.05 ملجم/ لتر، تكون الأمونيا غير المؤينة ضارة لأنواع الأسماك ويمكن أن تؤدي إلى ضعف النمو ومعدلات تحول العلف، وانخفاض الخصوبة والخصوبة وزيادة الإجهاد والتعرض للعدوى والأمراض الجرثومية.[139] عند تعرضها لفرط الأمونيا، قد تعاني الأسماك من فقدان التوازن والإثارة المفرطة وزيادة نشاط الجهاز التنفسي وامتصاص الأكسجين وزيادة معدل ضربات القلب.[138] بتركيزات تزيد عن 2.0 ملجم/لتر، تسبب الأمونيا تلفًا في الخياشيم والأنسجة، والخمول الشديد، والتشنجات، والغيبوبة، والموت.[138][140] أظهرت التجارب أن التركيز المميت لمجموعة متنوعة من أنواع الأسماك يتراوح من 0.2 إلى 2.0 ملجم/لتر.[140]
خلال فصل الشتاء، عند إعطاء الأعلاف المخفضة لمخزون تربية الأحياء المائية، يمكن أن تكون مستويات الأمونيا أعلى. تقلل درجات الحرارة المحيطة المنخفضة من معدل التمثيل الضوئي للطحالب بحيث يتم إزالة كمية أقل من الأمونيا بواسطة أي طحالب موجودة. في بيئة تربية الأحياء المائية، وخاصة على نطاق واسع، لا يوجد علاج سريع المفعول لارتفاع مستويات الأمونيا. يوصى بالوقاية بدلاً من التصحيح لتقليل الضرر الذي يلحق بالأسماك المستزرعة[140] وفي أنظمة المياه المفتوحة، البيئة المحيطة.
معلومات التخزين
كما هو الحال مع الپروپان، تغلي الأمونيا اللامائية تحت درجة حرارة الغرفة عند الضغط الجوي. وعاء تخزين قادر على احتواء 250 psi (1.7 MPa) يكون مناسباً على احتواء السائل.[141] تستخدم الأمونيا في العديد من التطبيقات الصناعية المختلفة التي تتطلب أوعية تخزين من الكربون أو الفولاذ المقاوم للصدأ. الأمونيا التي تحتوي على نسبة لا تقل عن 0.2٪ من وزنها ماء لا تسبب تآكلًا للفولاذ الكربوني. يمكن أن تستمر صهاريج تخزين الإنشاءات المصنوعة من الصلب الكربوني عن تخزين NH
3 تحتوي على 0.2% أو أكثر من مزنها ماء لأكثر من 50 عامًا في الخدمة.[142] يحذر الخبراء من أنه لا يُسمح لمركبات الأمونيوم بالتلامس مع القواعد (ما لم يكن في تفاعل مقصود ومحتوى)، حيث يمكنها أن تطلق كميات خطيرة من غاز الأمونيا.
معملياً
تعتمد مخاطر محاليل الأمونيا على التركيز: محاليل الأمونيا "المخففة" عادة ما تكون 5-10٪ بالوزن (<5.62 مول/لتر)؛ عادة ما يتم تحضير المحاليل "المركزة" بنسبة > 25٪ بالوزن. المحلول 25٪ (بالوزن) بكثافة 0.907 جم/سم3، أما المحلول الأقل كثافة سيكون أكثر تركيزًا. يوضح الجدول تصنيف الاتحاد الأوروبي لمحاليل الأمونيا.
| التركيز حسب الوزن (w/w) |
التركيز المولي | التركيز الكتلة/ الحكم(w/v) |
GHS pictograms | H-phrases |
|---|---|---|---|---|
| 5–10% | 2.87–5.62 مول/لتر | 48.9–95.7 ج/لتر | 
|
H314 |
| 10–25% | 5.62–13.29 مول/لتر | 95.7–226.3 ج/لتر |  
|
H314, H335, H400 |
| >25% | >13.29 مول/لتر | >226.3 ج/لتر |   
|
H314, H335, H400, H411 |
يُسبب بخار الأمونيا الناتج عن محاليل الأمونيا المركزة تهيجًا شديدًا للعيون والجهاز التنفسي، ويحذر الخبراء من أن هذه المحاليل لا يتم التعامل معها إلا في غطاء دخان. يمكن للمحاليل المشبعة ("0.880" - راجع #الخصائص) ويمكنها تطوير ضغط كبير داخل الزجاجة المغلقة في الطقس الدافئ، ويحذر الخبراء أيضًا من فتح الزجاجة بعناية. لا يمثل هذا عادةً مشكلة بالنسبة لحلول 25٪ ("0.900").
يحذر الخبراء من عدم خلط محاليل الأمونيا مع الهالوجين، حيث يتم تكوين منتجات سامة و/أو متفجرة. يحذر الخبراء أيضًا من أن ملامسة محاليل الأمونيا لفترات طويلة مع الفضة، الزئبق أو اليود أملاح يمكن أن يؤدي أيضًا إلى منتجات متفجرة: غالبًا ما تتشكل هذه الخلائط في التحليل النوعي غير العضوي، ويجب أن تكون قليلة الحموضة ولكن غير مركزة (أقل من 6٪ الوزن/الحجم) قبل اكتمال عملية التخلص منها.
الاستخدام المعملي للأمونيا اللامائية (الغازية أو السائلة)
تُنصف الأمونيا اللامائية كمادة سامة (T) وخطرة على البيئة (N). الغاز قابل للاشتعال (درجة حرارة الاشتعال الذاتي: 651 °س) ويمكن أن يشكل مزيج متفجر مع الهواء (16–25%). حد التعرض المسموح (PEL) في الولايات المتحدة هو 50 ppm (35 mg/m3)، بينما يقدر تركيز IDLH بـ 300 ppm. يقلل التعرض المتكرر للأمونيا من الحساسية لرائحة الغاز: عادةً ما يمكن اكتشاف الرائحة بتركيزات أقل من 50 ppm، لكن الأفراد الذين يعانون من الحساسية قد لا يكتشفونها حتى عند تركيزات 100 ppm. تؤدي الأمونيا اللامائية إلى تآكل النحاس -والسبائك التي تحتوي على الزنك- مما يجعل تركيبات النحاس الأصفر غير مناسبة لنقل الغاز. يمكن للأمونيا السائلة أن تهاجم المطاط وبعض أنواع اللدائن.
تتفاعل الأمونيا بعنف مع الهالوجين. النيتروجين ثلاثي اليود، لتشكل مادة شديد الانفجار أولية، تتشكل عندما تتلامس الأمونيا مع اليود. تسبب الأمونيا بلمرة أكسيد الإيثيلين المتفجرة. كما تشكل مركبات متفجرة مع مركبات الذهب، الفضة، الزئبق، الجرمانيوم أو [التيلوريوم]]، ومع الستيبين. كما أثبلغ عن تفاعلات عنيفة مع محاليل الأسيتالدهيد والهيپوكلوريت وفيريسيانيد الپوتاسيوم والپروكسيدات.
الإنتاج
تتمتع الأمونيا بأحد أعلى معدلات إنتاج عن أي مادة كيميائية غير عضوية. وأحياناً، يـُعبـَّر عن الإنتاج بإسم "النيتروجين المثبت". قُدر الإنتاج العالمي بـ 160 مليون طن عام 2020 (147 طنًا من النيتروجين المثبت).[144] تنتج الصين 26.5% من إجمالي الإنتاج العالمي من الأمونيا، تليها روسيا بإنتاج 11.0%، ثم الولايات المتحدة 9.5%، والهند 8.3%.[144]
قبل اندلاع الحرب العالمية الأولى، كان يتم الحصول على الأمونيا عن طريق التقطير الجاف[145] للنفايات النيتروجينية النباتية والحيوانية، بما في ذلك روث الجمال، حيث يجرى التقطير عن طريق تقليل حمض النيتروز والنتريت مع الهيدروجين؛ بالإضافة إلى ذلك، كانت الأمونيا تنتج عن طريق تقطير الفحم، وأيضًا عن طريق تحلل أملاح الأمونيوم بواسطة هيدروكسيدات قلوية[146] مثل الجير الحي:[24]
بالنسبة للتركيبات المختبرية صغيرة الحجم، يمكن تسخين اليوريا وهيدروكسيد الكالسيوم:
- (NH
2)
2CO + Ca(OH)
2 → CaCO
3 + 2 NH
3
هابر-بوش

عملية هابر Haber Process[147] طريقة تجارية لإنتاج النشادر من النيتروجين والهيدروجين.[148][149] It converts atmospheric nitrogen (N2) to ammonia (NH3) by a reaction with hydrogen (H2) using finely divided iron metal as a catalyst:
This reaction is thermodynamically favorable at room temperature, but the kinetics are prohibitively slow. At high temperatures at which catalysts are active enough that the reaction proceeds to equilibrium, the reaction is reactant-favored rather than product-favored. As a result, high pressures are needed to drive the reaction forward.
وقد طور العملية الكيميائي الألماني فريتز هابر وعرضها في عام 1909. وسجَّل براءة اختراعها في عام 1910. وبعد ذلك، طور كارل بوش وهو كيميائي ألماني آخر الطريقة للاستخدام الصناعي. وهي تُعرف أيضًا بطريقة هابر-بوش.
وفي طريقة هابر، تتحد ثلاثة أجزاء من الهيدروجين مع جزء من النيتروجين لتكوّن النشادر NH3. وتُجرى العملية عند حوالي 550° م. وتحت 200 - 250 ضغطًا جويًا. ويتحد النيتروجين والهيدروجين على سطح عامل حفَّاز صلب، وهي المادة التي تسرع التفاعل، وتتكون أساسًا من الحديد مع كميات صغيرة من الألومينا وأكسيد البوتاسيوم. ولا يتحد كل الهيدروجين والنيتروجين. ويعاد تدوير الغازات التي لم تتحد خلال العملية.
وتستخدم معظم مصانع النشادر الحديثة طريقة هابر أو بعض تعديلاتها. وكان معظم مصانع النشادر الأولى التي استخدمت طريقة هابر تحصل على الهيدروجين من غاز الماء، وعلى النيتروجين من غاز المولدات. ويحضر كلا الغازين غاز الماء وغاز المولدات من فحم الكوك الساخن. انظر: الغاز. واليوم يحصل الكثير من مصانع النشادر على الهيدروجين والنيتروجين من مصادر أخرى، وربما تحصل على الهيدروجين من الغاز الطبيعي. أما النيتروجين فربما يأتي من تقطير الهواء السائل. وتتضمن التعديلات الأخرى للطريقة التغيير في تركيب العامل الحفاز وفي درجة الحرارة والضغط المستخدمين.
The German chemists Fritz Haber and Carl Bosch developed the process in the first decade of the 20th century, and its improved efficiency over existing methods such as the Birkeland-Eyde and Frank-Caro processes was a major advancement in the industrial production of ammonia.[150][151][152] The Haber process can be combined with steam reforming to produce ammonia with just three chemical inputs: water, natural gas, and atmospheric nitrogen. Both Haber and Bosch were eventually awarded the Nobel Prize in Chemistry: Haber in 1918 for ammonia synthesis specifically, and Bosch in 1931 for related contributions to high-pressure chemistry.الكهروكيميائية
يمكن تخليق الأمونيا كهربائياً. المدخلات الوحيدة المطلوبة هي مصادر النيتروجين (الغلاف الجوي المحتمل) والهيدروجين (الماء)، مما يسمح بالتوليد عند نقطة الاستخدام. يوفر توافر الطاقة المتجددة إمكانية إنتاج انبعاثات صفرية.[153][154]
هناك عملية تخليق كهروكيميائية أخرى عن طريق التشكيل اختزالي النيتريد الليثيوم، والذي يمكن أن يكون پروتونات للأمونيا، بالنظر إلى مصدر الپروتون. استخدم الإيثانول كمصدر، على الرغم من أنه قد يتحلل. أثبلغ عن أول استخدام لهذه الكيمياء عام 1930، حيث استخدمت محاليل الليثيوم في الإيثانول لإنتاج الأمونيا عند ضغوط تصل إلى 1000 بار.[155] عام 1994، استخدم تسونيتو وزملائه الترسيب الكهربائي لليثيوم في رباعي هيدرو الفوران لتخليق الأمونيا عند ضغوط أكثر اعتدالًا وبكفاءة فارادية معقولة.[156] ومنذ ذلك الحين، استخدمت دراسات أخرى نظام الإيثانول-رباعي الهيدروفيوران لتخليق الأمونيا كهروكيميائياً.[157][158] عام 2019، اقترح لازوسكي وزملائه آلية لشرح حركية تكوين الأمونيا المرصودة.[157]
عام 2020، قام لازوسكي وزملائه بتطوير قطب كهربائي لنشر الغاز غير مذيب لتحسين نقل النيتروجين إلى الليثيوم التفاعلي. قيمت الدراسة إنتاج NH
3 المرصود بمعدلات تصل لأكثر من 30 ± 5 نانمول/ث/سم2 وبكفاءة فارادية تصل لأكثر من 47.5 ± 4% في درجة حرارة محيطة وضغط 1 بار.[159]
عام 2021، استبدل سوريانتو وزملائه الإيثانول برباعي ألكيل ملح الفوسفونيوم. هذا الكاتيون يمكن أن يخضع بشكل ثابت لدورات نزع التوتر وإعادة التنغيم، بينما يعزز الموصلية الأيونية للوسط.[160] أشارت الدراسة لمعدلات إنتاج NH
3 تصل إلى 53 ± 1 نانومول/ث/سم2 بكفاءة فارادية 69 ± 1% تحت ضغط 0.5-بار هيدروجين 19.5-بار نيتروجين ضغط جزئي في درجة حرارة الغرفة.[160]
دور الأمونيا في النظم الحيوية والأمراض البشرية
الأمونيا هي فضلات ومدخلات أيضية في جميع أنحاء المحيط الحيوي. وهي مصدر هام للنيتروجين للأنظمة الحية. على الرغم من وفرة النيتروجين في الغلاف الجوي (أكثر من 75%)، إلا أن القليل من العضيات قادرة على استخدام نيتروجين الغلاف الجوي في شكله ثنائي الذرة، غاز N
2. بالتالي، فإن تثبيت النيتروجين مطلوب لتخليق الأحماض الأمينية، التي تعد اللبنات الأساسية للپروتين. تعتمد بعض النباتات على الأمونيا والفضلات النيتروجينية الأخرى المدمجة في التربة عن طريق المواد المتحللة. يستفيد البعض الآخر، مثل البقوليات المثبتة للنيتروجين، من علاقات تكافلية مع بكتيريا ريزوبيا التي تنتج الأمونيا من النيتروجين الجوي.[162]
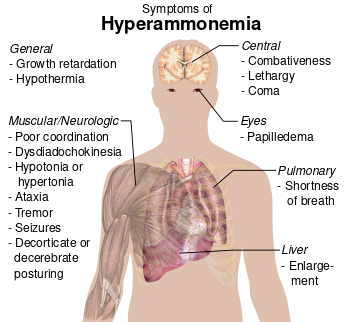
في البشر، يمكن أن يؤدي استنشاق الأمونيا بتركيزات عالية إلى الوفاة. يمكن أن يسبب التعرض للأمونيا إلى الإصابة بالصداع، الوذمة، ضعف الذاكرة، النوبات والغيبوبة كما يكون ذو طبيعة سامة عصبياً. [163]
التخليق الحيوي
في بعض العضيات، تُنتج الأمونيا من النيتروجين الجوي عن طريق إنزيم يسمى النيتروجيناز. العملية الكلية تسمى تثبيت النيتروجين. توجهت جهود مكثفة نحو فهم آلية التثبيت الحيوي للنيتروجين. الدافع وراء الاهتمام العلمي بهذه المشكلة هو البنية غير العادية للموقع النشط للإنزيم، والذي يتكون من مجموعة Fe
7MoS
9.[164]
الأمونيا هي أيضًا منتج أيضي لنزع أمين الأحماض الأمينية المحفز بواسطة إنزيمات مثل نازعة هيدروجين الجلوتامات 1. يعتبر إفراز الأمونيا شائعًا في الحيوانات المائية. في البشر، يتم تحويله سريعًا إلى يوريا (عن طريق الكبد)، وهو أقل سمية بكثير، ولا سيما القاعدية. تعتبر اليوريا مكونًا رئيسيًا في الوزن الجاف للبول. تفرز معظم الزواحف والطيور والحشرات والقواقع حمض البوليك فقط كفضلات نيتروجينية.
الفسيولوجيا
تلعب الأمونيا دورًا في فسيولوجيا كل من الحيوانات الطبيعية وغير الطبيعي. تُخلق حيويًا من خلال التمثيل الغذائي للأحماض الأمينية الطبيعية وتكون سامة بتركيزات عالية. يحول الكبد الأمونيا إلى يوريا من خلال سلسلة من التفاعلات المعروفة باسم دورة اليوريا. قد يؤدي ضعف الكبد، مثل الذي يظهر في حالات تليف الكبد، إلى ارتفاع كميات الأمونيا في الدم (فرط أمونيا الدم). وبالمثل، فإن اضطرابات الإنزيمات المسؤولة عن دورة اليوريا، مثل ornithine transcarbamylase، تؤدي إلى فرط أمونيا الدم. يساهم فرط أمونيا الدم في حدوث ارتباك وغيبوبة الاعتلال الدماغي الكبدي، بالإضافة إلى المرض العصبي الشائع لدى الأشخاص المصابين باضطرابات دورة اليوريا والبيلة العضوية الحمضية.[165]
الأمونيا هامة لتوازن الحمضي/القاعدي في الحيوانات الطبيعية. بعد تكوين الأمونيوم من الجلوتامين، قد يتحلل ألفا- كيتوجلوتارات لإنتاج اثنين من أيونات البيكربونات، والتي تتوفر بعد ذلك كمواد عازلة للأحماض الغذائية. يُفرز الأمونيوم في البول، مما يؤدي إلى فقدان الحمض الصافي. قد تنتشر الأمونيا نفسها عبر الأنابيب الكلوية، وتتحد مع أيون الهيدروجين، وبالتالي تسمح بمزيد من إفراز الحمض.[166]
الإخراج
أيونات الأمونيوم هي منتج فضلات سام ناتج عن الاستقلاب في الحيوانات. في الأسماك واللافقاريات المائية، تفرز مباشرة في الماء. في الثدييات وأسماك القرش والبرمائيات، تتحول إلى يوريا في دورة اليوريا، وهي أقل سمية ويمكن تخزينها بكفاءة أكبر. في الطيور، والزواحف، والقواقع الأرضية، تتحول تحويل الأمونيوم الأيضي إلى حمض البوليك، وهو مادة صلبة ويمكن بالتالي التخلص منها بأقل قدر من فقدان الماء.[167]
خارج كوكب الأرض
اكتشفت الأمونيا في أجواء الكواكب العملاقة مثل المشتري وزحل وأورانوس ونپتون، جنبًا إلى جنب مع غازات أخرى مثل الميثان والهيدروجين والهليوم. قد يشتمل الجزء الداخلي من زحل على بلورات أمونيا مجمدة.[168] كما وُجدت الأمونيا في قمري المريخ ديموس وفوبوس.
الفضاء النجمي
اكتشفت الأمونيا لأول مرة في الفضاء النجمي عام 1968، بناءً على انبعاثات موجات مكروية من اتجاه قلب المجرة.[169] كان هذا هو أول جزيء متعدد الذرات يُكتشف على هذا النحو. إن حساسية الجزيء لمجموعة كبيرة من الإثارة والسهولة التي يمكن ملاحظتها بها في عدد من المناطق جعلت من الأمونيا أحد أهم الجزيئات لدراسات السحب الجزيئية.[170] يمكن استخدام الكثافة النسبية لخطوط الأمونيا لقياس درجة حرارة الوسط المنبعث.
اكتشف الأنواع النظيرية التالية من الأمونيا: NH
3، 15
NH
3، NH
2D، NHD
2، و ND
3. اتبر اكتشاف الأمونيا الثلاثية منزوعة الدوتريوم مفاجأة لأن الديوتيريوم نادر نسبيًا. يُعتقد أن ظروف درجات الحرارة المنخفضة تسمح لهذا الجزيء بالبقاء والتراكم.[171]
منذ اكتشاف الأمونيا بين النجوم، أثبتت أنها أداة طيفية لا تقدر بثمن في دراسة الوسط النجمي. مع وجود عدد كبير من الانتقالات الحساسة لمجموعة واسعة من ظروف الإثارة، اكتشف NH
3 على نطاق واسع على نطاق واسع - وأبلغ عن اكتشافه في مئات المقالات في المجلات. المدرجة أدناه هي عينة من مقالات المجلات التي تسلط الضوء على مجموعة من أجهزة الكشف التي استخدمت لتحديد الأمونيا.
كانت دراسة الأمونيا بين النجوم هامة لعدد من مجالات البحث في العقود القليلة الماضية. تم تحديد بعضها أدناه وتتضمن بشكل أساسي استخدام الأمونيا كمقياس حرارة بين النجوم.
آليات التخليق بين النجوم
تم قياس وفرة الأمونيا بين النجوم لمجموعة متنوعة من البيئات. تتراوح نسبة [NH
3]/[H
2] من 10−7 في السحب الداكنة الصغيرة[172] حتى 10−5 داخل اللب الكثيف في سحابة الجبار الجزيئية.[173] على الرغم من اقتراح ما مجموعه 18 مسار إنتاج إجمالي،[174] آلية التكوين الرئيسية لـ NH
3 بين النجوم كما في المعادلة التالية:
- [NH
4]+
+ e−
→ NH
3 + H
ثابت المعدل، k، من هذا التفاعل يعتمد على درجة حرارة البيئة، بقيمة 5.2×10−6 عند 10 K.[175] يُحسب ثابت المعدل من المعادلة . لتفاعل التكوين الأولي، a = 1.05×10−6 و B = −0.47. بافتراض أن وفرة NH+
4 هي 3×10−7 ووفرة الإلكترون هي 10−7 نموذجي للسحب الجزيئية، سيستمر التكوين بمعدل 1.6×10−9 cm−3s−1 في سحابة جزيئية من الكثافة الكلية 105 cm−3.[176]
جميع تفاعلات التكوين الأخرى المقترحة لها ثوابت معدل تتراوح بين 2 و13 رتبة أصغر، مما يجعل مساهمتها في وفرة الأمونيا ضئيلة نسبيًا.[177] كمثال على المساهمة البسيطة التي تلعبها تفاعلات التكوين الأخرى، فإن التفاعل:
- H
2 + NH
2 → NH
3 + H
بثابت معدل يبلغ 2.2 ×10−15. بافتراض أن كثافة H
2 هي 105 و [NH
2] / [H
2] بمعدل 10−7، يستمر هذا التفاعل بمعدل 2.2 ×10−12، أي أكثر من 3 مرات من حيث الحجم أبطأ من التفاعل الأولي أعلاه.
بعض تفاعلات التكوين المحتملة الأخرى هي:
- H−
+ [NH
4]+
→ NH
3 + H
2 - [PNH
3]+
+ e−
→ P + NH
3
آليات التدمير بين النجوم
هناك إجمالي 113 من ردود الفعل المقترحة تؤدي إلى تدمير NH
3. من بين هؤلاء، تم جدولة 39 رد فعل في جداول شاملة للكيمياء بين مركبات C و N و O.[178] تستشهد مراجعة الأمونيا بين النجوم بالتفاعلات التالية باعتبارها آليات التفكك الرئيسية:[170]
-
NH
3 + [H
3]+
→ [NH
4]+
+ H
2(1)
-
NH
3 + HCO+
→ [NH
4]+
+ CO(2)
مع ثوابت المعدل 4.39×10−9[179] و 2.2×10−9،[180] على التوالي. المعادلات التالية (1، 2) تسير بمعدل 8.8×10−9 و 4.4×10−13، على التوالي. افترضت هذه الحسابات ثوابت المعدل المعطى ووفرة [NH
3]/[H
2] = 10−5، [[H
3]+
]/[H
2] = 2×10−5، [HCO+
]/[H
2] = 2×10−9، والكثافات الإجمالية لـ n = 105، نموذجي للسحب الجزيئية الباردة الكثيفة.[181] من الواضح، بين هذين التفاعلين الأساسيين، المعادلة (1) هو تفاعل التدمير السائد بمعدل 10.000 مرة أسرع من المعادلة (2). يرجع هذا إلى وفرة عالية نسبياً من [H
3]+
.
اكتشافات الهوائي الفردي
تكشف الملاحظات الراديوية لـ NH
3 من تليسكوپ راديو إيفيلسبرگ أن خط الأمونيا مفصول إلى مكونين - حافة خلفية ونواة لم يتم حلها. تتوافق الخلفية جيدًا مع المواقع التي اكتشفت مسبقًا من أول أكسيد الكربون.[182] تحقق تلسكوپ تشيلبولتون في إنگلترة من التوقيعات الراديوية للأمونيا في H II regions، HNH2O ميزر، أجرام H-H، والأشياء الأخرى المرتبطة بتكوين النجوم. تشير المقارنة بين عرض خط الانبعاث إلى أن السرعات المضطربة أو المنهجية لا تزداد في النوى المركزية للسحب الجزيئية.[183]
لوحظ إشعاع الميكروويڤ من الأمونيا في العديد من الأجرام المجرية بما في ذلك W3 (OH) والجبار أ و W43 و W51 وخمسة مصادر في مركز المجرة. يشير معدل الكشف المرتفع إلى أن هذا جزيء شائع في الوسط بين النجوم وأن المناطق عالية الكثافة شائعة في المجرة.[184]
دراسات قياس التداخل
كشفت ملاحظات المصفوفة بالغة الكبر لـ NH
3 في سبع مناطق ذات تدفقات غازية عالية السرعة عن تكاثف أقل من 0.1 pc في L1551 و S140 و الملتهب A. تم الكشف عن ثلاثة تكاثفات فردية في الملتهب A، أحدها ذو شكل ممدود للغاية. قد يلعبون دورًا مهمًا في خلق التدفق ثنائي القطب في المنطقة.[185]
صورت الأمونيا خارج المجرة باستخدام VLA في IC 342. يحتوي الغاز الساخن على درجات حرارة أعلى من 70 كلڤن، والتي استنتجت من نسب خط الأمونيا ويبدو أنها مرتبطة ارتباطًا وثيقًا بالأجزاء الأعمق من الشريط النووي التي تظهر في ثاني أكسيد الكربون.[186] كما رُصد NH
3 أيضاً بواسطة المصفوفة بالغة الكبرى على عينة من أربع مناطق مجرية فائقة الصغر HII: G9.62 + 0.19 ، G10.47 + 0.03 G29.96-0.02، و G31.41 + 0.31. استنادًا إلى تشخيصات درجة الحرارة والكثافة، استنتج أن هذه التكتلات بشكل عام هي على الأرجح مواقع تشكل النجوم الضخمة في مرحلة تطورية مبكرة قبل تطوير المنطقة HII فائقة الصغر.[187]
الرصد بالأشعة تحت الحمراء
تم تسجيل الامتصاص عند 2.97 ميكرومتر للأمونيا الصلبة من حبيبات بين النجوم في جرم بكلين-نيوگباور وربما في NGC 2264-IR أيضًا. ساعد هذا الاكتشاف في تفسير الشكل المادي لخطوط امتصاص الجليد ذات الصلة وغير المفهومة سابقًا.[188]
تم الحصول على طيف لقرص المشتري من مرصد كويپر المحمول جواً، بناطق طيفي يبلغ 100 إلى 300 سم−1 يوفر التحليل الطيفي معلومات عن الخصائص المتوسطة العالمية لغاز الأمونيا وضباب جليد الأمونيا.[189]
جرى مسح ما مجموعه 149 موقعًا للسحب المظلمة بحثًا عن دليل على "النوى الكثيفة" باستخدام (J، K) = (1،1) خط الانعكاس الدوار لـ NH 3 . بشكل عام، لا تتشكل النوى بشكل كروي، مع نسب أبعاد تتراوح من 1.1 إلى 4.4. وجد أيضًا أن النوى ذات النجوم لها خطوط أوسع من النوى بدون نجوم.[190]
جرى الكشف عن الأمونيا في سديم التنين وفي واحدة أو ربما اثنتين من السحب الجزيئية، والتي ترتبط بالسدم السمحاقية المجرية high-latitude. تكمن أهمية هذا الاكتشاف لأنه قد يمثل أماكن ولادة المجموعة الأولى من النجوم المعدنية من النوع B في هالة المجرة التي يمكن أن تكون محمولة في قرص المجرة.[191]
الرصد في السحب السوداء القريبة
من خلال الموازنة بين الانبعاث المستحث والانبعاث التلقائي، من الممكن بناء علاقة بين درجة حرارة الإثارة والكثافة. علاوة على ذلك، نظرًا لأنه يمكن تقريب المستويات الانتقالية للأمونيا بواسطة نظام من مستويين عند درجات حرارة منخفضة، فإن هذا الحساب بسيط إلى حد ما. يمكن تطبيق هذه الفرضية على السحب السوداء، والمناطق المشتبه في وجود درجات حرارة منخفضة للغاية والمواقع المحتملة لتشكيل النجوم في المستقبل. تُظهر عمليات الكشف عن الأمونيا في السحب السوداء خطوطًا ضيقة جدًا - لا تشير فقط إلى درجات الحرارة المنخفضة، لكن أيضًا على مستوى منخفض من اضطراب السحب الداخلية. توفر حسابات نسبة الخط قياسًا لدرجة حرارة السحابة بشكل مستقل عن ملاحظات أول أكسيد الكربون السابقة. كانت ملاحظات الأمونيا متوافقة مع قياسات ثاني أكسيد الكربون لدرجات حرارة دوران ≈10 ك.باستخدام هذه القياسات، يمكن تحديد الكثافات، وتم حسابها لتتراوح بين 104 و 105 سم−3 في السحب السوداء. يعطي رسم خرائط NH
3 أحجامًا نموذجية للسحب تبلغ 0.1 pc وكتل قريبة من كتلة شمسية واحدة. هذه النوى الباردة الكثيفة هي مواقع تشكل النجوم في المستقبل.
مناطق UC HII
تعد مناطق HII شديدة الصغر من بين أفضل أدوات التتبع لتشكيل النجوم عالية الكتلة. من المحتمل أن تكون المادة الكثيفة المحيطة بمناطق UCHII جزيئية في المقام الأول. نظرًا لأن الدراسة الكاملة لتشكيل النجوم الضخم تتضمن بالضرورة السحابة التي تشكل منها النجم، فإن الأمونيا هي أداة لا تقدر بثمن في فهم هذه المادة الجزيئية المحيطة. نظرًا لأنه يمكن حل هذه المادة الجزيئية مكانيًا، فمن الممكن تقييد مصادر التسخين/المؤينة ودرجات الحرارة والكتل وأحجام المناطق. تسمح مكونات سرعة إزاحة دوبلر بفصل مناطق متميزة من الغاز الجزيئي التي يمكن أن تتبع التدفقات الخارجة والنوى الساخنة الناشئة من النجوم المتكونة.
التواجد خارج المجرة
تم التحقق من وجود الأمونيا في المجرات الخارجية،[192][193] ومن خلال قياس عدة خطوط في وقت واحد، يمكن قياس درجة حرارة الغاز في هذه المجرات مباشرة. تشير نسب الخط إلى أن درجات حرارة الغاز تكون دافئة (≈50 K)، قادمة من غيوم كثيفة بأحجام عشرات pc. تتوافق هذه الصورة مع الصورة الموجودة داخل درب التبانة حيث تتكون النوى الجزيئية الكثيفة الساخنة للمجرة حول النجوم المتكونة حديثًا والمضمنة في سحب أكبر من المواد الجزيئية على مقياس من عدة مئات من أجهزة الكمبيوتر (السحب الجزيئية العملاقة؛ GMCs).
انظر أيضاً
- أمونيا (صفحة بيانات)
- نافورة الأمونيا
- إنتاج الأمونيا
- محلول الأمونيا – مركب كيميائي
- الثمن النسبي للكهرباء المولدة من المصادر المختلفة
- تشكل الغاز
- عملية هابر – Industrial process for ammonia production
- هيدرازين
- تنقية المياه
المصادر
- ^ "NOMENCLATURE OF INORGANIC CHEMISTRY IUPAC Recommendations 2005" (PDF).
- ^ "Gases – Densities". Retrieved 3 March 2016.
- ^ Yost, Don M. (2007). "Ammonia and Liquid Ammonia Solutions". Systematic Inorganic Chemistry. READ BOOKS. p. 132. ISBN 978-1-4067-7302-6.
- ^ Blum, Alexander (1975). "On crystalline character of transparent solid ammonia". Radiation Effects and Defects in Solids. 24 (4): 277. doi:10.1080/00337577508240819.
- ^ Budavari, Susan, ed. (1996). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (12th ed.). Merck. ISBN 978-0-911910-12-4.
- ^ Perrin, D. D., Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution; 2nd Ed., Pergamon Press: Oxford, 1982.
- ^ Iwasaki, Hiroji; Takahashi, Mitsuo (1968). "Studies on the transport properties of fluids at high pressure". The Review of Physical Chemistry of Japan. 38 (1).
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ أ ب "Ammonia". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Sigma-Aldrich Co., Ammonia.
- ^ NIOSH Pocket Guide to Chemical Hazards 0028
- ^ Hannah, Ritchie. "How many people does synthetic fertilizer feed?". Our World in Data. Our World in Data. Retrieved 4 September 2021.
- ^ "Ammonia Technology Roadmap – Analysis".
- ^ "40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities". Government Printing Office.
{{cite web}}:|archive-date=requires|archive-url=(help) - ^ أ ب "Mineral Commodity Summaries 2020, p. 117 – Nitrogen" (PDF). USGS. 2020. Archived (PDF) from the original on 2022-10-09. Retrieved 12 February 2020.
- ^ "Nitrogen (fixed) - ammonia statistics". USGS. 2017. Retrieved 12 February 2020.
- ^ "Global ammonia annual production capacity".
- ^ "Mitsubishi Heavy Industries BrandVoice: Scaling Ammonia Production for the World's Food Supply". Forbes.
- ^ R. Norris Shreve; Joseph Brink (1977). Chemical Process Industries (4th ed.). p. 276. ISBN 978-0-07-057145-7. See also Gas carrier and Bottled gas.
- ^ "Ammonium hydroxide physical properties" (PDF). Archived from the original (PDF) on 27 November 2007.
- ^ "Pliny the Elder, The Natural History, BOOK XXXI. REMEDIES DERIVED FROM THE AQUATIC PRODUCTION, CHAP. 39. (7.)—THE VARIOUS KINDS OF SALT; THE METHODS OF PREPARING IT, AND THE REMEDIES DERIVED FROM IT. TWO HUNDRED AND FOUR OBSERVATIONS THERE UPON". www.perseus.tufts.edu.
- ^ Hoover, Herbert (1950). Georgius Agricola De Re Metallica - Translated from the first Latin edition of 1556. New York: Dover Publications. p. 560. ISBN 978-0486600062.
- ^ "Siwa, Egypt".
- ^ أ ب ت ث ج ح خ د Chisholm 1911, p. 861.
- ^ Shannon, Francis Patrick (1938) Tables of the properties of aqua-ammonia solutions. Part 1 of The Thermodynamics of Absorption Refrigeration. Lehigh University studies. Science and technology series
- ^ An ammonia-water slurry may swirl below Pluto's icy surface. Purdue University (9 November 2015)
- ^ Pimputkar, Siddha; Nakamura, Shuji (January 2016). "Decomposition of supercritical ammonia and modeling of supercritical ammonia–nitrogen–hydrogen solutions with applicability toward ammonothermal conditions". The Journal of Supercritical Fluids. 107: 17–30. doi:10.1016/j.supflu.2015.07.032.
- ^ Hewat, A. W.; Riekel, C. (1979). "The crystal structure of deuteroammonia between 2 and 180 K by neutron powder profile refinement". Acta Crystallographica Section A. 35 (4): 569. Bibcode:1979AcCrA..35..569H. doi:10.1107/S0567739479001340.
- ^ White, Alfred H.; Melville, Wm. (April 1905). "The Decomposition of Ammonia at High Temperatures". Journal of the American Chemical Society (in الإنجليزية). 27 (4): 373–386. doi:10.1021/ja01982a005. ISSN 0002-7863.
- ^ أ ب ت Neufeld, R.; Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). "Introducing a Hydrogen-Bond Donor into a Weakly Nucleophilic Brønsted Base: Alkali Metal Hexamethyldisilazides (MHMDS, M = Li, Na, K, Rb and Cs) with Ammonia". Chem. Eur. J. 22 (35): 12340–12346. doi:10.1002/chem.201600833. PMID 27457218.
- ^ أ ب ت Combellas, C; Kanoufi, F; Thiébault, A (2001). "Solutions of solvated electrons in liquid ammonia". Journal of Electroanalytical Chemistry. 499: 144–151. doi:10.1016/S0022-0728(00)00504-0.
- ^ أ ب Haynes, William M., ed. (2013). CRC Handbook of Chemistry and Physics (94th ed.). CRC Press. pp. 9–26. ISBN 9781466571143.
- ^ Cleeton, C. E.; Williams, N. H. (1934). "Electromagnetic Waves of 1.1 cm (0 in). Wave-Length and the Absorption Spectrum of Ammonia". Physical Review. 45 (4): 234. Bibcode:1934PhRv...45..234C. doi:10.1103/PhysRev.45.234.
- ^ أ ب ت Chisholm 1911, p. 862.
- ^ Baker, H. B. (1894). "Influence of moisture on chemical change". J. Chem. Soc. 65: 611–624. doi:10.1039/CT8946500611.
- ^ "Ammonia". PubChem.
- ^ Kobayashi, Hideaki; Hayakawa, Akihiro; Somarathne, K.D. Kunkuma A.; Okafor, Ekenechukwu C. (2019). "Science and technology of ammonia combustion". Proceedings of the Combustion Institute. 37: 109–133. doi:10.1016/j.proci.2018.09.029.
- ^ Khan, A.S.; Kelley, R.D.; Chapman, K.S.; Fenton, D.L. (1995). Flammability limits of ammonia-air mixtures. U.S.: U.S. DOE Office of Scientific and Technical Information. OSTI 215703.
- ^ Shrestha, Krishna P.; Seidel, Lars; Zeuch, Thomas; Mauss, Fabian (2018-07-07). "Detailed kinetic mechanism for the oxidation of ammonia including the formation and reduction of nitrogen oxides" (PDF). Energy & Fuels. 32 (10): 10202–10217. doi:10.1021/acs.energyfuels.8b01056. ISSN 0887-0624. S2CID 103854263. Archived (PDF) from the original on 2022-10-09.
- ^ Sterrett, K. F.; Caron, A. P. (1966). "High pressure chemistry of hydrogenous fuels". Northrop Space Labs. Archived from the original on 23 August 2011. Retrieved 24 December 2009.
- ^ Laurence, C. and Gal, J-F. Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50-51 ISBN 978-0-470-74957-9
- ^ Cramer, R. E.; Bopp, T. T. (1977). "Graphical display of the enthalpies of adduct formation for Lewis acids and bases". Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. تستخدم المخططات الموضحة في هذه الورقة تستخدم كمتغيرات أقدم. أدرجت متغيرات E&C المحسّنة في نموذج ECW.
- ^ أ ب Chisholm 1911, p. 863.
- ^ (OSHA) Source: Sax, N. Irving (1984) Dangerous Properties of Industrial Materials. 6th Ed. Van Nostrand Reinhold. ISBN 0-442-28304-0.
- ^ Hurtado, J. L. Martinez; Lowe, C. R. (2014). "Ammonia-Sensitive Photonic Structures Fabricated in Nafion Membranes by Laser Ablation". ACS Applied Materials & Interfaces. 6 (11): 8903–8908. doi:10.1021/am5016588. ISSN 1944-8244. PMID 24803236.
- ^ Herodotus with George Rawlinson, trans., The History of Herodotus (New York, New York: Tandy-Thomas Co., 1909), vol.2, Book 4, § 181, pp. 304–305.
- ^ The land of the Ammonians is mentioned elsewhere in Herodotus' History and in Pausanias' Description of Greece:
- Herodotus with George Rawlinson, trans., The History of Herodotus (New York, New York: Tandy-Thomas Co., 1909), vol. 1, Book 2, § 42, p. 245, vol. 2, Book 3, § 25, p. 73, and vol. 2, Book 3, § 26, p. 74.
- Pausanias with W.H.S. Jones, trans., Description of Greece (London, England: William Heinemann Ltd., 1979), vol. 2, Book 3, Ch. 18, § 3, pp. 109 and 111 and vol. 4, Book 9, Ch. 16, § 1, p. 239.
- ^ Kopp, Hermann, Geschichte der Chemie [History of Chemistry] (Braunschweig, (Germany): Friedrich Vieweg und Sohn, 1845), Part 3, p. 237. [in German]
- ^ Chisholm 1911 cites Pliny Nat. Hist. xxxi. 39. See: Pliny the Elder with John Bostock and H. T. Riley, ed.s, The Natural History (London, England: H. G. Bohn, 1857), vol. 5, Book 31, § 39, p. 502.
- ^ "Sal-ammoniac". Webmineral. Retrieved 7 July 2009.
- ^ Pliny also mentioned that when some samples of what was purported to be natron (Latin: nitrum, impure sodium carbonate) were treated with lime (calcium carbonate) and water, the natron would emit a pungent smell, which some authors have interpreted as signifying that the natron either was ammonium chloride or was contaminated with it. See:
- Pliny with W.H.S. Jones, trans., Natural History (London, England: William Heinemann Ltd., 1963), vol. 8, Book 31, § 46, pp. 448–449. From pp. 448–449: "Adulteratur in Aegypto calce, deprehenditur gusto. Sincerum enim statim resolvitur, adulteratum calce pungit et asperum [or aspersum] reddit odorem vehementer." (In Egypt it [i.e., natron] is adulterated with lime, which is detected by taste; for pure natron melts at once, but adulterated natron stings because of the lime, and emits a strong, bitter odour [or: when sprinkled [(aspersum) with water] emits a vehement odour])
- Kidd, John, Outlines of Mineralogy (Oxford, England: N. Bliss, 1809), vol. 2, p. 6.
- Moore, Nathaniel Fish, Ancient Mineralogy: Or, An Inquiry Respecting Mineral Substances Mentioned by the Ancients: ... (New York, New York: G. & C. Carvill & Co., 1834), pp. 96–97.
- ^ See:
- Forbes, R.J., Studies in Ancient Technology, vol. 5, 2nd ed. (Leiden, Netherlands: E.J. Brill, 1966), pp. 19, 48, and 65.
- Moeller, Walter O., The Wool Trade of Ancient Pompeii (Leiden, Netherlands: E.J. Brill, 1976), p. 20.
- Faber, G.A. (pseudonym of: Goldschmidt, Günther) (May 1938) "Dyeing and tanning in classical antiquity," Ciba Review, 9 : 277–312. Available at: Elizabethan Costume
- Smith, William, A Dictionary of Greek and Roman Antiquities (London, England: John Murray, 1875), article: "Fullo" (i.e., fullers or launderers), pp. 551–553.
- Rousset, Henri (31 March 1917) "The laundries of the Ancients," Scientific American Supplement, 83 (2152) : 197.
- Bond, Sarah E., Trade and Taboo: Disreputable Professions in the Roman Mediterranean (Ann Arbor, Michigan: University of Michigan Press, 2016), p. 112.
- Binz, Arthur (1936) "Altes und Neues über die technische Verwendung des Harnes" (Ancient and modern [information] about the technological use of urine), Zeitschrift für Angewandte Chemie, 49 (23) : 355–360. [in German]
- Witty, Michael (December 2016) "Ancient Roman urine chemistry," Acta Archaeologica, 87 (1) : 179–191. Witty speculates that the Romans obtained ammonia in concentrated form by adding wood ash (impure potassium carbonate) to urine that had been fermented for several hours. Struvite (magnesium ammonium phosphate) is thereby precipitated, and the yield of struvite can be increased by then treating the solution with bittern, a magnesium-rich solution that is a byproduct of making salt from sea water. Roasting struvite releases ammonia vapors.
- ^ Lenkeit, Roberta Edwards (2018-10-23). High Heels and Bound Feet: And Other Essays on Everyday Anthropology, Second Edition (in الإنجليزية). Waveland Press. p. 72. ISBN 978-1-4786-3841-4.
- ^ Perdigão, Jorge (2016-08-03). Tooth Whitening: An Evidence-Based Perspective (in الإنجليزية). Springer. p. 170. ISBN 978-3-319-38849-6.
- ^ Bonitz, Michael; Lopez, Jose; Becker, Kurt; Thomsen, Hauke (2014-04-09). Complex Plasmas: Scientific Challenges and Technological Opportunities (in الإنجليزية). Springer Science & Business Media. p. 465. ISBN 978-3-319-05437-7.
- ^ Haq, Syed Nomanul (1995). Names, Natures and Things: The Alchemist Jabir Ibn Hayyan and His Kitab Al-Ahjar (Book of Stones). Springer. ISBN 978-0-7923-3254-1.
- ^ Spiritus salis urinæ (spirit of the salt of urine, i.e., ammonium carbonate) had apparently been produced before Valentinus, although he presented a new, simpler method for preparing it in his book: Valentinus, Basilius, Vier Tractätlein Fr. Basilii Valentini ... [Four essays of Brother Basil Valentine ... ] (Frankfurt am Main, (Germany): Luca Jennis, 1625), "Supplementum oder Zugabe" (Supplement or appendix), pp. 80–81: "Der Weg zum Universal, damit die drei Stein zusammen kommen." (The path to the Universal, so that the three stones come together.). From p. 81: "Der Spiritus salis Urinæ nimbt langes wesen zubereiten / dieser proceß aber ist waß leichter unnd näher auß dem Salz von Armenia, ... Nun nimb sauberen schönen Armenischen Salz armoniac ohn alles sublimiren / thue ihn in ein Kolben / giesse ein Oleum Tartari drauff / daß es wie ein Muß oder Brey werde / vermachs baldt / dafür thu auch ein grosen vorlag / so lege sich als baldt der Spiritus Salis Urinæ im Helm an Crystallisch ... " (Spirit of the salt of urine [i.e., ammonium carbonate] requires a long method [i.e., procedure] to prepare; this [i.e., Valentine's] process [starting] from the salt from Armenia [i.e., ammonium chloride], however, is somewhat easier and shorter ... Now take clean nice Armenian salt, without sublimating all [of it]; put it in a [distillation] flask; pour oil of tartar [i.e., potassium carbonate that has dissolved only in the water that it has absorbed from the air] on it, [so] that it [i.e., the mixture] becomes like a mush or paste; assemble it [i.e., the distilling apparatus (alembic)] quickly; for that [purpose] connect a large receiving flask; then soon spirit of the salt of urine deposits as crystals in the "helmet" [i.e., the outlet for the vapors, which is atop the distillation flask] ...)
See also: Kopp, Hermann, Geschichte der Chemie [History of Chemistry] (Braunschweig, (Germany): Friedrich Vieweg und Sohn, 1845), Part 3, p. 243. [in German] - ^ Maurice P. Crosland (2004). Historical Studies in the Language of Chemistry. Courier Dover Publications. p. 72. ISBN 978-0-486-43802-3.
- ^ Black, Joseph (1893) [1755]. Experiments upon magnesia alba, quick-lime, and other alcaline substances. Edinburgh: W.F. Clay.
- ^ Jacobson, Mark Z. (2012-04-23). Air Pollution and Global Warming: History, Science, and Solutions (in الإنجليزية). Cambridge University Press. ISBN 9781107691155.
- ^ "Woulfe's bottle". Chemistry World (in الإنجليزية). Retrieved 2017-07-01.
- ^ Woulfe, Peter (1767-01-01). "Experiments on the Distillation of Acids, Volatile Alkalies, &c. Shewing How They May be Condensed without Loss, and How Thereby We May Avoid Disagreeable and Noxious Fumes: In a Letter from Mr. Peter Woulfe, F. R. S. to John Ellis, Esq; F. R. S." Philosophical Transactions (in الإنجليزية). 57: 517–536. Bibcode:1767RSPT...57..517W. doi:10.1098/rstl.1767.0052. ISSN 0261-0523.
- ^ Pictorial life history of the apothecary chemist Carl Wilhelm Scheele. American Institute of the History of Pharmacy. 1942. hdl:1811/28946/Pictorial%20Life%20History_Scheele.pdf.
- ^ See:
- Priestley, Joseph (1773) "Extrait d'une lettre de M. Priestley, en date du 14 Octobre 1773" (Extract of a letter from Mr. Priestley, dated 14 October 1773), Observations sur la Physique ..., 2 : 389.
- Priestley, Joseph, Experiments and Observations on Different Kinds of Air, vol. 1, 2nd ed. (London, England: 1775), Part 2, § 1: Observations on Alkaline Air, pp. 163–177.
- Schofield, Robert E., The Enlightened Joseph Priestley: A Study of His Life and Work from 1773 to 1804 (University Park, Pennsylvania: Pennsylvania State University Press, 2004), pp. 93–94.
- By 1775, Priestley had observed that electricity could decompose ammonia ("alkaline air"), yielding a flammable gas (hydrogen). See: Priestley, Joseph, Experiments and Observations on Different Kinds of Air, vol. 2 (London, England: J. Johnson, 1775), pp. 239–240.
- ^ Berthollet (1785) "Analyse de l'alkali volatil" (Analysis of volatile alkali), Mémoires de l'Académie Royale des Sciences, 316–326.
- ^ أ ب Max Appl (2006). "Ammonia". Ammonia, in Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
- ^ Smith, Roland (2001). Conquering Chemistry. Sydney: McGraw-Hill. ISBN 978-0-07-470146-1.
- ^ موفق شخاشيرو. "النشادر". الموسوعة العربية. Retrieved 2012-04-02.
- ^ Edwin M. Kaiser (2001). "Calcium–Ammonia". Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rc003. ISBN 978-0471936237.
- ^ Lassaletta, Luis; Billen, Gilles; Grizzetti, Bruna; Anglade, Juliette; Garnier, Josette (2014). "50-year trends in nitrogen use efficiency of world cropping systems: the relationship between yield and nitrogen input to cropland". Environmental Research Letters (in الإنجليزية). 9 (10): 105011. Bibcode:2014ERL.....9j5011L. doi:10.1088/1748-9326/9/10/105011. ISSN 1748-9326.
- ^ David Brown (18 April 2013). "Anhydrous ammonia fertilizer: abundant, important, hazardous". Washington Post. Retrieved 23 April 2013.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- ^ "The Facts About Ammonia". www.health.ny.gov (in الإنجليزية الأمريكية). Retrieved 2018-04-06.
- ^ "OSHA Hazard Communication Standard: Safety Data Sheets" (PDF). OSHA. Archived (PDF) from the original on 2022-10-09.
- ^ Rizk-Ouaini, Rosette; Ferriol, Michel; Gazet, Josette; Saugier-Cohen Adad; Marie Therese (2006). Oxidation reaction of ammonia with sodium hypochlorite. Production and degradation reactions of chloramines. Vol. 4. p. 512. doi:10.1002/14356007.a02_143.pub2. ISBN 978-3527306732.
{{cite book}}:|journal=ignored (help) - ^ Barry, Keith. "How To Clean Your Car's Interior". Consumer Reports. Retrieved 2021-01-31.
- ^ "Applications of Anhydrous Ammonia and Aqueous Ammonia". www.mysoreammonia.com. Retrieved 2022-02-02.
- ^ Samuel Rideal (1895). Disinfection and Disinfectants: An Introduction to the Study of. London: Charles Griffin and Company. p. 109.
- ^ Tajkarimi, Mehrdad; Riemann, H. P.; Hajmeer, M. N.; Gomez, E. L.; Razavilar, V.; Cliver, D. O.; et al. (2008). "Ammonia disinfection of animal feeds – Laboratory study". International Journal of Food Microbiology. 122 (1–2): 23–28. doi:10.1016/j.ijfoodmicro.2007.11.040. PMID 18155794.
- ^ Kim, J. S.; Lee, Y. Y.; Kim, T. H. (January 2016). "A review on alkaline pretreatment technology for bioconversion of lignocellulosic biomass". Bioresource Technology. 199: 42–48. doi:10.1016/j.biortech.2015.08.085. PMID 26341010.
- ^ "Evaluation of Treatment Methods for Reducing Bacteria in Textured Beef", Jensen, Jean L et al., American Society of Agricultural and Biological Engineers Annual Meeting 2009
- ^ Reference Document: Antimicrobial Interventions for Beef, Dawna Winkler and Kerri B. Harris, Center for Food Safety, Department of Animal Science, Texas A&M University, May 2009, page 12
- ^ Moss, Michael (3 October 2009). "The Burger That Shattered Her Life". The New York Times.
- ^ Moss, Michael (31 December 2009). "Safety of Beef Processing Method Is Questioned". The New York Times.
- ^ أ ب ت Lan, Rong; Tao, Shanwen (28 August 2014). "Ammonia as a suitable fuel for fuel cells". Frontiers in Energy Research. 2: 35. doi:10.3389/fenrg.2014.00035.
- ^ Giddey, S.; Badwal, S. P. S.; Munnings, C.; Dolan, M. (10 October 2017). "Ammonia as a Renewable Energy Transportation Media". ACS Sustainable Chemistry & Engineering. 5 (11): 10231–10239. doi:10.1021/acssuschemeng.7b02219.
- ^ Afif, Ahmed; Radenahmad, Nikdilila; Cheok, Quentin; Shams, Shahriar; Hyun Kim, Jung; Azad, Abul (2016-02-12). "Ammonia-fed fuel cells: a comprehensive review". Renewable and Sustainable Energy Reviews. 60: 822–835. doi:10.1016/j.rser.2016.01.120. Retrieved 2021-01-01.
- ^ David, William I. F.; Makepeace, Joshua W.; Callear, Samantha K.; Hunter, Hazel M. A.; Taylor, James D.; Wood, Thomas J.; Jones, Martin O. (2014-09-24). "Hydrogen Production from Ammonia Using Sodium Amide". Journal of the American Chemical Society. 136 (38): 13082–13085. doi:10.1021/ja5042836. ISSN 0002-7863. PMID 24972299.
- ^ Lucentini, Ilaria; García Colli, Germán; Luzi, Carlos D.; Serrano, Isabel; Martínez, Osvaldo M.; Llorca, Jordi (2021-06-05). "Catalytic ammonia decomposition over Ni-Ru supported on CeO2 for hydrogen production: Effect of metal loading and kinetic analysis". Applied Catalysis B: Environmental (in الإنجليزية). 286: 119896. doi:10.1016/j.apcatb.2021.119896. ISSN 0926-3373. S2CID 233540470.
- ^ Douglas Self (1 October 2007). "Ammonia Motors". Retrieved 28 November 2010.
- ^ Louis C. Hennick; Elbridge Harper Charlton (1965). The Streetcars of New Orleans. Pelican Publishing. pp. 14–16. ISBN 9781455612598.
- ^ أ ب "Ammonia as a Transportation Fuel IV" (PDF). Norm Olson – Iowa Energy Center. 15–16 October 2007. Archived from the original (PDF) on 7 February 2012.
- ^ Lee, Dongeun; Min, Hyungeun; Park, Hyunho; Song, Han Ho (2017-11-01). "Development of new combustion strategy for internal combustion engine fueled by pure ammonia" (PDF). Seoul National University, Department of Mechanical Engineering. Archived (PDF) from the original on 2022-10-09. Retrieved 2019-01-29.
- ^ Brohi, Emtiaz Ali (2014). "Ammonia as fuel for internal combustion engines?" (PDF). Chalmers University of Technology. Archived (PDF) from the original on 2022-10-09. Retrieved 2019-01-29.
- ^ Elucidare (2 February 2008). "Ammonia: New possibilities for hydrogen storage and transportation" (PDF). Elucidare Limited. Archived (PDF) from the original on 8 October 2010.
- ^ "Ammonia". chm.bris.ac.uk. Retrieved 3 March 2016.
- ^ Zacharakis-Jutz, George; Kong, Song-Charng (2013). "Characteristics of an SI Engine Using Direct Ammonia Injection" (PDF). Department of Mechanical Engineering, Iowa State University. Archived (PDF) from the original on 2022-10-09. Retrieved 2019-01-29.
- ^ "Green ammonia | Royal Society". royalsociety.org.
- ^ Ammonia Powered Car at YouTube
- ^ "Watch 'Ammonia Fuel'". Greg Vezina. Retrieved 7 July 2009.
- ^ "Welcome to NH3 Car". NH3Car.com.
- ^ Lindzon, Jared (27 February 2019). "He's Creating a New Fuel Out of Thin Air – for 85 Cents per Gallon". OZY. Retrieved 26 April 2019.
- ^ 'Carbon-free fuel': Australian hydrogen car breakthrough could go global, Lexy Hamilton-Smith, ABC News Online, 2018-08-08
- ^ "Saudi Arabia Sends Blue Ammonia to Japan in World-First Shipment". Bloomberg.com. 2020-09-27. Retrieved 2020-09-28.
- ^ Service, Robert F. (2018-07-12). "Ammonia—a renewable fuel made from sun, air, and water—could power the globe without carbon". Science | AAAS (in الإنجليزية). Retrieved 2020-09-28.
- ^ "Will Saudi Arabia build the world's largest green hydrogen and ammonia plant?". energypost.eu. 2020-09-17. Retrieved 2020-10-09.
- ^ "DSME gets LR AIP for ammonia-fueled 23,000 TEU boxship". Offshore Energy. 6 October 2020. Retrieved 9 October 2020.
- ^ "What will power aircraft in the future?". Aviafuture. 30 March 2022. Retrieved 24 May 2022.
- ^ "Japan to advance ammonia co-firing technology". Argus Media. 24 June 2021. Retrieved 8 November 2021.
- ^ "First International Conference on Fuel Ammonia 2021". ICFA. 6 October 2021. Retrieved 7 November 2021.
- ^ "First International Conference on Fuel Ammonia Held". METI, Japan. 12 October 2021. Retrieved 7 November 2021.
- ^ "CO2-free power generation achieved with the world's first gas turbine using 100% liquid ammonia" (Press release). IHI Corporation. 16 June 2022. Retrieved 1 July 2022.
- ^ Masaya Kato (14 July 2022). "Quad members agree to promote hydrogen, ammonia fuel tech". The Nikkei. Retrieved 14 July 2022.
- ^ "On the use of ammonia as a fuel – A perspective" (PDF).
- ^ "Nitrogen Oxides as a By-product of Ammonia/Hydrogen Combustion Regimes" (PDF).
- ^ "Diesel: Greener Than You Think". Archived from the original on 10 May 2008. Retrieved 7 July 2009.
- ^ "Phosgene: Health and Safety Guide". International Programme on Chemical Safety. 1998.
- ^ "MOL studies ammonia FSRU concept". Offshore Energy (in الإنجليزية الأمريكية). 2022-02-03. Retrieved 2022-02-03.
- ^ Collins (l_collins), Leigh (2022-01-27). "SPECIAL REPORT | Why shipping pure hydrogen around the world might already be dead in the water | Recharge". Recharge | Latest renewable energy news (in الإنجليزية). Retrieved 2022-02-03.
- ^ Wright, Jerry (2015-04-13). "Cooling System Keeps Space Station Safe, Productive". NASA (in الإنجليزية). Retrieved 2017-07-01.
- ^ "International Space Station's Cooling System: How It Works (Infographic)". Space.com. Retrieved 2017-07-01.
- ^ "Reducing Hydrofluorocarbon (HFC) Use and Emissions in the Federal Sector through SNAP" (PDF). Archived (PDF) from the original on 2022-10-09. Retrieved 2018-12-02.
- ^ "Anhydrous ammonia tank locks have flaws". Cedar Rapids Gazette. 6 October 2009.
- ^ "Illinois Attorney General | Basic Understanding of Meth". Illinoisattorneygeneral.gov. Archived from the original on 10 September 2010. Retrieved 21 May 2011.
- ^ Greenberg, Michael I. (2003-01-01). Occupational, Industrial, and Environmental Toxicology (in الإنجليزية). Elsevier Health Sciences. ISBN 978-0323013406.
- ^ Włochowicz, A.; Stelmasiak, E. (1983). "Change in thermal properties of wool after treatment with liquid ammonia". Journal of Thermal Analysis and Calorimetry. 26 (1): 17. doi:10.1007/BF01914084. S2CID 96930751.
- ^ Horkheimer, Donald (2005). "Ammonia - A Solution for Airships Demanding Rapid Changes in Net Buoyancy". AIAA 5th ATIO and16th Lighter-Than-Air Sys Tech. And Balloon Systems Conferences. doi:10.2514/6.2005-7393. ISBN 978-1-62410-067-3. Retrieved 27 October 2022.
{{cite book}}:|website=ignored (help) - ^ Fuming white oak. woodweb.com
- ^ minerals year book, vol. 3
- ^ "Toxic FAQ Sheet for Ammonia" (PDF). Agency for Toxic Substances and Disease Registry (ATSDR). September 2004. Archived (PDF) from the original on 2022-10-09.
- ^ Ammonia, IDLH Documentation
- ^ Is Anhydrous Ammonia covered under the Hazardous Materials Safety Permit Program? from the website of the United States Department of Transportation (DOT)
- ^ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2002). "23.4: Ammonium Ion is Converted into Urea in Most Terrestrial Vertebrates". Biochemistry (5th ed.).
- ^ Wang, Mingyi; Kong, Weimeng; Marten, Ruby; He, Xu-Cheng; Chen, Dexian; Pfeifer, Joschka; Heitto, Arto; Kontkanen, Jenni; Dada, Lubna; Kürten, Andreas; Yli-Juuti, Taina (2020-05-13). "Rapid growth of new atmospheric particles by nitric acid and ammonia condensation". Nature (in الإنجليزية). 581 (7807): 184–189. Bibcode:2020Natur.581..184W. doi:10.1038/s41586-020-2270-4. ISSN 1476-4687. PMC 7334196. PMID 32405020.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smoke". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ "Cutting-Edge Solutions For Coking Wastewater Reuse To Meet The Standard of Circulation Cooling Systems". www.wateronline.com. Retrieved 2016-01-16.
- ^ Vasudevan Rajaram; Subijoy Dutta; Krishna Parameswaran (30 June 2005). Sustainable Mining Practices: A Global Perspective. CRC Press. p. 113. ISBN 978-1-4398-3423-7.
- ^ أ ب ت Oram, Brian. "Ammonia in Groundwater, Runoff, and Streams". The Water Centre. Retrieved 3 December 2014.
- ^ Hargreaves, J.A.; Tucker, C.S. (2004). Managing ammonia in fish ponds. Southern Regional Aquaculture Center.
- ^ أ ب ت Sergeant, Chris (5 February 2014). "The Management of Ammonia Levels in an Aquaculture Environment". Water/Wastewater. Retrieved 3 December 2014.
- ^ Electronic Code of Federal Regulations: Archived 4 نوفمبر 2011 at the Wayback Machine. Ecfr.gpoaccess.gov. Retrieved on 22 December 2011.
- ^ "Ammonia Tanks - Carbon and Stainless Steel Construction". ammoniatanks.com. Retrieved 2021-06-28.
- ^ "Nitrogen Statistics and Information U.S. Geological Survey". www.usgs.gov. Retrieved 24 January 2023.
- ^ أ ب "Nitrogen (Fixed)--Ammonia (2022)" (PDF). U.S. National Minerals Information Center. Retrieved 24 January 2023.
- ^ "Nobel Prize in Chemistry (1918) – Haber–Bosch process". Retrieved 7 July 2009.
- ^ "Chemistry of the Group 2 Elements – Be, Mg, Ca, Sr, Ba, Ra". BBC.co.uk. Retrieved 7 July 2009.
- ^ Habers process chemistry. India: Arihant publications. 2018. p. 264. ISBN 978-93-131-6303-9.
- ^ Appl, M. (1982). "The Haber–Bosch Process and the Development of Chemical Engineering". A Century of Chemical Engineering. New York: Plenum Press. pp. 29–54. ISBN 978-0-306-40895-3.
- ^ Appl, Max (2006). "Ammonia". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_143.pub2.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ Smil, Vaclav (2004). Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production (1st ed.). Cambridge, MA: MIT. ISBN 978-0-262-69313-4.
- ^ Hager, Thomas (2008). The Alchemy of Air: A Jewish genius, a doomed tycoon, and the scientific discovery that fed the world but fueled the rise of Hitler (1st ed.). New York, New York: Harmony Books. ISBN 978-0-307-35178-4.
- ^ Sittig, Marshall (1979). Fertilizer Industry: Processes, Pollution Control, and Energy Conservation. Park Ridge, New Jersey: Noyes Data Corp. ISBN 978-0-8155-0734-5.
- ^ Lavars, Nick (2021-11-30). "Green ammonia electrolysis breakthrough could finally kill Haber-Bosch". New Atlas (in الإنجليزية الأمريكية). Archived from the original on 30 November 2021. Retrieved 2021-12-03.
- ^ Blaine, Loz (2021-11-19). "FuelPositive promises green ammonia at 60% the cost of today's gray". New Atlas (in الإنجليزية الأمريكية). Archived from the original on 19 November 2021. Retrieved 2021-12-03.
- ^ Fichter, Fr.; Girard, Pierre; Erlenmeyer, Hans (1930-12-01). "Elektrolytische Bindung von komprimiertem Stickstoff bei gewöhnlicher Temperatur". Helvetica Chimica Acta (in الإنجليزية). 13 (6): 1228–1236. doi:10.1002/hlca.19300130604.
- ^ Tsuneto, Akira; Kudo, Akihiko; Sakata, Tadayoshi (1994-03-04). "Lithium-mediated electrochemical reduction of high pressure N2 to NH3". Journal of Electroanalytical Chemistry (in الإنجليزية). 367 (1): 183–188. doi:10.1016/0022-0728(93)03025-K. ISSN 1572-6657.
- ^ أ ب Lazouski, Nikifar; Schiffer, Zachary J.; Williams, Kindle; Manthiram, Karthish (2019-04-17). "Understanding Continuous Lithium-Mediated Electrochemical Nitrogen Reduction". Joule (in الإنجليزية). 3 (4): 1127–1139. doi:10.1016/j.joule.2019.02.003. ISSN 2542-4351. S2CID 107985507.
- ^ Andersen, Suzanne Z.; Čolić, Viktor; Yang, Sungeun; Schwalbe, Jay A.; Nielander, Adam C.; McEnaney, Joshua M.; Enemark-Rasmussen, Kasper; Baker, Jon G.; Singh, Aayush R.; Rohr, Brian A.; Statt, Michael J. (June 2019). "A rigorous electrochemical ammonia synthesis protocol with quantitative isotope measurements". Nature (in الإنجليزية). 570 (7762): 504–508. Bibcode:2019Natur.570..504A. doi:10.1038/s41586-019-1260-x. hdl:10044/1/72812. ISSN 1476-4687. PMID 31117118. S2CID 162182383.
- ^ Lazouski, Nikifar; Chung, Minju; Williams, Kindle; Gala, Michal L.; Manthiram, Karthish (2020-05-01). "Non-aqueous gas diffusion electrodes for rapid ammonia synthesis from nitrogen and water-splitting-derived hydrogen". Nature Catalysis (in الإنجليزية). 3 (5): 463–469. doi:10.1038/s41929-020-0455-8. ISSN 2520-1158. S2CID 218495730.
- ^ أ ب Suryanto, Bryan H. R.; Matuszek, Karolina; Choi, Jaecheol; Hodgetts, Rebecca Y.; Du, Hoang-Long; Bakker, Jacinta M.; Kang, Colin S. M.; Cherepanov, Pavel V.; Simonov, Alexandr N.; MacFarlane, Douglas R. (2021-06-11). "Nitrogen reduction to ammonia at high efficiency and rates based on a phosphonium proton shuttle". Science (in الإنجليزية). 372 (6547): 1187–1191. Bibcode:2021Sci...372.1187S. doi:10.1126/science.abg2371. ISSN 0036-8075. PMID 34112690. S2CID 235396282.
- ^ Roth, Karl S. "eMedicine Specialties > Metabolic Diseases > Hyperammonemia". Retrieved 7 July 2009.
- ^ Adjei, M. B.; Quesenberry, K. H.; Chamblis, C. G. (June 2002). "Nitrogen Fixation and Inoculation of Forage Legumes". University of Florida IFAS Extension. Archived from the original on 20 May 2007.
- ^ Identifying the direct effects of ammonia on the brain - PubMed
- ^ Igarashi, Robert Y.; Laryukhin, Mikhail; Dos Santos, Patricia C.; Lee, Hong-In; Dean, Dennis R.; Seefeldt, Lance C.; Hoffman, Brian M. (May 2005). "Trapping H- Bound to the Nitrogenase FeMo-Cofactor Active Site during H2 Evolution: Characterization by ENDOR Spectroscopy". Journal of the American Chemical Society. 127 (17): 6231–6241. doi:10.1021/ja043596p. PMID 15853328.
- ^ Zschocke, Johannes; Hoffman, Georg (2004). Vademecum Metabolism. Schattauer Verlag. ISBN 978-3794523856.
- ^ Rose, Burton; Helmut Rennke (1994). Renal Pathophysiology. Baltimore: Williams & Wilkins. ISBN 978-0-683-07354-6.
- ^ Campbell, Neil A.; Jane B. Reece (2002). "44". Biology (6th ed.). San Francisco: Pearson Education, Inc. pp. 937–938. ISBN 978-0-8053-6624-2.
- ^ Edited by Kirk Munsell. Image page credit Lunar and Planetary Institute. NASA. "NASA's Solar Exploration: Multimedia: Gallery: Gas Giant Interiors Archived 20 فبراير 2006 at the Wayback Machine". Retrieved 26 April 2006.
- ^ Cheung, A. C.; Rank, D. M.; Townes, C. H.; Thornton, D. D.; Welch, W. J. (1968). "Detection of NH3 molecules in the interstellar medium by their microwave emission". Phys. Rev. Lett. 21 (25): 1701. Bibcode:1968PhRvL..21.1701C. doi:10.1103/PhysRevLett.21.1701.
- ^ أ ب Ho, P. T. P.; Townes, C. H. (1983). "Interstellar ammonia". Annu. Rev. Astron. Astrophys. 21 (1): 239–70. Bibcode:1983ARA&A..21..239H. doi:10.1146/annurev.aa.21.090183.001323.
- ^ Millar, T. J. (2003). "Deuterium Fractionation in Interstellar Clouds". Space Science Reviews. 106 (1): 73–86. Bibcode:2003SSRv..106...73M. doi:10.1023/A:1024677318645. S2CID 189793190.
- ^ Ungerechts, H.; Walmsley, C. M.; Winnewisser, G. (1980). "Ammonia and cyanoacetylene observations of the high-density core of L-183 (L-134-N)". Astron. Astrophys. 88: 259. Bibcode:1980A&A....88..259U.
- ^ Genzel, R.; Downes, D.; Ho, P. T. P. (1982). "NH3 in Orion-KL – A new interpretation". Astrophysical Journal. 259: L103. Bibcode:1982ApJ...259L.103G. doi:10.1086/183856.
- ^ "The UMIST data for Astrochemistry". Retrieved 7 July 2009.
- ^ Vikor, L.; Al-Khalili, A.; Danared, H.; Djuric, N.; Dunn, G. H.; Larsson, M.; Le Padellec, A.; Rosen, S.; Af Ugglas, M. (1999). "Branching fractions of dissociative recombination of NH4+ and NH2+ molecular ions". Astronomy and Astrophysics. 344: 1027. Bibcode:1999A&A...344.1027V.
- ^ van Dishoeck, E. F.; Black, J. H. (1986). "Comprehensive models of diffuse interstellar clouds – Physical conditions and molecular abundances" (PDF). Astrophys. J. Suppl. Ser. 62: 109–145. Bibcode:1986ApJS...62..109V. doi:10.1086/191135. hdl:1887/1980.
- ^ "astrochemistry.net". astrochemistry.net. Retrieved 21 May 2011.
- ^ Prasad, S. S.; Huntress, W. T. (1980). "A model for gas phase chemistry in interstellar clouds". The Astrophysical Journal Supplement Series. 43: 1. Bibcode:1980ApJS...43....1P. doi:10.1086/190665.
- ^ Lininger, W.; Albritton, D. L.; Fehsenfeld, F. C.; Schmeltekopf, A. L.; Ferguson, E. E. (1975). "Flow–drift tube measurements of kinetic energy dependences of some exothermic proton transfer rate constants". J. Chem. Phys. 62 (9): 3549. Bibcode:1975JChPh..62.3549L. doi:10.1063/1.430946.
- ^ Smith, D.; Adams, N. G. (1977). "Reactions of CH+n IONS with ammonia at 300 K". Chemical Physics Letters. 47 (1): 145. Bibcode:1977CPL....47..145S. doi:10.1016/0009-2614(77)85326-8.
- ^ Wooten, A.; Bozyan, E. P.; Garrett, D. B. (1980). "Detection of C2H in cold dark clouds". Astrophysical Journal. 239: 844. Bibcode:1980ApJ...239..844W. doi:10.1086/158168.
- ^ Wilson, T. L.; Downes, D.; Bieging, J. (1979). "Ammonia in Orion". Astronomy and Astrophysics. 71 (3): 275. Bibcode:1979A&A....71..275W.
- ^ MacDonald, G. H.; Little, L. T.; Brown, A. T.; Riley, P. W.; Matheson, D. N.; Felli, M. (1981). "Detection of new ammonia sources". MNRAS. 195 (2): 387. Bibcode:1981MNRAS.195..387M. doi:10.1093/mnras/195.2.387.
- ^ Morris, M.; Zuckerman, B.; Palmer, P.; Turner, B. E. (1973). "Interstellar ammonia". Astrophysical Journal. 186: 501. Bibcode:1973ApJ...186..501M. doi:10.1086/152515.
- ^ Torrelles, J. M.; Ho, P. T. P.; Rodriguez, L. F.; Canto, J. (1985). "VLA observations of ammonia and continuum in regions with high-velocity gaseous outflows". Astrophysical Journal. 288: 595. Bibcode:1985ApJ...288..595T. doi:10.1086/162825. S2CID 123014355.
- ^ Ho, P. T. P.; Martin, R. N.; Turner, J. L.; Jackson, J. M. (1990). "VLA imaging of extragalactic ammonia – Hot gas in the nucleus of IC 342". Astrophysical Journal Letters. 355: L19. Bibcode:1990ApJ...355L..19H. doi:10.1086/185728.
- ^ Cesaroni, R.; Churchwell, E.; Hofner, P.; Walmsley, C. M.; Kurtz, S. (1994). "Hot ammonia toward compact HII regions". Astronomy and Astrophysics. 288: 903. Bibcode:1994A&A...288..903C.
- ^ Knacke, R. F.; McCorkle, S.; Puetter, R. C.; Erickson, E. F.; Kraetschmer, W. (1982). "Observation of interstellar ammonia ice". Astrophysical Journal. 260: 141. Bibcode:1982ApJ...260..141K. doi:10.1086/160241.
- ^ Orton, G. S.; Aumann, H. H.; Martonchik, J. V.; Appleby, J. F. (1982). "Airborne spectroscopy of Jupiter in the 100- to 300-cm−1 region: Global properties of ammonia gas and ice haze". Icarus. 52 (1): 81. Bibcode:1982Icar...52...81O. doi:10.1016/0019-1035(82)90170-1.
- ^ Benson, P. J.; Myers, P. (1989). "A survey for dense cores in dark clouds". Astrophysical Journal Supplement Series. 71: 89. Bibcode:1989ApJS...71...89B. doi:10.1086/191365.
- ^ Mebold, U.; Heithausen, A.; Reif, K. (1987). "Ammonia in the galactic halo and the infrared cirrus". Astronomy and Astrophysics. 180: 213. Bibcode:1987A&A...180..213M.
- ^ Martin, R. N.; Ho, P. T. P. (1979). "Detection of extragalactic ammonia". Astronomy and Astrophysics. 74 (1): L7. Bibcode:1979A&A....74L...7M.
- ^ Takano, S.; Nakai, N.; Kawaguchi, K. (1 April 2002). "Observations of Ammonia in External Galaxies I. NGC 253 and M 82". Publications of the Astronomical Society of Japan. 54 (2): 195–207. Bibcode:2002PASJ...54..195T. doi:10.1093/pasj/54.2.195.
المراجع
- الموسوعة المعرفية الشاملة
- Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edn. ed.). Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - Housecroft, C. E. (2001). Inorganic Chemistry. Harlow (UK): Prentice Education. ISBN 0-582-31080-6.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - Bretherick, L., ed. (1986). Hazards in the Chemical Laboratory (4th Edn. ed.). London: Royal Society of Chemistry. ISBN 0-85186-489-9.
{{cite book}}:|edition=has extra text (help) - Weast, R. C., ed. (1972), Handbook of Chemistry and Physics (53rd ed.), Cleveland, OH: Chemical Rubber Co.
وصلات خارجية
- International Chemical Safety Card 0414 (anhydrous ammonia), ilo.org.
- International Chemical Safety Card 0215 (aqueous solutions), ilo.org.
- CID 222 من PubChem
- "Ammoniac et solutions aqueuses" (in الفرنسية). Institut National de Recherche et de Sécurité. Archived from the original on 11 December 2010.
- Emergency Response to Ammonia Fertilizer Releases (Spills) for the Minnesota Department of Agriculture.ammoniaspills.org
- National Institute for Occupational Safety and Health – Ammonia Page, cdc.gov
- NIOSH Pocket Guide to Chemical Hazards – Ammonia, cdc.gov
- Ammonia, video
| الأملاح والمشتقات المكافئة لأيون النيتريد | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| NH3 | He(N2)11 | ||||||||||||||||||
| Li3N | Be3N2 | BN | β-C3N4 g-C3N4 |
N2 | NxOy | NF3 | Ne | ||||||||||||
| Na3N | Mg3N2 | AlN | SiN | PN P3N5 |
SxNy SN S4N4 |
NCl3 | Ar | ||||||||||||
| K3N | Ca3N2 | ScN | TiN | VN | CrN Cr2N |
MnxNy | FexNy | CoN | Ni3N | CuN | Zn3N2 | GaN | Ge3N4 | As | Se | NBr3 | Kr | ||
| Rb3N | Sr3N2 | YN | ZrN | NbN | β-Mo2N | Tc | Ru | Rh | PdN | Ag3N | CdN | In | Sn | Sb | Te | I | Xe | ||
| Cs3N | Ba3N2 | Hf3N4 | TaN | WN | Re | Os | Ir | Pt | Au | Hg3N2 | TlN | Pb | BiN | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La | CeN | Pr | Nd | Pm | Sm | Eu | GdN | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UN | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
- صفحات بها مخططات
- CS1 errors: archive-url
- CS1: Julian–Gregorian uncertainty
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- CS1 errors: periodical ignored
- Short description with empty Wikidata description
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Articles with hatnote templates targeting a nonexistent page
- Articles with excerpts
- CS1 errors: unsupported parameter
- CS1 errors: extra text: edition
- PubChem ID (CID) not in Wikidata
- CS1 الفرنسية-language sources (fr)
- أمونيا
- أمينات لاعضوية
- قواعد (كيمياء)
- كيماويات برائحة الوقود
- Gaseous signaling molecules
- كيماويات منزلية
- غازات صناعية
- مذيبات لاعضوية
- هيدريدات النيتروجين
- هيردات النيتروجين
- Nitrogen(−III) compounds
- علم السموم
- مواد كيميائية
- مركبات الهيدروجين
- مركبات النيتروجين
- أيض النيتروجين
- مبردات
- أمان وصحة وظيفية