نتريد الزنك
(تم التحويل من نيتريد الزنك)
| |
| المُعرِّفات | |
|---|---|
| رقم CAS | |
3D model (JSmol)
|
|
| ECHA InfoCard | 100.013.826 |
| رقم EC |
|
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Zn3N2 |
| كتلة مولية | 224.15 g/mol[1] |
| المظهر | مسحوق رمادي[1] |
| الكثافة | 6.22 g/cm³، صلب[1] |
| قابلية الذوبان في الماء | غير قابل للذوبان (يتحلل) |
| البنية | |
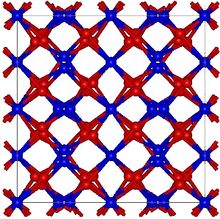
| البنية البلورية | مكعب، cI80 |
| الزمرة الفراغية | Ia-3, No. 206[1][2] |
| المخاطر | |
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | Warning |
| H315, H319 | |
| P264, P280, P302+P352, P305+P351+P338, P321, P332+P313, P337+P313, P362 | |
| NFPA 704 (معيـَّن النار) | |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
نتريد زنك Zinc nitride (Zn3N2) هو مركب كيميائي له الصيغة Zn3N2 ، ويكون على شكل مسحوق رمادي. في صيغته النقية يكون ذو بنية بلورية مكعبة.[1][2]
الخواص الكيميائية
يمكن الحصول على نتريد الزنك بالتفكك الحراري للـ زنكاميد (ثنائي أمين الزنك)[3] في بيئة لاهوائية، عند درجات حرارة تتجاوز 200 °س. الناتج الجانبي للتفاعل هو الأمونيا.[4]
ويمكن أيضاً أن تتكون بتسخين الزنك إلى 600 °س في تيار من الأمونيا؛ الناتج الجانبي هو غاز الهيدروجين.[3][5]
يتفاعل نتريد الزنك بعنف مع الماء ليشكل أمونيا وأكسيد الزنك.[3][4]
وهو قابل للذوبان في حمض الهيدروكلوريك[6] و يتفاعل "عكسياً مع الليثيوم كهروكيميائياً".[7] ومثل نتريد المغنسيوم (Mg3N2) و نتريد الليثيوم (Li3N)، وله نقطة ذوبان عالية.[8]
انظر أيضاً
الهامش
- ^ أ ب ت ث ج Sangeeta, D. (1997). Inorganic Materials Chemistry Desk Reference. CRC Press. p. 278. ISBN 978-0-8493-8900-9. Retrieved 2007-09-30.
- ^ أ ب Partin, D. E.; Williams, D. J.; O'Keeffe, M. (1997). "The Crystal Structures of Mg3N2 and Zn3N2". Journal of Solid State Chemistry. 132 (1): 56–59. Bibcode:1997JSSCh.132...56P. doi:10.1006/jssc.1997.7407.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب ت Roscoe, H. E.; Schorlemmer, C. (1907) [1878]. A Treatise on Chemistry: Volume II, The Metals (4th ed.). London: Macmillan. pp. 650–651. Retrieved 2007-11-01.
- ^ أ ب Bloxam, C. L. (1903). Chemistry, Inorganic and Organic (9th ed.). Philadelphia: P. Blakiston's Son & Co. p. 380. Retrieved 2007-10-31.
- ^ Lowry, M. T. (1922). Inorganic Chemistry. Macmillan. p. 872. Retrieved 2007-11-01.
- ^
Comey, A. M.; Hahn, D. A. (1921). A Dictionary of Chemical Solubilities: Inorganic (2nd ed.). New York: Macmillan. p. 1124. Retrieved 2007-11-01.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Amatucci, G. G.; Pereira, N. (2004). "Nitride and Silicide Negative Electrodes". In Nazri, G.-A.; Pistoia, G. (ed.). Lithium Batteries: Science and Technology. Kluwer Academic Publishers. p. 256. ISBN 978-1-4020-7628-2. Retrieved 2007-11-01.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Grolier Incorporated (1994). Academic American Encyclopedia. Danbury, CT: Grolier Inc. p. 202. ISBN 978-0-7172-2053-3. Retrieved 2007-11-01.
للاستزادة
- Futsuhara, M.; Yoshioka, K.; Takai, O. (1998). "Structural, electrical and optical properties of zinc nitride thin films prepared by reactive RF magnetron sputtering". Thin Solid Films. Elsevier. 322 (1): 274–281. Bibcode:1998TSF...322..274F. doi:10.1016/S0040-6090(97)00910-3.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - Lyutaya, M. D.; Bakuta, S. A. (1980). "Synthesis of the nitrides of Group II elements". Powder Metallurgy and Metal Ceramics. Springer. 19 (2): 118–122. doi:10.1007/BF00792038.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
وصلات خارجية
الكلمات الدالة:
This article contains content from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.
