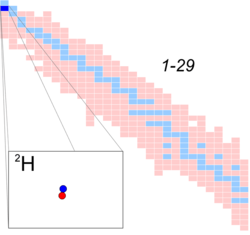
ديوتريوم
| هيدروجين-2 Hydrogen-2 | |
|---|---|
 | |
| عام | |
| الاسم، الرمز | deuterium, 2H or D |
| النيوترونات | 1 |
| الپروتونات | 1 |
| بيانات النيوكليد | |
| الوفرة الطبيعية | 0.015% |
| عمر النصف | مستقر |
| كتلة النظير | 2.01355321270 u |
| سپين | 1+ |
| الطاقة الزائدة | 13135.720 ± 0.001 keV |
| طاقة الربط | 2224.52 ± 0.20 keV |
الديوتريوم Deuterium ، وأحياناً يسمى "الهيدروجين الثقيل"، هو الذرة التي تحتوي نواتها على بروتون واحد ونيوترون واحد ، وتسمى نواة الديوتريوم بالديوترون. وبذلك يعتبر الديوتريوم أحد النظائر المستقرة الثلاثة الطبيعية للهيدروجين. حيث أن الشكل الشائع لذرة الهيدروجين هو ذرة مكونة من بروتون واحد فقط، وهذا هو النظير الأول للهيدروجين وأكثر تلك النظائر شهرة (يسمى أحياناً بالبروتيوم). وهناك نظير ثالث للهيدروجين يسمى التريشيوم (التريتيوم) وتكون نواة ذرة الهيدروجين في هذه الحالة مكونة من بروتون واحد ونيوترونين اثنين، والتريتيوم هو أثقل نظائر الهيدروجين الطبيعية وأكثرها ندرة.
التواجد في الطبيعة
يوجد الديوتريوم في الطبيعة في مياه المحيطات والبحار، حيث أن هناك ذرة ديوتريوم واحدة من بين كل 6500 ذرة هيدروجين في الطبيعة (أي 154 لكل مليون). وبعبارة أخرى فإن نسبة الهيدوجين الثقيل إلى مجمل الهيدروجين الموجود في الطبيعة هي 0.015% ( أو 0.030% بالنظر إلى الكتلة).
ويعتقد أنه يمكن العثور على نسبة أكبر من الديوتريوم كلما توغلنا أكثر في عمق مياه المحيطات.
من الناحية الفيزيائية فإن الديوتريوم هو غاز في درجة الحرارة العادية، وهو نظير مستقر إشعاعياً، أي أنه ليس له عمر نصف. كتلة هذا النظير هي 2.01355321270 وحدة كتل ذرية.
يرمز للديوتريوم عادةً بالرمز D أو 2H ، فمثلاً الرمز الكيميائي لجزيء الماء الثقيل هو D2O على خلاف جزيء الماء العادي والذي يرمز له بالرمز H2O . ومما يجدر ذكره أن الماء الثقيل أكثر لزوجة من الماء العادي وكثافته النسبية أعلى منه.
الخواص الكمومية
الديوترون له سبين +1 وهو لذلك بوزون. تردد الرنين المغناطيسي النووي للديوتريوم يختلف بشكل ملحوظ عن الهيدروجين الخفيف الشائع.
الخواص النووية
Deuterium as an isospin singlet
الثلاثي triplet هو
تاريخ الديوتريوم
تم اكتشاف نظير الهيدروجين الديوتريوم عام 1931 من قبل العالم الأمريكي هارولد اوري، في جامعة كلومبيا، والذي استلم جائزة نوبل في الكيمياء عام 1934 على هذا الاكتشاف.
نصف قطر الديوتريوم
الجذر التربيعي لمتوسط مربع نصف قطر الديوتريوم، المقاس تجريبياً، هو
التطبيقات
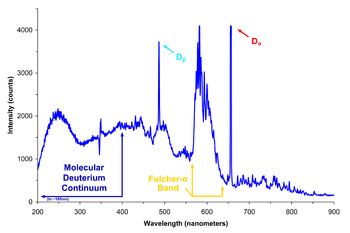
الاستخدام الأهم للديوتريوم هو في إنتاج الماء الثقيل والذي يستخدم بدوره في بعض المفاعلات النووية.
كما أن القدرة العالية له على إنتاج الطاقة عند إدخاله في تفاعلات نووية إندماجية تجعله أحد أفضل الخيارات التي يعول عليها العلماء لتوليد طاقة نووية نظيفة في المستقبل.
ويستفاد من الديوتريوم اليوم في إجراء الكثير من التجارب والأبحاث العلمية في مجالي الكيمياء والكيمياء الحيوية، حيث يستخدم كنظير غير مشع في تتبع الجزيئات في التفاعلات الكيميائية. وذلك لأن الديوتريوم يتصرف في التفاعلات الكيميائية تماماً كالهيدروجين العادي، ويمكن تتبع الديوتريوم وتمييزه عن الهيدروجين العادي في نهاية التجربة بسبب فارق الكتلة بينهما.
من التفاعلات النووية الإندماجية الشائعة في النجوم (بما فيها شمسنا) هو اندماج أنوية ذرات الهيدروجين العادي لتكوين الديوتريوم والتريتيوم والهليوم الثلاثي والرباعي.
الديوتريوم في المفاعلات النووية
الديوتريوم مفيد في تفاعلات الاندماج النووي، وخصوصاً مجتمعاً مع التريتيوم، بسبب معدل التفاعل العالي (أو nuclear cross section) وناتج الطاقة العالية من تفاعل D–T. وهناك even higher-yield D–3He fusion reaction, بالرغم من أن نقطة breakeven of D–3He هي أعلى من نظيراتها في التفاعلات الاندماجية الأخرى؛ together with the scarcity of 3He, this makes it implausible as a practical power source until at least D–T and D–D fusion reactions have been performed على نطاق تجاري.
يستخدم الديوتريوم في مفاعلات الانشطار المسهـَّل بالماء الثقيل، عادة D2O سائل، ليبطئ النيوترونات بدون امتصاص عالي للنيوترونات للهيدروجين العادي.
مطيافية الرنين المغناطيسي النووي للديوتريوم
Deuterium NMR spectra are especially informative in the solid state because of its relatively small quadrupole moment in comparison with those of bigger quadrupolar nuclei such as chlorine-35, for example.
كشاف نظير مستقر
في الكيمياء والكيمياء الحيوية والعلوم البيئية، يستخدم الديوتريوم ككشاف نظير مستقر غير مشع، على سبيل المثال، في doubly-labeled water test. في التفاعلات الكيميائية والسبل الأيضية، يتصرف الديوتريوم بطريقة مشابهة إلى حد ما للهيدروجين العادي (with a few chemical differences, as noted). It can be distinguished from ordinary hydrogen most easily by its mass, using mass spectrometry or infrared spectrometry. Deuterium can be detected by femtosecond infrared spectroscopy, since the mass difference drastically affects the frequency of molecular vibrations; deuterium-carbon bond vibrations are found in locations free of other signals.
Measurements of small variations in the natural abundances of deuterium, along with those of the stable heavy oxygen isotopes 17O and 18O, are of importance in الهيدرولوجيا, to trace the geographic origin of Earth's waters. The heavy isotopes of hydrogen and oxygen in rainwater (so-called meteoric water) are enriched as a function of the environmental temperature of the region in which the precipitation falls (and thus enrichment is related to mean latitude). The relative enrichment of the heavy isotopes in rainwater (as referenced to mean ocean water), when plotted against temperature falls predictably along a line called the global meteoric water line (GMWL). This plot allows samples of precipitation-originated water to be identified along with general information about the climate in which it originated. Evaporative and other processes in bodies of water, and also ground water processes, also differentially alter the ratios of heavy hydrogen and oxygen isotopes in fresh and salt waters, in characteristic and often regionally-distinctive ways.[1]
دراسات تشتت النيوترونات (خصائص التناقض)
Neutron scattering techniques particularly profit from availability of deuterated samples: The H and D cross sections are very distinct and different in sign, which allows contrast variation in such experiments. Further, a nuisance problem of ordinary hydrogen is its large incoherent neutron cross section, which is nil for D. The substitution of hydrogen atoms for deuterium atoms thus reduces scattering noise.
Hydrogen is an important and major component in all materials of organic chemistry and life science, but is barely interacts with X-rays. As hydrogen (and deuterium) interact strongly with neutrons, neutron scattering techniques, together with a modern deuteration facility, fills a niche in many studies of macromolecules in biology and many other areas.
مطيافية الرنين النووي
Deuterium is useful in hydrogen nuclear magnetic resonance spectroscopy (proton NMR). NMR ordinarily requires compounds of interest to be analyzed as dissolved in solution. Because of deuterium's nuclear spin properties which differ from the light hydrogen usually present in organic molecules, NMR spectra of hydrogen/protium are highly differentiable from that of deuterium, and in practice deuterium is not "seen" by an NMR instrument tuned to light-hydrogen. Deuterated solvents (including heavy water, but also compounds like deuterated chloroform, CDCl3) are therefore routinely used in NMR spectroscopy, in order to allow only the light-hydrogen spectra of the compound of interest to be measured, without solvent-signal interference.
انظر أيضاً
| أخف: هيدروجين 1 |
ديوتريوم هو نظير لعنصر الهيدروجين |
أثقل: هيدروجين 3 |
| ناتج انحلال: انظر انبعاث الپروتونات |
سلسلة إنحلال ديوتريوم |
انحلالات ل: مستقر |
المصادر
الهامش
- ^ "Oxygen – Isotopes and Hydrology". SAHRA. Retrieved 2007-09-10.
مصادر عامة
- Nuclear Data Evaluation Lab
- Mullins, Justin (27 April 2005). "Desktop nuclear fusion demonstrated with deuterium gas". New Scientist. Retrieved 2007-09-10.
{{cite journal}}: Check date values in:|date=(help) - Annotated bibliography for Deuterium from the Alsos Digital Library for Nuclear Issues
- Missing Gas Found in Milky Way. Space.com

