حمض النيتريك
| |||
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Nitric acid
| |||
| أسماء أخرى
Aqua fortis; Spirit of nitre; Salpetre acid
| |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.832 | ||
| رقم EC |
| ||
| مرجع Gmelin | 1576 | ||
| KEGG | |||
| عناوين مواضيع طبية MeSH | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
| UN number | 2031 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | HNO3 | ||
| كتلة مولية | 63.012 g/mol | ||
| المظهر | سائل رائق, عديم اللون | ||
| الرائحة | acrid, suffocating[1] | ||
| الكثافة | 1.51 g cm−3, 1.41 g cm−3 [68% w/w] | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | Completely miscible | ||
| log P | −0.13[2] | ||
| ضغط البخار | 48 mmHg (20 °C)[1] | ||
| الحموضة (pKa) | −1.4[3] | ||
| القابلية المغناطيسية | −1.99×10−5 cm3/mol | ||
| معامل الانكسار (nD) | 1.397 (16.5 °C) | ||
| Dipole moment | 2.17 ± 0.02 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−207 kJ·mol−1[4] | ||
| Standard molar entropy S |
146 J·mol−1·K−1[4] | ||
| المخاطر | |||
| صفحة بيانات السلامة | ICSC 0183 | ||
| ن.م.ع. مخطط تصويري |  
| ||
| ن.م.ع. كلمة الاشارة | DANGER | ||
| H272, H300, H310, H330, H373, H411 | |||
| P210, P220, P260, P305+P351+P338, P310, P370+P378 | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | غير قابل للاشتعال | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LC50 (التركيز الأوسط)
|
138 ppm (rat, 30 min)[1] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 2 ppm (5 mg/m3)[1] | ||
REL (الموصى به)
|
TWA 2 ppm (5 mg/m3) ST 4 ppm (10 mg/m3)[1] | ||
IDLH (خطر عاجل)
|
25 ppm[1] | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
حمض النيتروز | ||
كاتيونات أخرى
|
Sodium nitrate Potassium nitrate Ammonium nitrate | ||
مركـّبات ذات علاقة
|
Dinitrogen pentoxide | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
حمض النيتريك (بالإنجليزية: Nitric acid) هو المركب الكيميائي HNO3 هو محلول مائى لنترات الهيدروجين (حمض النيتريك اللامائى). وهو حمض معدنى قوي، شديد التآكلية، سام، له القدرة على إحداث حروق خطيرة. عديم اللون في حالة نقاوته، العينات القديمة يميل لونها إلى الأصفر نتيجة تراكم أكاسيد النيتروجين. اذا كان المحلول يحتوى على أكثر من 86% حمض نيتريك، فإنه يسمى بحمض النيتريك المدخن، حمض النيتريك المدخن يميز كحمض النيتريك المدخن الأبيض و حمض النيتريك المدخن الأحمر على حسب كمية ثانى أكسيد النيتروجين المحتوى عليها.
الخصائص الطبيعية والكيميائية
Commercially available nitric acid is an azeotrope with water at a concentration of 68% HNO3. This solution has a boiling temperature of 120.5 °C at 1 atm. It is known as "concentrated nitric acid". Pure concentrated nitric acid is a colourless liquid at room temperature.
Two solid hydrates are known; the monohydrate (HNO3·H2O or [H3O]NO3) and the trihydrate (HNO3·3H2O).
An older density scale is occasionally seen, with concentrated nitric acid specified as 42° Baumé.[5]
التلوث بثاني أكسيد النيتروجين
Nitric acid is subject to thermal or light decomposition and for this reason it was often stored in brown glass bottles:
- 4 HNO3 → 2 H2O + 4 NO2 + O2
This reaction may give rise to some non-negligible variations in the vapor pressure above the liquid because the nitrogen oxides produced dissolve partly or completely in the acid.
The nitrogen dioxide (NO2) remains dissolved in the nitric acid coloring it yellow or even red at higher temperatures. While the pure acid tends to give off white fumes when exposed to air, acid with dissolved nitrogen dioxide gives off reddish-brown vapors, leading to the common names "red fuming nitric acid" and "white fuming nitric acid". Nitrogen oxides (NOx) are soluble in nitric acid.
Fuming nitric acid
A commercial grade of fuming nitric acid contains 98% HNO3 and has a density of 1.50 g/cm3. This grade is often used in the explosives industry. It is not as volatile nor as corrosive as the anhydrous acid and has the approximate concentration of 21.4 M.
Red fuming nitric acid, or RFNA, contains substantial quantities of dissolved nitrogen dioxide (NO2) leaving the solution with a reddish-brown color. Due to the dissolved nitrogen dioxide, the density of red fuming nitric acid is lower at 1.490 g/cm3.
An inhibited fuming nitric acid (either IWFNA, or IRFNA) can be made by the addition of 0.6 to 0.7% hydrogen fluoride (HF). This fluoride is added for corrosion resistance in metal tanks. The fluoride creates a metal fluoride layer that protects the metal.
حمض النيتريك اللامائي
White fuming nitric acid, pure nitric acid or WFNA, is very close to anhydrous nitric acid. It is available as 99.9% nitric acid by assay. One specification for white fuming nitric acid is that it has a maximum of 2% water and a maximum of 0.5% dissolved NO2. Anhydrous nitric acid has a density of 1.513 g/cm3 and has the approximate concentration of 24 molar. Anhydrous nitric acid is a colorless mobile liquid with a density of 1.512 g/cm3 that solidifies at −42 °C to form white crystals. As it decomposes to NO2 and water, it obtains a yellow tint. It boils at 83 °C. It is usually stored in a glass shatterproof amber bottle with twice the volume of head space to allow for pressure build up, but even with those precautions the bottle must be vented monthly to release pressure.
البنية والترابط
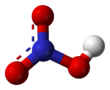
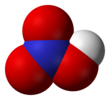
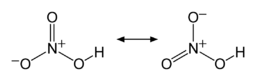
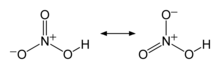
Two of the N–O bonds are equivalent and relatively short (this can be explained by theories of resonance; the canonical forms show double-bond character in these two bonds, causing them to be shorter than typical N–O bonds), and the third N–O bond is elongated because the O atom is also attached to a proton.[6][7]
التفاعلات
الخصائص الحامضية-القاعدية
Nitric acid is normally considered to be a strong acid at ambient temperatures. There is some disagreement over the value of the acid dissociation constant, though the pKa value is usually reported as less than −1. This means that the nitric acid in diluted solution is fully dissociated except in extremely acidic solutions. The pKa value rises to 1 at a temperature of 250 °C.[8]
Nitric acid can act as a base with respect to an acid such as sulfuric acid:
- HNO3 + 2 H2SO4 ⇌ NO+2 + H3O+ + 2 HSO−4; Equilibrium constant: K ≈ 22
The nitronium ion, NO+2, is the active reagent in aromatic nitration reactions. Since nitric acid has both acidic and basic properties, it can undergo an autoprotolysis reaction, similar to the self-ionization of water:
- 2 HNO3 ⇌ NO+2 + NO−3 + H2O
تفاعلاته مع الفلزات
Nitric acid reacts with most metals, but the details depend on the concentration of the acid and the nature of the metal. Dilute nitric acid behaves as a typical acid in its reaction with most metals. Magnesium, manganese, and zinc liberate H2:
- Mg + 2 HNO3 → Mg(NO3)2 + H2 (Magnesium nitrate)
- Mn + 2 HNO3 → Mn(NO3)2 + H2 (Manganese nitrate)
Nitric acid can oxidize non-active metals such as copper and silver. With these non-active or less electropositive metals the products depend on temperature and the acid concentration. For example, copper reacts with dilute nitric acid at ambient temperatures with a 3:8 stoichiometry:
- 3 Cu + 8 HNO3 → 3 Cu2+ + 2 NO + 4 H2O + 6 NO−3
The nitric oxide produced may react with atmospheric oxygen to give nitrogen dioxide. With more concentrated nitric acid, nitrogen dioxide is produced directly in a reaction with 1:4 stoichiometry:
- Cu + 4 H+ + 2 NO−3 → Cu2+ + 2 NO2 + 2 H2O
Upon reaction with nitric acid, most metals give the corresponding nitrates. Some metalloids and metals give the oxides; for instance, Sn, As, Sb, and Ti are oxidized into SnO2, As2O5, Sb2O5, and TiO2 respectively.[9]
- Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
الخواص الحامضية تنحى لأن تسود في حالة الحمض المخفف, coupled with the preferential formation of nitrogen oxide (NO).
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Since nitric acid is an oxidizing agent, hydrogen (H2) is rarely formed. Only magnesium (Mg) and calcium (Ca) react with cold, dilute nitric acid to give hydrogen:
- Mg(s) + 2HNO3 (aq) → Mg(NO3)2 (aq) + H2 (g)
Passivation
Although chromium (Cr), iron (Fe) and aluminium (Al) readily dissolve in dilute nitric acid, the concentrated acid forms a metal oxide layer that protects the metal from further oxidation, which is called passivation.
التفاعل مع اللا فلزات
Being a powerful oxidizing acid, nitric acid reacts violently with many organic materials and the reactions may be explosive. The hydroxyl group will typically strip a hydrogen from the organic molecule to form water, and the remaining nitro group takes the hydrogen's place. Nitration of organic compounds with nitric acid is the primary method of synthesis of many common explosives, such as nitroglycerin and trinitrotoluene (TNT). As very many less stable byproducts are possible, these reactions must be carefully thermally controlled, and the byproducts removed to isolate the desired product.
التفاعل مع العناصر اللا فلزية, باستثناء السليكون والهالوجينات، عادة ما يؤكسدهم إلى أعلى حالات الأكسدة كأحماض مع تكوين ثاني اكسيد النيتروجين للحمض المركز واكسيد النيتروجين للحمض المخفف.
- C + 4HNO3 → CO2 + 4NO2 + 2H2O
أو
- 3C + 4HNO3 → 3CO2 + 4NO + 2H2O
Concentrated nitric acid oxidizes I2, P4, and S8 into HIO3, H3PO4, and H2SO4, respectively.[9] Although it reacts with graphite and amorphous carbon, it does not react with diamond; it can separate diamond from the graphite that it oxidizes.[10]
Xanthoproteic test
Nitric acid reacts with proteins to form yellow nitrated products. This reaction is known as the xanthoproteic reaction. This test is carried out by adding concentrated nitric acid to the substance being tested, and then heating the mixture. If proteins that contain amino acids with aromatic rings are present, the mixture turns yellow. Upon adding a base such as ammonia, the color turns orange. These color changes are caused by nitrated aromatic rings in the protein.[11][12] Xanthoproteic acid is formed when the acid contacts epithelial cells. Respective local skin color changes are indicative of inadequate safety precautions when handling nitric acid.
التركيب والانتاج
Nitric acid is made by reaction of nitrogen dioxide (NO2) with water.
- 4 NO2 + 2 H2O → 2 HNO3 + NO + NO2 + H2O
Or, shortened:
- 3 NO2 + H2O → 2 HNO3 + NO
Normally, the nitric oxide produced by the reaction is reoxidized by the oxygen in air to produce additional nitrogen dioxide.
Bubbling nitrogen dioxide through hydrogen peroxide can help to improve acid yield.
- 2 NO2 + H2O2 → 2 HNO3
Commercial grade nitric acid solutions are usually between 52% and 68% nitric acid. Production of nitric acid is via the Ostwald process, named after German chemist Wilhelm Ostwald. In this process, anhydrous ammonia is oxidized to nitric oxide, in the presence of platinum or rhodium gauze catalyst at a high temperature of about 500 K and a pressure of 9 atm.
- 4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (g) (ΔH = −905.2 kJ/mol)
Nitric oxide is then reacted with oxygen in air to form nitrogen dioxide.
- 2 NO (g) + O2 (g) → 2 NO2 (g) (ΔH = −114 kJ/mol)
This is subsequently absorbed in water to form nitric acid and nitric oxide.
- 3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g) (ΔH = −117 kJ/mol)
The nitric oxide is cycled back for reoxidation. Alternatively, if the last step is carried out in air:
- 4 NO2 (g) + O2 (g) + 2 H2O (l) → 4 HNO3 (aq)
The aqueous HNO3 obtained can be concentrated by distillation up to about 68% by mass. Further concentration to 98% can be achieved by dehydration with concentrated H2SO4. By using ammonia derived from the Haber process, the final product can be produced from nitrogen, hydrogen, and oxygen which are derived from air and natural gas as the sole feedstocks.[13]
التخليق في المعمل
In laboratory, nitric acid can be made by thermal decomposition of copper(II) nitrate, producing nitrogen dioxide and oxygen gases, which are then passed through water to give nitric acid.
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
Then, following the Ostwald process:
- 2 NO 2 + H 2O → HNO 2 + HNO 3
Alternatively, the reaction of equal masses of any nitrate salt such as sodium nitrate with sulfuric acid (H2SO4), and distilling this mixture at nitric acid's boiling point of 83 °C. A nonvolatile residue of the metal hydrogen sulfate remains in the distillation vessel. The red fuming nitric acid obtained may be converted to the white nitric acid.[7]
- NaNO3 + H2SO4 → HNO3 + NaHSO4
The dissolved NOx is readily removed using reduced pressure at room temperature (10–30 minutes at 200 mmHg or 27 kPa) to give white fuming nitric acid. This procedure can also be performed under reduced pressure and temperature in one step in order to produce less nitrogen dioxide gas.[citation needed]
Dilute nitric acid may be concentrated by distillation up to 68% acid, which is a maximum boiling azeotrope. In the laboratory, further concentration involves distillation with either sulfuric acid or magnesium nitrate, which serve as dehydrating agents. Such distillations must be done with all-glass apparatus at reduced pressure, to prevent decomposition of the acid. Industrially, highly concentrated nitric acid is produced by dissolving additional nitrogen dioxide in 68% nitric acid in an absorption tower.[14] Dissolved nitrogen oxides are either stripped in the case of white fuming nitric acid, or remain in solution to form red fuming nitric acid. More recently, electrochemical means have been developed to produce anhydrous acid from concentrated nitric acid feedstock.[15]
الاستخدامات
The main industrial use of nitric acid is for the production of fertilizers. Nitric acid is neutralized with ammonia to give ammonium nitrate. This application consumes 75–80% of the 26 million tonnes produced annually (1987). The other main applications are for the production of explosives, nylon precursors, and specialty organic compounds.[16]
Precursor to organic nitrogen compounds
In organic synthesis, industrial and otherwise, the nitro group is a versatile functional group. A mixture of nitric and sulfuric acids introduces a nitro substituent onto various aromatic compounds by electrophilic aromatic substitution. Many explosives, such as TNT, are prepared this way:
- C6H5CH3 + 3 HNO3 → C6H2(NO2)3CH3 + 3 H2O
Either concentrated sulfuric acid or oleum absorbs the excess water.
The nitro group can be reduced to give an amine group, allowing synthesis of aniline compounds from various nitrobenzenes:
Use as an oxidant
The precursor to nylon, adipic acid, is produced on a large scale by oxidation of "KA oil"—a mixture of cyclohexanone and cyclohexanol—with nitric acid.[16]
Rocket propellant
Nitric acid has been used in various forms as the oxidizer in liquid-fueled rockets. These forms include red fuming nitric acid, white fuming nitric acid, mixtures with sulfuric acid, and these forms with HF inhibitor.[17] IRFNA (inhibited red fuming nitric acid) was one of 3 liquid fuel components for the BOMARC missile.[18]
Niche uses
Analytical reagent
In elemental analysis by ICP-MS, ICP-AES, GFAA, and Flame AA, dilute nitric acid (0.5–5.0%) is used as a matrix compound for determining metal traces in solutions.[19] Ultrapure trace metal grade acid is required for such determination, because small amounts of metal ions could affect the result of the analysis.
It is also typically used in the digestion process of turbid water samples, sludge samples, solid samples as well as other types of unique samples which require elemental analysis via ICP-MS, ICP-OES, ICP-AES, GFAA and flame atomic absorption spectroscopy. Typically these digestions use a 50% solution of the purchased HNO 3 mixed with Type 1 DI Water.
In electrochemistry, nitric acid is used as a chemical doping agent for organic semiconductors, and in purification processes for raw carbon nanotubes.
Woodworking
In a low concentration (approximately 10%), nitric acid is often used to artificially age pine and maple. The color produced is a grey-gold very much like very old wax or oil finished wood (wood finishing).[20]
Etchant and cleaning agent
The corrosive effects of nitric acid are exploited for some specialty applications, such as etching in printmaking, pickling stainless steel or cleaning silicon wafers in electronics.[21]
A solution of nitric acid, water and alcohol, Nital, is used for etching metals to reveal the microstructure. ISO 14104 is one of the standards detailing this well known procedure.
Nitric acid is used either in combination with hydrochloric acid or alone to clean glass cover slips and glass slides for high-end microscopy applications.[22] It is also used to clean glass before silvering when making silver mirrors.[23]
Commercially available aqueous blends of 5–30% nitric acid and 15–40% phosphoric acid are commonly used for cleaning food and dairy equipment primarily to remove precipitated calcium and magnesium compounds (either deposited from the process stream or resulting from the use of hard water during production and cleaning). The phosphoric acid content helps to passivate ferrous alloys against corrosion by the dilute nitric acid.[citation needed]
Nitric acid can be used as a spot test for alkaloids like LSD, giving a variety of colours depending on the alkaloid.[24]
السلامة
Nitric acid is a corrosive acid and a powerful oxidizing agent. The major hazard posed by it is chemical burns, as it carries out acid hydrolysis with proteins (amide) and fats (ester), which consequently decomposes living tissue (e.g. skin and flesh). Concentrated nitric acid stains human skin yellow due to its reaction with the keratin. These yellow stains turn orange when neutralized.[25] Systemic effects are unlikely, however, and the substance is not considered a carcinogen or mutagen.[26]
The standard first-aid treatment for acid spills on the skin is, as for other corrosive agents, irrigation with large quantities of water. Washing is continued for at least 10–15 minutes to cool the tissue surrounding the acid burn and to prevent secondary damage. Contaminated clothing is removed immediately and the underlying skin washed thoroughly.
Being a strong oxidizing agent, nitric acid can react with compounds such as cyanides, carbides, or metallic powders explosively and with many organic compounds, such as turpentine, violently and hypergolically (i.e. self-igniting). Hence, it should be stored away from bases and organics.
التاريخ
The first mention of nitric acid is in the works of Arabic alchemists such as Muhammad ibn Zakariya al-Razi (854-925),[27] and then later in Pseudo-Geber's De Inventione Veritatis, wherein it is obtained by calcining a mixture of niter, alum and blue vitriol. It was again described by Albert the Great in the 13th century and by Ramon Lull, who prepared it by heating niter and clay and called it "eau forte" (aqua fortis).[28]
Glauber devised a process to obtain it by distilling potassium nitrate with sulfuric acid. In 1776 Lavoisier showed that it contained oxygen, and in 1785 Henry Cavendish determined its precise composition and showed that it could be synthesized by passing a stream of electric sparks through moist air.[28] In 1806, Humphry Davy reported the results of extensive distilled water electrolysis experiments concluding that nitric acid was produced at the anode from dissolved atmospheric nitrogen gas. He used a high voltage battery and non-reactive electrodes and vessels such as gold electrode cones that doubled as vessels bridged by damp asbestos.[29]
The industrial production of nitric acid from atmospheric air began in 1905 with the Birkeland–Eyde process, also known as the arc process.[30] This process is based upon the oxidation of atmospheric nitrogen by atmospheric oxygen to nitric oxide with a very high temperature electric arc. Yields of up to approximately 4-5% nitric oxide were obtained at 3000°C and less at lower temperatures.[30][31] The nitric oxide was cooled and oxidized by the remaining atmospheric oxygen to nitrogen dioxide, and this was subsequently absorbed in water in a series of packed column or plate column absorption towers to produce dilute nitric acid. The first towers bubbled the nitrogen dioxide through water and non-reactive quartz fragments. About 20% of the produced oxides of nitrogen remained unreacted so the final towers contained an alkali solution to neutralize the rest.[32] The process was very energy intensive and was rapidly displaced by the Ostwald process once cheap ammonia became available.
Another early production method was invented by French engineer Albert Nodon around 1913. His method produced nitric acid from electrolysis of calcium nitrate converted by bacteria from nitrogenous matter in peat bogs. An earthenware pot surrounded by lime was sunk into the peat and staked with tarred lumber to make a compartment for the carbon anode around which the nitric acid is formed. Nitric acid was pumped out from a glass[33] pipe that was sunk down to the bottom of the pot. Fresh water was pumped into the top through another glass pipe to replace the fluid removed. The interior was filled with coke. Cast iron cathodes were sunk into the peat surrounding it. Resistance was about 3 ohms per cubic meter and the power supplied was around 10 volts. Production from one deposit was 800 tons per year.[33][34]
Once the Haber process for the efficient production of ammonia was introduced in 1913, nitric acid production from ammonia using the Ostwald process overtook production from the Birkeland–Eyde process. This method of production is still in use today.
المصادر
- ^ أ ب ت ث ج ح NIOSH Pocket Guide to Chemical Hazards 0447
- ^ "nitric acid_msds".
- ^ Bell, R. P. (1973), The Proton in Chemistry (2nd ed.), Ithaca, NY: Cornell University Press
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ Dean, John (1992). Lange's Handbook of Chemistry (14 ed.). McGraw-Hill. pp. 2.79–2.80. ISBN 978-0-07-016194-8.
- ^ Luzzati, V. (1951). "Structure cristalline de l'acide nitrique anhydre". Acta Crystallographica (in الفرنسية). 4 (2): 120–131. doi:10.1107/S0365110X51000404.
- ^ أ ب Allan, D. R.; Marshall, W. G.; Francis, D. J.; Oswald, I. D. H.; Pulham, C. R.; Spanswick, C. (2010). "The crystal structures of the low-temperature and high-pressure polymorphs of nitric acid" (PDF). Dalton Trans. (Submitted manuscript). 39 (15): 3736–3743. doi:10.1039/B923975H. PMID 20354626.
- ^ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands
- ^ أ ب Catherine E. Housecroft; Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (3rd ed.). Pearson. ISBN 978-0-13-175553-6.
- ^ Ōsawa, Eiji (December 2007). "Recent progress and perspectives in single-digit nanodiamond". Diamond and Related Materials. 16 (12): 2018–2022. Bibcode:2007DRM....16.2018O. doi:10.1016/j.diamond.2007.08.008.
- ^ Sherman, Henry Clapp (2007). Methods of organic analysis. Read Books. p. 315. ISBN 978-1-4086-2802-7.
- ^ Knowles, Frank (2007). A practical course in agricultural chemistry. Read Books. p. 76. ISBN 978-1-4067-4583-2.
- ^ Considine, Douglas M., ed. (1974). Chemical and process technology encyclopedia. New York: McGraw-Hill. pp. 769–72. ISBN 978-0-07-012423-3.
- ^ Urbanski, Tadeusz (1965). Chemistry and technology of explosives. Oxford: Pergamon Press. pp. 85–86. ISBN 978-0-08-010239-9.
- ^ {{{1}}} patent {{{2}}}
- ^ أ ب Thiemann, Michael; Scheibler, Erich; Wiegand, Karl Wilhelm (2000). "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a17_293. ISBN 978-3527306732.
- ^ Clark, John D (1972). Ignition!. Rutgers University Press. ISBN 978-0-8135-0725-5.
- ^ "BOMARC Summary". BILLONY.COM. Retrieved 2009-05-28.
- ^ Clesceri, Lenore S.; Greenberg, Arnold E.; Eaton, Andrew D., eds. (1998). Standard methods for the examination of water and wastewater (20th ed.). American Public Health Association, American Water Works Association, Water Environment Federation. ISBN 978-0-87553-235-6.[صفحة مطلوبة]
- ^ Jewitt, Jeff (1997). Hand-applied finishes. Taunton Press. ISBN 978-1-56158-154-2. Retrieved 2009-05-28.
- ^ Muraoka, Hisashi (1995) "Silicon wafer cleaning fluid with HNO3, HF, HCl, surfactant, and water" U.S. Patent 5٬635٬463
- ^ Fischer, A. H.; Jacobson, K. A.; Rose, J.; Zeller, R. (1 May 2008). "Preparation of Slides and Coverslips for Microscopy". Cold Spring Harbor Protocols. 2008 (6): pdb.prot4988. doi:10.1101/pdb.prot4988. PMID 21356831.
- ^ Curtis, Heber D. (February 1911). "Methods of Silvering Mirrors". Publications of the Astronomical Society of the Pacific. 23 (135): 13. Bibcode:1911PASP...23...13C. doi:10.1086/122040.
- ^ O’Neal, Carol L; Crouch, Dennis J; Fatah, Alim A (April 2000). "Validation of twelve chemical spot tests for the detection of drugs of abuse". Forensic Science International. 109 (3): 189–201. doi:10.1016/S0379-0738(99)00235-2. PMID 10725655.
- ^ May, Paul (November 2007). "Nitric acid". Retrieved 2009-05-28.
- ^ "Nitric acid: Toxicological overview". Health Protection Agency. Retrieved 2011-12-07.
- ^ Ahmad Y. Al-Hassan, Cultural contacts in building a universal civilisation: Islamic contributions, published by O.I.C. Research Centre for Islamic History, Art and Culture in 2005 and available online at History of Science and Technology in Islam
- ^ أ ب
 Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية. Vol. 19 (eleventh ed.). Cambridge University Press. pp. 711–712.
Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية. Vol. 19 (eleventh ed.). Cambridge University Press. pp. 711–712. {{cite encyclopedia}}: Cite has empty unknown parameter:|coauthors=(help) - ^ Davy, John, ed. (1839). "On Some Chemical Agencies of Electricity". The Collected Works of Sir Humphry Davy. Vol. 5. pp. 1–12.
- ^ أ ب Mellor, J. W. (1918). Modern Inorganic Chemistry. Longmans, Green and Co. p. 509.
- ^ Martin, Geoffrey; Barbour, William (1915). Industrial Nitrogen Compounds and Explosives. Crosby Lockwood and Son. p. 21.
- ^ Knox, Joseph (1914). The Fixation of Atmospheric Nitrogen. D. Van Nostrand Company. pp. 45–50.
- ^ أ ب Dary, G. (1913). "The Production of Nitrates by the Direct Electrolysis of Peat Deposits". London Electrical Review. 73: 1020–1021.
- ^ Hale, Arthur (1919). The Manufacture of Chemicals by Electrolysis. D. Van Nostrand Co. pp. 30–32. Retrieved 2019-09-15.
وصلات خارجية
- NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory – Nitric Acid Fact Sheet
- Calculators: surface tensions, and densities, molarities and molalities of aqueous nitric acid
- CS1 الفرنسية-language sources (fr)
- مقالات بالمعرفة بحاجة لذكر رقم الصفحة بالمصدر from April 2019
- مقالات المعرفة المحتوية على معلومات من دائرة المعارف البريطانية طبعة 1911
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from January 2008
- Articles with unsourced statements from September 2011
- مركبات الهيدروجين
- أحماض النيتروجين الأكسجينية
- أحماض معدنية
- كيماويات التصوير الضوئي
- Drug testing reagents
- Oxidizing acids
- Nitrogen(+5) compounds
- نيترات
- أحماض
- بذرة كيمياء
- مركبات غير عضوية
- كيمياء غير عضوية