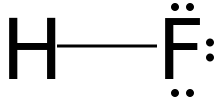فلوريد الهيدروجين
|
| |||
| المُعرِّفات | |||
|---|---|---|---|
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.759 | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | HF | ||
| كتلة مولية | 20.01 g mol-1 | ||
| المظهر | colourless gas or colourless liquid (below 19.5°C) | ||
| الكثافة | 1.15 g/L, gas (25 °C) 0.99 g/mL, liquid (19.5 °C) | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | miscible | ||
| ضغط البخار | 783 mmHg (20°C)[1] | ||
| الحموضة (pKa) | 3.17[2][3] | ||
| معامل الانكسار (nD) | 1.00001 | ||
| البنية | |||
| الشكل الجزيئي | Linear | ||
| Dipole moment | 1.86 D | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−13.66 kJ/g (gas) −14.99 kJ/g (liquid) | ||
| Standard molar entropy S |
8.687 J/g K (gas) | ||
| المخاطر | |||
| NFPA 704 (معيـَّن النار) | |||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LC50 (التركيز الأوسط)
|
1276 ppm (rat, 1 hr) 1774 ppm (monkey, 1 hr) 4327 ppm (guinea pig, 15 min)[4] | ||
LCLo (المنشورة الأقل)
|
313 ppm (rabbit, 7 hr)[4] | ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 3 ppm[1] | ||
REL (الموصى به)
|
TWA 3 ppm (2.5 mg/m3) C 6 ppm (5 mg/m3) [15-minute][1] | ||
IDLH (خطر عاجل)
|
30 ppm[1] | ||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
Hydrogen chloride Hydrogen bromide Hydrogen iodide | ||
كاتيونات أخرى
|
Sodium fluoride Potassium fluoride Rubidium fluoride Caesium fluoride | ||
مركـّبات ذات علاقة
|
Water Ammonia | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
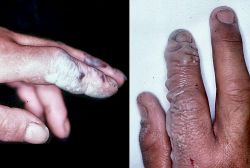
فلوريد الهيدروجين Hydrogen fluoride هو مركب كيميائي ذو الصيغة HF. وهو المصدر الصناعي الأساسي للفلور، ويكون غالبا بشكل حمض الهيدروفلوريك، فهو إذن الطليعة للعديد من المركبات المهمة مثل المركبات الصيدلانية ومبلمرات (مثل التيفلون). يستخدم فلوريد الهيدروجين استخدامًا واسعًا في صناعات البتروكيمياويات ومكون للعديد من الحموض الفائقة. يغلي فلوريد الهيدروجين في درجة حرارة أقل من درجة حرارة الغرفة في حين تتكاثف هاليدات الهيدروجين (en) الأخرى عند درجات حرارة أقل بكثير. وفلوريد الهيدروجين، خلافا لهاليدات الهيدروجين الأخرى، أخف من الهواء، وهو قادر على الاختراق خصوصا مما يجعله مؤذيا للرئتين. المحاليل المائية لفلوريد الهيدروجين، تسمى حمض الهيدروفلوريك، وهو مادة أكالة قوية.
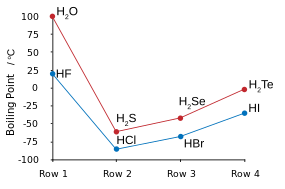
روابط الهيدروجين
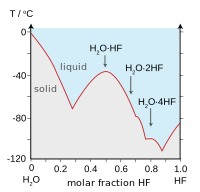
| تماثلات HF and H2O | |
|
|
| نقاط الغليان لهاليدات الهيدروجين (أزرق) وكالكوجينات الهيدروجين (أحمر): HF و H2O يكسران الأنماط. | نقاط التجمد لخلائط HF/ H2O: الأسهم تبين مركبات في الحالة الصلبة. |
الحموضة
تكون درجة الحموضة عالية ما لم يخفف بالماء.
الإنتاج والاستخدامات
التأثيرات الصحية
المراجع
- ^ أ ب ت ث NIOSH Pocket Guide to Chemical Hazards 0334
- ^ "pKa's of Inorganic and Oxo-Acids" (PDF). Harvard. Retrieved 9 September 2013.
- ^ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432-433.
- ^ أ ب "Hydrogen fluoride". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
الكلمات الدالة:
This article may include material from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.