كلوريد الصوديوم

| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Sodium chloride
| |
| أسماء أخرى
Common salt; هاليت؛ ملح المائدة؛ ملح صخري
| |
| المُعرِّفات | |
| رقم CAS | |
| ChemSpider | |
| ECHA InfoCard | 100.028.726 |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | NaCl |
| كتلة مولية | 58.443 g/mol |
| المظهر | عديم اللون/صلب بلوري أبيض |
| الرائحة | Odorless |
| الكثافة | 2.165 گ/سم3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 35.6 گ/100 گ مل (0 °س) 35.9 گ/100 مل (25 °س) 39.1 گ/100 مل (100 °س) |
| قابلية الذوبان | يذوب في گليسرول وإثلين گلايكول وحمض الفورميك لا يذوب في HCl |
| قابلية الذوبان في مثانول | 1.49 g/100 mL |
| قابلية الذوبان في أمونيا | 2.15 g/100 mL |
| الحموضة (pKa) | 6.7-7.3 |
| معامل الانكسار (nD) | 1.5442 (589 nm) |
| البنية | |
| البنية البلورية | مكعب موسطن حول الوجه (see text), cF8 |
| الزمرة الفراغية | Fm3m, No. 225 |
| ثابت العقد | a = 564.02 pm |
| هندسة إحداثية |
ثماني الأوجه (Na+) ثماني الأوجه (Cl−) |
| المخاطر | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | Non-flammable |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
3000–8000 مگ/كگ (فموياً في الفئران والأرانب)[1] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
فلوريد الصوديوم بروميد الصوديوم يوديد الصوديوم |
كاتيونات أخرى
|
كلوريد الليثيوم كلوريد البوتاسيوم كلوريد الروبيديوم كلوريد السيزيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كلوريد الصوديوم هو مركب كيميائي يرمز له بـ NaCl. يتكون من الكلور والصوديوم. كما يسمى بملح الطعام أو الهاليت. يعد المركب أكثر المسببين لملوحة مياه المحيطات، ويستخدم كثيراً في الطعام.
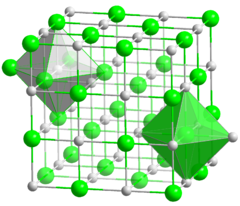
يشكل المركب على هيئة بلورية مكعبة، تترتب فيها أيونات الصوديوم الصغيرة لتملأ الفراغات الثمانية بين أيونات الكلور الأكبر.
الانتاج والاستخدامات
برك تبخير الملح الأردنية والإسرائيلية عند الطرف الجنوبي من البحر الميت.
أكوام الملح، في سالار ده اويوني، بوليڤيا.
منجم ملح صخري حديث بالقرب من ماونت موريس, نيويورك, الولايات المتحدة.
Evaporation lagoons, Aigues-Mortes, فرنسا.
| قابلية ذوبان NaCl في المذيبات المختلفة (گ NaCl / 100 گ من المذيب عند 25 °س) | |
|---|---|
| H2O | 36 |
| أمونيا سائلة | 3.02 |
| مثانول | 1.4 |
| Sulfolane | 0.005 |
| حمض الفورميك | 5.2 |
| أسيتون | 0.000042 |
| فورماميد | 9.4 |
| Acetonitrile | 0.0003 |
| Dimethylformamide | 0.04 |
| Reference: Burgess, J. Metal Ions in Solution (Ellis Horwood, New York, 1978) ISBN 0-85312-027-7 | |
بيانات بصرية
- Transmitivity: 92% (from 400 nm to 13μm)
- Refractive Index: 1.494 @ 10μm
- Reflection Loss: 7.5% @ 10μm (2 surfaces)
- dN/dT: -36.2 x 10-6/°C @ 0.7μm
الأهمية الحيوية
كلوريد الصوديوم مهم للحياة على كوكب الأرض. فتحتوي الأنسجة الرقيقة وسوائل الأجسام الحيوية على نسب مختلفة من الأملاح. كما أن الخلايا العصبية تتطلب Na+ لقنوات أيونات الصوديوم حتى تعمل لتتم عملية نقل الرسائل. قمع مثل هذه المستقبلات أو غياب Na+ يسبب في التوقف الوظيفي المباشر مع أعراض أخرى. كما تحتاج الأنسجة الطلائية Cl- للوظائف المناسبة وغير المناسبة لقنوات Cl- التي تسبب اضطرابات مثل التليف الكيسي.
الاستخدامات في مكافحة الحريق
في الطقس

البنية البلورية
ملح الطرقات
| S(g/kg) | 0 | 10 | 20 | 24.7 | 30 | 35 |
| T(freezing) (C) | 0 | -0.5 | -1.08 | -1.33 | -1.63 | -1.91 |
انظر أيضاً
- Biosalinity
- Kala Namak
- Halite, the mineral form of sodium chloride
- Schüßler's list of 12 Biochemic cell salts (names: "Nat Mur" for "Natrum muriaticum", etc.); List of homeopathic preparations
- ملوحة
- ملح
- صابون
- Salting the earth
الهامش
- ^ Martel, B.; Cassidy, K. (2004), Chemical Risk Analysis: A Practical Handbook, Butterworth–Heinemann, p. 369, ISBN 1903996651
للاستزادة
- Kaufmann, Dale W., SODIUM CHLORIDE, The Production and Properties of Salt and Brine, ACS Monograph 145, American Chemical Society, Washington, D.C., 1960, 743 pages. Library of Congress Catalog Card Number 79-50778.
- Kurlansky, Mark, SALT, A World History, Walker and Company, New York, 2002, 484 pages. ISBN 0-8027-1373-4
وصلات خارجية
- The Salt Manufacturers Association website
- Salt Institute website
- Salt Archive website
- Salt United States Geological Survey Statistics and Information
- US Road Management website
- Salt Intake in Cold Weather
- Oxford MSDS
- JtBaker MSDS
- Articles with hatnote templates targeting a nonexistent page
- Missing redirects
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- مواد حبيبية
- مواد حافظة
- معقمات
- ازالة الثلج
- مركبات الصوديوم
- كلوريدات
- الأدوية الأساسية حسب منظمة الصحة العالمية
- أملاح






