پلاتين
 | |||||||||||||||
| Platinum | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | silvery white | ||||||||||||||
| الوزن الذري العياري Ar°(Pt) | |||||||||||||||
| Platinum في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 78 | ||||||||||||||
| المجموعة | 10 | ||||||||||||||
| الدورة | period 6 | ||||||||||||||
| المستوى الفرعي | d-block | ||||||||||||||
| التوزيع الإلكتروني | [Xe] 4f14 5d9 6s1 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 18, 32, 17, 1 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 2041.4 K (1768.3 °س، 3214.9 °F) | ||||||||||||||
| نقطة الغليان | 4098 K (3825 °س، 6917 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 21.45 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 19.77 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 22.17 kJ/mol | ||||||||||||||
| حرارة التبخر | 510 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 25.86 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 2.28 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 139 pm | ||||||||||||||
| نصف قطر التكافؤ | 136±5 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 175 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| البنية البلورية | face-centered cubic (fcc) | ||||||||||||||
| سرعة الصوت قضيب رفيع | 71.6 W/(m·K) | ||||||||||||||
| التمدد الحراري | 8.8 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 105 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | paramagnetic | ||||||||||||||
| القابلية المغناطيسية | +201.9 × 10−6 cm3/mol (290 K)[1] | ||||||||||||||
| قوة الشد | 125–240 MPa | ||||||||||||||
| معامل يونگ | 168 GPa | ||||||||||||||
| معامل القص | 61 GPa | ||||||||||||||
| معاير الحجم | 230 GPa | ||||||||||||||
| نسبة پواسون | 0.38 | ||||||||||||||
| صلادة موز | 3.5 | ||||||||||||||
| صلادة ڤيكرز | 400–550 MPa | ||||||||||||||
| صلادة برينل | 300–500 MPa | ||||||||||||||
| رقم كاس | 7440-06-4 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف | Antonio de Ulloa (1735) | ||||||||||||||
| نظائر الplatinum | |||||||||||||||
| قالب:جدول نظائر platinum غير موجود | |||||||||||||||
الپلاتين Platinum عنصر كيميائي في الجدول الدوري يرمز له بالرمز Pt وعدده الذري 78 ووزنه الذري 195.09 ومداره الأخير 5d9 ودرجة تجمده 1772C ودرجة غليانه 3827C. يعتبر عنصر ثمين ، لونه رمادي-أبيض ، يستخدم في صناعة الحلي والزينة ، الأدوات المخبرية وغيرها ، يسميه البعض الذهب الأبيض. Its name originates from Spanish platina, a diminutive of plata "silver".[2][3]
Platinum is a member of the platinum group of elements and group 10 of the periodic table of elements. It has six naturally occurring isotopes. It is one of the rarer elements in Earth's crust, with an average abundance of approximately 5 μg/kg. It occurs in some nickel and copper ores along with some native deposits, mostly in South Africa, which accounts for ~80% of the world production. Because of its scarcity in Earth's crust, only a few hundred tonnes are produced annually, and given its important uses, it is highly valuable and is a major precious metal commodity.[4]
Platinum is one of the least reactive metals. It has remarkable resistance to corrosion, even at high temperatures, and is therefore considered a noble metal. Consequently, platinum is often found chemically uncombined as native platinum. Because it occurs naturally in the alluvial sands of various rivers, it was first used by pre-Columbian South American natives to produce artifacts. It was referenced in European writings as early as the 16th century, but it was not until Antonio de Ulloa published a report on a new metal of Colombian origin in 1748 that it began to be investigated by scientists.
Platinum is used in catalytic converters, laboratory equipment, electrical contacts and electrodes, platinum resistance thermometers, dentistry equipment, and jewelry. Platinum is used in the glass industry[5] to manipulate molten glass which does not "wet" platinum. As a heavy metal, it leads to health problems upon exposure to its salts; but due to its corrosion resistance, metallic platinum has not been linked to adverse health effects.[6] Compounds containing platinum, such as cisplatin, oxaliplatin and carboplatin, are applied in chemotherapy against certain types of cancer.[7]
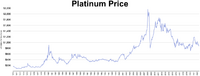
Pure platinum is currently less expensive than pure gold, having been so continuously since 2015, but has been twice as expensive or more, mostly prior to 2008.[8] In early 2021, the value of platinum ranged from US$1,055 to US$1,320 per troy ounce.[9]
التاريخ والمصطلح
يطلق على مجموعة معادن الروثينيوم Ru والروديوم Rh والبلاديوم Pd والأُسميوم Os والإيريديوم Ir والبلاتين Pt اسم زمرة المعادن البلاتينية وهي جميعها معادن ثمينة.[10]
وقد أخذ اسم الروثينيوم Ruthenium من اللاتينية «روتينية» Rutheinia ومعناها «روسية» وذلك تكريماً لمكتشفه الكيميائي الروسي كارل كلاوس Karl Claus (1796- 1864) الذي استطاع عزله عام 1845، أما الأسميوم فقد اكتشفه الإنكليزي تينانت Tennant عام 1804، وقد اشتق اسمه من الكلمة اليونانية Osme التي تعني رائحة، وذلك بسبب الرائحة المميزة لأحد مركباته المتطايرة OsO4؛ واكتشف الإنكليزي ولاَّستون Wallaston الروديوم عام 1804 واكتشف في العام نفسه البلاديوم. أما البلاتين فيعود اكتشافه في المكسيك إلى الشاعر الإيطالي يوليوس قيصر سكاليجر عام 1557 وقد اشتق اسمه من الكلمة الإسبانية Plate التي تعني فِضة.
الخواص
الجدول 1 يبين بعض خواص هذه المعادن البلاتينية.
| العنصر | Ru | Rh | Pd | Os | Ir | Pt |
|---|---|---|---|---|---|---|
| نصف القطر الذري (أنغستروم) | 1.24 | 1.25 | 1.88 | 1.26 | 1.26 | 1.29 |
| الكثافة | 21.2 | 12.4 | 11.9 | 22.5 | 22.4 | 21.4 |
| درجة الانصهار (س) | 2500 | 1970 | 1590 | 2700 | 2450 | 1770 |
| أهم الأكاسيد | RuO2 | Rh2O2 | PdO | OsO2 | IrO2 | PrO |
| RuO4 | OsO4 | PrO2 | ||||
| العدد الذري | 44 | 45 | 46 | 76 | 77 | 78 |
الخواص الكيميائية
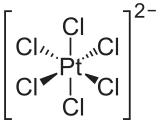
 الپلاتين يذوب في الماء الملكي الساخن. |
درجات الأكسدة الرئيسة له: +2 و+4 وله درجات أكسدة ثانوية وهي: صفر، و+1و+3 و+5 و+6، ويمتاز بمقاومته لمختلف المؤثرات بالدرجة العادية من الحرارة. له ميل شديد لتكوين مركبات معقَّدة، ومركباته البسيطة إما عديمة الانحلال أو ضعيفة التشرد (التأيّن) في الماء. ينحل بالتسخين بالماء الملكي مكوِّناً H2[PtCl]4، ولا يتفاعل وهو في الحالة المتراصة مع اللامعادن المعروفة في الشروط العادية، ولا يجري التفاعل إلا بالتسخين وبدرجات حرارة متفاوتة. وتزداد شدة التفاعل إذا كان على هيئة مسحوق. وأثبت أكاسيده PtO2، وهو بني اللون ويتفكك بدرجة (650ْس) ويستعمل وسيطاً في تفاعلات هدرجة كثيرٍ من المركبات العضوية. أما هيدروكسيده Pt(OH)4 فينحل في الحموض والقلويات، ولا تكون نواتج التفاعلات أملاحاً بسيطة بل مركبات معقدة، فمع HCl مثلاً يتكون H2[PtCl]6، ومع NaOH يتكون Na[Pt(OH)]6. وهو يتفاعل مباشرة مع الكبريت S والسيلينيوم Se والتلوريوم Te والفوسفور P والزرنيخ As والبزموت Bi والقصدير Sn والرصاص Pb وبشروط مختلفة وتتكون من ذلك التفاعل نواتج صلبة شبيهة بالمعادن تقاوم الحموض عدا حمض الآزوت. ويتفاعل البلاتين مع الفلور ويتكون PtF6 بلون أحمر غامق ينصهر بالدرجة 61.3ْس، و PtF5 بلون أحمر ودرجة انصهاره 80ْس. و PtF4 بلون بني مصفر. ويعدّ PtF6 من أقوى العوامل المؤكسدة المعروفة فهو يتفاعل مع الأكسجين والكزينون مكوناً O2+PtF6 و Xe(PtF6)n. ويتفكك PtF6 بسهولة متحولاً إلى فلور وفلوريدات بلاتين بدرجة أكسدة أخفض من +6. ويكوّن البلاتين بالاتحاد المباشر مع الهالوجينات الأخرى هاليدات متنوعة بحسب درجة الحرارة، وتتكون المركبات: PtI4 , PtBr4, PtBr2 , PtCl2 , PtCl4 , PtI3 ,PtBr3 , PtCl3 , PtI2. وبصهره مع مزيج من KNO3 وKOH يتكون K2PtO3. ومن مركبات البلاتين بدرجة الأكسدة صفر: Pt(NH3)5، ويكوِّن البلاتين، بخلاف باقي معادن الفصيلة VIII B، مركبات ألكيلية ثابتة حرارياً مثل ( Me= ميتيل) Me3PtI وذلك بالتفاعل بين PtCl4 وMeMg. وقد أدت الدراسات التي أُجريت على معقدات البلاتين (معقدات البلاتين الثنائي خاصة) دوراً كبيراً في تطوير الكيمياء التساندية. إذ تتصف هذه المعقدات، كما هي معقدات البلاتين الرباعي IV، ببطء تفاعلاتها.
النظائر
Platinum has six naturally occurring isotopes: 190 Pt, 192 Pt, 194 Pt, 195 Pt, 196 Pt, and 198 Pt. The most abundant of these is 195 Pt, comprising 33.83% of all platinum. It is the only stable isotope with a non-zero spin. The spin of 1/2 and other favourable magnetic properties of the nucleus are utilised in 195 Pt NMR. Due to its spin and large abundance, 195 Pt satellite peaks are also often observed in 1 H and 31 P NMR spectroscopy (e.g., for Pt-phosphine and Pt-alkyl complexes). 190 Pt is the least abundant at only 0.01%. Of the naturally occurring isotopes, only 190 Pt is unstable, though it decays with a half-life of 6.5×1011 years, causing an activity of 15 Bq/kg of natural platinum. 198 Pt can undergo alpha decay, but its decay has never been observed (the half-life is known to be longer than 3.2×1014 years); therefore, it is considered stable. Platinum also has 34 synthetic isotopes ranging in atomic mass from 165 to 204, making the total number of known isotopes 40. The least stable of these are 165 Pt and 166 Pt, with half-lives of 260 µs, whereas the most stable is 193 Pt with a half-life of 50 years. Most platinum isotopes decay by some combination of beta decay and alpha decay. 188 Pt, 191 Pt, and 193 Pt decay primarily by electron capture. 190 Pt and 198 Pt are predicted to have energetically favorable double beta decay paths.[11]
الخواص الفيزيائية
يتصف البلاتين، وهو في حالته الحرة المتراصة، ببريق معدني أبيض فضي، درجة انصهاره مرتفعة 1770ْس، ودرجة غليانه مرتفعة 3800ْس، وهو ثقيل كثافته 21.45، وله قابلية كبيرة للسحب والطرق، وناقليته الكهربائية منخفضة نسبياً، وعامل تمدده الخطي هو الأصغر بين المعادن التجارية جميعها، وهو لا يَسْوَدُّ في الهواء، ويتألف في معظمه من أربعة نظائر هي Pt…198, Pt…196, Pt…195, Pt…194 ونظيرين مشعين بنسبة ضئيلة جداً هما Pt…190 وPt…192.
التواجد
الپلاتين معدن فائق الندرة،[12] يتواجد فقط بنسبة 5 ppb في القشرة الأرضية.[13][14] It is sometimes mistaken for silver. Platinum is often found chemically uncombined as native platinum and as alloy with the other platinum-group metals and iron mostly. Most often the native platinum is found in secondary deposits in alluvial deposits. The alluvial deposits used by pre-Columbian people in the Chocó Department, Colombia are still a source for platinum-group metals. Another large alluvial deposit is in the Ural Mountains, Russia, and it is still mined.[15]
In nickel and copper deposits, platinum-group metals occur as sulfides (e.g., (Pt,Pd)S), tellurides (e.g., PtBiTe), antimonides (PdSb), and arsenides (e.g. PtAs
2), and as end alloys with nickel or copper. Platinum arsenide, sperrylite (PtAs
2), is a major source of platinum associated with nickel ores in the Sudbury Basin deposit in Ontario, Canada. At Platinum, Alaska, about 17،000 kg (550،000 ozt) was mined between 1927 and 1975. The mine ceased operations in 1990.[16] The rare sulfide mineral cooperite, (Pt,Pd,Ni)S, contains platinum along with palladium and nickel. Cooperite occurs in the Merensky Reef within the Bushveld complex, Gauteng, South Africa.[17]
In 1865, chromites were identified in the Bushveld region of South Africa, followed by the discovery of platinum in 1906.[18] In 1924, the geologist Hans Merensky discovered a large supply of platinum in the Bushveld Igneous Complex in South Africa. The specific layer he found, named the Merensky Reef, contains around 75% of the world's known platinum.[19][20] The large copper–nickel deposits near Norilsk in Russia, and the Sudbury Basin, Canada, are the two other large deposits. In the Sudbury Basin, the huge quantities of nickel ore processed make up for the fact platinum is present as only 0.5 ppm in the ore. Smaller reserves can be found in the United States,[20] for example in the Absaroka Range in Montana.[21] In 2010, South Africa was the top producer of platinum, with an almost 77% share, followed by Russia at 13%; world production in 2010 was 192،000 kg (423،000 lb).[22]
Large platinum deposits are present in the state of Tamil Nadu, India.[23]
Platinum exists in higher abundances on the Moon and in meteorites. Correspondingly, platinum is found in slightly higher abundances at sites of bolide impact on Earth that are associated with resulting post-impact volcanism, and can be mined economically; the Sudbury Basin is one such example.[24]
وتكون المعادن البلاتينية مترافقة بعضها مع بعض ومبعثرة في مختلف فلزات المعادن الأخرى كالحديد والفضة والنحاس والنيكل والذهب. وتوجد حرةً في الطبيعة لخمولها الكيمياوي، كما توجد على هيئة مركبات مع الكبريت أو الزرنيخ مثل الكوبريت PtS والسيرّيليت PtAs2. ويتطلب استخلاص المعادن البلاتينية من الفلزات الطبيعية الكثير من العمليات التقنية المعقدة مما يفسر ارتفاع ثمنها. وتختلف طريقة استخلاصها باختلاف الفلز؛ ويُجرى لفصل بعضها عن بعض كثير من العمليات المعقدة التي يعتمد جلها على الطرائق الكيمياوية الكلاسيكية. ولا تتجاوز كمية البلاتين المستخلصة من فلز غني بضعة غرامات من الطن الواحد.
الرمز الخيميائي للپلاتين (مرسوم إلى اليسار) صيغ من ربط رمزَيّ الفضة والذهب.
الانتاج
ويقدَّر الإنتاج العالمي بما يزيد على (100) طن سنوياً. وتأتي جمهورية جنوب إفريقية والاتحاد السوفييتي (سابقاً) وكندا في المرتبة الأولى في إنتاجه. وتأتي كولومبية في المرتبة الثانية.
انتاج العالم من الپلاتين يتراوح حول 7 مليون اوقية (199,000 كجم) في السنة.[25][26] أسعار الپلاتين تتأرجح حول $1250 للاوقية ($40/جم). [1] يصنع البلاتين على هيئة مسحوق ناعم أسود أو بشكل إسفنجي أو معدني متراص، ويدعى المسحوق «أسود البلاتين» ويستخلص بإرجاع كلوريد البلاتين. وعندما يستخلص البلاتين بتفكيك مركباته بدرجات حرارة منخفضة نسبياً يتكون البلاتين في الحالة «الإسفنجية» أما البلاتين المتراص (كالذي يستعمل في صناعة المجوهرات) فيستخلص بصهر البلاتين الإسفنجي.
المركبات
الهاليدات
Hexachloroplatinic acid mentioned above is probably the most important platinum compound, as it serves as the precursor for many other platinum compounds. By itself, it has various applications in photography, zinc etchings, indelible ink, plating, mirrors, porcelain coloring, and as a catalyst.[27]
Treatment of hexachloroplatinic acid with an ammonium salt, such as ammonium chloride, gives ammonium hexachloroplatinate,[28] which is relatively insoluble in ammonium solutions. Heating this ammonium salt in the presence of hydrogen reduces it to elemental platinum. Potassium hexachloroplatinate is similarly insoluble, and hexachloroplatinic acid has been used in the determination of potassium ions by gravimetry.[29]
When hexachloroplatinic acid is heated, it decomposes through platinum(IV) chloride and platinum(II) chloride to elemental platinum, although the reactions do not occur stepwise:[30]
- (H
3O)
2PtCl
6·nH
2O ⇌ PtCl
4 + 2 HCl + (n + 2) H
2O - PtCl
4 ⇌ PtCl
2 + Cl
2 - PtCl
2 ⇌ Pt + Cl
2
All three reactions are reversible. Platinum(II) and platinum(IV) bromides are known as well. Platinum hexafluoride is a strong oxidizer capable of oxidizing oxygen.
Oxides
Platinum(IV) oxide, PtO
2, also known as "Adams' catalyst", is a black powder that is soluble in potassium hydroxide (KOH) solutions and concentrated acids.[31] PtO
2 and the less common PtO both decompose upon heating.[32] Platinum(II,IV) oxide, Pt
3O
4, is formed in the following reaction:
- 2 Pt2+ + Pt4+ + 4 O2− → Pt
3O
4
المركبات الأخرى
Unlike palladium acetate, platinum(II) acetate is not commercially available. Where a base is desired, the halides have been used in conjunction with sodium acetate.[33] The use of platinum(II) acetylacetonate has also been reported.[34]
Several barium platinides have been synthesized in which platinum exhibits negative oxidation states ranging from −1 to −2. These include BaPt, Ba 3Pt 2, and Ba 2Pt.[35] Caesium platinide, Cs 2Pt, a dark-red transparent crystalline compound[36] has been shown to contain Pt2− anions.[37] Platinum also exhibits negative oxidation states at surfaces reduced electrochemically.[38] The negative oxidation states exhibited by platinum are unusual for metallic elements, and they are attributed to the relativistic stabilization of the 6s orbitals.[37]
It is predicted that even the cation PtO2+4 in which platinum exists in +10 oxidation state may be achievable.[39]
Zeise's salt, containing an ethylene ligand, was one of the first organometallic compounds discovered. قالب:Chem name is a commercially available olefin complex, which contains easily displaceable cod ligands ("cod" being an abbreviation of 1,5-cyclooctadiene). The cod complex and the halides are convenient starting points to platinum chemistry.[33]
Cisplatin, or قالب:Chem name is the first of a series of square planar platinum(II)-containing chemotherapy drugs.[40] Others include carboplatin and oxaliplatin. These compounds are capable of crosslinking DNA, and kill cells by similar pathways to alkylating chemotherapeutic agents.[41] (Side effects of cisplatin include nausea and vomiting, hair loss, tinnitus, hearing loss, and nephrotoxicity.)[42][43]
Organoplatinum compounds such as the above antitumour agents, as well as soluble inorganic platinum complexes, are routinely characterised using 195 Pt nuclear magnetic resonance spectroscopy.
التطبيقات

البلاتين مؤثر مهم في الوساطة الكيمياوية، فهو يستعمل وسيطاً في صناعة حمض الكبريت والنشادر وحمض الآزوت؛ وبوجوده ينفجر مزيج من الأكسجين والهدروجين للحال كما يؤدي وجوده إلى اشتعال بخار الكحول في الهواء. ويستعمل أيضاً وسيطاً في تفاعلات الهدرجة إذ إنه يمتص الهدروجين، وتزداد درجة امتصاصه له بارتفاع درجة الحرارة، ويكون معظم الهيدْروجين الممتص في الحالة الذرية، ويتمتع بنشاط كيمياوي كبير. تزداد قوة الوساطة بتجزئة المعدن كما في حالة البلاتين الإسفنجي وأسود البلاتين. وبسبب الخمول الكيمياوي الكبير للإيريديوم والبلاتين، استعملت الخليطة المكونة من 90% من البلاتين و10 % من الإيريديوم لصنع المتر والكيلو غرام العيارييْن المحفوظين في جنيف. ويستفاد منه في صنع الأدوات الكيمياوية التي تستعمل في حالات التسخين الشديد لأنه خامل، وهو صعب الانصهار، ويمكن طرقه بسهولة. إلا أنه يجب الحذر عند استعماله بدرجات الحرارة العالية لأنه يتأثر عندئذ بكثير من المواد كالماء الملكي ومحلول الكلور وكلوريد الحديد (III) والقلويات المصهورة، كما يؤلف خلائط مع كثير من المعادن لاسيما الرصاص، والقصدير، والبزموت، والزئبق، ويتحد مع الكربون والفوسفور والكبريت والسيليكون فيصبح قابلاً للكسر. ويمكن تسخين كربونات المعادن القلوية في البواتق البلاتينية من دون أن تتخرش. وتستعمل خليطته مع الكوبلْت في صنع المغانط القوية. وتُلْحَم أسلاك البلاتين في داخل الزجاج لتنقل التيار الكهربائي إلى داخل الأنابيب الزجاجية ومصابيح الإضاءة لأنه عندما يسخن يصبح عامل تمدده مساوياً عامل تمدد الزجاج. ويستعمل هو وخلائطه في صناعة الزجاج وذلك لحفظ الزجاج المصهور أو نقله أو تحريكه. ويستعمل في صناعة السيارات في خلية الوقود وسيطاً لتوليد الكهرباء من تفاعلات كيمياوية. ويدخل في صناعة المجوهرات وفي طب الأسنان إذ يدخل في تركيب حشوة نخور الأسنان.
Of the 218 tonnes of platinum sold in 2014, 98 tonnes were used for vehicle emissions control devices (45%), 74.7 tonnes for jewelry (34%), 20.0 tonnes for chemical production and petroleum refining (9.2%), and 5.85 tonnes for electrical applications such as hard disk drives (2.7%). The remaining 28.9 tonnes went to various other minor applications, such as medicine and biomedicine, glassmaking equipment, investment, electrodes, anticancer drugs, oxygen sensors, spark plugs and turbine engines.[44]
Catalyst
The most common use of platinum is as a catalyst in chemical reactions, often as platinum black. It has been employed as a catalyst since the early 19th century, when platinum powder was used to catalyze the ignition of hydrogen. Its most important application is in automobiles as a catalytic converter, which allows the complete combustion of low concentrations of unburned hydrocarbons from the exhaust into carbon dioxide and water vapor. Platinum is also used in the petroleum industry as a catalyst in a number of separate processes, but especially in catalytic reforming of straight-run naphthas into higher-octane gasoline that becomes rich in aromatic compounds. PtO
2, also known as Adams' catalyst, is used as a hydrogenation catalyst, specifically for vegetable oils.[27] Platinum also strongly catalyzes the decomposition of hydrogen peroxide into water and oxygen[45] and it is used in fuel cells[46] as a catalyst for the reduction of oxygen.[47]
Standard

From 1889 to 1960, the meter was defined as the length of a platinum-iridium (90:10) alloy bar, known as the international prototype meter. The previous bar was made of platinum in 1799. Until May 2019, the kilogram was defined as the mass of the international prototype of the kilogram, a cylinder of the same platinum-iridium alloy made in 1879.[48]
The Standard Platinum Resistance Thermometer (SPRT) is one of the four types of thermometers used to define the International Temperature Scale of 1990 (ITS-90), the international calibration standard for temperature measurements. The resistance wire in the thermometer is made of pure platinum (NIST manufactured the wires from platinum bar stock with a chemical purity of 99.999% by weight).[49][50] In addition to laboratory uses, Platinum Resistance Thermometry (PRT) also has many industrial applications, industrial standards include ASTM E1137 and IEC 60751.
The standard hydrogen electrode also uses a platinized platinum electrode due to its corrosion resistance, and other attributes.[51]
As an investment
Platinum is a precious metal commodity; its bullion has the ISO currency code of XPT. Coins, bars, and ingots are traded or collected. Platinum finds use in jewellery, usually as a 90–95% alloy, due to its inertness. It is used for this purpose for its prestige and inherent bullion value. Jewellery trade publications advise jewellers to present minute surface scratches (which they term patina) as a desirable feature in an attempt to enhance value of platinum products.[52][53]
In watchmaking, Vacheron Constantin, Patek Philippe, Rolex, Breitling, and other companies use platinum for producing their limited edition watch series. Watchmakers appreciate the unique properties of platinum, as it neither tarnishes nor wears out (the latter quality relative to gold).[54]
During periods of sustained economic stability and growth, the price of platinum tends to be as much as twice the price of gold, whereas during periods of economic uncertainty,[55] the price of platinum tends to decrease due to reduced industrial demand, falling below the price of gold. Gold prices are more stable in slow economic times, as gold is considered a safe haven. Although gold is also used in industrial applications, especially in electronics due to its use as a conductor, its demand is not so driven by industrial uses. In the 18th century, platinum's rarity made King Louis XV of France declare it the only metal fit for a king.[56]
1,000 cubic centimeters of 99.9% pure platinum, worth about US$696,000 at 29 Jun 2016 prices[57]
Other uses
In the laboratory, platinum wire is used for electrodes; platinum pans and supports are used in thermogravimetric analysis because of the stringent requirements of chemical inertness upon heating to high temperatures (~1000 °C). Platinum is used as an alloying agent for various metal products, including fine wires, noncorrosive laboratory containers, medical instruments, dental prostheses, electrical contacts, and thermocouples. Platinum-cobalt, an alloy of roughly three parts platinum and one part cobalt, is used to make relatively strong permanent magnets.[27] Platinum-based anodes are used in ships, pipelines, and steel piers.[15] Platinum drugs are used to treat a wide variety of cancers, including testicular and ovarian carcinomas, melanoma, small-cell and non-small-cell lung cancer, myelomas and lymphomas.[58]
Symbol of prestige in marketing
Platinum's rarity as a metal has caused advertisers to associate it with exclusivity and wealth. "Platinum" debit and credit cards have greater privileges than "gold" cards.[59] "Platinum awards" are the second highest possible, ranking above "gold", "silver" and "bronze", but below diamond. For example, in the United States, a musical album that has sold more than 1 million copies will be credited as "platinum", whereas an album that has sold more than 10 million copies will be certified as "diamond".[60] Some products, such as blenders and vehicles, with a silvery-white color are identified as "platinum". Platinum is considered a precious metal, although its use is not as common as the use of gold or silver. The frame of the Crown of Queen Elizabeth The Queen Mother, manufactured for her coronation as Consort of King George VI, is made of platinum. It was the first British crown to be made of this particular metal.[61]
المخاطر الصحية
تركيزات الپلاتين في التربة والماء والهواء ضئيلة، وفى بعض الأماكن نجد أن الترسبات بفعل العمليات الطبيعية تكون غنية بمحتواها من البلاتنيوم وخاصة في جنوب أفريقيا وروسيا والولايات المتحدة الأمريكية. يستخدم البلاتنيوم كمكون لمنتجات معدنية عديدة مثل الإلكترود، وكعامل مساعد في العديد من التفاعلات الكيميائية. تستخدم مركبات البلاتنيوم كنوع من أنواع العقاقير لعلاج السرطان.[62]
والبلاتنيوم كمعدن ليس خطيراً، لكن مع أملاح البلاتنيوم يكون التأثير الضار لهذا المعدن ومنها:
- تغير في الصفات الوراثية.
- السرطان.
- عند التعرض لها يصاب بعض الأشخاص بحساسية في الجلد أو الأغشية المخاطية.
- ضمور في بعض الأعضاء مثل الأمعاء الدقيقة، الكلى، نخاع العظام.
- ضمور الأعصاب السمعية.
- عند استخدام أملاح البلاتنيوم فهناك احتمالية بزيادة خطورة بعض المواد الكيميائية الأخرى في جسم الإنسان مثل السيلنيوم.
- لا توجد هناك أية نتائج تشير بحدوث تسمم البلاتنيوم من الأطعمة.
انظر أيضاً
المصادر
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ "platinum (Pt)". Archived 5 أبريل 2012 at the Wayback Machine Encyclopædia Britannica. Encyclopædia Britannica Inc., 2012. 24 April 2012
- ^ قالب:OEtymD
- ^ Hobson, Peter. "Currency shocks knock platinum to 10-year lows". Reuters (in الإنجليزية). Retrieved 2018-08-20.
- ^ "Platinum in the Glass Industry". Johnson Matthey Technology Review.
- ^ "Chapter 6.11 Platinum", Air Quality Guidelines (2nd ed.), WHO Regional Office for Europe, Copenhagen, Denmark, 2000
- ^ Wheate, N. J.; Walker, S.; Craig, G. E.; Oun, R. (2010). "The status of platinum anticancer drugs in the clinic and in clinical trials" (PDF). Dalton Transactions. 39 (35): 8113–27. doi:10.1039/C0DT00292E. hdl:2123/14271. PMID 20593091.
- ^ "Platinum Prices vs Gold Prices".
- ^ "Live latinum Price Charts & Historical Data". APMEX. Retrieved 14 March 2021.
- ^ هيام بيرقدار. "البلاتين". الموسوعة العربية. Retrieved 2012-05-01.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A 729: 3–128, doi:, Bibcode: 2003NuPhA.729....3A, https://hal.archives-ouvertes.fr/in2p3-00020241/document
- ^ Cohen, D. (23 May 2007). "Earth's natural wealth: an audit". New Scientist. doi:10.1016/S0262-4079(07)61315-3.
- ^ Stellman, Jeanne Mager (1998). Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations. International Labour Organization. p. 141. ISBN 978-92-2-109816-4. Archived from the original on 24 مارس 2017.
- ^ Murata, K. J. (1958). in Symposium on Spectrocemical Analysis for Trace Elements. ASTM International. p. 71. Archived from the original on 24 مارس 2017.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةCRC - ^ "The History of Platinum". Alaska Community Database Online. ExploreNorth. Archived from the original on 22 ديسمبر 2010. Retrieved 12 أبريل 2011.
Platinum is located on the Bering Sea coast, below Red Mountain on the south spit of Goodnews Bay.
- ^ Xiao, Z.; Laplante, A. R. (2004). "Characterizing and recovering the platinum group minerals—a review". Minerals Engineering. 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ Dan Oancea Platinum In South Africa Archived 13 أغسطس 2011 at the Wayback Machine. MINING.com. September 2008
- ^ R. Grant Cawthorn (1999). "Seventy-fifth Anniversary of the Discovery of the Platiniferous Merensky Reef". Platinum Metals Review. Retrieved 24 Dec 2017.
- ^ أ ب Seymour, R. J.; O'Farrelly, J. I. (2001). "Platinum-group metals". Kirk Othmer Encyclopedia of Chemical Technology. Wiley. doi:10.1002/0471238961.1612012019052513.a01.pub2. ISBN 978-0471238966.
- ^ "Mining Platinum in Montana". New York Times. 13 أغسطس 1998. Archived from the original on 3 فبراير 2008. Retrieved 9 سبتمبر 2008.
- ^ Loferski, P. J. (يوليو 2012). "Platinum–Group Metals" (PDF). USGS Mineral Resources Program. Archived (PDF) from the original on 7 يوليو 2012. Retrieved 17 يوليو 2012.
- ^ "Evidence of huge deposits of platinum in State". The Hindu. Chennai, India. 2 يوليو 2010. Archived from the original on 6 ديسمبر 2011.
- ^ Koeberl, Christian (1998). "Identification of meteoritic components in imactites". Meteorites: flux with time and impact effects. pp. 133–155. ISBN 978-1-86239-017-1. Archived from the original on 24 مارس 2017.
- ^ Johnson Matthey 2006 supply and demand charts
- ^ BBC 2002 article on supply and demand
- ^ أ ب ت Krebs, Robert E. (1998). "Platinum". The History and Use of our Earth's Chemical Elements. Greenwood Press. pp. 124–127. ISBN 978-0-313-30123-0.
- ^ Kauffman, George B.; Thurner, Joseph J.; Zatko, David A. (1967). Ammonium Hexachloroplatinate(IV). Inorganic Syntheses. Vol. 9. pp. 182–185. doi:10.1002/9780470132401.ch51. ISBN 978-0-470-13240-1.
- ^ Smith, G. F.; Gring, J. L. (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". Journal of the American Chemical Society. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ^ Schweizer, A. E.; Kerr, G. T. (1978). "Thermal Decomposition of Hexachloroplatinic Acid". Inorganic Chemistry. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ^ Perry, D. L. (1995). Handbook of Inorganic Compounds. Vol. 177. pp. 296–298. Bibcode:1956Natur.177..639.. doi:10.1038/177639a0. ISBN 978-0-8493-8671-8. S2CID 4184615.
{{cite book}}:|journal=ignored (help) - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةlagowski - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةhan - ^ Ahrens, Sebastian; Strassner, Thomas (2006). "Detour-free synthesis of platinum-bis-NHC chloride complexes, their structure and catalytic activity in the CH activation of methane". Inorganica Chimica Acta. 359 (15): 4789–4796. doi:10.1016/j.ica.2006.05.042.
- ^ Karpov, Andrey; Konuma, Mitsuharu; Jansen, Martin (2006). "An experimental proof for negative oxidation states of platinum: ESCA-measurements on barium platinides". Chemical Communications. 44 (8): 838–840. doi:10.1039/b514631c. PMID 16479284.
- ^ Karpov, Andrey; Nuss, Jürgen; Wedig, Ulrich; Jansen, Martin (2003). "Cs2Pt: A Platinide(-II) Exhibiting Complete Charge Separation". Angewandte Chemie International Edition. 42 (39): 4818–21. doi:10.1002/anie.200352314. PMID 14562358.
- ^ أ ب Jansen, Martin (2005). "Effects of relativistic motion of electrons on the chemistry of gold and platinum". Solid State Sciences. 7 (12): 1464–74. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ^ Ghilane, J.; Lagrost, C.; Guilloux-Viry, M.; Simonet, J.; et al. (2007). "Spectroscopic Evidence of Platinum Negative Oxidation States at Electrochemically Reduced Surfaces". Journal of Physical Chemistry C. 111 (15): 5701–7. doi:10.1021/jp068879d.
- ^ Gunther, M. (13 June 2016). "Oxidation state +10 may exist in a platinum compound". Chemistry World.
Yu, H.S.; Truhlar, D.G. (2016). "Oxidation State 10 Exists". Angew. Chem. Int. Ed. 55 (31): 9004–6. doi:10.1002/anie.201604670. PMID 27273799. - ^ Riddell, Imogen A.; Lippard, Stephen J. (2018). "Cisplatin and Oxaliplatin:Our Current Understanding of Their Actions". In Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K. O. (eds.). Metallo-Drugs:Development and Action of Anticancer Agents. Vol. 18. pp. 1–42. doi:10.1515/9783110470734-007. ISBN 978-3-11-046984-4. PMID 29394020.
{{cite book}}:|journal=ignored (help) - ^ Richards, A. D.; Rodger, A. (2007). "Synthetic metallomolecules as agents for the control of DNA structure" (PDF). Chemical Society Reviews. 36 (3): 471–483. doi:10.1039/b609495c. PMID 17325786.
- ^ Carinder, James A.; Morrison, Pilar M.; Morrison, David G.; Jack E. Saux III (7 يوليو 2014). Practical Oncology Protocols. Mill City Press, Incorporated. p. 22. ISBN 978-1-62652-816-1. Archived from the original on 9 نوفمبر 2017. Retrieved 11 يونيو 2016.
- ^ Taguchi, Takashi; Nazneen, Arifa; Abid, M. Ruhul; Razzaque, Mohammed S. (2005). Cisplatin-Associated Nephrotoxicity and Pathological Events. Contributions to Nephrology. Vol. 148. pp. 107–121. doi:10.1159/000086055. ISBN 978-3-8055-7858-5. PMID 15912030. S2CID 24509477.
- ^ Loferski, P. J. (يوليو 2016). "2014 Minerals Yearbook; Platinum-group metals" (PDF). USGS Mineral Resources Program. Archived (PDF) from the original on 18 أغسطس 2016. Retrieved 11 يوليو 2016.
- ^ Petrucci, Ralph H. (2007). General Chemistry: Principles & Modern Applications (9th ed.). Prentice Hall. p. 606. ISBN 978-0-13-149330-8.
- ^ Laramie, James; Dicks, Andrew (2003). Fuel Cell System Explained. John Wiley & Sons Ltd. ISBN 978-0-470-84857-9.
- ^ Wang, C.; Daimon, H.; Onodera, T.; Koda, T.; Sun, S. (2008). "A general approach to the size- and shape-controlled synthesis of platinum nanoparticles and their catalytic reduction of oxygen". Angewandte Chemie International Edition. 47 (19): 3588–91. doi:10.1002/anie.200800073. PMID 18399516.
- ^ Gupta, S. V. (2010). "Chapter 4. Metre Convention and Evolution of Base Units". Units of Measurement. Springer Series in Materials Science. Vol. 122. p. 47. doi:10.1007/978-3-642-00738-5_4. ISBN 978-3-642-00777-4. S2CID 150519250.
- ^ "Guide to the Realization of the ITS-90 - Platinum Resistance Thermometry" (PDF). International Committee for Weights and Measures. Archived from the original (PDF) on 24 February 2021. Retrieved 23 October 2020.
- ^ "Standard Reference Material 1750:Standard Platinum Resistance Thermometers,13.8033 K to 429.7485 K" (PDF). NIST.
- ^ Feltham, A. M.; Spiro, Michael (1971). "Platinized platinum electrodes". Chemical Reviews. 71 (2): 177–193. doi:10.1021/cr60270a002.
- ^ "Professional Jeweler's Magazine Archives, issue of August 2004". Archived from the original on 28 سبتمبر 2011. Retrieved 19 يونيو 2011.
- ^ "Platinum primer". Diamond Cutters International. 12 ديسمبر 2008. Archived from the original on 27 سبتمبر 2011. Retrieved 18 يونيو 2011.
- ^ "Unknown Facts about Platinum". watches.infoniac.com. Archived from the original on 21 سبتمبر 2008. Retrieved 9 سبتمبر 2008.
- ^ "Platinum versus Gold". The Speculative Invertor. 14 أبريل 2002. Archived from the original on 26 أكتوبر 2008.
- ^ "Platinum". Minerals Zone. Archived from the original on 12 أكتوبر 2008. Retrieved 9 سبتمبر 2008.
- ^ "21.09kg Pt". WolframAlpha. Archived from the original on 23 أغسطس 2014. Retrieved 14 يوليو 2012.
- ^ Apps, Michael G; Choi, Eugene H Y; Wheate, Nial J (August 2015). "The state-of-play and future of platinum drugs". Endocrine-Related Cancer. Society for Endocrinology. 22 (4): R219–R233. doi:10.1530/ERC-15-0237. PMID 26113607.
- ^ Gwin, John (1986). "Pricing Financial Institution Products". Journal of Professional Services Marketing. 1 (3): 91–99. doi:10.1300/J090v01n03_07.
- ^ Crouse, Richard (1 مايو 2000). Big Bang Baby: The Rock Trivia Book. p. 126. ISBN 978-0-88882-219-2. Archived from the original on 24 مارس 2017.
- ^ Gauding, Madonna (6 أكتوبر 2009). The Signs and Symbols Bible: The Definitive Guide to Mysterious Markings. ISBN 978-1-4027-7004-3. Archived from the original on 24 مارس 2017.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
- Los Alamos National Laboratory — Platinum
- Nuclides and Isotopes Fourteenth Edition: Chart of the Nuclides, General Electric Company, 1989.
- Einhorn LH. "Treatment of testicular cancer: a new and improved model" J. Clin. Oncol. 1990 Vol 8, pp1777-81.
- Von Hoff DD, et al. "Toxic effects of cis-dichlorodiammineplatinum(II) in man." Cancer Treat. Rep. 1979 Sep-Oct; 63(9-10), pp1527-31.
مراجع للإستزادة
- هيام بيرقدار، كيمياء المعادن الانتقالية (الشام للطباعة ـ منشورات جامعة دمشق 1984(.
- Cotton and Wilkinson, Advaneed Inorganic Chemistry, Fourth Edition (John Wiley& Sons 1980).
- James E. Huheey, Inorganic Chemistry, Principles of Structure and Reactivity, Third Edition (Harper& Row 1983).
وصلات خارجية
- Kitco Platinum prices
- The Platinum Group Metals Database
- A balanced historical account of the sequence of discoveries of platinum; illustrated.
- WebElements.com — Platinum
- Platinum Metals Review E-Journal
- Platinum Guild International
- Platinum Today: Current and historical prices
- Platinum - Redefinition of Noble Metals







![1,000 cubic centimeters of 99.9% pure platinum, worth about US$696,000 at 29 Jun 2016 prices[57]](/w/images/thumb/4/48/One_litre_of_Platinum.jpg/200px-One_litre_of_Platinum.jpg)