سترونشيوم
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سترونشيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | معدني أبيض فضي. بلون أصفر شاحب [1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الوزن الذري العياري Ar°(Sr) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سترونشيوم في الجدول الدوري | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الرقم الذري (Z) | 38 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة | 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الدورة | period 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المستوى الفرعي | s-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Kr] 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الإلكترونات بالغلاف | 2، 8، 18، 8، 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور at د.ح.ض.ق | solid | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1050 K (777 °س، 1431 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 1650 K (1377 °س، 2511 °ف) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 2.64 ج/سم³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 2.375 ج/سم³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 7.43 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 141 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية المولية | 26.4 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
ضغط البخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 0.95 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف القطر الذري | empirical: 215 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر التكافؤ | 195±10 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 249 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خصائص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | face-centered cubic (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت قضيب رفيع | 35.4 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 22.5 µm/(m⋅K) (عند 25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقاومة الكهربائية | 132 nΩ⋅m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الترتيب المغناطيسي | مغناطيسي مساير | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| القابلية المغناطيسية | −92.0×10−6 cm3/mol (298 ك)[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونگ | 15.7 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 6.03 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة پواسون | 0.28 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موز | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم كاس | 7440-24-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التاريخ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التسمية | after the mineral strontianite, itself named after Strontian, Scotland | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاكتشاف | William Cruickshank (1787) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أول عزل | Humphry Davy (1808) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نظائر السترونشيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
سترونشيوم (إنگليزية: Strontium)، هو عنصر كيميائي رمزه Sr ورقمه الذري 38. كعنصر قلوبي ترابي، السترونشيوم هو عنصر فلزي صلب أبيض-فضي مائل للصفرة شديد التفاعل كيميائياً. يشكل المعدن طبقة أكسيد داكنة عند تعرضه للهواء. يمتلك السترونشيوم خواصاً فيزيائية وكيميائية مشابهة لتلك الخاصة بجيرانه الرأسيين في الجدول الدوري، الكالسيوم والباريوم. يتواجد في الطبيعة بشكل رئيسي في معدني السلستين والسترونتيانايت، ويتم استخراجه في الغالب من هذين المعدنين.
سُمي كل من السترونشيوم والسترونتيانايت على اسم سترونتيان، وهي قرية في إسكتلندا تم اكتشاف المعدن بالقرب منها في عام 1790 بواسطة أدير كرافورد ووليام كروكشانك؛ تم تحديده كعنصر جديد في العام التالي من لونه الأحمر القرمزي في اختبار اللهب. تم عزل السترونشيوم لأول مرة كمعدن في عام 1808 بواسطة همفري ديڤي باستخدام عملية التحليل الكهربائي المكتشفة حديثاً في ذلك الوقت. خلال القرن التاسع عشر، كان السترونشيوم يستخدم غالباً في إنتاج السكر من بنجر السكر (انظر عملية السترونشيوم ). في ذروة إنتاج أنابيب أشعة الكاثود للتلفزيون، استخدم ما يصل إلى 75 في المائة من استهلاك السترونشيوم في الولايات المتحدة لصناعة زجاج الواجهة.[4] مع استبدال أنابيب أشعة الكاثود بطرق عرض أخرى، انخفض استهلاك السترونشيوم بشكل كبير.[4] في حين أن السترونشيوم الطبيعي (الذي غالباً ما يكون النظير السترونشيوم-88) مستقر، فإن المركب الصناعي السترونتيوم-90 مشع وهو أحد أخطر مكونات التساقط النووي، مثل السترونشيوم يمتصه الجسم بطريقة مشابهة للكالسيوم. من ناحية أخرى، السترونتيوم الطبيعي المستقر لا يشكل خطورة على الصحة.
الخصائص

السترونشيوم هو معدن فضي ثنائي التكافؤ ذو لون أصفر باهت تكون خواصه في الغالب متوسطة بين ومماثلة لتلك الخاصة بمجموعته المجاورة الكالسيوم والباريوم.[5] وهو ألين من الكالسيوم وأكثر صلابة من الباريوم. درجة انصهاره (777°س) ونقطة غليانه (1377°س) هما أقل من تلك الخاصة بالكالسيوم (843°س) و1484°س على التوالي)؛ ويواصل الباريوم هذا الاتجاه التنازلي في نقطة الانصهار (843°س)، لكن الأمر ليس كذلك في ما يتعلق بنقطة الغليان (1900°س). كثافة السترونشيوم (2.64 گ/سم3) وهي متوسطة بالمثل بين تلك الخاصة بالكالسيوم (1.54 گ/سم3) والباريوم (3.594 گ/سم3).[6] التآصلات الثلاث لتواجد السنتروشيوم المعدني، بنقطتي انتقال عند 234 و540°س.[7]
جهد القطب القياسي لزوج Sr2+/Sr هو −2.89 ڤ، التي تقع تقريباً في منتصف المسافة بين تلك الخاصة بزوجي Ca2+/Ca (−2.84 V) و Ba2+/Ba (−2.92 ڤ، والقريبة من تلك الخاصة بالفلزين القلويين المجاورين.[8] السترونشيوم هو وسيط بين الكالسيوم والباريوم في تفاعله مع الماء، ويتفاعل معه عند التلامس لإنتاج هيدروكسيد السترونشيوم وغاز الهيدروجين. يحترق معدن السترونشيوم في الهواء لينتج كلاً من أكسيد السترونشيوم ونيتريد السترونشيوم، ولكن نظرًا لأنه لا يتفاعل مع النيتروجين تحت درجة 380°س، في درجة حرارة الغرفة، ويشكل الأكسيد فقط بشكل تلقائي.[6] بجنب أكسيد SrO البسيط، قد ينتج پيروكسيد SrO2 بالاكسدة المباشرة لفلز السترونشيوم تحت ضغط الأكسجين المرتفع، وهناك بعض الأدلة على وجود أكسيد فائق أصفر Sr(O2)2.[9] هيدروكسيد السترونشيوم، Sr(OH)2، هي قاعدة قوية، على الرغم من أنه ليس قوياً مثل هيدروكسيدات الباريوم أو الفلزات القلوية.[10] جميع ألهديات السترونشيوم الأربعة معروفة.[11]
نظرًا للحجم الكبير لعناصر مستوى فرعي s الثقيلة، بما في ذلك السترونشيوم، هناك مجموعة واسعة الناطق معروفة من أرقام التنسيق، من 2 أو 3 أو 4 وصولاً إلى 22 أو 24 في SrCd11 وSrZn13. Sr2+ هو أيون كبير للغالية، لذا فإن العدد التساندي المرتفع هو القاعدة.[12] يلعب الحجم الكبير للسترونشيوم والباريوم دوراً هاماً في تثبيت مركبات السترونشيوم باستخدام روابط متعددة السنون كبيرة الحلقة مثل الإثيرات التاجية: على سبيل المثال، بينما 18-تاج-6 تشكل مركبات ضعيفة نسبياً مع الكالسيوم والفلزات القلوية، تكون مركبات السترونشيوم والباريوم أقوى بكثير.[13]
تحتوي مركبات السترونشيوم العضوي على واحد أو أكثر من روابط السترونشيوم الكربوني. أُبلغ عنها عنها كوسائط في تفاعلات باربييه.[14][15][16] على الرغم من أن السترونشيوم يقع في نفس مجموعة المغنيسيوم، وأن مركبات المغنسيوم العضوي شائعة الاستخدام في الكيمياء، فإن مركبات السيرونشيوم العضوية ليست منتشرة بشكل مشابه لأن تحضيرها أكثر صعوبة وهي أكثر تفاعلًا. تميل مركبات السترونشيوم العضوية إلى أن تكون أكثر تشابهًا مع المركبات العضوية للاوروپيوم أو المركبات العضوية السماريوم بسبب نصف القطر الأيوني لهذه العناصر (Sr2+ 118 pm; Eu2+ 117 pm; Sm2+ 122 pm). لا يمكن تحضير معظم هذه المركبات إلا في درجات حرارة منخفضة؛ تميل الروابط الضخمة إلى تفضيل الاستقرار. على سبيل المثال، dicyclopentadienyl السترونشيوم، Sr(C5H5)2 يجب أن يتم عن طريق التفاعل المباشر لمعدن السترونشيوم مع المركوروسين أو السيكلوپنتادايين نفسه؛ باستبدال ربيطة C5H5 بربيطة C5(CH3)5 الأضخم، ومن ناحية أخرى، يزيد من قابلية ذوبان المركب وتقلبه واستقراره الحركي.[17]
بسبب تفاعله الشديد مع الأكسجين والماء، يتواجد السترونشيوم بشكل طبيعي فقط في المركبات التي تحتوي على عناصر أخرى، مثل معادن السترونتيانيت والسلستين. يحتفظ بها تحت سائل هيدروكربوني مثل الزيت المعدني أو الكيروسين لمنع الأكسدة؛ يتحول معدن السترونشيوم المعرض حديثاً إلى اللون الأصفر بسرعة مع تكوين الأكسيد. معدن السترونشيوم المسحوق ناعماً هو قابل للاشتعال تلقائياً، مما يعني أنه سيشتعل تلقائياً في الهواء عند درجة حرارة الغرفة. تضفي أملاح السترونشيوم المتطايرة لوناً أحمر فاتحاً على اللهب، وتستخدم هذه الأملاح في الألعاب النارية وفي إنتاج المواد المتوهجة.[6] مثل الكالسيوم والباريوم، وكذلك الفلزات القلوية ولانثانيدات الاوروپيوم والإتربيوم ثنائية التكافؤ، يذوب فلز السترونشيوم مباشرة في الأمونيا السائلة لإعطاء محلول أزرق داكن من الإلكترونات المنحلة.[5]
النظائر
السترونشيوم الطبيعي هو مزيج من أربع نظائر مستقرة: 84Sr، 86Sr، 87Sr، و88Sr.[6] تزداد وفرتها مع زيادة عدد الكتلة، والنظير الأثقل، 88Sr، يشكل حوالي 82.6% من السترونشيوم الطبيعي، على الرغم من أن الوفرة تختلف بسبب إنتاج 87Sr إشعاعي المنشأ كوليد لـ87Rb ذي اضمحلال بيتا طويل العمر.[18] يعتبر هذا أساساً تأريخ الروبيديوم-السترونشيوم. من بين النظائر الغير مستقرة، يكون وضع الاضمحلال الأساسي للنظائر أخف من 85Sr هو اصطياد إلكترون أو انبعاث الپوزيترون لنظائر الروبيدوم، والنظائر أثقل من 88Sr هي انبعاث إلكترون لنظائر الإتريوم. من النظائر الجديرة بالذكر 89Sr و90Sr. الأول له بعمر نصف 50.6 يوم ويستخدم لعلاج سرطان العظام بسبب التشابه الكيميائي للسترونشيوم وبالتالي القدرة على استبدال الكالسيوم.[19][20] بينما 90Sr (بعمر نصف 28.90 سنة) يستخدم بشكل مماثل، وهو أيضًا نظير مثير للقلق في التساقط من الأسلحة والحوادث النووية نظراً لإنتاجه كمنتج انشطاري. قد يؤدي تواجد السترونشيوم في العظام إلى الإصابة بسرطان العظام وسرطان الأنسجة المجاورة، وابيضاض الدم.[21] تسبب حادث تشرنوبل النووي 1986 في تلوث حوالي 30.000 كم² بأكثر من 10 kBq/م2 بمادة 90Sr، التي تشكل حوالي 5% من 90Sr الذي كان في مركز المفاعل.[22]
التاريخ
سُمي السترونشيوم على اسم قرية سترونشيان الإسكتلندية (بالگالية Sròn an t-Sìthein)، حيث تم اكتشافه في خامات مناجم الرصاص.[23]
عام 1790، أدرك أدير كروفورد، وهو طبيب يعمل في تحضير الباريوم، وزميله وليام كروكشانك، أن خامات الشترونشيوم أظهرت خصائص تختلف عن تلك الموجودة في خامات مصادر أخرى "للسپارس الثقيل".[24] سمح هذا لكروفورد أن يستنتج في الصفحة رقم 355 "... من المحتمل بالفعل، أن المعدن الإسكتلندي هو نوع جديد لم يتم فحصه بشكل كافٍ حتى الآن." قام الطبيب وجامع المعادن فردريش گابرييل سولزر ويوهان فريدريش بلومنباخ بتحليل معدن من السترونشيوم وأطلق عليه اسم سترونشيانيت. كما توصل إلى استنتاج مفاده أنه كان متميزًا عن الويذريت ويحتوي على أرض جديدة (neue Grunderde).[25] عام 1793 قام توماس تشارلز هوب، أستاذ الكيمياء بجامعة گلاسگو بدراسة المعدن[26][27] واقترح اسم سترونتيتس.[28][29][30] أكد العمل السابق لكروفورد وأضاف: "... الرأي المناسب تمامًا، مثل أي صفة قد يمتلكها، وهي الطريقة الحالية". في النهاية قام السير همفري ديڤي بعزل العنصر في عام 1808 بواسطة التحليل الكهربائي لمزيج يحتوي على كلوريد السترونشيوم وأكسيد الزئبق، وأعلن عنه في محاضرة ألقيت في الجمعية الملكية في 30 يونيو 1808.[31] تمشيا مع تسمية العناصر الأرضية القلوية الأخرى، قام بتغيير الاسم إلى "السترونشيوم".[32][33][34][35][36]
كان أول استخدام واسع النطاق للسترونشيوم في إنتاج السكر من بنجر السكر. على الرغم من تسجيل براءة اختراع لعملية التبلور باستخدام هيدروكسيد السترونشيوم بواسطة أوگستين-پيير دبرونفو عام 1849[37] وطُرح على نطاق واسع مع تحسين العملية في أوائل سبعينيات القرن التاسع عشر. استخدمت صناعة السكر الألمانية هذه العملية جيداً في القرن العشرين. قبل الحرب العالمية الأولى استخدمت صناعة سكر البنجر 100.000 إلى 150.000 طن من هيدروكسيد السترونشيوم لهذه العملية سنوياً.[38] في هذه العملية، أُعيد تدوير هيدروكسيد السترونشيوم، لكن الطلب على استبدال الخسائر أثناء الإنتاج كان مرتفعاً بما يكفي لخلق طلب كبير لبدء تعدين السترونتيانيت في مونسترلاند. انتهى تعدين السترونتيانيت في ألمانيا عندما بدأ تعدين رواسب السلستين في گلوسترشاير.[39] أنتجت هذه المناجم معظم إمدادات السترونشيوم في العالم من عام 1884 إلى عام 1941. على الرغم من أن رواسب السلستين في حوض غرناطة كانت معروفة لبعض الوقت، إلا أن التعدين على نطاق واسع لم يبدأ قبل الخمسينيات.[40]
أثناء اختبار الأسلحة النووية في الغلاف الجوي، لوحظ أن السترونشيوم-90 هو أحد منتجات الانشطار النووي ذات العائد المرتفع نسبياً. التشابه مع الكالسيوم وفرصة أن السترونشيوم-90 قد يصبح مخصباً في العظام جعل البحث حول استقلاب السترونشيوم موضوعاً هاماً.[41][42]
التواجد
يتواجد السترونشيوم بشكل شائع في الطبيعة، حيث يحتل الترتيب 15 من حيث وفرة العناصر على الأرض (يحتل الباريوم الأثقل الترتيب الرابع عشر)، ويقدر بمتوسط 360 درجة تقريباً؛ جزء في المليون في قشرة الأرض[43] ويتواجد بشكل أساسي على شكل أملاح سلستين الكبريتتات (SrSO4) وسترونتيانيت الكربونات(SrCO3). من بين الاثنين، يحدث السلستين بوتيرة أكبر في الرواسب ذات الحجم الكافي للتعدين. نظرًا لاستخدام السترونشيوم في أغلب الأحيان على شكل كربونات، فإن السترونتيانيت سيكون أكثر فائدة من المعدنين الشائعين، ولكن تم اكتشاف القليل من الرواسب المناسبة للتطوير.[44] بسبب الطريقة التي يتفاعل بها السترونشيوم مع الهواء والماء، لا يتواجد السترونشيوم في الطبيعة إلا عندما يقترن بتكوين المعادن. يكون السترونشيوم المتواجود بشكل طبيعي مستقراً، لكن نظيره الاصطناعي Sr-90 ينتج فقط عن طريق الغبار النووي.
في المياه الجوفية يكون السلوك الكيميائي للسترونشيوم مشابهاً للكالسيوم. في درجة الحموضة من المتوسطة إلى الحمضية يكونSr2+ هو الشكل المهيمن للسترونشيوم. في وجود أيونات الكالسيوم، عادة ما يشكل السترونشيوم ترسيبات مشتركة مع أملاح الكالسيوم مثل الكالسيت والأنهدريت عند ازدياد درجة الحموضة. في درجة الحموضة من المتوسطة إلى الحمضية، يرتبط السترونشيوم المذاب بجزيئات التربة بواسطة التبادل الكاتيوني.[45]
متوسط محتوى السترونشيوم في مياه المحيطات 8 ملجم/لتر.[46][47] بتركيز بين 82 و90 μmol/لتر من السترونشيوم، يكون التركيز أقل بكثير من تركيز الكالسيوم، والذي يتراوح عادة بين 9.6 و11.6 μmol/لتر.[48][49] ومع ذلك فهو أعلى بكثير من الباريوم، الذي يصل تركيزه إلى 13 μg/لتر.[6]
الإنتاج
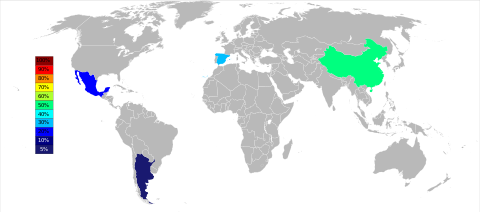
المنتجون الرئيسيون الثلاثة للسترونشيوم والسلستين اعتباراً من عام 2015 هم الصين (150.000 طن) وإسپانيا (90.000 طن) والمكسيك (70.000 طن)؛ الأرجنتين (10.000 طن) والمغرب (2،500 طن) المنتجان الأصغر. على الرغم من وجود رواسب السترونشيوم على نطاق واسع في الولايات المتحدة، إلا أنه لم يتم تعدينه منذ عام 1959.[50]
يتم تحويل نسبة كبيرة من السلستين المعدن (SrSO4) إلى كربونات بواسطة عمليتين. إما أن يتم ترشيح السلستين مباشرة بمحلول كربونات الصوديوم أو يتم تحميصه بالفحم لتكوين الكبريتيد. تنتج المرحلة الثانية مادة داكنة اللون تحتوي في الغالب على كبريتيد السترونشيوم. هذا ما يسمى "بالرماد الأسود" الذي يذوب في الماء ويتم تصفيته. تترسب كربونات السترونشيوم من محلول كبريتيد السترونشيوم عن طريق إدخال ثاني أكسيد الكربون.[51] تُختزل الكبريتات إلى كبريتيد عن طريق الاختزال الكربوحراري:
- SrSO4 + 2 C → SrS + 2 CO2
تعالج 300.000 طن سنوياً بهذه الطريقة.[52]
يُنتج الفلز تجارياً باختزال أكسيد السترونشيوم مع الألومنيوم. يُقطر السترنشيوم من المزيج.[52] يمكن أيضاً تحضير فلز السترنشيوم على نطاق صغير عن طريق التحليل الكهربائي لمحلول كلوريد السترنشيوم في كلوريد الپوتاسيوم المذاب:[8]
- Sr2+ + 2 e− → Sr
- 2 Cl− → Cl2 + 2 e−
التطبيقات
باستهلاك 75% من الإنتاج، كان الاستخدام الأساسي للسترونشيوم في الزجاج للصناعة أنابيب الأشعة المهبطية للتلفزيونات الملونة،[52] حيث يمنع انبعاث الأشعة السينية.[53][54] انخفض تطبيق السترونشيوم هذا نظرًا لاستبدال أنابيب الأشعة المهبطية بطرق عرض أخرى. كان لهذا الانخفاض تأثير كبير على تعدين وتنقية السترونشيوم.[44] يجب أن تمتص جميع أجزاء أنابيب الأشعة المهبطية الأشعة السينية. في عنق وقمع الأنبوب، يستخدم لهذا الغرض زجاج الرصاص، ولكن هذا النوع من الزجاج يظهر تأثير بني بسبب تفاعل الأشعة السينية مع الزجاج. لذلك، تصنع اللوحة الأمامية من خليط زجاجي مختلف مع السترونشيوم والباريوم لامتصاص الأشعة السينية. متوسط قيم خليط الزجاج المحددة لدراسة إعادة التدوير في 2005 هو 8.5% أكسيد السترونشيوم و10% [[أكسيد الباريوم].[55]
لأن السترونشيوم مشابه جداً للكالسيوم، فهو مدمج في العظام. جميع النظائر الأربعة المستقرة مدمجة، بنفس النسب تقريباً الموجودة في الطبيعة. ومع ذلك، فإن التوزيع الفعلي للنظائر يميل إلى الاختلاف الكبير من موقع جغرافي لآخر. وبالتالي، فإن تحليل عظام الفرد يمكن أن يساعد في تحديد المنطقة التي جاء منها.[56][57] يساعد هذا النهج في تحديد أنماط الهجرة القديمة وأصل البقايا البشرية المختلطة بمواقع الدفن في ساحة المعارك.[58]
تستخدم نسب 87Sr/86Sr بشكل شائع لتحديد مناطق المنشأ المحتملة للرواسب في النظم الطبيعية، خاصة في البيئات البحرية والنهرية. أظهر داش (1969) أن رواسب سطح المحيط الأطلسي توضح نسب 87Sr/86Sr التي يمكن اعتبارها متوسطات مجمعة لنسب 87Sr/86Sr في التضاريس الجيولوجية من الكتل الأرضية المجاورة.[59] يعد نظام نهر النيل-البحر المتوسط أحد الأمثلة الجيدة على النظام النهري-البحري الذي استخدمت فيه دراسات منشأ النظائر بنجاح.[60] نظرًا لاختلاف أعمار الصخور التي تشكل غالبية النيل الأزرق والأبيض، يمكن تمييز مناطق مستجمعات المياه ذات المصدر المتغير للرواسب التي تصل إلى دلتا النيل وشرق المتوسط من خلال دراسات نظائر السترونشيوم. يتم التحكم في مثل هذه التغييرات مناخيًا في أواخر العصر الرباعي.[60]
مؤخراً، استخدمت أيضاً نسب 87Sr/86Sr لتحديد مصدر المواد الأثرية القديمة مثل الأخشاب والذرة في أخدود تشاكو، نيو مكسيكو.[61][62] يمكن أيضاً استخدام نسب 87Sr/86Sr في الأسنان لتتبع هجرات الحيوانات.[63][64]
كثيرا ما تستخدم ألومينات السترونشيوم في ألعاب التوهج في الظلام، لأنها خاملة كيميائياً وحيوياً.[citation needed]
تضاف كربونات السترونشيوم وأملاح السترونشيوم الأخرى إلى الألعاب النارية لإعطاء لون أحمر غامق.[65] هذا التأثير نفسه يحدد كاتيونات السترونشيوم في اختبار اللهب. تستهلك الألعاب النارية حوالي 5% من الإنتاج العالمي للسترونشيوم.[52] تُستخدم كربونات السترونتيوم في تصنيع المغناطيس الحديدي الصلب.[66][67]
يُستخدم كلوريد السترونشيوم أحياناً في معاجين الأسنان الحساسة. تتضمن إحدى العلامات التجارية الشهيرة نسبة إجمالية تبلغ 10% من سداسي هيدرات كلوريد السترونشيوم حسب الوزن.[68] تستخدم كميات صغيرة في تكرير الزنك لإزالة كميات صغيرة من شوائب الرصاص.[6] المعدن نفسه له استخدام محدود كمادة ماصة للغازات، لإزالة الغازات غير المرغوب فيها في الفراغات بالتفاعل معها، على الرغم من أنه يمكن أيضًا استخدام الباريوم لهذا الغرض.[8]
الانتقال البصري فائق الضيق بين إلكترون الحالة القاعية لـ [Kr]5s2 1S0 والحالة المثارة لـ 87 Sr هي أحد المرشحين الرئيسيين لإعادة تعريف الثانية من حيث الانتقال البصري على عكس التعريف الحالي المشتق من انتقال الموجات المجروية بين مختلف الحالت القاعية فائقة الدقة لل133Cs.[69] إن الساعة الذرية الضوئية الحالية التي تعمل على هذا الانتقال تتجاوز بالفعل دقة ودقة التعريف الحالي للثانية.
السترونشيوم المشع
89Sr هو العنصر النشط في المـِتاستارون،[70] دواء مشع يستخدم لعلاج آلام العظام الناجمة عن سرطان العظام النقيلي. يُعالج السترونشيوم مثل الكالسيوم من قبل الجسم، مع دمجه بشكل تفضيلي في العظام في مواقع تكون العظام المتزايدة. يركز هذا التوطين على التعرض للإشعاع على الآفة السرطانية.[20]
يستخدم 90Sr كمصدر للطاقة في المولدات الكهروحرارية بالنظائر المشعة. ينتج 90Sr حوالي 0.93 واط من الحرارة لكل گرام (يكون أقل على هيئة 90Sr المستخدم في المولدات الكهروحرارية بالنظائر المشعة، حيث يستخدم فلوريد السترنشيوم).[71] إلا أن عمر 90Sr يبلغ الثلث ويتمتع بكثافة أقل من 238Pu، وقود آخر يستخدم في المولدات الكهروحرارية بالنظائر المشعة. الميزة الرئيسية للـ90Sr هي أنه أرخص من 238Pu ويتواجد في النفايات النووية. نشر الاتحاد السوڤيتي قرابة 1000 مولد كهروحراري بالنظائر المشعة على ساحله الشمالي كمصدر طاقة للمنارات ومحطات الأرصاد الجوية.[72][73]
الدور الحيوي
| المخاطر | |
|---|---|
| ن.م.ع. مخطط تصويري |  
|
| ن.م.ع. كلمة الاشارة | خطر |
| H261, H315 | |
| P223, P231+P232, P370+P378, P422[74] | |
| NFPA 704 (معيـَّن النار) | |
الأكانثاريا ، مجموعة كبيرة نسبيًا من الأوليات الشعوعية، تنتج معادن ذات هياكل معقدة تتكون من كبريتات السترونشيوم.[75] في الأنظمة الحيوية، يُستبدل الكالسيوم إلى حدٍّ ما بالسترونشيوم.[76]
في جسم الإنسان ، يترسب معظم السترونتيوم الممتص في العظام. تتراوح نسبة السترونشيوم إلى الكالسيوم في عظام الإنسان بين 1: 1000 و1: 2000، تقريبًا في نفس النطاق كما في مصل الدم.[77]
تأثيره على الجسم البشري
يمتص جسم الإنسان السترونشيوم كما لو أنه كالسيوم متجانس أخف. نظرًا لأن العناصر متشابهة جدًا كيميائيًا، فإن نظائر السترونشيوم المستقرة لا تشكل تهديدًا صحيًا كبيرًا. يستهلك الإنسان العادي حوالي مليجرام من السترونشيوم يوميًا.[78] لدى البالغين، يميل السترونشيوم المستهلك إلى الالتصاق بسطح العظام فقط، ولكن لدى الأطفال، يمكن أن يحل السترونشيوم محل الكالسيوم الموجود في معدن العظام النامية وبالتالي يؤدي إلى مشاكل في نمو العظام.[79]
تم الإبلاغ أن عمر النصف الحيوي للسترونشيوم في الجسم لابشري من 14 إلى 600 يوم،[80][81] 1.000 يوم،[82] 18 سنة،[83] 30 سنة،[84] وبحد أقصى 40 سنة.[85] تُلإسر أرقام عمر النصف الحيوي المنشورة على نطاق واسع من خلال التمثيل الغذائي المعقد للسترونشيوم داخل الجسم. ومع ذلك، من خلال حساب متوسط جميع مسارات الإخراج، يُقدر عمر النصف الحيوي الكلي بحوالي 18 عاماً.[86] يتأثر معدل التخلص من السترونشيوم بشدة بالعمر والجنس، بسبب الاختلافات في استقلاب العظام.[87]
يساعد عقار رانيلات السترونشيوم على نمو العظام، ويزيد من كثافتها، ويقلل من الإصابة بكسور عظام الفقرات، والعظام المحيطية، والورك.[88][89] ومع ذلك، فإن رانيلات السترونشيوم تزيد أيضاً من خطر الإصابة بالجلطات الدموية الوريدية، والانسداد الرئوي، واضطرابات القلب والأوعية الدموية الخطيرة، بما في ذلك احتشاء عضلة القلب. ولذلك فإن استخدامه مقيد حالياً.[90] آثاره المفيدة مشكوك فيها أيضاً، لأن زيادة كثافة العظام ناتجة جزئياً عن زيادة كثافة السترونشيوم فوق الكالسيوم الذي يحل محله. يتراكم السترنشيوم أيضاً حيوياً في الجسم.[91] على الرغم من القيود المفروضة على رانيلات السترونشيوم، لا يزال السترونشيوم موجوداً في بعض المكملات.[92][93] لا توجد أدلة علمية كثيرة على مخاطر كلوريد السترونشيوم عند تناوله عن طريق الفم. يُنصح أولئك الذين لديهم تاريخ شخصي أو عائلي من اضطرابات تخثر الدم بتجنب السترونشيوم.[92][93]
ثبت أن السترونشيوم يثبط التهيج الحسي عند استخدامه موضعياً على الجلد.[94][95] تم استخدامه موضعياً، وقد ثبت أن السترونشيوم يسرع من معدل استعادة حاجز نفاذية البشرة (حاجز الجلد).[96]
النفايات النووية
السترونشيوم 90 هو منتج ثانوي مشع ينتج عن المفاعلات النووية المستخدمة في الطاقة النووية. وهو أحد مكونات النفايات النووية والوقود النووي المستهلك. عمر النصف طويل، حوالي 30 عامًا، ويصنف على أنه نفايات عالية المستوى. يمكن أن يستغرق الأمر مئات السنين ليتحلل إلى مستويات لا تذكر. قد يؤدي التعرض من الماء والغذاء الملوثين بالسترونشيوم 90 إلى زيادة خطر الإسابة بسرطان الدم، سرطان العظام[97] وفرط نشاط الجار درقية الأولي.[98]
العلاج
أظهرت الطحالب انتقائية للسترونشيوم في الدراسات، حيث لم تظهر معظم النباتات المستخدمة في المعالجة الحيوية انتقائية بين الكالسيوم والسترونشيوم، وغالبًا ما تصبح مشبعة بالكالسيوم، وهو أكبر من حيث الكمية ويوجد أيضًا في النفايات النووية.[97]
نظر الباحثون في التراكم الحيوي للسترونشيوم بواسطة "السندسموس سپيسوس" (طحالب) في مياه الصرف الصحي المحاكاة. تزعم الدراسة أن قدرة الامتصاص الحيوي انتقائية للغاية للسترونشيوم من قبل السندسموس، مما يشير إلى أنه قد يكون مناسباً لاستخدام مياه الصرف النووية.[99]
خلصت دراسة أجريت على طحالب البرك " كلوستريوم مونيلفروم" باستخدام السترونشيوم غير المشع أن تغيير نسبة الباريوم إلى السترونشيوم في الماء يحسن انتقائية السترونشيوم.[97]
المصادر
- ^ Greenwood and Earnshaw, p. 112
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. (2021). "The NUBASE2020 evaluation of nuclear properties" (PDF). Chinese Physics C. 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ أ ب "Mineral Resource of the Month: Strontium". U.S. Geological Survey. 8 December 2014. Retrieved 16 August 2015.
- ^ أ ب Greenwood and Earnshaw, pp. 112–13
- ^ أ ب ت ث ج ح C. R. Hammond The elements (pp. 4–35) in Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Ropp, Richard C. (31 December 2012). Encyclopedia of the Alkaline Earth Compounds. p. 16. ISBN 978-0-444-59553-9.
- ^ أ ب ت Greenwood and Earnshaw, p. 111
- ^ Greenwood and Earnshaw, p. 119
- ^ Greenwood and Earnshaw, p. 121
- ^ Greenwood and Earnshaw, p. 117
- ^ Greenwood and Earnshaw, p. 115
- ^ Greenwood and Earnshaw, p. 124
- ^ Miyoshi, N.; Kamiura, K.; Oka, H.; Kita, A.; Kuwata, R.; Ikehara, D.; Wada, M. (2004). "The Barbier-Type Alkylation of Aldehydes with Alkyl Halides in the Presence of Metallic Strontium". Bulletin of the Chemical Society of Japan. 77 (2): 341. doi:10.1246/bcsj.77.341.
- ^ Miyoshi, N.; Ikehara, D.; Kohno, T.; Matsui, A.; Wada, M. (2005). "The Chemistry of Alkylstrontium Halide Analogues: Barbier-type Alkylation of Imines with Alkyl Halides". Chemistry Letters. 34 (6): 760. doi:10.1246/cl.2005.760.
- ^ Miyoshi, N.; Matsuo, T.; Wada, M. (2005). "The Chemistry of Alkylstrontium Halide Analogues, Part 2: Barbier-Type Dialkylation of Esters with Alkyl Halides". European Journal of Organic Chemistry. 2005 (20): 4253. doi:10.1002/ejoc.200500484.
- ^ Greenwood and Earnshaw, pp. 136–37
- ^ Greenwood and Earnshaw, p. 19
- ^ Halperin, Edward C.; Perez, Carlos A.; Brady, Luther W. (2008). Perez and Brady's principles and practice of radiation oncology. Lippincott Williams & Wilkins. pp. 1997–. ISBN 978-0-7817-6369-1. Retrieved 19 July 2011.
- ^ أ ب Bauman, Glenn; Charette, Manya; Reid, Robert; Sathya, Jinka (2005). "Radiopharmaceuticals for the palliation of painful bone metastases – a systematic review". Radiotherapy and Oncology. 75 (3): 258.E1–258.E13. doi:10.1016/j.radonc.2005.03.003. PMID 16299924.
- ^ "Strontium | Radiation Protection | US EPA". EPA. 24 April 2012. Retrieved 18 June 2012.
- ^ "Chernobyl: Assessment of Radiological and Health Impact, 2002 update; Chapter I – The site and accident sequence" (PDF). OECD-NEA. 2002. Retrieved 3 June 2015.
- ^ Murray, W. H. (1977). The Companion Guide to the West Highlands of Scotland. London: Collins. ISBN 978-0-00-211135-5.
- ^ Crawford, Adair (1790). "On the medicinal properties of the muriated barytes". Medical Communications. 2: 301–59.
- ^ Sulzer, Friedrich Gabriel; Blumenbach, Johann Friedrich (1791). "Über den Strontianit, ein Schottisches Foßil, das ebenfalls eine neue Grunderde zu enthalten scheint". Bergmännisches Journal: 433–36.
- ^ "Thomas Charles Hope, MD, FRSE, FRS (1766-1844) - School of Chemistry". www.chem.ed.ac.uk.
- ^ Doyle, W.P. "Thomas Charles Hope, MD, FRSE, FRS (1766–1844)". The University of Edinburgh. Archived from the original on 2 يونيو 2013.
- ^ Although Thomas C. Hope had investigated strontium ores since 1791, his research was published in: Hope, Thomas Charles (1798). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. 4 (2): 3–39. doi:10.1017/S0080456800030726.
- ^ Murray, T. (1993). "Elementary Scots: The Discovery of Strontium". Scottish Medical Journal. 38 (6): 188–89. doi:10.1177/003693309303800611. PMID 8146640. S2CID 20396691.
- ^ Hope, Thomas Charles (1794). "Account of a mineral from Strontian and of a particular species of earth which it contains". Transactions of the Royal Society of Edinburgh. 3 (2): 141–49. doi:10.1017/S0080456800020275.
- ^ Davy, H. (1808). "Electro-chemical researches on the decomposition of the earths; with observations on the metals obtained from the alkaline earths, and on the amalgam procured from ammonia". Philosophical Transactions of the Royal Society of London. 98: 333–70. Bibcode:1808RSPT...98..333D. doi:10.1098/rstl.1808.0023.
- ^ Taylor, Stuart (19 يونيو 2008). "Strontian gets set for anniversary". Lochaber News. Archived from the original on 13 يناير 2009.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ Weeks, Mary Elvira (1932). "The discovery of the elements: X. The alkaline earth metals and magnesium and cadmium". Journal of Chemical Education. 9 (6): 1046–57. Bibcode:1932JChEd...9.1046W. doi:10.1021/ed009p1046.
- ^ Partington, J. R. (1942). "The early history of strontium". Annals of Science. 5 (2): 157. doi:10.1080/00033794200201411.
- ^ Partington, J. R. (1951). "The early history of strontium. Part II". Annals of Science. 7: 95. doi:10.1080/00033795100202211.
- ^ Many other early investigators examined strontium ore, among them: (1) Martin Heinrich Klaproth, "Chemische Versuche über die Strontianerde" (Chemical experiments on strontian ore), Crell's Annalen (September 1793) no. ii, pp. 189–202 ; and "Nachtrag zu den Versuchen über die Strontianerde" (Addition to the Experiments on Strontian Ore), Crell's Annalen (February 1794) no. i, p. 99 ; also (2) Kirwan, Richard (1794). "Experiments on a new earth found near Stronthian in Scotland". The Transactions of the Royal Irish Academy. 5: 243–56.
- ^ Fachgruppe Geschichte Der Chemie, Gesellschaft Deutscher Chemiker (2005). Metalle in der Elektrochemie. pp. 158–62.
- ^ Heriot, T. H. P (2008). "strontium saccharate process". Manufacture of Sugar from the Cane and Beet. ISBN 978-1-4437-2504-0.
- ^ Börnchen, Martin. "Der Strontianitbergbau im Münsterland". Archived from the original on 11 ديسمبر 2014. Retrieved 9 نوفمبر 2010.
- ^ Martin, Josèm; Ortega-Huertas, Miguel; Torres-Ruiz, Jose (1984). "Genesis and evolution of strontium deposits of the granada basin (Southeastern Spain): Evidence of diagenetic replacement of a stromatolite belt". Sedimentary Geology. 39 (3–4): 281. Bibcode:1984SedG...39..281M. doi:10.1016/0037-0738(84)90055-1.
- ^ "Chain Fission Yields". iaea.org.
- ^ Nordin, B. E. (1968). "Strontium Comes of Age". British Medical Journal. 1 (5591): 566. doi:10.1136/bmj.1.5591.566. PMC 1985251.
- ^ Turekian, K. K.; Wedepohl, K. H. (1961). "Distribution of the elements in some major units of the Earth's crust". Geological Society of America Bulletin. 72 (2): 175–92. Bibcode:1961GSAB...72..175T. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2.
- ^ أ ب Ober, Joyce A. "Mineral Commodity Summaries 2010: Strontium" (PDF). United States Geological Survey. Retrieved 14 May 2010.
- ^ Heuel-Fabianek, B. (2014). "Partition Coefficients (Kd) for the Modelling of Transport Processes of Radionuclides in Groundwater" (PDF). Berichte des Forschungszentrums Jülich. 4375. ISSN 0944-2952.
- ^ Stringfield, V. T. (1966). "Strontium". Artesian water in Tertiary limestone in the southeastern States. Geological Survey Professional Paper. United States Government Printing Office. pp. 138–39.
- ^ Angino, Ernest E.; Billings, Gale K.; Andersen, Neil (1966). "Observed variations in the strontium concentration of sea water". Chemical Geology. 1: 145. Bibcode:1966ChGeo...1..145A. doi:10.1016/0009-2541(66)90013-1.
- ^ Sun, Y.; Sun, M.; Lee, T.; Nie, B. (2005). "Influence of seawater Sr content on coral Sr/Ca and Sr thermometry". Coral Reefs. 24: 23. doi:10.1007/s00338-004-0467-x. S2CID 31543482.
- ^ Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M. (5 March 2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses. ISBN 978-0-87335-233-8.
- ^ أ ب Ober, Joyce A. "Mineral Commodity Summaries 2015: Strontium" (PDF). United States Geological Survey. Retrieved 26 March 2016.
- ^ Kemal, Mevlüt; Arslan, V.; Akar, A.; Canbazoglu, M. (1996). Production of SrCO3 by black ash process: Determination of reductive roasting parameters. p. 401. ISBN 978-90-5410-829-0.
- ^ أ ب ت ث MacMillan, J. Paul; Park, Jai Won; Gerstenberg, Rolf; Wagner, Heinz; Köhler, Karl and Wallbrecht, Peter (2002) "Strontium and Strontium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a25_321.
- ^ "Cathode Ray Tube Glass-To-Glass Recycling" (PDF). ICF Incorporated, USEP Agency. Archived from the original (PDF) on 19 December 2008. Retrieved 7 January 2012.
- ^ Ober, Joyce A.; Polyak, Désirée E. "Mineral Yearbook 2007: Strontium" (PDF). United States Geological Survey. Retrieved 14 October 2008.
- ^ Méar, F.; Yot, P.; Cambon, M.; Ribes, M. (2006). "The characterization of waste cathode-ray tube glass". Waste Management. 26 (12): 1468–76. doi:10.1016/j.wasman.2005.11.017. PMID 16427267.
- ^ Price, T. Douglas; Schoeninger, Margaret J.; Armelagos, George J. (1985). "Bone chemistry and past behavior: an overview". Journal of Human Evolution. 14 (5): 419–47. doi:10.1016/S0047-2484(85)80022-1.
- ^ Steadman, Luville T.; Brudevold, Finn; Smith, Frank A. (1958). "Distribution of strontium in teeth from different geographic areas". The Journal of the American Dental Association. 57 (3): 340–44. doi:10.14219/jada.archive.1958.0161. PMID 13575071.
- ^ Schweissing, Matthew Mike; Grupe, Gisela (2003). "Stable strontium isotopes in human teeth and bone: a key to migration events of the late Roman period in Bavaria". Journal of Archaeological Science. 30 (11): 1373–83. doi:10.1016/S0305-4403(03)00025-6.
- ^ Dasch, J. (1969). "Strontium isotopes in weathering profiles, deep-sea sediments, and sedimentary rocks". Geochimica et Cosmochimica Acta. 33 (12): 1521–52. Bibcode:1969GeCoA..33.1521D. doi:10.1016/0016-7037(69)90153-7.
- ^ أ ب Krom, M. D.; Cliff, R.; Eijsink, L. M.; Herut, B.; Chester, R. (1999). "The characterisation of Saharan dusts and Nile particulate matter in surface sediments from the Levantine basin using Sr isotopes". Marine Geology. 155 (3–4): 319–30. Bibcode:1999MGeol.155..319K. doi:10.1016/S0025-3227(98)00130-3.
- ^ Benson, L.; Cordell, L.; Vincent, K.; Taylor, H.; Stein, J.; Farmer, G. & Kiyoto, F. (2003). "Ancient maize from Chacoan great houses: where was it grown?". Proceedings of the National Academy of Sciences. 100 (22): 13111–15. Bibcode:2003PNAS..10013111B. doi:10.1073/pnas.2135068100. PMC 240753. PMID 14563925.
- ^ English NB; Betancourt JL; Dean JS; Quade J. (October 2001). "Strontium isotopes reveal distant sources of architectural timber in Chaco Canyon, New Mexico". Proc Natl Acad Sci USA. 98 (21): 11891–96. Bibcode:2001PNAS...9811891E. doi:10.1073/pnas.211305498. PMC 59738. PMID 11572943.
- ^ Barnett-Johnson, Rachel; Grimes, Churchill B.; Royer, Chantell F.; Donohoe, Christopher J. (2007). "Identifying the contribution of wild and hatchery Chinook salmon (Oncorhynchus tshawytscha) to the ocean fishery using otolith microstructure as natural tags". Canadian Journal of Fisheries and Aquatic Sciences. 64 (12): 1683–92. doi:10.1139/F07-129.
- ^ Porder, S.; Paytan, A. & E.A. Hadly (2003). "Mapping the origin of faunal assemblages using strontium isotopes". Paleobiology. 29 (2): 197–204. doi:10.1666/0094-8373(2003)029<0197:MTOOFA>2.0.CO;2.
- ^ "Chemistry of Firework Colors – How Fireworks Are Colored". Chemistry.about.com. 10 April 2012. Retrieved 14 April 2012.
- ^ "Ferrite Permanent Magnets". Arnold Magnetic Technologies. Archived from the original on 14 مايو 2012. Retrieved 18 يناير 2014.
- ^ "Barium Carbonate". Chemical Products Corporation. Archived from the original on 6 أكتوبر 2014. Retrieved 18 يناير 2014.
- ^ Ghom (1 December 2005). Textbook of Oral Medicine. p. 885. ISBN 978-81-8061-431-6.
- ^ CartlidgeMar. 1, Edwin; 2018; Pm, 12:00 (2018-02-28). "With better atomic clocks, scientists prepare to redefine the second". Science | AAAS (in الإنجليزية). Retrieved 2019-02-10.
{{cite web}}:|last2=has numeric name (help)CS1 maint: numeric names: authors list (link) - ^ "FDA ANDA Generic Drug Approvals". Food and Drug Administration.
- ^ "What are the fuels for radioisotope thermoelectric generators?". qrg.northwestern.edu.
- ^ Doyle, James (30 June 2008). Nuclear safeguards, security and nonproliferation: achieving security with technology and policy. p. 459. ISBN 978-0-7506-8673-0.
- ^ O'Brien, R. C.; Ambrosi, R. M.; Bannister, N. P.; Howe, S. D.; Atkinson, H. V. (2008). "Safe radioisotope thermoelectric generators and heat sources for space applications". Journal of Nuclear Materials. 377 (3): 506–21. Bibcode:2008JNuM..377..506O. doi:10.1016/j.jnucmat.2008.04.009.
- ^ "Strontium 343730". Sigma-Aldrich.
- ^ De Deckker, Patrick (2004). "On the celestite-secreting Acantharia and their effect on seawater strontium to calcium ratios". Hydrobiologia. 517 (1–3): 1. doi:10.1023/B:HYDR.0000027333.02017.50. S2CID 42526332.
- ^ Pors Nielsen, S. (2004). "The biological role of strontium". Bone. 35 (3): 583–88. doi:10.1016/j.bone.2004.04.026. PMID 15336592.
- ^ Cabrera, Walter E.; Schrooten, Iris; De Broe, Marc E.; d'Haese, Patrick C. (1999). "Strontium and Bone". Journal of Bone and Mineral Research. 14 (5): 661–68. doi:10.1359/jbmr.1999.14.5.661. PMID 10320513. S2CID 32627349.
- ^ Emsley, John (2011). Nature's building blocks: an A–Z guide to the elements. Oxford University Press. p. 507. ISBN 978-0-19-960563-7.
- ^ Agency for Toxic Substances and Disease Registry (21 January 2015). "ATSDR – Public Health Statement: Strontium". cdc.gov. Agency for Toxic Substances and Disease Registry. Retrieved 17 November 2016.
- ^ Tiller, B. L. (2001), "4.5 Fish and Wildlife Surveillance", Hanford Site 2001 Environmental Report, DOE
- ^ Driver, C. J. (1994), Ecotoxicity Literature Review of Selected Hanford Site Contaminants, DOE, doi:, http://www.osti.gov/bridge/servlets/purl/10136486-6sLptZ/native/10136486.pdf, retrieved on 14 January 2014
- ^ "Freshwater Ecology and Human Influence". Area IV Envirothon. Archived from the original on 1 يناير 2014. Retrieved 14 يناير 2014.
- ^ "Radioisotopes That May Impact Food Resources" (PDF). Epidemiology, Health and Social Services, State of Alaska. Archived from the original on 21 أغسطس 2014. Retrieved 14 يناير 2014.
{{cite web}}: CS1 maint: bot: original URL status unknown (link) - ^ "Human Health Fact Sheet: Strontium" (PDF). Argonne National Laboratory. أكتوبر 2001. Archived from the original (PDF) on 24 يناير 2014. Retrieved 14 يناير 2014.
- ^ "Biological Half-life". HyperPhysics. Retrieved 14 January 2014.
- ^ Glasstone, Samuel; Dolan, Philip J. (1977). "XII: Biological Effects" (PDF). The effects of Nuclear Weapons. p. 605. Retrieved 14 January 2014.
- ^ Shagina, N. B.; Bougrov, N. G.; Degteva, M. O.; Kozheurov, V. P.; Tolstykh, E. I. (2006). "An application of in vivo whole body counting technique for studying strontium metabolism and internal dose reconstruction for the Techa River population". Journal of Physics: Conference Series. 41 (1): 433–40. Bibcode:2006JPhCS..41..433S. doi:10.1088/1742-6596/41/1/048. S2CID 32732782.
- ^ Meunier P. J.; Roux C.; Seeman E.; Ortolani, S.; Badurski, J. E.; Spector, T. D.; Cannata, J.; Balogh, A.; Lemmel, E. M.; Pors-Nielsen, S.; Rizzoli, R.; Genant, H. K.; Reginster, J. Y. (January 2004). "The effects of strontium ranelate on the risk of vertebral fracture in women with postmenopausal osteoporosis" (PDF). New England Journal of Medicine. 350 (5): 459–68. doi:10.1056/NEJMoa022436. PMID 14749454.
- ^ Reginster JY; Seeman E; De Vernejoul MC; Adami, S.; Compston, J.; Phenekos, C.; Devogelaer, J. P.; Diaz Curiel, M.; Sawicki, A.; Goemaere, S.; Sorensen, O. H.; Felsenberg, D.; Meunier, P. J. (May 2005). "Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: treatment of peripheral osteoporosis (TROPOS) study" (PDF). The Journal of Clinical Endocrinology & Metabolism. 90 (5): 2816–22. doi:10.1210/jc.2004-1774. PMID 15728210.
- ^ "Strontium ranelate: cardiovascular risk – restricted indication and new monitoring requirements". Medicines and Healthcare products Regulatory Agency, UK. March 2014.
- ^ Price, Charles T.; Langford, Joshua R.; Liporace, Frank A. (5 April 2012). "Essential Nutrients for Bone Health and a Review of their Availability in the Average North American Diet". Open Orthop. J. 6: 143–49. doi:10.2174/1874325001206010143. PMC 3330619. PMID 22523525.
- ^ أ ب "Strontium". WebMD. Retrieved 20 November 2017.
- ^ أ ب "Strontium for Osteoporosis". WebMD. Retrieved 20 November 2017.
- ^ Hahn, G.S. (1999). "Strontium Is a Potent and Selective Inhibitor of Sensory Irritation" (PDF). Dermatologic Surgery. 25 (9): 689–94. doi:10.1046/j.1524-4725.1999.99099.x. PMID 10491058. Archived from the original (PDF) on 31 مايو 2016.
- ^ Hahn, G.S. (2001). Anti-irritants for Sensory Irritation. p. 285. ISBN 978-0-8247-0292-2.
{{cite book}}:|journal=ignored (help) - ^ Kim, Hyun Jeong; Kim, Min Jung; Jeong, Se Kyoo (2006). "The Effects of Strontium Ions on Epidermal Permeability Barrier". The Korean Dermatological Association, Korean Journal of Dermatology. 44 (11): 1309.
- ^ أ ب ت Potera, Carol (2011). "HAZARDOUS WASTE: Pond Algae Sequester Strontium-90". Environ Health Perspect. 119 (6): A244. doi:10.1289/ehp.119-a244. PMC 3114833. PMID 21628117.
- ^ Boehm, BO; Rosinger, S; Belyi, D; Dietrich, JW (18 August 2011). "The parathyroid as a target for radiation damage". The New England Journal of Medicine. 365 (7): 676–8. doi:10.1056/NEJMc1104982. PMID 21848480.
- ^ Liu, Mingxue; Dong, Faqin; Kang, Wu; Sun, Shiyong; Wei, Hongfu; Zhang, Wei; Nie, Xiaoqin; Guo, Yuting; Huang, Ting; Liu, Yuanyuan (2014). "Biosorption of Strontium from Simulated Nuclear Wastewater by Scenedesmus spinosus under Culture Conditions: Adsorption and Bioaccumulation Processes and Models". Int J Environ Res Public Health. 11 (6): 6099–6118. doi:10.3390/ijerph110606099. PMC 4078568. PMID 24919131.
المراجع
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
وصلات خارجية
- WebElements.com – Strontium
- Strontium at The Periodic Table of Videos (University of Nottingham)
- CS1 maint: bot: original URL status unknown
- CS1 errors: numeric name
- CS1 maint: numeric names: authors list
- CS1 errors: periodical ignored
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with unsourced statements from July 2018
- Chembox container only
- Articles with hatnote templates targeting a nonexistent page
- سترونشيوم
- عوامل مختزلة
- عناصر كيميائية
- فلزات أرضية قاعدية
- لوخ أبر







