أكسيد المغنسيوم
ساهم بشكل رئيسي في تحرير هذا المقال
|

| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاكs
أكسيد المغنسيوم
Magnesium oxide | |
| أسماء أخرى
Magnesia
بيريكلاس | |
| المُعرِّفات | |
| رقم CAS | |
| ChEMBL | |
| ECHA InfoCard | 100.013.793 |
| E number | E530 (acidity regulators, ...) |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | MgO |
| كتلة مولية | 40.3044 g/mol |
| المظهر | مسحوق أبيض |
| الرائحة | Odorless |
| الكثافة | 3.58 g/cm3 |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 0.0086 ج/100 مل (30 °س) |
| قابلية الذوبان | قابل للذوبان في حمض الأمونيا غير قابل للذوبان في الكحول |
| الفجوة الحزمية | 7.8 eV[1] |
| القابلية المغناطيسية | −10.2·10−6 cm3/mol[3] |
| التوصيل الحراري | 45–60 W·m−1·K−1[2] |
| معامل الانكسار (nD) | 1.7355 |
| Dipole moment | 6.2 ± 0.6 D |
| البنية | |
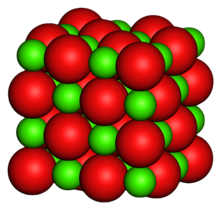
| البنية البلورية | الهاليت (مكعب)، cF8 |
| الزمرة الفراغية | Fm3م. رقم 225 |
| ثابت العقد | a = 4.212Å |
| هندسة إحداثية |
Octahedral (Mg2+); ثماني الأسطح (O2−) |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−601.6 ± 0.3 ك.جول/مول−1[4] |
| Standard molar entropy S |
26.95 ± 0.15 J·mol−1·K−1[4] |
| سعة الحرارة النوعية، C | 37.2 جول/مول ك[5] |
| علم الأدوية | |
| A02AA02 (WHO) A06AD02، A12CC10 | |
| المخاطر | |
| خطر رئيسي | حمى أدخنة المعادن، مهيج |
| صفحة بيانات السلامة | ICSC 0504 |
| ن.م.ع. مخطط تصويري | 
|
| ن.م.ع. كلمة الاشارة | تحذير |
| H315, H319, H335 | |
| P261, P264, P271, P273, P280, P302+P352, P304+P340, P305+P351+P338, P312, P333+P313, P337+P313, P362, P363, P391, P403+P233, P405 | |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | غير قابل للاشعال |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 15 ملج/م3 (دخان)[6] |
REL (الموصى به)
|
لم يُخصص[6] |
IDLH (خطر عاجل)
|
750 ملج/م3 (بخار)[6] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
كبريتيد المغنسيوم |
كاتيونات أخرى
|
أكسيد البريليوم أكسيد الكالسيوم أكسيد السترونشم أكسيد الباريوم |
مركـّبات ذات علاقة
|
هيدروكسيد المغنسيوم نيتريد المغنسيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
أكسيد المغنسيوم (MgO)، أو مغنسيا magnesia، هو معدن صلب أبيض استرطابي يتواجد في الطبيعة على شكل بيريكلاس، وهو مصدر المغنسيوم (انظر أيضاً أكسيد). صيغته المجملة هي MgO ويتألف من شبكة من أيوناتMg2+ وأيونات O2− تجمعهما معاً رابطة أيونية. يتشكل هيدروكسيد المغنيسيوم في وجود الماء (MgO + H2O → Mg(OH)2)، لكن يمكن عكسه بتسخينه لفصل الرطوبة.
كان أكسيد المغنسيوم يُعرف تاريخياً باسم مغنسيا ألبا (تعني حرفياً، المعدن الأبيضمن المغنيسيا - هناك مصادر أخرى تعطي مغنسيا ألبامثل MgCO3)، للتفرقة بينه وبين مغنسيا نيجرا، المعدن الأسود الذي يحتوي على ما يُعرف الآن بالمنجنيز.
الأكاسيد ذات الصلة
بينما يشير مصطلح "أكسيد المغنيسيوم" عادة إلى MgO، پروكسيد المغنسيوم MgO2 فهو يُعرف أيضاً كمركب. وفقًا لتوقعات البنية البلورية التطورية،[7] يكون MgO2 مستقر ديناميكيًا حراريًا عند ضغوط أعلى من 116 جيجا باسكال، وتحت أكسيد شبه موصل ويكون Mg3O2 مستقر ديناميكيًا حراريًا فوق 500 جيجا بسكال. نظرًا لاستقراره، يستخدم MgO كنظام نموذجي لفحص الخصائص الاهتزازية للبلورات.[8]
الخصائص الكهربائية
Pure MgO ليس موصلاً ولديه مقاومة عالية للتيار الكهربائي في درجة حرارة الغرفة. يحتوي مسحوق MgO النقي على ثابت عازل يتراوح بين 3.2 إلى 9.9 مع فقدان عزل كهربائي تقريبي لـ tan(δ) > 2.16x103 عند 1kHz.[9][10][11]
الانتاج
يُنتج أكسيد المغنسيوم بتكليس كربونات المغنسيوم أو هيدروكسيد المنسيوم. يُحصل على الأخير عن طريق معالجة محاليل كلوريد المغنسيوم، عادة مياه البحر، مع الجير.[12]
- Mg2+ + Ca(OH)2 → Mg(OH)2 + Ca2+
ينتج عن التكليس عند درجات حرارة مختلفة أكسيد المغنيسيوم ذي التفاعل المختلف. تقلل درجات الحرارة المرتفعة 1500-2000 درجة مئوية من مساحة السطح المتاحة وتنتج مغنيسيا محترقة ميتة، وهو شكل غير متفاعل يستخدم كمواد مقاومة للحرارة. تنتج درجات حرارة التكليس 1000 - 1500 درجة مئوية ماغنيسيا شديدة الاحتراق، والتي لها تفاعل محدود وتكلس عند درجة حرارة منخفضة، (700-1000 درجة مئوية) تنتج مغنيسيا محترقة خفيفة، وهي صورة تفاعلية، تُعرف أيضًا باسم المغنيسيا المكلسة الكاوية. على الرغم من أن بعض تحلل الكربونات إلى أكسيد يحدث في درجات حرارة أقل من 700 درجة مئوية، يبدو أن المواد الناتجة تعيد امتصاص ثاني أكسيد الكربون من الهواء.[13]
الاستخدامات
يتم إنتاج المغنسيات الحديثة عالية النقاء في عمليات محكومة جيداً. المصادر الرئيسية للمغنسيات هى المحاليل الملحية (الآبار العميقة في الغالب) ومياه البحر. يُرسب هيدروكسيد المغنسيوم، Mg(OH)2، من هذه المصادر عن طريق التفاعل مع الدولوميت المكلس أو الحجر الجيرى؛ و أحد المصادر يستخدم عملية مفاعل حديثة. وتتم تصفية (ترشيح) هيدروكسيد المغنسيوم الناتج لزيادة محتواه من المواد الصلبة. ثم يمكن إدخال عجينة الترشيح مباشرة إلى قمينة دوارة لانتاج مغنسيا حرارية الرتبة، ولكن الأكثر شيوعا الآن هو تكليس عجينة الترشيح في نحو 900-1000 ْم (1650 -1830 ْف)، عادة في أفران متعددة المواقد/المجامر، لتحويل هيدروكسيد المغنسيوم إلى مغنسيا نشطة. ثم تُقولب هذه المغنسيا المكلسة أو تُكوَّر لحرقها إلى مغنسيا حرارية الرتبة كثيفة، عادة في قمائن قائمة تصل إلى درجات حرارة حوالى 2000 ْم (3630 ْف). المنتج النهائى هو مغنسيا متكلسة. وتنتج المغنسيا المصهورة بصهر مغنسيا حرارية الرتبة أو بادئة من مغنسيا أخرى في فرن قوس كهربائية. ثم تُزال الكتلة المنصهرة من الفرن ويتم تبريدها وتكسيرها حتى تبدأ مسيرتها من أجل استخدامها في الحراريات.[14]
عناصر التسخين
من بين الاستخدامات الأبرز لأكسيد المغنسيوم استخدامه كمادة حرارية، أي مادة صلبة مستقرة فيزيائيًا وكيميائيًا عند درجات حرارة عالية. له سمتان مفيدتان: الموصلية الحرارية العالية والتوصيل الكهربائي المنخفض. يعد ملء عناصر التسخين العلوية لمجموعة عناصر التسخين الحلزونية في المواقد الكهربائية بالمطبخ استخدامًا رئيسيًا. إلى حد كبير تعتبر الصناعات الحرارية هي أكبر مستهلك للمغنسيا في جميع أنحاء العالم، التي استهلكت حوالي 56٪ من المغنيسيا في الولايات المتحدة عام 2004، و44٪ الباقية تستخدم في التطبيقات الزراعية، والكيميائية، والبناء، والبيئية، وغيرها من التطبيقات الصناعية." يستخدم أكسيد المغنسيوم كمادة حرارية أساسية للبوتقات.[15]
مقاومة الحريق
أكسيد المغنسيوم هو مكون رئيسي مقاوم للحريق في مواد البناء. كمادة بناء، تتميز ألواح جدران أكسيد المغنيسيوم بعدة خصائص جذابة: مقاومة الحريق، ومقاومة النمل الأبيض، ومقاومة الرطوبة، ومقاومة العفن، والقوة.[16][15]
رتائن الغاز
تستخدم معظم رتائن الغاز أكسيد المغنسيوم. استخدمت التكرارات المبكرة مثل سلة كلاموند هذا المركب فقط. تستخدم الإصدارات اللاحقة حوالي 60٪ من أكسيد المغنيسيوم، مع مكونات أخرى مثل أكسيد اللانثانوم أو أكسيد الإيثريوم التي تشكل الباقي. الاستثناء الآخر هو رتائن الثوريوم.
استخدامات خاصة
أكسيد المغنسيوم هو أحد المكونات الموجودة في أسمنت بورتلاند في محطات المعالجة الجافة.
يستخدم أكسيد المغنيسيوم على نطاق واسع في معالجة التربة والمياه الجوفية، ومعالجة مياه الصرف، ومعالجة مياه الشرب، ومعالجة انبعاثات الهواء، وصناعات معالجة النفايات لقدرته على تخزين الأحماض والفعالية ذات الصلة في تثبيت أنواع المعادن الثقيلة الذائبة.
العديد من أنواع المعادن الثقيلة، مثل الرصاص والكادميوم أكثر قابلية للذوبان في الماء عند درجة حموضة (أقل من 6) بالإضافة إلى درجة الحموضة العالية (أعلى من 11). تؤثر قابلية ذوبان المعادن على التوافر الحيوي للأنواع وتنقل التربة وأنظمة المياه الجوفية. معظم أنواع المعادن سامة للإنسان عند تركيزات معينة، لذلك من الضروري تقليل التوافر الحيوي للمعادن وتنقلها.
غالبًا ما يُمزج أكسيد المغنسيوم الحبيبي في التربة الملوثة بالمعادن أو مواد النفايات، والتي تكون أيضًا عادةً ذات درجة حموضة منخفضة (حمضية)، من أجل دفع الأس الهيدروجيني إلى نطاق 8-10 حيث تكون معظم المعادن في أدنى درجة ذوبان لها (قاعدي). تميل معقدات هيدروكسيد المعادن إلى الترسب من المحلول المائي في نطاق الأس الهيدروجيني من 8-10. يُنظر إلى أكسيد المغنسيوم على نطاق واسع على أنه أكثر مركبات تثبيت المعادن فاعلية عند مقارنتها بأسمنت بورتلاند والجير ومنتجات غبار أفران قمين ومنتجات نفايات توليد الطاقة ومنتجات الملكية المختلفة نظرًا لقدرة التخزين المؤقت الفائقة لـ MgO وفعالية التكلفة وسهولة/أمان التداول.
إن معظم، إن لم يكن جميع المنتجات التي يتم تسويقها كتقنيات لتثبيت المعادن، تخلق ظروفًا عالية جدًا لدرجة الحموضة في طبقات المياه الجوفية، في حين أن أكسيد المغنسيوم يخلق حالة الخزان الجوفي المثالية بأس هيدروجيني 8-10. بالإضافة إلى ذلك، يتم توفير المغنيسيوم، وهو عنصر أساسي في معظم النظم الحيوية، للمجموعات الميكروبية للتربة والمياه الجوفية أثناء معالجة المعادن بمساعدة أكسيد المغنسيوم كميزة إضافية.
الأسمنت
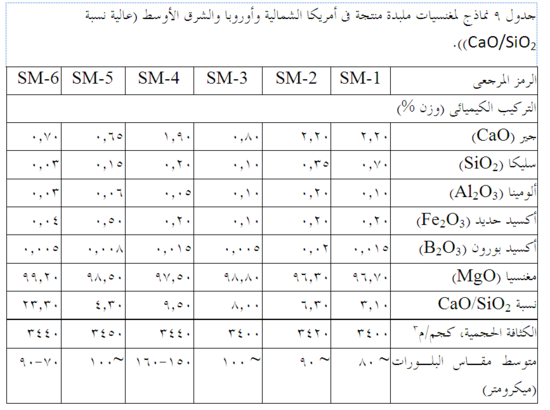
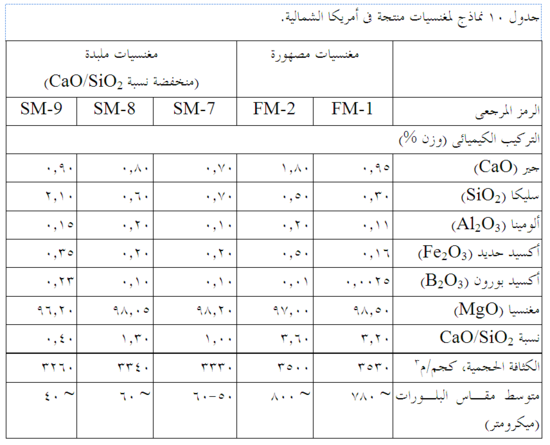
الشوائب في المغنسيا محكومة بتركيب المصدر الأصلى للمغنسيا (المياه المالحة أو مياه البحر)، وتركيب الدولوميت المكلس أو الحجر الجيري، وتقنيات التجهيز. ولا سيما كميات ونسبة CaO وSiO2 فهى تخضع لرقابة صارمة، ويُحافظ على B2O3 في مستويات متدنية للغاية. النتائج النهائية هى مغنسيات حرارية عالية الدرجة جاهزة لتصنيع المنتجات الحرارية. يبين جدول 9 وجدول 10 تركيب الرتب المختلفة من المغنسيا.
النقاوة العالية هامة للغاية لأن MgO لديها مقامة عالية للحرارة ومقاومة جيدة للأخباث القاعدية. فالتقليل من المحتوى الكلى للشوائب في المغنسيا مهم جداً، لأن الشوائب تؤثر على مقاومة الحرارة والأداء. والنسبة العالية لـ CaO/SiO2، ويفضل أن تكون 2:1 أو أعلى بقليل، هى الأمثل للحفاظ على مقاومة عالية للحرارة في المغنسيا. وبانخفاض إجمالى الشوائب إلى نحو 1 ٪ أو أقل يقل تأثير وأهمية نسبة CaO/SiO2 شيئاً فشيئاً. الكثافة العالية تقلل من الترشُّح وانحلال حبيبات المغنسيا عن طريق الخبث. ويوفر الحجم الكبير للبلورات (محقق كأفضل ما يمكن المغنسيا المنصهرة) مساحة سطح أقل لهجوم الخبث. انخفاض محتوى B2O3 يضمن مقاومة عالية في درجات الحرارة المرتفعة للطوب المحروق. وانخفاض نسب الجير إلى SiO2 مطلوبة في بعض المنتجات، حيث تستخدم MgO مع مواد خام أخرى (مثل Cr2O3) أو لمقاومة التميه إلى الحد الأقصى. وطوب المغنسيا الحرارى متاح في عدة صور: مترابط كيميائياً، ومترابط بالزفت، ومحروق، ومحروق ثم مشرب في الزفت.
الطبية
يتمتع أكسيد المغنيسيوم بقابلية ضعيفة للذوبان في الماء ويتم امتصاصه بشكل سيئ من القناة الهضمية. لهذا السبب، فإن أكسيد المغنيسيوم غير فعال نسبيًا لتصحيح نقص المغنيسيوم. يستخدم أكسيد المغنيسيوم للتخفيف من حرقة المعدة وحموضة المعدة، وكمضاد للحموضة، ومكملات المغنيسيوم، وكمادة ملينة على المدى القصير. كما أنه يستخدم لتحسين أعراض عسر الهضم. قد تشمل الآثار الجانبية لأكسيد المغنيسيوم الغثيان والتشنج.[17] بكميات كافية للحصول على تأثير ملين، تشمل الآثار الجانبية للاستخدام طويل الأمد الأمعاء مما يؤدي إلى انسداد الأمعاء.[18]
يُستخدم أكسيد المغنسيوم كغذاء إضافي وكمُضاد حموضة إما وحده أو بالمشاركة مع هيدروكسيد الألومنيوم. إضافة لذلك فيمكن اعتباره مليناً تناضحياً.
الزمرة الدوائية
ملح من أملاح المغنزيوم مضاد حموضة، وملين.
الاستطباب
- علاج الإمساك العابر القصير الأمد.
- علاج فرط الحموضة المعدية الأعراضي.
آلية التأثير
- يحث على عملية إفراغ الأمعاء باحتباسه للسوائل ضمنها بآلية تناضحية الأمر الذي يؤدي لتمدد الكولون وبالتالي زيادة فعاليته التمعجية.
- يتفاعل مع حمض كلور الماء المعدي ليشكل كلوريد المغنزيوم.
مضادات الاستطباب
- فرط الحساسية للمركب أو لأحد مكوناته.
- التهاب الزائدة، رفو اللفائفي، رفو القولون، التهاب القولون التقرحي، التهاب الرتوج، حصار القلب، أذية العضلة القلبية، اضطراب الوظيفة الكلوية الشديد، التهاب الكبد، داء أديسون.
التأثير على صحة الجسم
إن استخدام أكسيد المغنيزيوم هو استخدام واسع في المجالات الصيدلانية والعلاجية ففي إطار العلاج يُعطى 250-500 ملغ فموياً منه كمُضاد حموضة و 2-5 غ كمُليّن تناضحي .و قد تم تصنيفه في فئة المواد غير السامة إذا أعطي بمقادير مسموحة له ، عند استخدامه كسواغ بالرغم من أن آثاره الجانبية الناشئة عن تأثيره المليّن لا تظهر إلا في الجرعات العالية جداً.
الآثار الجانبية
تحدث بنسبة 1% إلى 10%:
- هضمية: إسهال عند تناوله بجرعة مفرطة.
تحدث بنسبة تقل عن 1%:
- قلبية وعائية: هبوط التوتر الشرياني.
- غدية واستقلابية: فرط مغنزيوم الدم.
- هضمية: مغص بطني.
- عصبية عضلية: ضعف عضلي.
- تنفسية: تثبيط تنفسي.
الجرعة
- البالغين (فموياً):
• إعاضة عوز المغنزيوم: 27-45 مك (1-2 قرص) 2-3 مرات/يوم. • علاج فرط الحموضة المعدية: 0.5-3 أقراص مع الماء أو الحليب 4 مرات/يوم (بعد الوجبات وعند النوم). • علاج الإمساك: 2-4 غرام عند النوم مع كأس كاملة من الماء.
- يجب مراقبة تركيز مغنزيوم المصل عند إعطاء هذا المحضر لمريض تقل تصفية الكرياتينين لديه عن 25 مل/د، ويجب عدم إعطائه للمريض المصاب بالقصور الكلوي الشديد.
الحرائك الدوائية
- يبدأ تأثيره الملين خلال 4-8 ساعات من تناوله.
- الإطراح: تُطرح أيونات المغنزيوم الممتصة (30%) مع البول، وتُطرح غير الممتصة مع البراز.
فرط الجرعة/الانسمام
- قد يحدث اضطراب توازن شاردي خطير ومهدد للحياة عند استخدامه لفترة طويلة أو بجرعة مفرطة بسبب الإسهال المرافق.
- يتظاهر فرط الجرعة بارتفاع تركيز مغنزيوم المصل والتخليط والتثبيط العصبي المركزي وانخفاض التوتر الشرياني والضعف العضلي وحصار النقل العصبي العضلي المحيطي.
- عندما يزيد تركيز مغنزيوم المصل عن 4 مك/ليتر قد نلاحظ ضعف المنعكسات الوترية، وعندما يبلغ 10 مك/ليتر أو أكثر قد نلاحظ غيابها وتطور شلل تنفسي وحصار قلبي.
- يعاطس الكالسيوم الوريدي (5-10 مك) الشلل التنفسي وحصار القلب الناجمين عن الانسمام بالمغنزيوم، وفي حالات نادرة قد يستطب اللجوء للديلزة الدموية والبريتوانية.
- قد يموت المريض في حال زاد تركيز مغنزيوم المصل عن 12 مك/ليتر.
التداخلات الدوائية
- ينقص معدل امتصاص التتراسيكلينات والديجوكسين وأملاح الحديد والإندوميتاسين عند إشراك أحد هذه المحضرات معه.
- إن أوكسيد المغنيزيوم هو أكسيد أساسي و يستطيع أن يتفاعل مع المركبات الحامضية في حالتها الصلبة لإعطاء الأملاح مثل Mg(ibuprophen)2 أو يفسد عقاقير Labile القلويـة.
- يمكن لأوكسيد المغنيزيوم أن يشكل معقدات مع البوليميرات مثال على ذلك إيدرجيت SR يثبط تحرر العقاقير .
التداخلات المخبرية
يسبب تناوله ارتفاع تركيز مغنزيوم المصل وانخفاض تركيز البروتين والكالسيوم والبوتاسيوم.
سلامة الاستعمال
تختلف الاحتياطات المتبعة أثناء التعامل مع أكسيد المغنيزيوم وفقاً للظروف و الكميات المستعملة حيث أنه قد يؤدي إلى أذيات فيما إذا استنشق أو أخذ بجرعات عالية نسبياً و يُعتبر مخرشاً للأعين و الجهاز التنفسي حيث يُنصح باستعمال القفازات و القناع الأنفي أو استخدام جهاز التنفس الاصطناعي ، كما يُنصح بحماية الأعين .
التعليمات الخاصة بالمريض
- أقرط وامضغ الأقراص قبل ابتلاعها، وتناولها مع كأس كاملة من الماء.
- راجع الطبيب في حال عدم تحسن الألم البطني أو في حال ظهور إحدى علامات النزف الهضمي.
تحذيرات
- استخدمه بحذر عند المريض المسن أو الذي يُعالج بالليثيوم.
- قد يسبب تناوله إسهالاً شديداً يترافق مع اضطراب التوازن المائي والشاردي.
- اسستخدمه بحذر عند المريض المصاب باضطراب الوظيفة الكلوية ولا سيما إن كانت تصفية الكرياتينين تقل عن 30 مل/د حيث قد يتراكم في الجسم مسبباً الانسمام بالمغنزيوم.
- استخدمه بحذر عند المريض الذي يتناول أحد محضرات الديجيتال لأنه قد يسبب الحصار.
- استخدمه بحذر عند المريض الذي يتناول أحد الليثيوم أو المرخيات العضلية أو مثبطات الجملة العصبية المركزية.
معلومات إضافية
يحوي هذا المحضر المغنسيوم العنصري بنسبة 60% (49.6 مك مغنزيوم/غ)
المستحضرات الصيدلانية
- كبسول: 140 ملغ.
- أقراص: 400 ملغ، 425 ملغ.
أخرى
كمادة مضافة للأغذية، يستخدم أكسيد المغنسيوم كعامل [[مضاد تكتل مضاد للتكتل]]. وهو معروفة لدى إدارة الغذاء والدواء الأمريكية لاستخدامه في منتجات الكاكاو، البازلاء المعلبة، والحلوى المجمدة.[19] رقم E لأكسيد المغنسيوم هو E530.
استخدم أكسيد المغنسيوم تاريخيًا كلون أبيض مرجعي في قياس الألوان، نظرًا لخصائصه الجيدة الناشرة والانعكاسية.[20] يمكن تدخينه على سطح مادة معتمة لتشكيل مجال اندماج.
يستخدم أكسيد المغنسيوم على نطاق واسع كعامل كهربائي في عناصر تسخين البناء الأنبوبية. هناك العديد من أحجام الشبكة المتاحة والأكثر استخدامًا هي 40 و80 شبكة بحسب جمعية المسابك الأمريكية. يرجع الاستخدام المكثف إلى قوتها العالية في العزل الكهربائي ومتوسط التوصيل الحراري. عادة ما يتم سحق أكسيد المغنسيوم وضغطه بأقل فجوات هوائية أو فراغات. كما جربت صناعة التدفئة الكهربائية أكسيد الألومنيوم، لكنه لم يعد مستخدماً.
ككاشف في تركيب مجموعة الكربوكسي بنزيل (Cbz) باستخدام كلوروفورمات البنزيل في EtOAc لمجموعة الحماية ن للأمينات والأميدات.[21]
كما يستخدم أيضًا كعامل عازل في الكابلات الكهربائية المقاومة للحرارة.
أثبتت منشطات أكسيد المغنسيوم فعاليتها في تثبيط نمو الحبيبات في الخزف وتحسين متانة الكسر عن طريق التحويل[مطلوب توضيح] آلية نمو الصدوع على المقياس النانوي.[22]
يستخدم أكسيد المغنسيوم المضغوط كمادة في صناعة البصريات. وهو شفاف يتراوح قطره من 0.3 إلى 7 ميكرومتر. يبلغ انكساره 1.72 عند 1 µm ويبلغ معامل آبي 53.58. يُعرف أحيانًا باسم العلامة التجارية إيستمان كوداك إيرتران-5، على الرغم من أن هذا التصنيف قديم. يتوفر أكسيد المغنسيوم النقي البلوري تجاريًا وله استخدام محدود في بصريات الأشعة تحت الحمراء.[23]
يُعبأ أكسيد المغنسيوم حول نفايات ما بعد اليورانيوم في المصنع التجريبي لعزل النفايات، للتحكم في قابلية ذوبان النويدات المشعة،[24]
يستخدم محلول رذاذ أكسيد المغنسيوم في علم المكتبات وإدارة المجموعات من أجل إزالة الحموضة للمواد الورقية المعرضة للخطر. في هذه العملية، تعمل قلوية أكسيد المغنسيوم (والمركبات المماثلة) على تحييد خاصية الحموضة العالية نسبيًا للورق منخفض الجودة، مما يؤدي إلى إبطاء معدل التدهور.[27]
- يستخدم أكسيد المغنسيوم أيضاً كطلاء واقي في شاشة البلازما.
- يستخدم أكسيد المغنيسيوم كحاجز للأكسيد في أجهزة حفر الأنفاق الدورانية. نظرًا للهيكل البلوري لأغشيةه الرقيقة، والتي يمكن ترسيبها بواسطة رشاش المغنطرون، على سبيل المثال، فإنه يُظهر خصائص تفوق تلك الخاصة بالأغشية غير المتبلورة الشائعة الاستخدام Al2O3. بشكل خاص، تم تحقيق استقطاب الدوران بحوالي 85٪ باستخدام أكسيد المغنسيوم[28] مقابل 40–60 % مع أكسيد الألومنيوم.[29] كما تعتبر قيمة المقاومة المغناطيسية النفقية كبيرة نسبياً لأكسيد المغنسيوم (600% عند درجة حرارة الغرفة و1,100 % عند درجة حرارة 4.2 كلفن[30]) than Al2O3 (ح. 70% عند درجة حرارة الغرفة[31]).
التحذيرات
استنشاق أبخرة أكسيد المغنسيوم يمكنه أن يسبب حمى أبخرة الفلزات.[32]
انظر أيضا
المصادر
- ^ Taurian, O.E.; Springborg, M.; Christensen, N.E. (1985). "Self-consistent electronic structures of MgO and SrO" (PDF). Solid State Communications. 55 (4): 351–5. Bibcode:1985SSCom..55..351T. doi:10.1016/0038-1098(85)90622-2.
- ^ Application of magnesium compounds to insulating heat-conductive fillers Archived 2013-12-30 at the Wayback Machine. konoshima.co.jp
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 4.133. ISBN 1439855110.
- ^ أ ب Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.2. ISBN 1439855110.
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. p. 5.15. ISBN 1439855110.
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0374
- ^ Zhu, Qiang; Oganov A.R.; Lyakhov A.O. (2013). "Novel stable compounds in the Mg-O system under high pressure" (PDF). Phys. Chem. Chem. Phys. 15 (20): 7696–7700. Bibcode:2013PCCP...15.7696Z. doi:10.1039/c3cp50678a.
- ^ Mei, AB; O. Hellman; C. M. Schlepütz; A. Rockett; T.-C. Chiang; L. Hultman; I. Petrov; J. E. Greene (2015). "Reflection Thermal Diffuse X-Ray Scattering for Quantitative Determination of Phonon Dispersion Relations". Physical Review B. 92 (17): 174301. Bibcode:2015PhRvB..92q4301M. doi:10.1103/physrevb.92.174301.
- ^ A P, Johnson (November 1986). Structural and electrical properties of magnesium oxide powders (Masters). Durham University.
{{cite thesis}}: CS1 maint: url-status (link) - ^ Subramanian, M. A.; Shannon, R. D.; Chai, B. H. T.; Abraham, M. M.; Wintersgill, M. C. (November 1989). "Dielectric constants of BeO, MgO, and CaO using the two-terminal method". Physics and Chemistry of Minerals (in الإنجليزية). 16 (8): 741–746. doi:10.1007/BF00209695. ISSN 0342-1791. S2CID 95280958.
- ^ Hornak, Jaroslav; Trnka, Pavel; Kadlec, Petr; Michal, Ondřej; Mentlík, Václav; Šutta, Pavol; Csányi, Gergely; Tamus, Zoltán (2018-05-30). "Magnesium Oxide Nanoparticles: Dielectric Properties, Surface Functionalization and Improvement of Epoxy-Based Composites Insulating Properties". Nanomaterials (in الإنجليزية). 8 (6): 381. doi:10.3390/nano8060381. ISSN 2079-4991. PMC 6027305. PMID 29848967.
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. "Magnesium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a15_595.pub2.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ Ropp, R C. Encyclopedia of the alkaline earth compounds. Elsevier. p. 109. ISBN 9780444595508.
- ^ وليد خليفة. "الحراريات المتالورجية: الأنواع والتركيبات الكيميائية (3) - حراريات المغنسيا والمغنسيا-جير". نول. Retrieved 2012-03-26.
- ^ أ ب Mark A. Shand (2006). The chemistry and technology of magnesia. John Wiley and Sons. ISBN 978-0-471-65603-6. Retrieved 10 September 2011.
- ^ Mármol, Gonzalo; Savastano, Holmer (July 2017). "Study of the degradation of non-conventional MgO-SiO 2 cement reinforced with lignocellulosic fibers". Cement and Concrete Composites. 80: 258–267. doi:10.1016/j.cemconcomp.2017.03.015.
- ^ Magnesium Oxide. MedlinePlus. Last reviewed 02/01/2009
- ^ Tatekawa Y; Nakatani K; Ishii H; et al. (1996). "Small bowel obstruction caused by a medication bezoar: report of a case". Surgery today. 26 (1): 68–70. doi:10.1007/BF00311997. PMID 8680127.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "Compound Summary for CID 14792 – Magnesium Oxide". PubChem.
- ^ Tellex, Peter A.; Waldron, Jack R. (1955). "Reflectance of Magnesium Oxide". JOSA. 45 (1): 19. doi:10.1364/JOSA.45.000019.
- ^ Dymicky, M. (1989-02-01). "Preparation of Carbobenzoxy-L-Tyrosine Methyl and Ethyl Esters and of the Corresponding Carbobenzoxy Hydrazides". Organic Preparations and Procedures International. 21 (1): 83–90. doi:10.1080/00304948909356350. ISSN 0030-4948.
- ^ Tan, C.Y.; Yaghoubi, A.; Ramesh, S.; Adzila, S.; Purbolaksono, J.; Hassan, M.A.; Kutty, M.G. (December 2013). "Sintering and mechanical properties of MgO-doped nanocrystalline hydroxyapatite" (PDF). Ceramics International. 39 (8): 8979–8983. doi:10.1016/j.ceramint.2013.04.098.
- ^ Stephens, Robert E. & Malitson, Irving H. (1952). "Index of Refraction of Magnesium Oxide" (PDF). Journal of Research of the National Bureau of Standards. 49 (4): 249–252. doi:10.6028/jres.049.025.
- ^ wipp.energy.gov Step-By-Step Guide for Waste Handling at WIPP. Waste Isolation Pilot Plant. wipp.energy.gov
- ^ Nutrient Science. fertilizer101.org. Retrieved on 2017-04-26.
- ^ Magnesium oxide for the Animal Feed Industry. lehvoss.de
- ^ "Mass Deacidification: Saving the Written Word". Library of Congress. Retrieved 26 September 2011.
- ^ Parkin, S. S. P.; Kaiser, C.; Panchula, A.; Rice, P. M.; Hughes, B.; Samant, M.; Yang, S. H. (2004). "Giant tunnelling magnetoresistance at room temperature with MgO (100) tunnel barriers". Nature Materials. 3 (12): 862–867. Bibcode:2004NatMa...3..862P. doi:10.1038/nmat1256. PMID 15516928. S2CID 33709206.
- ^ Monsma, D. J.; Parkin, S. S. P. (2000). "Spin polarization of tunneling current from ferromagnet/Al2O3 interfaces using copper-doped aluminum superconducting films". Applied Physics Letters. 77 (5): 720. Bibcode:2000ApPhL..77..720M. doi:10.1063/1.127097.
- ^ Ikeda, S.; Hayakawa, J.; Ashizawa, Y.; Lee, Y. M.; Miura, K.; Hasegawa, H.; Tsunoda, M.; Matsukura, F.; Ohno, H. (2008). "Tunnel magnetoresistance of 604% at 300 K by suppression of Ta diffusion in CoFeB∕MgO∕CoFeB pseudo-spin-valves annealed at high temperature". Applied Physics Letters. 93 (8): 082508. Bibcode:2008ApPhL..93h2508I. doi:10.1063/1.2976435.
- ^ Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J.; Wang, D.; Nordman, C.; Daughton, J. M.; Qian, Z.; Fink, J. (2004). "70% TMR at Room Temperature for SDT Sandwich Junctions with CoFeB as Free and Reference Layers". IEEE Transactions on Magnetics. 40 (4): 2269. Bibcode:2004ITM....40.2269W. CiteSeerX 10.1.1.476.8544. doi:10.1109/TMAG.2004.830219. S2CID 20439632.
- ^ Magnesium Oxide. National Pollutant Inventory, Government of Australia.
وصلات خارجية
- CS1 maint: url-status
- CS1 errors: unsupported parameter
- Short description is different from Wikidata
- Pages using Chembox with unknown parameters
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from June 2021
- معادن المغنسيوم
- مركبات المغنسيوم
- أكاسيد
- مواد حرارية
- مواد بصرية
- مواد سيراميكية
- مكونات الزجاج من الأكاسيد الشائعة
- مضادات أكسدة
- مضافات غذائية بأرقام أوروپية
- الهيكل البلوري للملح الصخري