كوبالت
 | |||||||||||||||
| كوبالت | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | فلز رمادي بزرقة لامعة صلبة | ||||||||||||||
| الوزن الذري العياري Ar°(Co) | |||||||||||||||
| كوبالت في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 27 | ||||||||||||||
| المجموعة | 9 | ||||||||||||||
| الدورة | period 4 | ||||||||||||||
| المستوى الفرعي | d-block | ||||||||||||||
| التوزيع الإلكتروني | [Ar] 3d7 4s2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 15, 2 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| Color | رمادي معدني | ||||||||||||||
| الطور at د.ح.ض.ق | صلب | ||||||||||||||
| نقطة الانصهار | 1768 K (1495 °س، 2723 °F) | ||||||||||||||
| نقطة الغليان | 3200 K (2927 °س، 5301 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 8.90 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 8.86 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 16.06 kJ/mol | ||||||||||||||
| حرارة التبخر | 377 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 24.81 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| حالات الأكسدة | −3, −1, +1, +2, +3, +4, +5[1] | ||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 1.88 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 125 pm | ||||||||||||||
| نصف قطر التكافؤ | Low spin: 126±3 pm High spin: 150±7 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| البنية البلورية | Hexagonal_close_packed.svg | ||||||||||||||
| سرعة الصوت قضيب رفيع | 4720 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 100 W/(m·K) | ||||||||||||||
| التمدد الحراري | 13.0 µm/(m⋅K) (عند 25 °س) | ||||||||||||||
| المقاومة الكهربائية | 62.4 nΩ⋅m (at 20 °C) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسية حديدية | ||||||||||||||
| معامل يونگ | 209 GPa | ||||||||||||||
| معامل القص | 75 GPa | ||||||||||||||
| معاير الحجم | 180 GPa | ||||||||||||||
| نسبة پواسون | 0.31 | ||||||||||||||
| صلادة موز | 5.0 | ||||||||||||||
| صلادة ڤيكرز | 1043 MPa | ||||||||||||||
| صلادة برينل | 470–3000 MPa | ||||||||||||||
| رقم كاس | 7440-48-4 | ||||||||||||||
| التاريخ | |||||||||||||||
| الاكتشاف وأول عزل | گيورگ برانت (1735) | ||||||||||||||
| نظائر الكوبالت | |||||||||||||||
| قالب:جدول نظائر كوبالت غير موجود | |||||||||||||||
الكوبالت cobalt معدن رمزه الكيمياوي Co، عدده الذري 27، وهو في زمرة الحديد (الفصيلة VIIIB أو 8) التي تشمل إضافة إلى الكوبالت في هذه الزمرة الحديد Fe (عدده الذري 26)، والنيكل Ni (عدده الذري 28)، وصنِّفت هذه العناصر في ثلاثية واحدة؛ لأن التشابه بينها أشدّ من التشابه المعتاد بين العنصر والعناصر التي تقع تحته في عمود واحد في الجدول الدوري. اكتشفه الكيميائي السويدي گيورگ برانت G.Brandt في عام 1735.
الكوبالت عنصر كيميائي فلزي لونه أبيض فضي، يستخدم أصلاً في صناعة السبائك. وللكوبالت كثير من خصائص الحديد والنيكل. والفلزات الثلاثة صلبة ومغنطيسية، وتتفاعل مع الأحماض العادية لتكوين الهيدروجين.

الرمز الكيميائي للكوبالتCo ، وعدده الذري 27، ووزنه الذري 58,9332 مقدراً بواحدة الكتل الذرية، وكثافته 8,9جم/سم§. وهو ينصهر عند 1,495°م ويغلي عند 2,870°م. تم اكتشاف الكوبالت عام 1737م، على يد كيميائي سويدي هو جورج برانت. وبنيته الإلكترونية [Ar] 3d74s2 حيث تدل [Ar] على البنية الإلكترونية للغاز الخامل أرغون، له تكافؤان +2 و+3. ودرجة الأكسدة +2 أثبت في حالة المركبات البسيطة. مثال ذلك مركبات الكلور مع الكوبالت، فالمركب CoCl2 ذو اللون الزهري أثبت من CoCl3 لأن الأيون (الشاردة) Co3+ ذو قوة مؤكسدة كبيرة؛ فهو يؤكسد الماء، وينطلق الأكسجين:
لكن درجة الأكسدة (+3) تزداد ثباتاً في المعقدات complexes. المعقَّد، فالمركب [Co (NH3)6]Cl3 أثبت من [Co(NH3)6]Cl2.
يتميز الكوبالت بأنه يشكل معقدات متنوعة، خاصة مع النشادر NH3 والسيانيد CN- وCO وNO. يمتص الهيدروجين H2 فيحوله إلى هيدروجين ذري نشيط؛ لذا كانت له أهمية كبيرة في التحضير في تفاعلات الهدرجة وفي تفاعلات تحفيز أخرى.
مصادر الكوبالت
المخزون الكلي للكوبالت في قشرة الأرض قليل نسبيا. ويظهر الكوبالت في مركَّبات مع الزرنيخ أو الأكسجين أو الكبريت، وفي خامات النيكل وغيره من الفلزات. يوجد الكوبالت في أحجار النيازك. وتتمتع كندا بمخزون كبير من خام الزرنيخ الذي يحوي الكوبالت والنيكل والحديد. ويقع هذا المخزون في اونتاريو. كما يوجد الكوبالت في فنلندا وأذربيجان وكازاخستان وروسيا والكونغو الديمقراطية (زائير سابقاً) وزامبيا. أما الولايات المتحدة ففيها مخزون متواضع من الكوبالت.
وجوده في الطبيعة وتحضيره واستعمالاته
يكوِّن الكوبالت 0.00023% وزناً من القشرة الأرضية، ويأتي ترتيبه الثلاثين بسعة الانتشار. وهو يوجد في جمهورية الكونغو الديمقراطية (زائير سابقاً) وزامبيا وكندا؛ المنتِجيْن الرئيسين له. وهو - مثل الحديد والنيكل - يتميز بخواص مغنطيسية حديدية. تعني هذه الخاصة أن قضيباً مصنوعاً منه يحتفظ بمغنطته حتى بعد زوال الحقل الخارجي الممغنِط. تتطلب هذه الخاصة وجود إلكترونات غير متزاوجة في الذرة؛ ولكن هذه الخاصة لا تظهر إلا إذا كان هناك بعد معين بين الأيونات في الشبكة البلورية.
يصادف الكوبالت في الطبيعة بشكل مركبات مع الكبريت والزرنيخ والأنتموان صيغها CoAsS الكوبالتيت، وCoAs2 السمالتيت.
وللحصول على الكوبالت من فلزاته، تطبق طرائق معقدة حسب نوع الفلز، وتكمن صعوبة استحصاله في فصله عن العناصر المرافقة له، مثل الكبريت والزرنيخ والنيكل والحديد. فالفلز الزرنيخي مثلاً يتحول بعد حرقه إلى مزيج من الأكاسيد المعدنية ومركبات الزرنيخ. يُحلُّ هذا المزيج في حمض كلور الماء، ومن ثم يعامل بغاز كبريتيد الهيدروجين H2S للتخلص من Bi وPb وCu. ويتمّ التخلص بعد ذلك من Fe وAs بترسيبهما بشكل CaHAsO4 وFe(OH)3 بمعالجة المحلول بـ CaCO3. وأخيراً بإضافة المسحوق القاصر؛ وهو مزيج من Ca(OH)2 وCaOCl2.
ينفصل الكوبالت في بدء الإضافة بشكل Co2O3 ومن ثم ينفصل أكسيد النيكل، ثم يُرجَع (يختزَل) أكسيد الكوبالت، وينقى المعدن الناتج بالتحليل الكهربائي.
الكوبالت ذو لون أبيض - مزرق، نقطة انصهاره 1493 ْس، ونقطة غليانه 3100 ْ س. كمونه النظامي (التحول إلى CO2+) يساوي -0.277 فلط. نصف قطر ذرته 125 بيكومتر، كمون تأينه مقدراً بالإلكترون فولط (الأول 7.86، الثاني 17.1، والثالث 33.5)، ناقليته الكهربائية أعلى من ناقلية الزئبق بعشر مرات، وناقليته الحرارية أعلى بثماني مرات، كتلته الحجمية 8.9 غ/سم3.
يستعمل الكوبالت بشكله المعدني؛ ليحول إلى نظير الكوبالت 60 المشع الذي عمر نصفه 5.7 سنة، يتفكك مطلقاً أشعة غاما، ويستخدم في الطب وفي الصناعة كما يستعمل المعدن في صناعة ضروب السيراميك ومجففات الدهان وحفّازاً. يدخل الكوبالت في صناعة العديد من السبائك فسبيكته القابلة للسحب التي تحوي 1-18% كوبالت والباقي نيكل لها تطبيقات خاصة إذ تستعمل في صنع الأغشية الرقيقة، فتكسب المعادن التي تكسى بها اللمعان والقساوة.
أما الفولاذ المستعمل عند درجات حرارة عالية (أعلى من 650 ْس) فيحوي 5-65% كوبالت، يستعمل في صناعة الطائرات والتوربينات الغازية وتطبيقات أخرى شبيهة. وبدرجات حرارة أعلى من 511 ْس تستعمل سبائك، مثل سبيكة النيمونيك 90 (Nimonic 90) وهي سبيكة أساسها النيكل وتحوي 18% كوبالت وكمية مماثلة من الكروم وقليلاً من التيتانيوم Ti. وتستعمل سبيكة أخرى في هذا المجال يطلق عليها اسم واسبَلوي Waspaloy.
وهنالك السبائك المستعملة في القطع ومقاومة الاهتراء بإضافة 2-12% كوبالت إلى الأدوات الفولاذية، تصبح هذه الأدوات قابلة للاستعمال من أجل القطع العميق والسرعات الكبيرة.
يستعمل نحو 25% من إنتاج الكوبالت عالمياً في صنع المغانط. والسبائك التي تصنع منها المغانط الدائمة الجيدة تحوي 2-40% من الكوبالت. كما أن ضروب الفولاذ (سبيكة حديد مع الكربون) الكوبالتي التي تحوي 2-40% كوبالت تستعمل بكثرة في صناعة المغانط.
أما سبائك الحديد - الكوبالت - الفاناديوم، مثل السبائك التي يطلق عليها اسم خلائط فيك Vik alloys؛ فتستعمل في صناعة المغانط، وتستعمل سبائك الكوبالت مع النحاس والنيكل للغرض نفسه، وكذلك سبائكه مع الحديد والمولبدن. ومنذ عام 1930 بدأت صناعة سبائك الكوبالت مع الألمنيوم؛ وهذه السبائك تدعى ألنيكو Alnicos تحوي 6-12% ألمنيوم و14-30% نيكل و5-35% كوبالت؛ ويضاف لها حديد وكميات صغيرة من النحاس والتيتانيوم، وتصنع من هذه السبائك مغانط كما تستعمل في صنع الأجهزة الكهربائية والأجهزة الإلكترونية.
وأما السبائك التي تحوي 60 ـ 65% كوبالت مع معادن الأتربة النادرة، خاصة برازيديميوم وسماريوم؛ فيستفاد منها في صناعة مساحيق المغانط التي تستعمل في الإلكترونيات.
السبائك الفائقة super alloys مقاومة حرارياً، وتستعمل في صناعة العنفات الغازية. وسبيكته مع كربيد التنغستن؛ وتدعى الكاربولوي carboloy قاسية تستعمل في قطع الفولاذ وشغله، وسبيكته مع الكروم لها الاستعمال نفسه؛ واسمها ستلِّيت Stellite.
خواصه الكيمياوية
يسلك الكوبالت - كيمياوياً - سلوك معدن انتقالي transition metal نموذجي. والمعادن الانتقالية هي مجموعة العناصر الواقعة بين الفصيلة IIA (أو 2) والفصيلة IIIA (أو 13). وهي تقع في ثلاثة أدوار - السلسلة الانتقالية الأولى والثانية والثالثة.
الكوبالت - مثل الحديد والنيكل - متوسط النشاط الكيمياوي فكمون مسرى الكوبالت (تحوله إلى Co2+) يساوي -0.28 فولط. فهو أكثر كهرجابية من الهيدروجين، وينحل بالحموض الممددة. وهو - في الشروط العادية - يتفاعل بدرجة تكاد لا تذكر مع اللامعادن النموذجية الجافة مثل الأكسجين والكبريت والكلور والبروم إلا أنه يتفاعل بشدة معها بالتسخين خاصة إذا كان مسحوقاً. وإذا كانت حبيبات المسحوق صغيرة جداً (القطر الوسطي للحبيبة 5 مكرونات)؛ فإنه يلتهب تلقائياً في الهواء عند درجة الحرارة العادية.
وهو يتحد - عند درجات الحرارة المرتفعة - مع الأنتموان والسيلسيوم (السيليكون) والفسفور والزرنيخ ومع الألمنيوم. ويكون التفاعل نشيطاً في معظم الحالات. فمزيج متساو من النيكل والألمنيوم يتفاعل بانفجار مكوّناً المركّب NiAl، ويكوّن مع الكربون كربيدات صيغتها العامة Co3C وCo2C.
يمتصّ الكوبالت غاز الهيدروجين عند درجات الحرارة العالية خاصة، ويزداد امتصاصه لهذا الغاز عندما يكون مسحوقاً. ولا يتكون من امتصاص الهيدروجين مركّبات محدودة التركيب.
يمتص الكوبالت غازَ الآزوت (النتروجين)، ويمتص أكسيد الكربون، وتتناقص درجة الامتصاص بارتفاع درجة الحرارة كما يمتص CO عند ضغط عال؛ ويتكوَّن كربونيل الكوبالت Co (CO)4.
يكوّن الكوبالت العديد من المعقدات بدرجتي الأكسدة +2 و+3 ومعقداته بدرجة الأكسدة +3 أثبت من معقداته بدرجة الأكسدة +2. ومعقدات الكوبالت كثيرة، مثال ذلك المعقَّد [CoF6]3- و[Co (NH3) 6]Cl3، وهي أكثر من معقدات أي عنصر آخر.
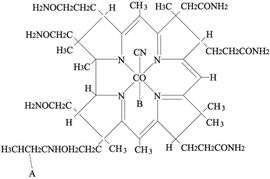
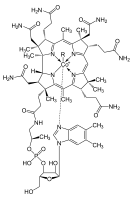
يوجد الكوبالت III في فيتامين ب 12 (B12). فهو يصون خلايا الدم الحمراء في الكبد. ويكون الكوبالت بدرجة أكسدة +3 مرتبطاً بخمس روابط مع خمس ذرات آزوت في أجزاء مختلفة من البنية المحيطية، وتجري في الموقع السادس الفعالية الكيمياوية الحيوية (الشكل-1).
أهم مركباته في درجة الأكسدة +2
الأكسيد CoO ذو لون أخضر مائل للرمادي يحضر بتفكك الكربونات، وهو ينحلّ في الحموض. ومعظم أملاح الكوبالت II مع الحموض القوية تنحل بالماء ومحاليلها ذات تفاعل حمضي ضعيف بسبب الحلمهة (التحلل بالماء). أما أملاح الحموض الضعيفة نسبياً فتكون غالباً صعبة الانحلال مثل الكربونات والفوسفات. وفي الحالة الجافة (اللامائية) لون الأيون Co2+ أحمر فاتح. أما لون الأيون Co2+ المميه فهو أحمر وردي.
تتبلور أملاحه مع الهاليدات في معظم الحالات مع ستة جزيئات ماء، وتنحل جيداً في الماء وفي الكحول باستثناء الفلوريد CoF2. ويختلف لونها في الحالة اللامائية حسب الهالوجين، كما أن فقدانها التدريجي للماء يؤدي إلى تغير لونها. فكلوريد الكوبالت بدرجة الأكسدة +2 CoCl2.x(H2O) يختلف لونه حسب قيمة x.
وتستعمل هذه الخاصة أحياناً لتقدير درجة الرطوبة في الجو؛ وذلك بتلون ورقة جُفِّف عليها محلول كلوريد الكوبالت II.
للكوبالت +2 ملح كبريتات CoSO4 يتبلور مع سبعة جزيئات ماء، وهو يكوِّن ملحاً مضاعفاً أو معقَّدات صيغتها العامة A2[Co(SO4)2].6H2O حيث A معدن قلوي[ر. القلويات] أو أيون الأمونيوم. وهو يكوِّن مع الثيوسيانيد الملحَ Co (SCN)2 الذي ينحل جيداً في الماء. وهذا بدوره يكوِّن مع ثيوسيانيدات المعادن القلوية المعقدات A2[Co(SCN)4] وA4[Co(SCN)6]، حيث A أيون معدن قلوي أو أيون أمونيوم. وهذه المعقدات ذات لون أزرق مميز، وتستعمل في الكيمياء التحليلية للكشف عن الكوبالت.
أهم المركبات الموافقة لدرجة الأكسدة +3
الأكسيد Co2O3 ذو لون بني غامق يستحصل عليه بتسخين النترات. وهو مؤكسد قوي يصعب الحصول عليه نقياً فهو دوماً ممزوج بـ CoO.
أملاح الكوبالت III البسيطة غير ثابتة في المحاليل إذ ترجَع بسهولة إلى أملاح الكوبالت II؛ فهي ذات صفة مؤكسدة قوية؛ إلا أنه بتكون معقدات لها يستقر التكافؤ الثلاثي الذي يشكل طائفة متنوعة من المعقدات التي تتميز بثباتها الشديد.
يكون الكوبالت الثلاثي مع النتريت الأيون المعقد [Co(NO2)6]3-؛ وهذا الأيون يكوِّن أملاحاً صعبة الانحـلال مع الأيونات المعدنية الأحادية التكافؤ باسـتثناء Na+ وLi+؛ لـذا يـستعمل محـلول المعـقد Na3[Co(NO2)6] للكشف عن البوتاسيوم الذي يكوِّن راسباً أصفر K3[Co(NO2)6].
استخدامات الكوبالت
معظم الكوبالت مستخدم في صورة سبائك. والباقي في صورة مركبات أو نظائر. ويسبك الكوبالت مع الألومنيوم أو النيكل أو الحديد أو بعض الفلزات الأخرى، لصناعة المغانط التي تستخدم في أجهزة الراديو والتلفاز، وكثير من الأجهزة الأخرى. ويتحد الكوبالت مع الكربون والتنجستن أو مع الكروم والحديد أو أي من المعادن الأخرى، حيث تنتج سبائك متينة جدًا تستخدم في بعض الآلات مثل لقم المثاقب وأدوات القطع. وكثير من سبائك الكوبالت تقاوم درجات الحرارة المرتفعة جدًا. ولهذا السبب تستخدم هذه السبائك في توربينات الغاز والمحركات النفاثة وغيرها من المعدات التي تعمل في درجة حرارة عالية.
تشمل مركبات الكوبالت أكاسيد الكوبالت وأملاحه. وتُستخدم أكاسيد الكوبالت أصبـاغاً لتلـوين الطلاء الزجاجي والأواني الخزفية والزجاج. وتستفيد صناعة الدهان من أملاح الكوبالت في تجفيف الدهانات ومواد الطلاء. ويعد فيتامين ب12، وهو أحد مركبات الكوبالت العضوية، ضروريا للحيلولة دون مرض فقر الدم الخبيث.
النظائر المشعة للكوبالت
| النظير | آلية الإضمحلال | نصف العمر |
|---|---|---|
| Co-50 | positron emission | 44 millisecond |
| Co-51 | positron emission | unmeasured |
| Co-52 | positron emission | 0.12 second |
| Co-53 | positron emission | 0.24 second |
| Co-54 | positron emission | 193.2 millisecond |
| Co-55 | positron emission | 17.53 h |
| Co-56 | electron capture, positron emission | 77.3 d |
| Co-57 | positron emission | 271.8 d |
| Co-58 | electron capture | 70.88 d |
| Co-59 | مستقر | ∞ |
| Co-60 | beta decay | 5.271 yr |
| Co-61 | beta decay | 1.65 hr |
| Co-62 | beta decay | 1.5 min |
| Co-63 | beta decay | 27.5 second |
| Co-64 | beta decay | 0.30 second |
| Co-65 | beta decay | 1.17 second |
| Co-66 | beta decay | 0.190 second |
| Co-67 | beta decay | 0.43 second |
| Co-68 | beta decay | 0.20 second |
| Co-69 | beta decay | 0.22 second |
| Co-70 | beta decay | 0.13 second |
| Co-71 | beta decay | 0.21 second |
| Co-72 | beta decay | 90 millisecond |
أوسع نظائر الكوبالت استخدامًا هو الكوبالت 60. ويقوم العلماء بتحضير هذا النظير المشع بطرق الكوبالت العادي أو كوبالت 59 بالنيوترونات داخل مفاعل نووي. ونصف عمر الكوبالت 60 حوالي خمس سنوات، أي أن نصف الذرات في عيِّنة من الكوبالت 60 تنحل (تتفكك) في 5 سنوات. وعند انحلال الكوبالت 60 يُصدر نوعين من الإشعاعات : جسيمات بيتا و أشعة جاما. ويستفاد من الكوبالت 60 في علاج السرطان، لأن الإشعاع الصادر منه يقتل الخلايا السرطانية، كما يستفاد منه في تشخيص بعض الأمراض. فمثلاً يكشف الأطباء عن مرض فقر الدم الخبيث بإعطاء المريض فيتامين ب12 الذي به بعض الكوبالت 60، ثم يتولى كاشف للإشعاعات قياس مقدار الكوبالت 60 ـ ومقدار الفيتامين في بول المريض. وبهذا يتمكن الأطباء من تحديد ما إذا كان الجسم يمتص الفيتامين بشكل طبيعي أم لا.
التاريخ
اِستُخدِمت مركبات الكوبالت لقرون لإعطاء لون أزرق سخي للزجاج و glazes، و ceramics. وقد عُثر على الكوبالت في المنحوتات المصرية والمجوهرات الفارسية من الألفية الثالثة ق.م.، في أطلال پومپي (التي تدمرت في 79 م)، وفي الصين من أسرة تانگ (618–907 م) وأسرة مينگ (1368–1644 م).[5]
اِستُخدِم الكوبالت لتلوين الزجاج من العصر البرونزي. حفريات حطام سفينة أولوبورون تضمنت سبيكة زجاج أزرق، مصبوبة أثناء القرن 14 ق.م.[6][7] الأغراض الزجاجية الزرقاء من مصر كانت ملونة بالنحاس أو الحديد أو الكوبالت. أقدم زجاج ملون بالكوبالت كان من الأسرة الثامنة عشر في مصر (1550–1292 ق.م.). مصدر ذلك الكوبالت غير معروف.[8][9]
كلمة كوبالت cobalt مشتقة من الألمانية kobalt، من kobold ويعني "goblin"، وهو تعبير متعلق بالخرافات، يستخدمه عمال المناجم اسماً لخام الكوبالت. أول محاولات صهر تلك الخامات للحصول على النحاس أو النيكل فشلت، وأنتجت بدلاً من ذلك مسحوق (أكسيد الكوبالت الثنائي). ولأن الخامات الرئيسية للكوبالت دائماً ما تحتوي زرنيخ، فإن صهر الخام كان يؤكسد الزرنيخ إلى أكسيد الرزنيخ عالي السمية والمتطاير، مضيفاً للسمعة السيئة للخام.[10]
الكيميائي السويدي گيورگ برانت (1694–1768) يعود إليه فضل اكتشاف الكوبالت حوالي 1735، مبيناً أنه عنصر كيميائي لم يك معروفاً من قبل، ويختلف عن البزموت والفلزات التقليدية الأخرى. وقد سماه برانت "شبه فلز" جديد.[11][12] وبيـَّن أن مركبات فلز الكوبالت كانت مصدر اللون الأزرق في الزجاج، والتي كانت تـُعـْزى في السابق إلى البزموت الذي كان يتواجد مع الكوبالت. فأصبح الكوبالت أول فلز يُكتشَف منذ الأزمنة قبل التاريخية، التي لم تسجل أسماء مكتشفي كل الفلزات المعروفة (الحديد والفضة والذهب والزنك والزئبق والقصدير والرصاص والبزموت).[13]
وأثناء القرن التاسع عشر، نُقل جزء كبير من إنتاج العالم من أزرق كوبالت (صبغة مصنوعة من مركبات الكوبالت والألومينا) وسمالت (زجاج كوبالت لاستخدامها في أغراض الصبغ في السيراميك والطلاء) في Blaafarveværket النرويجية.[14][15] كانت المناجم الأولى لإنتاج السمالت في القرن السادس عشر موجودة في النرويج والسويد وساكسونيا والمجر. مع اكتشاف خام الكوبالت في كاليدونيا الجديدة في عام 1864، انخفض تعدين الكوبالت في أوروبا. مع اكتشاف رواسب الخام في اونتاريو، كندا في عام 1904 واكتشاف رواسب أكبر في محافظة كاتنگا في الكونغو في عام 1914، تحولت عمليات التعدين مرة أخرى.[10] When the Shaba conflict started in 1978, the copper mines of Katanga Province nearly stopped production.[16][17] كان التأثير على اقتصاد الكوبالت العالمي من هذا الصراع أقل من المتوقع: الكوبالت معدن نادر، والصبغة شديدة السمية، وقد أنشأت الصناعة بالفعل طرقاً فعالة لإعادة تدوير مواد الكوبالت. في بعض الحالات، كانت الصناعة قادرة على التغيير إلى بدائل خالية من الكوبالت.[16][17]
وفي 1938، اكتشف جون لڤنگود وگلن سيبورگ النظير المشع كوبالت-60.[18]اشتهر استخدام هذا النظير في جامعة كلومبيا في الخمسينيات من القرن الماضي لإثبات انتهاك التكافؤ في اضمحلال بيتا للمواد المشعة.[19][20]
وبعد الحرب العالمية الثانية، أرادت الولايات المتحدة ضمان إمداد خام الكوبالت للاستخدامات العسكرية (كما كان يفعل الألمان) والتنقيب عن الكوبالت داخل حدود الولايات المتحدة. تم العثور على إمدادات كافية من الخام في ولاية أيداهو بالقرب من بلاكبيرد كانيون في جانب أحد الجبال. وبدأت شركة كاليرا للتعدين الإنتاج في الموقع.[21]
التواجد
يتم إنتاج الشكل المستقر من الكوبالت في المستعرات الأعظمية من خلال r-process.[22] والتي تتألف من 0.0029٪ من قشرة الأرض. الكوبالت الحر (فلز طبيعي) غير موجود على الأرض بسبب الأكسجين الموجود في الغلاف الجوي والكلور في المحيط. كلاهما وفير بما يكفي في الطبقات العليا من قشرة الأرض لمنع الكوبالت المعدني الأصلي من التكون. باستثناء ما تم تسليمه مؤخراً في الحديد النيزكي، فإن الكوبالت النقي في شكل معدن أصلي غير معروف على الأرض. يحتوي العنصر على وفرة متوسطة ولكن المركبات الطبيعية من الكوبالت عديدة وتوجد كميات صغيرة من مركبات الكوبالت في معظم الصخور والتربة والنباتات والحيوانات.[citation needed]
في الطبيعة، كثيراً ما يرتبط الكوبالت بالنيكل. كلاهما مكونان مميزان الحديد النيزكي، على الرغم من أن الكوبالت أقل وفرة في النيازك الحديدية من النيكل. كما هو الحال مع النيكل، قد يكون الكوبالت الموجود في سبائك الحديد النيزكي محمياً بشكل كافٍ من الأكسجين والرطوبة ليبقى كمعدن حر (لكن مخلوط)،[23] على الرغم من عدم رؤية أي من العناصر بهذا الشكل في القشرة الأرضية القديمة.[citation needed]
يوجد الكوبالت في شكل مركب في معادن النحاس والنيكل. هو المكون المعدني الرئيسي الذي يتحد مع الكبريت والزرنيخ في الكبريتيد الكوبالتيت (CoAsS)، سافلوريت(CoAs2)، الگلوكودوت ((Co,Fe)AsS) والسكوتيروديت (CoAs3).[24] المعدن كاترايت مشابه الپيريت ويوجد جنباً إلى جنب مع ڤايسيت في رواسب النحاس في محافظة كاتنگا.[25] عندما تصل إلى الغلاف الجوي، تحدث التجوية; تتأكسد معادن الكبريتيد وتتشكل الإريثريت ذات اللون الوردي ("بريق الكوبالت": Co3(AsO4)2·8H2O) وسفيروكوبالتيت (CoCO3).[26][27]
يعتبر الكوبالت أيضاً أحد مكونات دخان التبغ.[28]يمتصه نبات التبغ بسهولة وتتراكم الفلزات الثقيلة مثل الكوبالت من التربة المحيطة في أوراقه. يتم استنشاقها لاحقاً أثناء تدخين التبغ.[29]
في المحيطات
الكوبالت هو معدن نادر يشارك في عملية التمثيل الضوئي وتثبيت النيتروجين المكتشفة في معظم أحواض المحيطات وهو عنصر غذائي دقيق للعوالق النباتية والبكتيريا الزرقاء.[30][31] يتم تصنيع الكوبالامين المركب المحتوي على مركب مشترك فقط بواسطة طحالب زرقاء وعدد قليل من العتائق، لذلك تكون تركيزات الكوبالت المذابة منخفضة في الجزء العلوي من المحيط. مثل Mn وFe، يمتلك Co ملف تعريف هجيناً للامتصاص البيولوجي بواسطة العوالق النباتية عبر التمثيل الضوئي في أعالي المحيط والنبش في أعماق المحيط، على الرغم من أن معظم عمليات جمع القمامة محدودة بواسطة الروابط العضوية المعقدة.[32][33] يُعاد تدوير الكوبالت في المحيط عن طريق تحلل المواد العضوية التي تغرق تحت الجزء العلوي من المحيط، على الرغم من أن معظم البكتيريا تتأكسد.[citation needed]
تشمل مصادر الكوبالت للعديد من أجسام المحيطات الأنهار والجريان السطحي الأرضي مع بعض المدخلات من الفتحات الحرارية المائية.[34] في أعماق المحيطات، توجد مصادر الكوبالت ملقاة على قمة الجبال البحرية (والتي يمكن أن تكون كبيرة أو صغيرة) حيث تجتاح تيارات المحيط قاع المحيط لإزالة الرواسب على امتداد ملايين من سنوات مما يسمح لهم بتكوين قشور المنجنيز الحديدي.[35] على الرغم من محدودية رسم الخرائط لقاع البحر، تشير التحقيقات الأولية إلى وجود كمية كبيرة من هذه القشور الغنية بالكوبالت الموجودة في منطقة كلاريون كليبرتون،[36] وهي منطقة تحظى باهتمام متزايد لمشاريع تعدين قاع البحر بسبب البيئة الغنية بالمعادن ضمن مجالها. تساهم المدخلات البشرية كمصدر غير طبيعي ولكن بكميات قليلة جداً. يتم التحكم في تركيزات الكوبالت المذاب (dCo) عبر المحيطات بشكل أساسي عن طريق الخزانات حيث تكون تركيزات الأكسجين المذاب منخفضة. لا يزال يُساء فهم التدوير الكيميائي الحيوي المعقد للكوبالت في المحيط إلى حد ما، ولكن تم العثور على أنماط ذات تركيزات أعلى في مناطق منخفضة الأكسجين[37] مثل منطقة الحد الأدنى من الأكسجين (OMZ) في جنوب المحيط الأطلسي.[38]
يعتبر الكوبالت ساماً للبيئات البحرية بتركيزات عالية.[39] تنخفض التركيزات الآمنة حوالي 18 ميكروغرام/لتر في المياه البحرية للعوالق مثل الدياتومات. تتأثر معظم مستويات السمية الساحلية بمدخلات بشرية المنشأ مثل جريان مياه الصرف الصحي وحرق الوقود الأحفوري. تم تسجيل مستويات عالية من Co وSe في المأكولات البحرية التي يتم الحصول عليها من المناطق الساحلية ذات المستويات الأعلى من المعادن النزرة. على الرغم من وعي العلماء بالسمية المهددة، فقد تم إيلاء اهتمام أقل مقارنة بالمعادن النزرة الأخرى مثل الزئبق والرصاص في أنظمة المياه الملوثة.[citation needed]
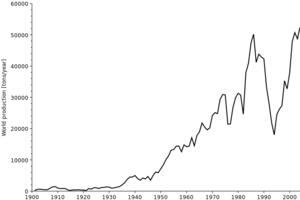
الانتاج
الخامات الرئيسية للكوبالت هي الكوبالتيت والإريثريت و الگلوكودوت وسكوتروديت (انظر أعلاه)، ولكن يتم الحصول على معظم الكوبالت عن طريق تقليل المنتجات الثانوية للكوبالت من تعدين وصهر النيكل والنحاس.[40][41]
نظراً لأن الكوبالت يُنتج عموماً كمنتج ثانوي، فإن إمداد الكوبالت يعتمد إلى حد كبير على الجدوى الاقتصادية لتعدين النحاس والنيكل في سوق معينة. ويُتوَقـَّع أن ينمو الطلب على الكوبالت بنسبة 6% في 2017.[42]
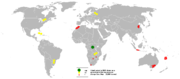
| البلد | الانتاج | الاحتياطيات |
|---|---|---|
| 64,000 | 3,500,000 | |
| 5,600 | 250,000 | |
| 5,000 | 1,200,000 | |
| 4,300 | 250,000 | |
| 4,200 | 500,000 | |
| 4,000 | 280,000 | |
| 3,800 | 150,000 | |
| 3,200 | 51,000 | |
| 2,900 | 270,000 | |
| 2,800 | - | |
| 2,500 | 29,000 | |
| 1,500 | ||
| 650 | 23,000 | |
| البلدان الأخرى | 5,900 | 560,000 |
| الإجمالي العالمي | 110,000 | 7,100,000 |
رواسب الكوبالت الأولية نادرة، مثل تلك التي تحدث في الرواسب الحرارية المائية، المرتبطة بـ الصخور فوق المافية، المميزة بمنطقة بوعزير في المغرب. في مثل هذه المواقع، يتم استخراج خامات الكوبالت حصرياً، وإن كان ذلك بتركيز أقل، وبالتالي تتطلب المزيد من المعالجة النهائية لاستخراج الكوبالت.[44][45]
توجد عدة طرق لفصل الكوبالت عن النحاس والنيكل، اعتماداً على تركيز الكوبالت والتركيب الدقيق للخام المستخدم. إحدى الطرق هي التعويم الرغوي، حيث يرتبط عامل فعال على السطح بمكونات الخام، مما يؤدي إلى تخصيب خامات الكوبالت. يحول التحميص اللاحق الخامات إلى كبريتات الكوبالت، ويتأكسد النحاس والحديد إلى أكسيد. يستخلص الترشيح بالماء الكبريتات مع الزرنيخ. يتم ترشيح المخلفات باستخدام حمض الكبريتيك، مما ينتج عنه محلول من كبريتات النحاس. يمكن أيضاً ترشيح الكوبالت من خبث صهر النحاس.[46]
تُحوَّل منتجات العمليات المذكورة أعلاه إلى أكسيد الكوبالت (Co3O4). يتم اختزال هذا الأكسيد إلى معدن بواسطة تفاعل الألمنيوم الحراري أو التحويل بالكربون في فرن لافح.[24]
الاستخلاص
تقدر هيئة المسح الجيولوجي الأمريكية الاحتياطيات العالمية من الكوبالت بـ 7,100,000 طن متري.[47] تنتج جمهورية الكونغو الديمقراطية (DRC) حالياً 63٪ من الكوبالت في العالم. قد تصل هذه الحصة السوقية إلى 73٪ بحلول عام 2025 إذا حدثت التوسعات المخطط لها من قبل منتجي التعدين مثل گلنكور Plc كما هو متوقع. ولكن بحلول عام 2030، قد يكون الطلب العالمي 47 مرة أكثر مما كان عليه في عام 2017، حسب تقديرات وكالة بلومبرگ لتمويل الطاقة الجديدة.[48]
جذبت التغييرات التي أدخلتها الكونغو على قوانين التعدين في عام 2002 استثمارات جديدة في مشاريع النحاس والكوبالت الكونغولية. قام منجم موتاندا الخاص بشركة گلنكور بشحن 24500 طن من الكوبالت في عام 2016، و40٪ من إنتاج جمهورية الكونغو الديمقراطية وحوالي ربع الإنتاج العالمي. بعد زيادة العرض، أغلقت شركة گلنكور مدينة موتاندا لمدة عامين في أواخر عام 2019.[49][50] كما يتم استئناف مشروع شركة گلنكور كاتانگا للتعدين، ومن المفترض أن ينتج 300 ألف طن من النحاس و20 ألف طن من الكوبالت بحلول عام 2019، وفقاً لشركة گلنكور.[42]
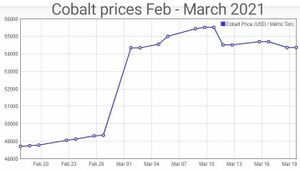
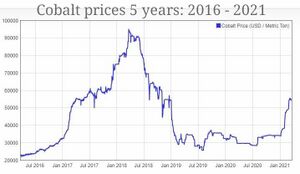
بعد أن وصلت إلى أعلى مستوياتها في العقد القريب في أوائل عام 2018 فوق 100,000 دولار أمريكي للطن الواحد، تراجعت أسعار الكوبالت المستخدم في سلسلة إمداد البطاريات الكهربائية العالمية بنسبة 45٪ في العامين التاليين. مع الارتفاع المفاجئ في الطلب على السيارات الكهربائية (EV) خلال عام 2020 وحتى عام 2021، ارتفعت أسعار الكوبالت في يناير 2021. يوضح مؤشر أسعار الكوبالت في مارس 2021 أن الأسعار ترتفع شهرياً إلى 54000 دولار أمريكي للطن في 19 مارس 2021، محققة مكاسب بنسبة 35٪ أكثر من شهرين.
تم تصنيف الكوبالت كمعدن بالغ الأهمية من قبل الولايات المتحدة، واليابان، وجمهورية كوريا، والمملكة المتحدة والاتحاد الأوروبي.
جمهورية الكونغو الديمقراطية
في عام 2005، كان أكبر منتج للكوبالت هو رواسب النحاس في محافظة كاتنگا بجمهورية الكونغو الديمقراطية. محافظة شابا سابقاً، كانت المنطقة تحتوي على ما يقرب من 40٪ من الاحتياطيات العالمية، وفقاً لما ذكرته هيئة المسح الجيولوجي البريطانية في عام 2009.[51] بحلول عام 2015، قدمت جمهورية الكونغو الديمقراطية 60٪ من إنتاج الكوبالت العالمي، 32000 طن بسعر 20000 إلى 26000 دولار للطن. يمكن أن يرجع النمو الأخير في الإنتاج جزئياً على الأقل إلى انخفاض إنتاج التعدين خلال الحروب الأهلية العنيفة للغاية في جمهورية الكونغو الديمقراطية في أوائل العقد الأول من القرن الحادي والعشرين، أو إلى التعديلات التي أجرتها الدولة على قانون التعدين في عام 2002 لتشجيع الاستثمار الأجنبي ومتعدد الجنسيات والتي فعلت ذلك. جلب عدد من المستثمرين، بما في ذلك گلنكور.[citation needed]
زاد التعدين الحرفي النسبة من 17٪ إلى 40٪ من إنتاج جمهورية الكونغو الديمقراطية.[52] يستخدم حوالي 100000 من عمال مناجم الكوبالت في جمهورية الكونغو الديمقراطية أدوات يدوية لحفر مئات الأقدام، مع القليل من التخطيط وتدابير السلامة الأقل، كما يقول العمال والمسؤولون الحكوميون والمنظمات غير الحكومية، بالإضافة إلى ملاحظات صحفيي واشنطن پوست حول زياراتهم إلى المناجم المعزولة. كثيرا ما يتسبب نقص احتياطات السلامة في حدوث إصابات أو وفيات.[53]يلوث التعدين المنطقة المجاورة ويعرض الحياة البرية المحلية والمجتمعات الأصلية للمعادن السامة التي يعتقد أنها تسبب تشوهات خلقية وصعوبات في التنفس، وفقاً لمسؤولي الصحة.[54]
زعم نشطاء حقوق الإنسان وذكرت الصحافة الاستقصائية تأكيداً،[55][56] أن عمالة الأطفال تُستخدم في تعدين الكوبالت في المناجم الحرفية الأفريقية.[52][57] دفع هذا الكشف شركة تصنيع الهواتف المحمولة أپل، في 3 مارس 2017، إلى التوقف عن شراء الخام من الموردين مثل ژىجيانگ هوايو كوبالت الذين مصدرهم من المناجم الحرفية في جمهورية الكونغو الديمقراطية، والبدء في استخدام الموردين الذين يتم التحقق منها لتلبية معايير مكان العمل.[58][59]
هناك دفعة عالمية من قبل الاتحاد الأوروبي وكبرى شركات تصنيع السيارات (OEM) للإنتاج العالمي للكوبالت من أجل الحصول عليه وإنتاجه على نحو مستدام ومسؤول وإمكانية تتبع سلسلة التوريد. تتبنى شركات التعدين وتمارس مبادرات ESG بما يتماشى مع إرشادات منظمة التعاون الاقتصادي والتنمية (OECD) ووضع دليل على أنشطة بصمة الكربون الصفرية إلى المنخفضة في إنتاج سلسلة التوريد بطاريات ليثيوم-أيون. يتم تنفيذ هذه المبادرات بالفعل مع شركات التعدين الكبرى، وشركات التعدين الحرفي والصغير الحجم (ASM). وتشارك شركات تصنيع السيارات وسلاسل توريد مصنعي البطاريات لتسلا وVW وBMW وBASF وگلنكور في العديد من المبادرات، مثل مبادرة الكوبالت المسؤولة ودراسة كوبالت من أجل التنمية. في عام 2018، أطلقت مجموعة BMW بالشراكة مع BASF وسامسونگ SDI وسامسونگ للإلكترونيات مشروعاً تجريبياً في جمهورية الكونغو الديمقراطية على منجم تجريبي واحد، لتحسين الظروف ومواجهة التحديات التي تواجه عمال المناجم الحرفيين والمجتمعات المحيطة.
تسببت الديناميات السياسية والعرقية في المنطقة في الماضي في اندلاع أعمال عنف وسنوات من الصراع المسلح ونزوح السكان. أثر عدم الاستقرار هذا على سعر الكوبالت وخلق أيضاً حوافز ضارة للمقاتلين في حربي الكونغو الأولى والثانية لإطالة أمد القتال، نظراً لأن الوصول إلى مناجم الماس والموارد القيمة الأخرى ساعد في تمويل أهدافهم العسكرية - والتي غالباً ما ترقى إلى الإبادة الجماعية - و كما أثرى المقاتلين أنفسهم. في حين أن جمهورية الكونغو الديمقراطية لم تتعرض للغزو مؤخراً من قبل القوات العسكرية المجاورة، إلا أن بعضاً من أغنى الرواسب المعدنية المتاخمة للمناطق التي لا يزال فيها التوتسي والهوتو يتصادمون بشكل متكرر، لا تزال الاضطرابات مستمرة على نطاق أصغر ولا يزال اللاجئون يفرون من اندلاع أعمال العنف.[60]
زود الكوبالت المستخرج من مساعي التعدين الحرفي الكونغولية الصغيرة في عام 2007 شركة صينية واحدة، كونغو دونگ فانگ العالمية للتعدين، وهي شركة تابعة لژىجيانگ هوايو كوبالت، أحد أكبر منتجي الكوبالت في العالم، قامت شركة كونگ دونگ فانگ بتوريد الكوبالت إلى بعض أكبر مصنعي البطاريات في العالم، الذين أنتجوا بطاريات للمنتجات في كل مكان مثل أپل ومنجاتها من أجهزة أيفون. نظراً لانتهاكات العمل المتهمين والمخاوف البيئية، قامت إل جي بعد ذلك بالتدقيق في شركة كونغو دونگ فانگ وفقاً لإرشادات منظمة التعاون والتنمية الاقتصادية. فرضت إل جي، التي تنتج أيضاً مواد البطاريات لشركات السيارات، قواعد سلوك على جميع الموردين الذين تقوم بفحصهم.[61]
قد يكون مشروع جبل موكوندو، الذي تديره شركة أفريقيا الوسطى للتعدين والاستكشاف (CAMEC) في محافظة كاتنگا، أغنى محمية للكوبالت في العالم. قد أنتجت ما يقدر بثلث إجمالي إنتاج الكوبالت العالمي في عام 2008.[62] في يوليو 2009، أعلنت CAMEC عن اتفاقية طويلة الأجل لتسليم كامل الإنتاج من مركز الكوبالت من جبل موكوندو إلى ژىجيانگ گاليكو كوبالت ونيكل ماتريالز الصينية.[63]
في فبراير 2018، حددت شركة إدارة الأصول العالمية ألاينسبرنشتين جمهورية الكونغو الديمقراطية بأنها مثل "المملكة العربية السعودية لعصر السيارات الكهربائية" من الناحية الاقتصادية، نظراً لمواردها من الكوبالت، باعتبارها ضرورية بطاريات الليثيوم-يون التي تقود السيارات الكهربائية.[64]
في 9 مارس 2018، حدّث الرئيس جوسف كابيلا قانون التعدين لعام 2002، وزاد رسوم الإتاوة وأعلن عن الكوبالت وكولتان بأنها "معادن إستراتيجية".[65][66]
وقد حُدِّث قانون التعدين لعام 2002 بشكل فعال في 4 ديسمبر 2018.[67]
في ديسمبر 2019، رفعت منظمة المدافعون عن الحقوق الدولية، وهي منظمة غير حكومية لحقوق الإنسان، قضية تاريخية ضد أپل، تسلا ودل ومايكروسوفت وجوجل شركة ألفابت "للاستفادة عن قصد من الاستخدام القاسي والوحشي للأطفال الصغار ومساعدتهم والتحريض عليهم "في تعدين الكوبالت.[68] وقد نفت الشركات المعنية مشاركتها في عمالة الأطفال.[69]
كندا
في عام 2017، كانت بعض شركات الاستكشاف تخطط لمسح مناجم الفضة والكوبالت القديمة في منطقة كوبالت، أونتاريو حيث يُعتقد أن هناك رواسب كبيرة.[70]
تعالج شيريت انترناشونال الكندية خامات الكوبالت في رواسب النيكل من مناجم موا في كوبا، وللجزيرة عدة مناجم أخرى في ماياري، كاماگوِيْ وپينار ديل ريو. الاستثمارات المستمرة من قبل شركة شيريت انترناشونال في إنتاج النيكل والكوبالت الكوبي مع الحصول على حقوق التعدين لمدة 17-20 عاماً جعلت الدولة الشيوعية في المرتبة الثالثة لاحتياطيات الكوبالت في عام 2019، قبل كندا نفسها.[71]
المغرب
 مقالة مفصلة: كوبالت المغرب
مقالة مفصلة: كوبالت المغرب
على الرغم من انخفاض أسعار الكوبالت، لا يزال الاهتمام كبيرًا بهذا المعدن، الذي يدخل مع الليثيوم والغرافيت والكوبالت ومواد أخرى في تصنيع البطاريات، بالإضافة إلى التفاؤل الحذر الذي يبديه المحللون بشأن إنتاج الكوبالت في السنوات المقبلة. وانخفض إنتاج الكوبالت المغربي من 2300 طن متري في عام 2019 إلى 1900 طن متري في عام 2020، حسبما نشر موقع إنفستينغ نيوز. وقد حظي الكوبالت المغربي باهتمام كبير بعد أن أعلنت عملاق تصنيع السيارات بي إم دبليو الألمانية أنها ستشتري الكوبالت مباشرة من المناجم في أستراليا والمغرب، للتأكد من أن مصدر المواد الخام للبطاريات هو مصدر موثوق. وحظي إنتاج البطاريات اهتمامًا خاصًا في المغرب، بالنظر إلى مكامن الكوبالت في البلاد، الذي يمثل المعدن النادر الضروري لإنتاج بطاريات أيونات الليثيوم أيون في السيارات الكهربائية.[72]
ويشتهر منجم بو عازر، الذي تملكه مجموعة مناجم المغربية للتعدين، وهي شركة خاصة مدرجة في بورصة الدار البيضاء وتمتلك العائلة المالكة أيضًا حصة فيها، بإنتاج معظم كميات الكوبالت في المغرب، ويقع في محافظة ورزازات الجنوبية، وينتج المنجم كاثود الكوبالت. ويقع المنجم -الذي اكتُشف عام 1928 عندما كان المغرب تحت سيطرة الاستعمار الفرنسي- على بعد 120 كيلومترًا جنوب مدينة ورزازات.
التطبيقات
في عام 2016، استُخدم 116000 طن من الكوبالت.[73] في إنتاج السبائك عالية الأداء.[40][41] يمكن استخدامه أيضاً في صنع بطاريات قابلة لإعادة الشحن، وربما يكون لظهور السيارات الكهربائية ونجاحها مع المستهلكين علاقة كبيرة بالإنتاج المرتفع لجمهورية الكونغو الديمقراطية.[citation needed] من العوامل المهمة الأخرى قانون التعدين لعام 2002، الذي شجع الاستثمار من قبل الشركات الأجنبية وعبر الوطنية مثل گلنكور، ونهاية حربي الكونغو الأولى والثانية.[citation needed]
السبائك
تاريخياً، استهلكت السبائك الفائقة التي أساسها الكوبالت معظم الكوبالت المنتج.[40][41] حيث يجعل استقرار درجة الحرارة لهذه السبائك مناسبة لريش التوربينات للعنفات الغازية والمحركات النفاثة للطائرات، على الرغم من أن سبائك النيكل أحادية البلورة تفوقها في الأداء.[74]السبائك التي أساسها الكوبالت هي أيضاً مقاومة للتآكل والاهتراء، مما يجعلها، مثل التيتانيوم، مفيدة في صنع الغرسات التي لا تبلى بمرور الزمن. فقد بدأ تطوير سبائك الكوبالت المقاومة للاهتراء في العقد الأول من القرن العشرين باستخدام سبائك الستالايت التي تحتوي على الكروم بكميات متفاوتة من التنگستن والكربون. تستخدم السبائك التي تحتوي على الكروم وكربيدات التنگستن شديدة الصلابة والمقاومة للتآكل.[75]والكوبالت والكروم الخاص - كالمولبدنم مثل الڤيتاليوم للأجزاء الاصطناعية (استبدال مفصل الورك والركبة).[76] وتستخدم سبائك الكوبالت أيضاً في الأطراف الصناعية كتركيبات الأسنان كبديل مفيد للنيكل، الذي قد يكون مسبباً للحساسية.[77] يحتوي بعض الفولاذ عالي السرعة أيضاً على الكوبالت لزيادة الحرارة ومقاومة التآكل. تُستخدم السبائك الخاصة من الألومنيوم والنيكل والكوبالت والحديد، والمعروفة باسم النيكو، والسماريوم والكوبالت (مغناطيس السماريوم - الكوبالت) في المغناطيس الدائم.[78] كما أنه مخلوط بنسبة 95٪ پلاتين للمجوهرات، مما ينتج عنه سبيكة مناسبة للصب الدقيق، وهي ذات مغناطيسية قليلة أيضاً.[79]
البطاريات
يستخدم أكسيد الكوبالت الليثيوم (LiCoO2) على نطاق واسع في كاثودات بطارية ليثيوم-أيون. تتكون المادة من طبقات أكسيد الكوبالت مع الليثيوم [[إقحام (كيمياء) | مقحم]ة]. أثناء التفريغ (أي عندما لا يتم شحنه بفعالية)، يتم تحرير الليثيوم كأيونات الليثيوم.[80] نيكل-كادميوم[81] (NiCd) و هيدريد معدن النيكل[82] تشتمل بطاريات (NiMH) أيضاً على الكوبالت لتحسين أكسدة النيكل في البطارية.[81] فقد قدرت أبحاث سوق الشفافية سوق بطاريات الليثيوم-أيون العالمية بنحو 30 مليار دولار في عام 2015 وتوقعت زيادة إلى أكثر من 75 مليار دولار بحلول عام 2024.[83]
على الرغم من استخدام معظم الكوبالت في البطاريات في عام 2018 في الأجهزة المحمولة،[84] ويوجد تطبيق أحدث للكوبالت هو البطاريات القابلة لإعادة الشحن للسيارات الكهربائية. فقد زادت هذه الصناعة خمسة أضعاف في طلبها على الكوبالت، مما يجعل إيجاد مواد خام جديدة في مناطق أكثر استقراراً في العالم أمراً ملحاً.[85] ومن المتوقع أن يستمر الطلب أو يزداد مع زيادة انتشار السيارات الكهربائية.[86]شمل الاستكشاف في عام 2016-2017 المنطقة المحيطة بـ كوبالت، أونتاريو، وهي منطقة توقفت فيها العديد من مناجم الفضة منذ عقود.[85] فقد زاد الكوبالت في السيارات الكهربائية بنسبة 81٪ مقارنة بالنصف الأول من عام 2018 إلى 7200 طن في النصف الأول من عام 2019، لبطارية سعة46.3 GWh.[87][88] قد يعتمد مستقبل السيارات الكهربائية على التعدين في أعماق البحار، لأن الكوبالت وفير في الصخور في قاع البحر.[89]
منذ أن تم الإبلاغ مراراً وتكراراً عن عمالة الأطفال والسخرة في تعدين الكوبالت، ولا سيما في المناجم الحرفية في جمهورية الكونغو الديمقراطية، واجهت شركات التكنولوجيا التي تبحث عن سلسلة توريد أخلاقية نقصاً في هذه المواد الخام و[90] وصل سعر معدن الكوبالت إلى أعلى مستوى في تسع سنوات في أكتوبر 2017، بأكثر من 30 دولاراً أمريكياً للرطل، مقابل 10 دولارات أمريكية في أواخر عام 2015.[91]بعد زيادة العرض، انخفض السعر إلى 15 دولاراً عادياً في عام 2019.[92][93] وكرد فعل على المشكلات المتعلقة بتعدين الكوبالت الحرفي في جمهورية الكونغو الديمقراطية، قام عدد من موردي الكوبالت وعملائهم بتشكيل تحالف الكوبالت العادل (FCA) الذي يهدف إلى إنهاء استخدام عمالة الأطفال وتحسين ظروف عمل تعدين الكوبالت ومعالجته في جمهورية الكونغو الديمقراطية. يشمل أعضاء FCA ژىجيانگ هوايو كوبالت وسونو موتورز و "Responsible Cobalt Initiative" وفاير فون وگلنكور وشركة تسلا[94][95]
يجري الاتحاد الأوروبي بحثاً حول إمكانية التخلص من متطلبات الكوبالت في إنتاج بطاريات الليثيوم-أيون.[96][97]اعتباراً من أغسطس 2020، خفض صانعو البطاريات تدريجياً محتوى الكاثود من الكوبالت من 1/3 ( NMC 111) إلى 2/10 (NMC 442) إلى 1/10 حالياً (NMC 811) وكما قاموا بإدخال كاثود LFP الخالي من الكوبالت في حزم بطاريات LFP للسيارات الكهربائية مثل طراز تسلا 3.[98][99] في سبتمبر 2020، حددت تسلا خططها لصنع خلايا بطاريات خاصة بها خالية من الكوبالت.[100]
المحفزات
العديد من مركبات الكوبالت هي محفزات أكسدة. تُستخدم أسيتات الكوبالت لتحويل زايلين إلى حمض الترفتاليك، سوابق البوليمر پولي إيثيلين تيرفتالات السائب. المحفزات النموذجية هي كربوكسيلات الكوبالت (المعروف باسم صابون الكوبالت). كما تُستخدم أيضاً في الدهانات الورنيش والأحبار "كعوامل تجفيف" من خلال أكسدة زيوت التجفيف.[101][80]تُستخدم الكربوكسيلات نفسها لتحسين الالتصاق بين الفولاذ والمطاط في الإطارات الشعاعية ذات الأحزمة الفولاذية. بالإضافة إلى أنها تستخدم كمسرعات في أنظمة راتنجات پوليإستر.[102][103][104]
تُستخدم المحفزات التي أساسها الكوبالت في التفاعلات التي تشتمل على أول أكسيد الكربون. يعتبر الكوبالت أيضاً عاملاً مساعداً في عملية فيشر-تروپش من أجل هدرجة أول أكسيد الكربون إلى وقود سائل.[105] غالباً ما يستخدم تخليق اوكسو من ألكين أوكتاكربونيل الكوبالت كعامل مساعد،[106]على الرغم من أنه غالباً ما يتم استبداله بمحفزات أكثر كفاءة قائمة على الإيريديوم والروديوم، على سبيل المثال عملية كاتيڤا.[citation needed]
يستخدم نزع الكبريت بالهيدروجين من البترول محفزاً مشتقاً من الكوبالت والموليبدينوم. تساعد هذه العملية على تنظيف البترول من شوائب الكبريت التي تتداخل مع تكرير الوقود السائل.[80]
الأصباغ والتلوين
قبل القرن التاسع عشر، استُخدم الكوبالت في الغالب كصبغة. فقد استُخدم منذ العصور الوسطى لصنع زجاج أزرق اللون أي مصقول باللون الأزرق. يتم إنتاج الإسملت صبغ أزرق عن طريق إذابة خليط من المعادن المحمصة سمالتيت والمرو وكربونات الپوتاسيوم، مما ينتج عنه زجاج سيليكات أزرق داكن، والذي يتم طحنه جيداً بعد الإنتاج.[107] استُخدم السمالت على نطاق واسع لتلوين الزجاج وكصبغة للرسم.[108] في عام 1780، اكتشف سڤين رينمان الكوبالت الأخضر، وفي عام 1802 اكتشف لويس جاك ثينارد الكوبالت الأزرق.[109] أصباغ الكوبالت مثل أزرق كوبالت (كوبالت ألومينات)، سيرولين أزرق (كوبالت (II) ستانات)، درجات مختلفة من كوبالت أخضر (خليط من أكسيد الكوبالت (II) وأكسيد الزنك)، وتستخدم الكوبالت البنفسجي (فوسفات الكوبالت) كأصباغ للرسامين بسبب ثباتها اللوني الفائق.[110][111]وقد استُبدل أوريولين (أصفر كوبالت) الآن إلى حد كبير بصبغات صفراء أكثر ثباتاً [مطلوب توضيح].[citation needed]
النظائر المشعة
يعتبر كوبالت-60 (Co-60 أو 60Co) مفيداً كمصدر لأشعة جاما لأنه يمكن إنتاجه بكميات يمكن التنبؤ بها بفعالية عالية بقذف الكوبالت بالنيوترونات. تنتج آشعة گاما طاقات تبلغ 1.17 و1.33 MeV.[112][113]
يستخدم الكوبالت في العلاج الإشعاعي بالأشعة الخارجية، وتعقيم الإمدادات الطبية والنفايات الطبية، والعلاج الإشعاعي لتعقيم الأطعمة (البسترة الباردة)،[114] التصوير الشعاعي الصناعي (مثل الصور الشعاعية لسلامة اللحام) وقياسات الكثافة (مثل قياسات كثافة الخرسانة) ومفاتيح ارتفاع ملء الخزان. يمتلك المعدن خاصية مؤسفة تتمثل في إنتاج غبار ناعم، مما يسبب مشاكل في الحماية من الإشعاع. كان الكوبالت من آلات العلاج الإشعاعي يشكل خطراً عندما لا يتم التخلص منه بشكل صحيح، وحدث أحد أسوأ حوادث التلوث الإشعاعي في أمريكا الشمالية في عام 1984، عندما تم تفكيك وحدة العلاج الإشعاعي المهملة التي تحتوي على الكوبالت-60 عن طريق الخطأ في ساحة للخردة في خواريز، المكسيك.[115][116]
للكوبالت-60 عمر نصف إشعاعي 5.27 سنة. يتطلب فقدان الفاعلية الاستبدال الدوري للمصدر في العلاج الإشعاعي وهو أحد أسباب استبدال آلات الكوبالت إلى حد كبير بالمسرعات الخطية في العلاج الإشعاعي الحديث.[117] كوبالت-57 (Co-57 or 57Co) هو أحد النظائر المشعة للكوبالت الذي يستخدم غالباً في الفحوصات الطبية، كعلامة إشعاعية لامتصاص فيتامين Bقالب:Ssub واختبار شيلينگ. يُستخدم الكوبالت-57 كمصدر في مطيافية موسباور وهو أحد المصادر العديدة المحتملة في أجهزة فلورية الأشعة السينية.[118][119]
يمكن أن تتضمن تصميمات الأسلحة النووية دمج 59Co، سيتم تنشيط بعضها في انفجار نووي لإنتاج 60Co. يُطلق على 60Co المتناثرة باسم التهاطل النووي أحياناً باسم قنبلة الكوبالت.[120]
استخدامات أخرى
- يستخدم الكوبالت في الطلاء الكهربائي لمظهره الجذاب وصلابته ومقاومته الأكسدة.[122]
- كما أنه يستخدم كطبقة أساس أولية لمينا الپورسلين.[123]
الدور الحيوي
الكوبالت ضروري لعملية التمثيل الغذائي لجميع الحيوانات. وهو مكون رئيسي للكوبالامين، المعروف أيضاً باسم فيتامين B12، المستودع البيولوجي الأساسي للكوبالت باعتباره عنصر فائق السرعة.[124][125]تقوم الجراثيم في معدة المجترات بتحويل أملاح الكوبالت إلى فيتامين B12، وهو مركب لا يمكن إنتاجه إلا عن طريق البكتيريا أو العتائق. لذلك فإن وجود حد أدنى من الكوبالت في التربة يحسن بشكل ملحوظ من صحة الحيوانات الراعية، ويوصى بتناول 0.20 mg/kg يومياً لأنه لا يحتوي على مصدر آخر لفيتامين B12.[126]
تستخدم البروتينات القائمة على الكوبالامين كورين للاحتفاظ بالكوبالت. يتميز الإنزيم المساعد B12 برابطة C-Co التفاعلية التي تشارك في التفاعلات.[127] لدى البشر، B12 نوعان من ربيطة ألكيل: ميثيل ويعزز MeB12 عمليات نقل مجموعة الميثيل (−CH3). تحفز نسخة الأدينوزيل من B12 عمليات إعادة الترتيب التي يتم فيها نقل ذرة الهيدروجين مباشرة بين ذرتين متجاورتين مع التبادل المصاحب للمادة البديلة الثانية، X، والتي قد تكون ذرة كربون مع البدائل، ذرة أكسجين من كحول أو أمين. يحول Methylmalonyl coenzyme A mutase (MUT) MMl-CoA إلى Su-CoA، وهي خطوة مهمة في استخراج الطاقة من البروتينات والدهون.[128]
على الرغم من أنه أقل شيوعاً من أنواع البروتين المعدني الأخرى (مثل تلك الموجودة في الزنك والحديد)، فإن البروتينات الكوبالتوبروتينات الأخرى معروفة إلى جانب B12. تشمل هذه البروتينات ميثيونين أمينوببتيداز 2، وهو إنزيم يحدث في البشر والثدييات الأخرى الذي لا يستخدم حلقة كورين لـ B12، ولكنه يربط الكوبالت مباشرة. إنزيم الكوبالت الآخر غير الكوري هو هيدرات النتريل، وهو إنزيم في البكتيريا يقوم باستقلاب النتريل.[129]
نقص الكوبالت
عند البشر، يلبي استهلاك فيتامين B12 المحتوي على الكوبالت جميع احتياجات الكوبالت. بالنسبة للماشية والأغنام، التي تلبي احتياجات فيتامين B12 عن طريق التوليف بواسطة البكتيريا المقيمة في الكرش، هناك وظيفة للكوبالت غير العضوي. في أوائل القرن العشرين، أثناء تطوير الزراعة في الهضبة البركانية الشمالية للجزيرة في نيوزيلندا، عانت الماشية مما أطلق عليه "مرض الأدغال". تم اكتشاف أن التربة البركانية تفتقر إلى أملاح الكوبالت الضرورية لسلسلة غذاء الماشية.[130][131]وُجد أن "مرض الساحل" الذي يصيب الأغنام في صحراء تسعين ميل من جنوب شرق جنوب أستراليا في ثلاثينيات القرن الماضي نشأ عن نقص غذائي للعناصر النزرة الكوبالت والنحاس. تم التغلب على نقص الكوبالت من خلال تطوير "طلقات الكوبالت"، وهي حبيبات كثيفة من أكسيد الكوبالت ممزوج بالطين يُعطى عن طريق الفم لاستقراره في كرش الحيوان.[مطلوب توضيح][132][131][133]
قضايا صحية
| المخاطر | |
|---|---|
| ن.م.ع. مخطط تصويري |  
|
| ن.م.ع. كلمة الاشارة | Danger |
| H302, H317, H319, H334, H341, H350, H360F, H412 | |
| P273, P280, P301+P312, P302+P352, P305+P351+P338, P308+P313 | |
| NFPA 704 (معيـَّن النار) | |
قُدرت قيمة [[جرعة مميتة للنصف | LLD50] لأملاح الكوبالت القابلة للذوبان بين 150 و500 ملجم/كجم.[135] في الولايات المتحدة، حددت إدارة السلامة والصحة المهنية (OSHA) حد التعرض المسموح به (PEL) في مكان العمل كمتوسط مرجح زمنياً (TWA) يبلغ 0.1 mg/m3. قام المعهد الوطني للسلامة والصحة المهنية (NIOSH) بتعيين حد التعرض الموصى به (REL) من 0.05 mg/m3، المتوسط المرجح بالزمن. قيمة IDLH (التي تشكل خطراً مباشراً على الحياة والصحة) هي 20 mg/m3.[136]
ومع ذلك، فقد تسبب تناول الكوبالت المزمن في مشاكل صحية خطيرة عند تناول جرعات أقل بكثير من الجرعة المميتة. في عام 1966، أدت إضافة مركبات الكوبالت لتثبيت رغوة البيرة في كندا إلى ظهور شكل غريب من اعتلال عضلة القلب الناجم عن السموم، والذي أصبح يُعرف باسم "اعتلال عضلة القلب لشارب البيرة".[137][138]
علاوة على ذلك، يُشتبه في أن معدن الكوبالت يسبب السرطان (على سبيل المثال، من المحتمل أن تكون مسببة للسرطان IC ،IARC Group 2B) وفقاً لأبحاث الوكالة الدولية لأبحاث السرطان (IARC). [PDF]
يسبب الكوبالت مشاكل في الجهاز التنفسي عند استنشاقه.[139] كما أنه يسبب مشاكل جلدية عند لمسه; بعد النيكل والكروم، يعتبر الكوبالت سبباً رئيسياً لالتهاب الجلد التماسي.[140]حيث يواجه عمال مناجم الكوبالت هذه المخاطر.[citation needed]
انظر أيضاً
- كولتان
- Conflict mineral
- Economy of the Democratic Republic of the Congo
- صناعة التعدين في جمهورية الكونغو الديمقراطية
المصادر
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. pp. 1117–1119. ISBN 978-0-08-037941-8.
- ^ Oxford English Dictionary, 2nd Edition 1989.
- ^ Meija, J.; Coplen, T. B. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". Pure and Applied Chemistry. 88 (3): 265–91. doi:10.1515/pac-2015-0305.
{{cite journal}}: Unknown parameter|displayauthors=ignored (|display-authors=suggested) (help) - ^ Nuclides and Isotopes: Chart of the Nuclides, 16th Edition, by Edward Baum, Harold Knox, and Thomas Miller; Knolls Atomic Power Laboratory; 2002
- ^ Cobalt, Encyclopædia Britannica Online.
- ^ Pulak, Cemal (1998). "The Uluburun shipwreck: an overview". International Journal of Nautical Archaeology. 27 (3): 188–224. doi:10.1111/j.1095-9270.1998.tb00803.x.
- ^ Henderson, Julian (2000). "Glass". The Science and Archaeology of Materials: An Investigation of Inorganic Materials. Routledge. p. 60. ISBN 978-0-415-19933-9.
- ^ Rehren, Th. (2003). "Aspects of the Production of Cobalt-blue Glass in Egypt". Archaeometry. 43 (4): 483–489. doi:10.1111/1475-4754.00031.
- ^ Lucas, A. (2003). Ancient Egyptian Materials and Industries. Kessinger Publishing. p. 217. ISBN 978-0-7661-5141-3.
- ^ أ ب Dennis, W. H (2010). "Cobalt". Metallurgy: 1863–1963. pp. 254–256. ISBN 978-0-202-36361-5.
- ^ Georg Brandt first showed cobalt to be a new metal in: G. Brandt (1735) "Dissertatio de semimetallis" (Dissertation on semi-metals), Acta Literaria et Scientiarum Sveciae (Journal of Swedish literature and sciences), vol. 4, pages 1–10.
See also: (1) G. Brandt (1746) "Rön och anmärkningar angäende en synnerlig färg — cobolt" (Observations and remarks concerning an extraordinary pigment — cobalt), Kongliga Svenska vetenskapsakademiens handlingar (Transactions of the Royal Swedish Academy of Science), vol. 7, pp. 119–130; (2) G. Brandt (1748) "Cobalti nova species examinata et descripta" (Cobalt, a new element examined and described), Acta Regiae Societatis Scientiarum Upsaliensis (Journal of the Royal Scientific Society of Uppsala), 1st series, vol. 3, pp. 33–41; (3) James L. Marshall and Virginia R. Marshall (Spring 2003) "Rediscovery of the Elements: Riddarhyttan, Sweden". The Hexagon (official journal of the Alpha Chi Sigma fraternity of chemists), vol. 94, no. 1, pages 3–8. - ^ Wang, Shijie (2006). "Cobalt—Its recovery, recycling, and application". Journal of the Minerals, Metals and Materials Society. 58 (10): 47–50. Bibcode:2006JOM....58j..47W. doi:10.1007/s11837-006-0201-y.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. III. Some eighteenth-century metals". Journal of Chemical Education. 9: 22. Bibcode:1932JChEd...9...22W. doi:10.1021/ed009p22.
- ^ Ramberg, Ivar B. (2008). The making of a land: geology of Norway. Geological Society. pp. 98–. ISBN 978-82-92394-42-7. Retrieved 2011-04-30.
- ^ Cyclopaedia (1852). C. Tomlinson. 9 divs (ed.). Cyclopædia of useful arts & manufactures. pp. 400–. Retrieved 2011-04-30.
{{cite book}}: CS1 maint: numeric names: editors list (link) - ^ أ ب Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". United States Geological Survey.
- ^ أ ب Westing, Arthur H; Stockholm International Peace Research Institute (1986). "cobalt". Global resources and international conflict: environmental factors in strategic policy and action. pp. 75–78. ISBN 978-0-19-829104-6.
- ^ Livingood, J.; Seaborg, Glenn T. (1938). "Long-Lived Radio Cobalt Isotopes". Physical Review. 53 (10): 847–848. Bibcode:1938PhRv...53..847L. doi:10.1103/PhysRev.53.847.
- ^ Wu, C. S. (1957). "Experimental Test of Parity Conservation in Beta Decay". Physical Review. 105 (4): 1413–1415. Bibcode:1957PhRv..105.1413W. doi:10.1103/PhysRev.105.1413.
- ^ Wróblewski, A. K. (2008). "The Downfall of Parity – the Revolution That Happened Fifty Years Ago" (PDF). Acta Physica Polonica B. 39 (2): 251. Bibcode:2008AcPPB..39..251W.
- ^ "Richest Hole In The Mountain" Popular Mechanics, May 1952, pp. 65–69.
- ^ Ptitsyn, D. A.; Chechetkin, V. M. (1980). "Creation of the Iron-Group Elements in a Supernova Explosion". Soviet Astronomy Letters. 6: 61–64. Bibcode:1980SvAL....6...61P.
- ^ Nuccio, Pasquale Mario and Valenza, Mariano (1979). "Determination of metallic iron, nickel and cobalt in meteorites" (PDF). Rendiconti Societa Italiana di Mineralogia e Petrografia. 35 (1): 355–360.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةHollemanAF - ^ Kerr, Paul F. (1945). "Cattierite and Vaesite: New Co-Ni Minerals from the Belgian Kongo" (PDF). American Mineralogist. 30: 483–492.
- ^ Buckley, A. N. (1987). "The Surface Oxidation of Cobaltite". Australian Journal of Chemistry. 40 (2): 231. doi:10.1071/CH9870231.
- ^ Young, R. (1957). "The geochemistry of cobalt". Geochimica et Cosmochimica Acta. 13 (1): 28–41. Bibcode:1957GeCoA..13...28Y. doi:10.1016/0016-7037(57)90056-X.
- ^ Talhout, Reinskje; Schulz, Thomas; Florek, Ewa; Van Benthem, Jan; Wester, Piet; Opperhuizen, Antoon (2011). "Hazardous Compounds in Tobacco Smok". International Journal of Environmental Research and Public Health. 8 (12): 613–628. doi:10.3390/ijerph8020613. ISSN 1660-4601. PMC 3084482. PMID 21556207.
- ^ Pourkhabbaz, A; Pourkhabbaz, H (2012). "Investigation of Toxic Metals in the Tobacco of Different Iranian Cigarette Brands and Related Health Issues". Iranian Journal of Basic Medical Sciences. 15 (1): 636–644. PMC 3586865. PMID 23493960.
- ^ Bundy, Randelle M.; Tagliabue, Alessandro; Hawco, Nicholas J.; Morton, Peter L.; Twining, Benjamin S.; Hatta, Mariko; Noble, Abigail E.; Cape, Mattias R.; John, Seth G.; Cullen, Jay T.; Saito, Mak A. (1 October 2020). "Elevated sources of cobalt in the Arctic Ocean". Biogeosciences. 17 (19): 4745–4767. Bibcode:2020BGeo...17.4745B. doi:10.5194/bg-17-4745-2020. Retrieved 24 November 2020.
- ^ Noble, Abigail E.; Lamborg, Carl H.; Ohnemus, Dan C.; Lam, Phoebe J.; Goepfert, Tyler J.; Measures, Chris I.; Frame, Caitlin H.; Casciotti, Karen L.; DiTullio, Giacomo R.; Jennings, Joe; Saito, Mak A. (2012). "Basin-scale inputs of cobalt, iron, and manganese from the Benguela-Angola front to the South Atlantic Ocean". Limnology and Oceanography (in الإنجليزية). 57 (4): 989–1010. Bibcode:2012LimOc..57..989N. doi:10.4319/lo.2012.57.4.0989. ISSN 1939-5590.
- ^ Cutter, Gregory A.; Bruland, Kenneth W. (2012). "Rapid and noncontaminating sampling system for trace elements in global ocean surveys". Limnology and Oceanography: Methods. 10 (6): 425–436. doi:10.4319/lom.2012.10.425.
- ^ Bruland, K. W.; Lohan, M. C. (1 December 2003). "Controls of Trace Metals in Seawater". Treatise on Geochemistry. 6: 23–47. Bibcode:2003TrGeo...6...23B. doi:10.1016/B0-08-043751-6/06105-3. ISBN 978-0-08-043751-4.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). "On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic". Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS....74....1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ International Seabed Authority. "Cobalt-Rich Crusts" (PDF). isa.org. International Seabed Authority. Retrieved 30 December 2020.
- ^ US Department of Commerce, National Oceanic and Atmospheric Administration. "DeepCCZ: Deep-sea Mining Interests in the Clarion-Clipperton Zone: NOAA Office of Ocean Exploration and Research". oceanexplorer.noaa.gov (in الإنجليزية الأمريكية). National Oceanic and Atmospheric Administration. Retrieved 30 December 2020.
- ^ Hawco, Nicholas J.; McIlvin, Matthew M.; Bundy, Randelle M.; Tagliabue, Alessandro; Goepfert, Tyler J.; Moran, Dawn M.; Valentin-Alvarado, Luis; DiTullio, Giacomo R.; Saito, Mak A. (7 July 2020). "Minimal cobalt metabolism in the marine cyanobacterium Prochlorococcus". Proceedings of the National Academy of Sciences. 117 (27): 15740–15747. Bibcode:2020PNAS..11715740H. doi:10.1073/pnas.2001393117. PMC 7354930. PMID 32576688.
- ^ Lass, Hans Ulrich; Mohrholz, Volker (November 2008). "On the interaction between the subtropical gyre and the Subtropical Cell on the shelf of the SE Atlantic". Journal of Marine Systems. 74 (1–2): 1–43. Bibcode:2008JMS....74....1L. doi:10.1016/j.jmarsys.2007.09.008.
- ^ Karthikeyan, Panneerselvam; Marigoudar, Shambanagouda Rudragouda; Nagarjuna, Avula; Sharma, K. Venkatarama (2019). "Toxicity assessment of cobalt and selenium on marine diatoms and copepods". Environmental Chemistry and Ecotoxicology. 1: 36–42. doi:10.1016/j.enceco.2019.06.001.
- ^ أ ب ت Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ أ ب ت Shedd, Kim B. "Commodity Report 2008: Cobalt" (PDF). United States Geological Survey. Retrieved 2008-10-26.
- ^ أ ب Henry Sanderson (March 14, 2017). "Cobalt's meteoric rise at risk from Congo's Katanga". Financial Times.
- ^ Cobalt Statistics and Information, U.S. Geological Survey, 2018, https://minerals.usgs.gov/minerals/pubs/commodity/cobalt/mcs-2018-cobal.pdf
- ^ Murray W. Hitzman, Arthur A. Bookstrom, John F. Slack, and Michael L. Zientek (2017). "Cobalt—Styles of Deposits and the Search for Primary Deposits". USGS. Retrieved 17 April 2021.
- ^ "Cobalt price: BMW avoids the Congo conundrum – for now". Mining.com. Retrieved 17 April 2021.
- ^ Davis, Joseph R. (2000). ASM specialty handbook: nickel, cobalt, and their alloys. ASM International. p. 347. ISBN 0-87170-685-7.
- ^ "Cobalt" (PDF). United States Geological Survey, Mineral Commodity Summaries. January 2016. pp. 52–53.
- ^ Thomas Wilson (October 26, 2017). "We'll All Be Relying on Congo to Power Our Electric Cars".
- ^ "Glencore's cobalt stock overhang contains prices despite mine suspension". Reuters (in الإنجليزية). 8 August 2019.
- ^ "Glencore closes Mutanda mine, 20% of global cobalt supply comes offline". Benchmark Mineral Intelligence. 28 November 2019.
the mine would be placed on care and maintenance for a period of no less than two years
- ^ "African Mineral Production" (PDF). British Geological Survey. Retrieved 2009-06-06.
- ^ أ ب Frankel, Todd C. (2016-09-30). "Cobalt mining for lithium ion batteries has a high human cost". The Washington Post. Retrieved 2016-10-18.
- ^ Mucha, Lena; Sadof, Karly Domb; Frankel, Todd C. (2018-02-28). "Perspective - The hidden costs of cobalt mining". The Washington Post (in الإنجليزية الأمريكية). ISSN 0190-8286. Retrieved 2018-03-07.
- ^ Todd C. Frankel (September 30, 2016). "THE COBALT PIPELINE: Tracing the path from deadly hand-dug mines in Congo to consumers' phones and laptops". The Washington Post.
- ^ Crawford, Alex. Meet Dorsen, 8, who mines cobalt to make your smartphone work. Sky News UK. Retrieved on 2018-01-07.
- ^ Are you holding a product of child labour right now? (Video). Sky News UK (2017-02-28). Retrieved on 2018-01-07.
- ^ Child labour behind smart phone and electric car batteries. Amnesty International (2016-01-19). Retrieved on 2018-01-07.
- ^ Reisinger, Don. (2017-03-03) Child Labor Revelation Prompts Apple to Make Supplier Policy Change. Fortune. Retrieved on 2018-01-07.
- ^ Frankel, Todd C. (2017-03-03) Apple cracks down further on cobalt supplier in Congo as child labor persists. The Washington Post. Retrieved on 2018-01-07.
- ^ Wellmer, Friedrich-Wilhelm; Becker-Platen, Jens Dieter. "Global Nonfuel Mineral Resources and Sustainability". Retrieved 2009-05-16.
- ^ Audit Report on Congo Dongfang International Mining sarl. DNV-GL Retrieved 18 April 2021.
- ^ "CAMEC – The Cobalt Champion" (PDF). International Mining. July 2008. Retrieved 2011-11-18.
- ^ Amy Witherden (6 July 2009). "Daily podcast – July 6, 2009". Mining weekly. Retrieved 2011-11-15.
- ^ Mining Journal "The [Ivanhoe] pullback investors have been waiting for", Aspermont Ltd., London, UK, February 22, 2018. Retrieved November 21, 2018.
- ^ Shabalala, Zandi "Cobalt to be declared a strategic mineral in Congo", Reuters, March 14, 2018. Retrieved October 3, 2018.]
- ^ Reuters "Congo's Kabila signs into law new mining code", March 14, 2018. Retrieved October 3, 2018.]
- ^ [1] "DRC declares cobalt 'strategic'", Mining Journal, December 4, 2018. Retrieved October 7, 2020.]
- ^ "U.S. cobalt lawsuit puts spotlight on 'sustainable' tech". Sustainability Times (in الإنجليزية البريطانية). 2019-12-17. Retrieved 2020-09-16.
- ^ "Apple, Google Fight Blame For Child Labor In Cobalt Mines - Law360". www.law360.com (in الإنجليزية). Retrieved 2020-09-16.
- ^ The Canadian Ghost Town That Tesla Is Bringing Back to Life. Bloomberg (2017-10-31). Retrieved on 2018-01-07.
- ^ "Cubas Nickel Production Exceeds 50000 metric tons". Cuba Business Report. Retrieved 18 April 2021.
- ^ نوار صبح (2021-11-11). "الكوبالت المغربي.. سوق واعدة لتغذية سوق السيارات الكهربائية عالميًا". attaqa.net.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةBochove - ^ Donachie, Matthew J. (2002). Superalloys: A Technical Guide. ASM International. ISBN 978-0-87170-749-9.
- ^ Campbell, Flake C (2008-06-30). "Cobalt and Cobalt Alloys". Elements of metallurgy and engineering alloys. pp. 557–558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). "Systemic effects of implanted prostheses made of cobalt-chromium alloys". Archives of Orthopaedic and Trauma Surgery. 110 (2): 61–74. doi:10.1007/BF00393876. PMID 2015136. S2CID 28903564.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. p. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). "Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles". Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP....28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application". Platinum Metals Review. 49: 2–15. doi:10.1595/147106705X24409.
- ^ أ ب ت Hawkins, M. (2001). "Why we need cobalt". Applied Earth Science. 110 (2): 66–71. doi:10.1179/aes.2001.110.2.66. S2CID 137529349.
- ^ أ ب Armstrong, R. D.; Briggs, G. W. D.; Charles, E. A. (1988). "Some effects of the addition of cobalt to the nickel hydroxide electrode". Journal of Applied Electrochemistry. 18 (2): 215–219. doi:10.1007/BF01009266. S2CID 97073898.
- ^ Zhang, P.; Yokoyama, Toshiro; Itabashi, Osamu; Wakui, Yoshito; Suzuki, Toshishige M.; Inoue, Katsutoshi (1999). "Recovery of metal values from spent nickel–metal hydride rechargeable batteries". Journal of Power Sources. 77 (2): 116–122. Bibcode:1999JPS....77..116Z. doi:10.1016/S0378-7753(98)00182-7.
- ^ Carmakers' electric dreams depend on supplies of rare minerals. The Guardian (2017-07-29). Retrieved on 2018-01-07.
- ^ Castellano, Robert (2017-10-13) How To Minimize Tesla's Cobalt Supply Chain Risk. Seeking Alpha.
- ^ أ ب "As Cobalt Supply Tightens, LiCo Energy Metals Announces Two New Cobalt Mines". cleantechnica.com. 2017-11-28. Retrieved 2018-01-07.
- ^ Shilling, Erik (2017-10-31) We May Not Have Enough Minerals To Even Meet Electric Car Demand. jalopnik.com
- ^ "State of Charge: EVs, Batteries and Battery Materials (Free Report from @AdamasIntel)". Adamas Intelligence. 20 September 2019. Archived from the original on 20 October 2019. Retrieved 20 October 2019.
- ^ "Muskmobiles running rivals off the road". MINING.COM. 26 September 2019. Archived from the original on 2019-09-30.
- ^ "Electric car future may depend on deep sea mining". BBC News. 13 November 2019.
- ^ Hermes, Jennifer. (2017-05-31) Tesla & GE Face Major Shortage Of Ethically Sourced Cobalt. Environmentalleader.com. Retrieved on 2018-01-07.
- ^ Electric cars yet to turn cobalt market into gold mine – Nornickel. MINING.com (2017-10-30). Retrieved on 2018-01-07.
- ^ "Why Have Cobalt Prices Crashed". International Banker. 31 July 2019. Archived from the original on 2019-11-30.
- ^ "Cobalt Prices and Cobalt Price Charts - InvestmentMine". www.infomine.com.
- ^ "Tesla joins "Fair Cobalt Alliance" to improve DRC artisanal mining". mining-technology.com. 2020-09-08. Retrieved 2020-09-26.
- ^ Klender, Joey (2020-09-08). "Tesla joins Fair Cobalt Alliance in support of moral mining efforts". teslarati.com. Retrieved 2020-09-26.
- ^ CObalt-free Batteries for FutuRe Automotive Applications website
- ^ COBRA project at European Union
- ^ Yoo-chul, Kim (2020-08-14). "Tesla's battery strategy, implications for LG and Samsung". koreatimes.co.kr. Retrieved 2020-09-26.
- ^ Shahan, Zachary (2020-08-31). "Lithium & Nickel & Tesla, Oh My!". cleantechnica.com. Retrieved 2020-09-26.
- ^ Calma, Justine (2020-09-22). "Tesla to make EV battery cathodes without cobalt". theverge.com. Retrieved 2020-09-26.
- ^ "Cobalt Drier for Paints | Cobalt Cem-All®". Borchers (in الإنجليزية الأمريكية). Retrieved 2021-05-15.
- ^ Weatherhead, R. G. (1980), Weatherhead, R. G., ed. (in en), Catalysts, Accelerators and Inhibitors for Unsaturated Polyester Resins, Dordrecht: Springer Netherlands, pp. 204–239, doi:, ISBN 978-94-009-8721-0, https://doi.org/10.1007/978-94-009-8721-0_10, retrieved on 2021-05-15
- ^ "The product selector | AOC". aocresins.com (in الإنجليزية). Retrieved 2021-05-15.
- ^ "Comar Chemicals - Polyester Acceleration". www.comarchemicals.com. Retrieved 2021-05-15.
- ^ Khodakov, Andrei Y.; Chu, Wei & Fongarland, Pascal (2007). "Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels". Chemical Reviews. 107 (5): 1692–1744. doi:10.1021/cr050972v. PMID 17488058.
- ^ Hebrard, Frédéric & Kalck, Philippe (2009). "Cobalt-Catalyzed Hydroformylation of Alkenes: Generation and Recycling of the Carbonyl Species, and Catalytic Cycle". Chemical Reviews. 109 (9): 4272–4282. doi:10.1021/cr8002533. PMID 19572688.
- ^ Overman, Frederick (1852). A treatise on metallurgy. D. Appleton & company. pp. 631–637.
- ^ Muhlethaler, Bruno; Thissen, Jean; Muhlethaler, Bruno (1969). "Smalt". Studies in Conservation. 14 (2): 47–61. doi:10.2307/1505347. JSTOR 1505347.
- ^ Gehlen, A. F. (1803). "Ueber die Bereitung einer blauen Farbe aus Kobalt, die eben so schön ist wie Ultramarin. Vom Bürger Thenard". Neues Allgemeines Journal der Chemie, Band 2. H. Frölich. (German translation from L. J. Thénard; Journal des Mines; Brumaire 12 1802; p 128–136)
- ^ Witteveen, H. J.; Farnau, E. F. (1921). "Colors Developed by Cobalt Oxides". Industrial & Engineering Chemistry. 13 (11): 1061–1066. doi:10.1021/ie50143a048.
- ^ Venetskii, S. (1970). "The charge of the guns of peace". Metallurgist. 14 (5): 334–336. doi:10.1007/BF00739447. S2CID 137225608.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةnubase - ^ Mandeville, C.; Fulbright, H. (1943). "The Energies of the γ-Rays from Sb122, Cd115, Ir192, Mn54, Zn65, and Co60". Physical Review. 64 (9–10): 265–267. Bibcode:1943PhRv...64..265M. doi:10.1103/PhysRev.64.265.
- ^ Wilkinson, V. M; Gould, G (1998). Food irradiation: a reference guide. p. 53. ISBN 978-1-85573-359-6.
- ^ Blakeslee, Sandra (1984-05-01). "The Juarez accident". The New York Times. Retrieved 2009-06-06.
- ^ "Ciudad Juarez orphaned source dispersal, 1983". Wm. Robert Johnston. 2005-11-23. Retrieved 2009-10-24.
- ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement; National Research Council (U.S.). Nuclear and Radiation Studies Board (January 2008). Radiation source use and replacement: abbreviated version. National Academies Press. pp. 35–. ISBN 978-0-309-11014-3. Retrieved 2011-04-29.
- ^ Meyer, Theresa (2001-11-30). Physical Therapist Examination Review. p. 368. ISBN 978-1-55642-588-2.
- ^ Kalnicky, D.; Singhvi, R. (2001). "Field portable XRF analysis of environmental samples". Journal of Hazardous Materials. 83 (1–2): 93–122. doi:10.1016/S0304-3894(00)00330-7. PMID 11267748.
- ^ Payne, L. R. (1977). "The Hazards of Cobalt". Occupational Medicine. 27 (1): 20–25. doi:10.1093/occmed/27.1.20. PMID 834025.
- ^ Puri-Mirza, Amna (2020). "Morocco Cobalt Production". Statistica.
- ^ Davis, Joseph R; Handbook Committee, ASM International (2000-05-01). "Cobalt". Nickel, cobalt, and their alloys. p. 354. ISBN 978-0-87170-685-0.
- ^ Committee On Technological Alternatives For Cobalt Conservation, National Research Council (U.S.); National Materials Advisory Board, National Research Council (U.S.) (1983). "Ground–Coat Frit". Cobalt conservation through technological alternatives. p. 129.
- ^ Yamada, Kazuhiro (2013). "Chapter 9. Cobalt: Its Role in Health and Disease". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9. PMID 24470095.
- ^ Cracan, Valentin; Banerjee, Ruma (2013). "Chapter 10 Cobalt and Corrinoid Transport and Biochemistry". In Banci, Lucia (ed.). Metallomics and the Cell. Metal Ions in Life Sciences. Vol. 12. Springer. pp. 333–374. doi:10.1007/978-94-007-5561-1_10. ISBN 978-94-007-5560-4. PMID 23595677. electronic-book ISBN 978-94-007-5561-1 قالب:Issn electronic-قالب:Issn.
- ^ Schwarz, F. J.; Kirchgessner, M.; Stangl, G. I. (2000). "Cobalt requirement of beef cattle – feed intake and growth at different levels of cobalt supply". Journal of Animal Physiology and Animal Nutrition. 83 (3): 121–131. doi:10.1046/j.1439-0396.2000.00258.x.
- ^ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ^ Smith, David M.; Golding, Bernard T.; Radom, Leo (1999). "Understanding the Mechanism of B12-Dependent Methylmalonyl-CoA Mutase: Partial Proton Transfer in Action". Journal of the American Chemical Society. 121 (40): 9388–9399. doi:10.1021/ja991649a.
- ^ Kobayashi, Michihiko; Shimizu, Sakayu (1999). "Cobalt proteins". European Journal of Biochemistry. 261 (1): 1–9. doi:10.1046/j.1432-1327.1999.00186.x. PMID 10103026.
- ^ "Soils". Waikato University. Archived from the original on 2012-01-25. Retrieved 2012-01-16.
- ^ أ ب McDowell, Lee Russell (2008). Vitamins in Animal and Human Nutrition (2nd ed.). Hoboken: John Wiley & Sons. p. 525. ISBN 978-0-470-37668-3.
- ^ Australian Academy of Science > Deceased Fellows > Hedley Ralph Marston 1900–1965 Accessed 12 May 2013.
- ^ Snook, Laurence C. (1962). "Cobalt: its use to control wasting disease". Journal of the Department of Agriculture, Western Australia. 4. 3 (11): 844–852.
- ^ "Cobalt 356891". Sigma-Aldrich. 2021-10-14. Retrieved 2021-12-22.
- ^ Donaldson, John D. and Beyersmann, Detmar (2005) "Cobalt and Cobalt Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_281.pub2
- ^ NIOSH Pocket Guide to Chemical Hazards 0146
- ^ Morin Y; Tětu A; Mercier G (1969). "Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects". Annals of the New York Academy of Sciences. 156 (1): 566–576. Bibcode:1969NYASA.156..566M. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148. S2CID 7422045.
- ^ Barceloux, Donald G. & Barceloux, Donald (1999). "Cobalt". Clinical Toxicology. 37 (2): 201–216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ Elbagir, Nima; van Heerden, Dominique; Mackintosh, Eliza (May 2018). "Dirty Energy". CNN. Retrieved 30 May 2018.
- ^ Basketter, David A.; Angelini, Gianni; Ingber, Arieh; Kern, Petra S.; Menné, Torkil (2003). "Nickel, chromium and cobalt in consumer products: revisiting safe levels in the new millennium". Contact Dermatitis. 49 (1): 1–7. doi:10.1111/j.0105-1873.2003.00149.x. PMID 14641113. S2CID 24562378.
للاستزادة
- Harper, E. M.; Kavlak, G.; Graedel, T. E. (2012). "Tracking the metal of the goblins: Cobalt's cycle of use". Environmental Science & Technology. 46 (2): 1079–86. Bibcode:2012EnST...46.1079H. doi:10.1021/es201874e. PMID 22142288.
- Narendrula, R.; Nkongolo, K. K.; Beckett, P. (2012). "Comparative soil metal analyses in Sudbury (Ontario, Canada) and Lubumbashi (Katanga, DR-Congo)". Bulletin of Environmental Contamination and Toxicology. 88 (2): 187–92. doi:10.1007/s00128-011-0485-7. PMID 22139330. S2CID 34070357.
- Pauwels, H.; Pettenati, M.; Greffié, C. (2010). "The combined effect of abandoned mines and agriculture on groundwater chemistry". Journal of Contaminant Hydrology. 115 (1–4): 64–78. Bibcode:2010JCHyd.115...64P. doi:10.1016/j.jconhyd.2010.04.003. PMID 20466452.
- Bulut, G. (2006). "Recovery of copper and cobalt from ancient slag". Waste Management & Research. 24 (2): 118–24. doi:10.1177/0734242X06063350. PMID 16634226. S2CID 24931095.
- Jefferson, J. A.; Escudero, E.; Hurtado, M. E.; Pando, J.; Tapia, R.; Swenson, E. R.; Prchal, J.; Schreiner, G. F.; Schoene, R. B.; Hurtado, A.; Johnson, R. J. (2002). "Excessive erythrocytosis, chronic mountain sickness, and serum cobalt levels". Lancet. 359 (9304): 407–8. doi:10.1016/s0140-6736(02)07594-3. PMID 11844517. S2CID 12319751.
- Løvold, T. V.; Haugsbø, L. (1999). "Cobalt mining factory--diagnoses 1822-32". Tidsskrift for den Norske Laegeforening. 119 (30): 4544–6. PMID 10827501.
- Bird, G. A.; Hesslein, R. H.; Mills, K. H.; Schwartz, W. J.; Turner, M. A. (1998). "Bioaccumulation of radionuclides in fertilized Canadian Shield lake basins". The Science of the Total Environment. 218 (1): 67–83. Bibcode:1998ScTEn.218...67B. doi:10.1016/s0048-9697(98)00179-x. PMID 9718743.
- Nemery, B. (1990). "Metal toxicity and the respiratory tract". The European Respiratory Journal. 3 (2): 202–19. PMID 2178966.
- Kazantzis, G. (1981). "Role of cobalt, iron, lead, manganese, mercury, platinum, selenium, and titanium in carcinogenesis". Environmental Health Perspectives. 40: 143–61. doi:10.1289/ehp.8140143. PMC 1568837. PMID 7023929.
- Kerfoot, E. J.; Fredrick, W. G.; Domeier, E. (1975). "Cobalt metal inhalation studies on miniature swine". American Industrial Hygiene Association Journal. 36 (1): 17–25. doi:10.1080/0002889758507202. PMID 1111264.
وصلات خارجية
- National Pollutant Inventory (Australia)– Cobalt fact sheet
- WebElements.com – Cobalt
- London celebrates 50 years of Cobalt-60 Radiotherapy
- The periodic table of videos: Cobalt
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
- CS1 errors: unsupported parameter
- CS1 maint: numeric names: editors list
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- CS1 الإنجليزية البريطانية-language sources (en-gb)
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles containing Mbugu-language text
- Articles with unsourced statements from January 2021
- Articles with hatnote templates targeting a nonexistent page
- Articles with unsourced statements from October 2019
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from March 2018
- Chemical articles with unknown parameter in Chembox
- Chembox container only
- عناصر كيميائية
- فلزات انتقالية
- معادن غذائية
- كوبالت
- مواد حديدية المغناطيسية
- IARC Group 2B carcinogens
- أحياء وصيدلة العناصر الكيميائية