طلاء كهربائي

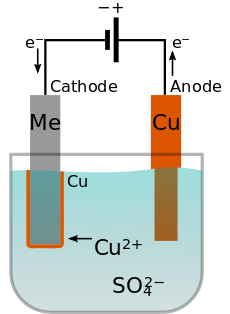
الطلاء الكهربائي (إنگليزية: Electroplating)، هو اسم عام للعمليات التي تنتج طلاء معدني على ركيزة صلبة من خلال اختزال الكاتيونات لهذا المعدن عن طريق تيار كهربائي مستمر. يعمل الجزء المراد تغطيته كمهبط (قطب كهربائي سالب) في خلية تحليل كهربائي؛ الكهرل هو محلول ملح من المعدن المراد طلاؤه؛ و المصعد (القطب الموجب) عادة ما يكون إما كتلة من هذا المعدن، أو من مادة موصلة خاملة. يتم توفير التيار عن طريق مصدر طاقة خارجي.
يستخدم الطلاء الكهربائي على نطاق واسع في الصناعة وفن الزخرفة لتحسين الصفات السطحية للأشياء - مثل مقاومة الاحتكاك والتآكل، التزييت، الانعكاسية، موصلية كهربائية، أو المظهر. يمكن استخدامه أيضاً لبناء سماكة على الأجزاء الصغيرة أو البالية، أو لتصنيع الصفائح المعدنية ذات الشكل المعقد، وهي عملية تسمى التشكيل الكهربائي. كما أنه يستخدم لتنقية المعادن مثل النحاس. يمكن أيضاً استخدام مصطلح "الطلاء بالكهرباء" أحياناً للعمليات التي تستخدم تياراً كهربائياً لتحقيق أكسدة الأنيون على ركيزة صلبة، كما هو الحال في تكوين كلوريد الفضة على الأسلاك الفضية لصنع أقطاب الفضة / كلوريد الفضة.
التلميع الكهروكيميائي، وهي عملية تستخدم تياراً كهربائياً لإزالة الكاتيونات المعدنية من سطح جسم معدني، يمكن اعتبارها عكس الطلاء الكهربائي. [1]
العملية
يجب أن يحتوي المنحل بالكهرباء على أيونات موجبة (كاتيونات) من المعدن المراد ترسبه. يتم تقليل هذه الكاتيونات عند المهبط إلى المعدن في حالة التكافؤ الصفري. على سبيل المثال، يمكن أن يكون المنحل بالكهرباء لطلاء النحاس محلولًا من كبريتات النحاس (II)، والذي يتفكك إلى كاتيونات Cu2+ و SO2−4ىأنيونات. في القطب السالب، يتم تقليل Cu2+ إلى نحاس معدني باكتساب إلكترونين. عندما يتكون المصعد من المعدن المطلي، قد يحدث رد فعل معاكس هناك، مما يحوله إلى كاتيونات مذابة. على سبيل المثال، يمكن أن يتأكسد النحاس عند المصعد إلى Cu2+ بفقدان إلكترونين. في هذه الحالة، فإن المعدل الذي يذوب عنده المصعد سيكون مساوياً للمعدل الذي يتم به طلاء المهبط، وبالتالي يتم تجديد الأيونات الموجودة في حمام الإلكتروليت باستمرار بواسطة الأنود. النتيجة النهائية هي النقل الفعال للمعدن من مصدر المصعد إلى المهبط.[2]
يمكن أن يصنع المصعد بدلاً من ذلك من مادة تقاوم الأكسدة الكهروكيميائية، مثل الرصاص أو الكربون. ثم يتم إنتاج الأكسجين، پروكسيد الهيدروجين، أو بعض المنتجات الثانوية الأخرى عند المصعد بدلاً من ذلك. في هذه الحالة، يجب إعادة تعبئة أيونات المعدن المراد طلاؤها بشكل دوري في الحمام حيث يتم سحبها من المحلول. [3]
غالباً ما يكون الطلاء عنصراً معدنياً واحداً، وليس سبيكة. ومع ذلك، يمكن ترسيب بعض السبائك كهربائياً، ولا سيما النحاس الأصفر و سبيكة لحام القصدير. "السبائك" المطلية ليست سبائك حقيقية، أي محاليل صلبة، ولكنها بلورات صغيرة منفصلة من المعادن التي يتم طلاءها. في حالة اللحام المطلي، من الضروري أحياناً أن يكون لديك "سبيكة حقيقية"، ويتم صهر اللحام المطلي للسماح للقصدير والرصاص بالاندماج لتشكيل سبيكة حقيقية. السبيكة الحقيقية أكثر مقاومة للتآكل من السبيكة المطلية.
تشتمل العديد من أجواض الطلاء السيانيدات من معادن أخرى (مثل سيانيد البوتاسيوم) بالإضافة إلى سيانيد المعدن المراد ترسيبه. تسهل هذه السيانيدات الحرة تآكل المصعد، وتساعد في الحفاظ على مستوى أيون معدني ثابت وتساهم في التوصيل. بالإضافة إلى ذلك، يمكن إضافة المواد الكيميائية غير المعدنية مثل الكربونات و الفوسفات لزيادة الموصلية.
عندما لا يكون الطلاء مرغوباً في مناطق معينة من الركيزة ، يتم تطبيق نقاط التوقف لمنع الحوض من الاتصال مع الركيزة. تشمل نقاط التوقف النموذجية الشريط اللاصق والرقائق وطلاء اللك والشمع. [4]
تسمى قدرة الطلاء على التغطية بشكل موحد قوة الرمي؛ كلما كانت قوة الرمي أفضل كلما كان الطلاء أكثر اتساقاً. [5]
الضربات
في البداية، يمكن استخدام رواسب طلاء خاصة تسمى الضربة أو الفلاش لتشكيل طلاء رقيق جداً (عادةً سماكة أقل من 0.1 ميكرومتر) بجودة عالية والالتزام الجيد بالركيزة. هذا بمثابة أساس لعمليات الطلاء اللاحقة. تستخدم الضربة كثافة تيار عالية وحماماً بتركيز أيوني منخفض. العملية بطيئة، لذلك يتم استخدام عمليات طلاء أكثر كفاءة بمجرد الحصول على سماكة الضربة المطلوب. تُستخدم طريقة الضرب أيضاً مع طلاء المعادن المختلفة. إذا كان من المرغوب فيه وضع نوع واحد من الرواسب على معدن لتحسين مقاومة التآكل ولكن هذا بطبيعته المعدن لديه التصاق ضعيف بالركيزة، فيمكن أولاً ترسيب ضربة متوافقة مع كليهما. أحد الأمثلة على هذه الحالة هو الالتصاق الضعيف للنيكل الكهربائي على سبائك الزنك، وفي هذه الحالة يتم استخدام ضربة النحاس، والتي لها التصاق جيد بكليهما. [3]
الترسيب الكهروكيميائي
تم استخدام الترسيب الكهروكيميائي على نطاق واسع منذ أواخر التسعينيات لتصنيع الأسلاك النحاسية الموصلة في أجهزة أشباه الموصلات المتقدمة. كانت هذه التقنية رائدة من قبل شركة IBM ، [6] وقد تم تطويرها لأن الطرق السابقة لصنع أسلاك الألمنيوم الموصلة في رقائق - عن طريق حفر الخطوط المعدنية ثم ملء طبقة رقيقة عازلة بترسيب البخار الكيميائي وعمليات ترسيب البخار الفيزيائي- لن تعمل مع النحاس لأن من الصعب حفر المعدن. حل ترسيب الطلاء الكهربائي الكيميائي للنحاس بشكل عام محل ترسيب كيميائي للبخار للألومنيوم (CVD) و ترسيب فيزيائي للبخار (PVD) لتصنيع الأسلاك الموصلة في رقائق أشباه الموصلات لجميع طبقات الجهاز الأكثر أهمية. [7]
الطلاء الكهربائي النبضي
تتضمن عملية الطلاء الكهربائي النبضي أو عملية الترسيب الكهربائي بالنبض (PED) التناوب السريع لـ الجهد الكهربائي أو التيار بين قيمتين مختلفتين ينتج عنه سلسلة من النبضات متساوية الاتساع والمدة والقطبية، مفصولة بتيار صفري. من خلال تغيير سعة النبضة وعرضها، من الممكن تغيير تكوين وسمك الفيلم المترسب. [8]
تتكون الوسطاء التجريبية للطلاء الكهربائي النبضي عادةً من تيار الذروة/الجهد، ودورة العمل، والتردد، وتيار فعال/الجهد. تيار الذروة/ الجهد هو أقصى إعداد لتيار الطلاء الكهربائي أو الجهد. دورة التشغيل هي الجزء الفعال من الوقت في فترة طلاء كهربائي معينة مع تطبيق التيار أو الجهد. يتم حساب التيار الفعال / الجهد بضرب دورة العمل وقيمة الذروة للتيار أو الجهد. يمكن أن يساعد الطلاء الكهربائي بالنبض على تحسين جودة الغشاء المطلي بالكهرباء وتحرير الضغط الداخلي المتراكم أثناء الترسيب السريع. إن الجمع بين دورة العمل القصيرة والتردد العالي يمكن أن يقلل من تشققات السطح. ومع ذلك، من أجل الحفاظ على التيار الفعال أو الحهد الثابت، قد تكون هناك حاجة إلى مصدر طاقة عالي الأداء لتوفير تيار عالي / جهد ومفتاح سريع. مشكلة أخرى شائعة للطلاء الكهربائي بالنبض هي أن مادة المصعد يمكن أن تتعرض للطلاء والتلوث أثناء الطلاء الكهربائي العكسي، خاصة بالنسبة للقطب الكهربي الخامل ذي التكلفة العالية مثل الپلاتين. تشمل العوامل الأخرى التي يمكن أن تؤثر على الطلاء الكهربائي النبضي درجة الحرارة وفجوة المصعد إلى المهبط والتحريك. في بعض الأحيان، يمكن إجراء الطلاء الكهربائي النبضي في حوض طلاء كهربائي ساخن لزيادة معدل الترسيب لأن معدل جميع التفاعلات الكيميائية تقريباً يزيد أضعافاً مضاعفة مع درجة الحرارة وفقاً لقانون أرهنيوس. ترتبط فجوة المصعد إلى المهبط بالتوزيع الحالي بين المصعد والمهبط. الفجوة الصغيرة لنسبة مساحة العينة قد تسبب توزيعاً غير متساوٍ للتيار وتؤثر على طوبولوجيا سطح العينة المطلية. قد يؤدي التقليب إلى زيادة معدل نقل / انتشار أيونات المعادن من المحلول السائب إلى سطح القطب. يختلف إعداد التحريك باختلاف عمليات الطلاء الكهربائي للمعادن.
الطلاء الكهربائي بالفرشاة
عملية ذات صلة وثيقة هي الطلاء الكهربائي بالفرشاة، حيث يتم طلاء المساحات الموضعية أو العناصر بأكملها باستخدام فرشاة مشبعة بمحلول الطلاء. الفرشاة، عادةً ما تكون عبارة عن جسم صلب مقاوم للصدأ ملفوف بقطعة قماش ماصة تحمل محلول الطلاء وتمنع الاتصال المباشر بالعنصر المطلي، يتم توصيلها بمصعد مصدر طاقة التيار المباشر للجزء منخفض الجهد، والعنصر المراد طلاءه متصل بمهبط. يقوم المشغل بغمس الفرشاة في محلول الطلاء ثم يقوم بتطبيقها على العنصر، وتحريك الفرشاة باستمرار للحصول على توزيع متساوٍ لمادة الطلاء. يتميز الطلاء الكهربائي بالفرشاة بالعديد من المزايا على طلاء الخزان، بما في ذلك قابلية النقل، والقدرة على طلي العناصر التي لا يمكن لسبب ما أن تكون مطلية بالخزان (كان أحد التطبيقات هو طلاء أجزاء من أعمدة الدعم الزخرفية الكبيرة جداً في ترميم المبنى)، متطلبات إخفاء منخفضة أو معدومة، ومتطلبات حجم محلول الطلاء المنخفض نسبياً. يمكن أن تشمل العيوب مقارنةً بطلاء الخزان مشاركة أكبر للمشغل (غالباً ما يتم طلاء الخزان بأقل قدر من الاهتمام)، وعدم القدرة على تحقيق سماكة كبيرة للوحة.
الكروم الصلب في الطلاء الكهربائي بالفرشاة
يعد الكروم الصلب أحد أكثر مواد الطلاء شيوعاً المستخدمة في الطلاء الصلب والطلاء الكهربائي، نظراً لقوته ومقاومته ولمسته الأخيرة الأنيقة. ومع ذلك، فإن الكروم خطير للغاية في حالته سداسية التكافؤ. عند استنشاقه أو استهلاكه، تم ربط Cr6+[JT2] المحمول في الهواء بسرطان الرئة وأنه تلفاً في الحلق والفم والأنف.
هذا لأن الكروم، في حالته سداسية التكافؤ، له خصائص مسرطنة وماسخة، والتي لها تأثير مطفر على الخلايا.
كل عام، يتعرض 558000 فني أمريكي للكروم سداسي التكافؤ في مكان العمل، حيث يتعرض العاملون في صناعات الطلاء الكهربائي واللحام والطلاء للخطر، بسبب زيادة التعرض لمستويات عالية من مركبات الكروم <6+ .[9]
نظراً للأخطار المرتبطة بالكروم سداسي التكافؤ، فإن إيجاد بدائل أكثر أماناً وصديقة للبيئة كان المحرك الرئيسي لأبحاث الطلاء الكهربائي بالفرشاة على مدار العقد الماضي. أحد البدائل التي تم تطويرها هو مركب معدني هيكلي (MMC). توفر MMC خصائص فريدة ومتفوقة لحلول طلاء المعادن بما في ذلك الصلابة ومقاومة التآكل وحماية الأكسدة في درجات الحرارة العالية. هذا الكروم البديل MMC يتضمن cobalt chromium carbide، nickel tungsten carbide وnickel chromium carbide. [10]
تصفيح البرميل
تعد تقنية الطلاء الكهربائي هذه واحدة من أكثر التقنيات المستخدمة شيوعاً في الصناعة لعدد كبير من الأشياء الصغيرة. يتم وضع الأشياء في قفص غير موصل على شكل برميل، ثم يتم غمرها في الحوض الكيميائي الذي يحتوي على ذرات معلقة من المعدن المراد طلاؤها عليها. يتم بعد ذلك تدوير البرميل، وتشغيل التيارات الكهربائية عبر القطع المختلفة في البرميل والتي تكمل الدوائر عندما تلامس بعضها البعض. والنتيجة هي عملية طلاء موحدة وفعالة للغاية، على الرغم من أن تشطيب المنتجات النهائية من المحتمل أن يعاني من التآكل أثناء عملية الطلاء. إنه غير مناسب للعناصر المزخرفة للغاية أو المصممة بدقة. [11]
التنظيف
النظافة ضرورية للطلاء بالكهرباء بنجاح، نظراً لأن الطبقات الجزيئية لـ الزيت يمكن أن تمنع التصاق الطلاء. ASTM B322 هو دليل قياسي لتنظيف المعادن قبل الطلاء بالكهرباء. يشمل التنظيف التنظيف بالمذيبات، وتنظيف المنظفات القلوية الساخنة، والتنظيف الكهربائي، والمعالجة الحمضية وما إلى ذلك. الاختبار الصناعي الأكثر شيوعاً للنظافة هو اختبار كسر الماء، حيث يتم شطف السطح جيداً وإمساكه بشكل عمودي. تتسبب الملوثات الكارهة للماء مثل الزيوت في تكسير الماء وتفككه، مما يسمح للمياه بالتصريف بسرعة. تعتبر الأسطح المعدنية النظيفة تماماً محبة للماء وستحتفظ بصفيحة غير مكسورة من الماء لا تنفجر أو تستنزف. يصف ASTM F22 نسخة من هذا الاختبار. لا يكتشف هذا الاختبار الملوثات المحبة للماء، ولكن الطلاء الكهربائي يمكن أن يحل محلها بسهولة لأن الحلول تعتمد على الماء. المؤثر السطحي مثل الصابون يقلل من حساسية الاختبار ويجب شطفه جيداً.
التأثيرات
يغير الطلاء الكهربائي الخواص الكيميائية والفيزيائية والميكانيكية لقطعة العمل. مثال على التغيير الكيميائي هو عندما يحسن طلاء النيكل مقاومة التآكل. مثال على التغيير الجسدي هو التغيير في المظهر الخارجي. مثال على التغيير الميكانيكي هو التغيير في مقاومة الشد أو صلابة السطح وهي سمة مطلوبة في صناعة الأدوات.[12] يقلل الطلاء الكهربائي للذهب الحمضي على الدوائر المطلية بالنحاس أو النيكل من مقاومة التلامس وكذلك صلابة السطح. تعمل المناطق المطلية بالنحاس من الفولاذ الطري كقناع إذا كان تصلب العلبة لهذه المناطق غير مرغوب فيه. الفولاذ المطلي بالقصدير مطلي بالكروم لمنع تلاشي السطح بسبب أكسدة القصدير.
يمكن استخدام الطلاء بالكهرباء أو الطلاء غير الكهربائي كطريقة لجعل الجزء المعدني مشع، باستخدام محلول مائي محضر من مركزات النيكل - فسفور التي تحتوي على أيونات هيپوفوسفيت 32P المشعة. [13]
بدائل الطلاء الكهربائي
هناك عدد من العمليات البديلة لإنتاج طلاءات معدنية على ركائز صلبة لا تتضمن الاختزال بالتحليل الكهربائي:
- الطلاء الكيميائي يستخدم الحوض الذي يحتوي على أيونات معدنية ومواد كيميائية تقللها إلى المعدن عن طريق تفاعل الأكسدة والاختزال. يجب أن يكون التفاعل محفزاً ذاتياً، بحيث يتم ترسيب المعدن الجديد فوق الغلاف المتنامي، بدلاً من ترسبه كمسحوق خلال الحوض بالكامل مرة واحدة. تُستخدم العمليات اللاكهربائية على نطاق واسع في ترسيب سبائك فوسفور النيكل أو النيكل والبورون لمقاومة التآكل، والفضة لصنع المرآة، والنحاس لـ لوحة دارات مطبوعة، وغيرها الكثير. الميزة الرئيسية لهذه العمليات التي تفوق الطلاء الكهربائي هي أنها يمكن أن تنتج طلاء بسماكة موحدة على أسطح ذات شكل عشوائي، حتى داخل الثقوب، ولا يلزم أن تكون الركيزة موصلة كهربائياً. فائدة رئيسية أخرى هي أنه لا يحتاج إلى مصادر الطاقة أو مصاعد ذات شكل خاص. تشمل العيوب سرعة الترسيب المنخفضة، واستهلاك المواد الكيميائية باهظة الثمن نسبياً، والاختيار المحدود لمعادن الطلاء.
- تستغل عمليات الطلاء بالغمر تفاعل الإزاحة حيث يتأكسد المعدن المترسب إلى أيونات قابلة للذوبان بينما يتم تقليل أيونات المعدن المطلي وترسب في مكانها. تقتصر هذه العملية على الطلاءات الرقيقة جداً، حيث يتوقف التفاعل بعد تغطية المادة المترسبة بالكامل. ومع ذلك، فإنه يحتوي على بعض التطبيقات المهمة، مثل عملية الذهب اللاكهربائي المغطى بالنيكل (ENIG) المستخدمة للحصول على ملامسات كهربائية مطلية بالذهب على لوحات الدارات المطبوعة.
- رش مهبطي يستخدم شعاع إلكترون قوي لإخراج الجسيمات الدقيقة من المعدن على الركيزة في فراغ.
- ترسيب فيزيائي للبخار ينقل المعدن إلى المادة المترسبة بتبخيره.
- ترسيب كيميائي للبخار يستخدم غازاً يحتوي على مركب متطاير من المعدن، والذي يترسب على الركيزة نتيجة لتفاعل كيميائي.
- مخطوط مذهب هي طريقة تقليدية لربط طبقة ذهبية بالمعادن عن طريق وضع صفيحة رقيقة جداً من الذهب مثبتة في مكانها بواسطة مادة لاصقة
التاريخ
تم الافتراض بأن الطلاء الكهربائي الأول تم في عصر الامبراطورية الپارثية. كان فيلهلم كونيغ مساعداً في المتحف العراقي في ثلاثينيات القرن الماضي، وقد لاحظ عدداً من القطع الفضية الدقيقة جداً من العراق القديم، والمطلية بطبقات رقيقة جداً من الذهب، وتكهن بأنها مطلية بالكهرباء [14][15][مرجع دائرة مفرغة].أيد فكرته بالإشارة إلى بطارية پارثية محتملة اكتُشِف في عام 1938 بالقرب من مدينة المدائن، عاصمة پارثيا (150 قبل الميلاد - 223 بعد الميلاد) و الساساني (224 - 650 م) في بلاد فارس.ولكن فقد تم فضح هذا على نطاق واسع من قبل الباحثين. ومع ذلك، يتفق علماء الآثار الحديثون الآن بشكل عام على أن الأشياء التي رآها كونيغ لم تكن، في الواقع، مطلية بالكهرباء على الإطلاق، بل كانت مطلية بالذهب باستخدام الزئبق. لذلك لا توجد أمثلة معروفة لأجسام من بلاد ما بين النهرين القديمة يمكن وصفها بشكل موثوق بأنها تظهر عليها علامات طلاء كهربائي. [16]
اخترع الكيميائي الإيطالي لويگي ڤالنتينو بروناتلي الطلاء بالكهرباء في عام 1805. استخدم بروناتلي اختراع زميله ألساندرو ڤولتا قبل خمس سنوات، الكومة الڤولتية، لتسهيل أول ترسيب كهربائي. تم قمع اختراعات بروناتلي من قبل أكاديمية العلوم الفرنسية ولم يتم استخدامها في الصناعة العامة خلال الثلاثين عام التالية. بحلول عام 1839، كان العلماء في بريطانيا وروسيا قد ابتكروا بشكل مستقل عمليات ترسيب المعادن مشابهة لما قام به بروناتلي للطلاء الكهربائي للنحاس لألواح المطبعة.
لم يقم Boris Jacobi في روسيا بإعادة اكتشاف الچلڤانوپلاستيك فحسب، بل طور التنميط الكهربائي ونحت الچلڤانوپلاستيك. سرعان ما ظهرت مادة الچلڤانوپلاستيك في الموضة في روسيا، حيث ساهم كل من المخترع پيتر باگراتيون، والعالم هاينريش لنز ومؤلف الخيال العلمي ڤلاديمير أودويڤسكي في زيادة تطوير التكنولوجيا. من بين أكثر حالات استخدام الطلاء الكهربائي شهرة في منتصف القرن التاسع عشر في روسيا، كانت التماثيل الچلڤانوپلاستيك العملاقة في كاتدرائية القديس إسحاق في سانت بطرسبرگ والقبة المطلية بالذهب لـكاتدرائية المسيح المخلص في موسكو، أطول كنيسة أرثوذكسية في العالم.[17]
بعد فترة وجيزة، اكتشف جون رايت من برمنگهام بإنكلترا، أن سيانيد البوتاسيوم كان كهرلاً مناسباً لطلاء الذهب والفضة بالكهرباء. مُنح زملاؤه جورج إلكينگتون وهنري إلكينگتون براءات الاختراع الأولى للطلاء بالكهرباء في عام 1840. ثم أسس هذان الشخصان صناعة الطلاء بالكهرباء في برمنگهام حيث انتشرت في جميع أنحاء العالم. يعد مولد وولريتش الكهربائي لعام 1844، الموجود حالياً في متحف برمنگهام للعلوم، أول مولد كهربائي يستخدم في الصناعة. [18] تم استخدامه بواسطة إلكينگتون.[19][20][21]
كانت Norddeutsche Affinerie في هامبورگ أول مصنع حديث للطلاء الكهربائي بدأ إنتاجه في عام 1876. [22]
مع نمو علم الكيمياء الكهربية، أصبحت علاقته بالطلاء الكهربائي مفهومة وتم تطوير أنواع أخرى من الطلاء الكهربائي للمعادن غير الزخرفية. تم تطوير الطلاء الكهربائي التجاري لـ النيكل والنحاس والقصدير والزنك بحلول خمسينيات القرن التاسع عشر. تم توسيع أحواض ومعدات الطلاء بالكهرباء بناءً على براءات الاختراع الخاصة بـ إلكينگتون لتلائم تصفيح العديد من الأشياء الكبيرة الحجم ولتطبيقات التصنيع والهندسة المحددة.
تلقت صناعة الطلاء دفعة كبيرة مع تطوير المولد الكهربائي في أواخر القرن التاسع عشر. مع توفر التيارات العالية، يمكن معالجة مكونات الماكينات المعدنية، والأجهزة، وأجزاء السيارات التي تتطلب حماية من التآكل وخصائص التآكل المحسّنة، جنباً إلى جنب مع المظهر الأفضل، بكميات كبيرة.
أعطت الحربان العالميتان وصناعة الطيران قوة دفع لمزيد من التطويرات والتحسينات بما في ذلك عمليات مثل طلاء الكروم، و البرونز والطلاء بالنيكل بالكبريتات، إلى جانب العديد من عمليات الطلاء الأخرى . تطورت معدات الطلاء من خزانات خشبية مبطنة بالقطران تعمل يدوياً إلى معدات آلية قادرة على معالجة آلاف الكيلوغرامات في الساعة من الأجزاء.
كان أحد مشاريع الفيزيائي الأمريكي ريتشارد فاينمان هو تطوير تكنولوجيا لطلاء المعدن بالكهرباء على البلاستيك. طور فاينمان الفكرة الأصلية لصديقه إلى اختراع ناجح، مما سمح لصاحب العمل (والصديق) بالوفاء بالوعود التجارية التي قطعها ولكن لم يكن من الممكن أن يفي بها بطريقة أخرى. [23]
خلية هال
خلية هال هي نوع من خلايا الاختبار المستخدمة للتحقق شبه الكمي من حالة حوض الطلاء الكهربائي. إنه يقيس نطاق كثافة التيار القابل للاستخدام، وتحسين تركيز المواد المضافة، والتعرف على تأثيرات الشوائب، وإشارة إلى قدرة قوة الرمي الكلي. [24] تقوم خلية هال بتكرار حوض الطلاء على مقياس معمل. يتم ملؤها بعينة من محلول الطلاء، وهو مصعد مناسب متصل بـ المقوم. يتم استبدال "العمل" بلوحة اختبار خلية هال التي سيتم طلاءها لإظهار "صحة" الحوض.
خلية الهيكل عبارة عن حاوية شبه منحرفة تحتوي على 267 ملليلتراً من محلول حوض الطلاء. يسمح هذا الشكل للشخص بوضع لوحة الاختبار على زاوية المصعد. نتيجة لذلك، يتم طلاء الرواسب عند نطاق كثافات التيار بطولها، والتي يمكن قياسها باستخدام مسطرة خلية هال. يسمح حجم المحلول بقياس شبه كمي لتركيز المادة المضافة: إضافة 1 جرام إلى 267 مل تعادل 0.5 أونصة / جالون في خزان الطلاء.[25]
خلية هارينگ-بلوم
تُستخدم خلية هارينگ-بلوم لتحديد قوة إلقاء الماكرو لحوض الطلاء. تتكون الخلية من اثنين من المهابط المتوازية مع مصعد ثابت في المنتصف. تقع المهابط على مسافات من المصعد بنسبة 1: 5. يتم حساب قوة رمي الماكرو من سماكة الطلاء عند المهابط عند تمرير تيار مستمر لفترة زمنية محددة. الخلية مختلقة من مادة الپرسپيكس أو الزجاج. [26][27]
انظر أيضاً
المصادر
- ^ "Archived copy". Archived from the original on 2020-11-28. Retrieved 2019-05-01.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ Dufour 2006, p. IX-1.
- ^ أ ب Dufour 2006, p. IX-2
- ^ Dufour 2006, p. IX-3
- ^ Pollution Prevention Technology Profile Trivalent Chromium Replacements for Hexavalent Chromium Plating. Northeast Waste Management Officials’ Association. 2003-10-18. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://www.newmoa.org/prevention/p2tech/TriChromeFinal.pdf. - ^ "One big wire change in '97 still helping chips achieve tiny scale". IBM Research Blog (in الإنجليزية الأمريكية). 2017-11-15. Retrieved 2021-04-20.
- ^ IBM Research Editorial Staff (November 15, 2017). "One big wire change in '97 still helping chips achieve tiny scale". International Business Machines. Retrieved June 7, 2021.
- ^ kunji durai, M. S.; chaala, Mathy (2008). "Pulse and pulse reverse plating—Conceptual, advantages and applications". Electrochimica Acta. 53 (8): 3313–3322. doi:10.1016/j.electacta.2007.11.054.
- ^ Proctor, Deborah M (2016). "Inhalation cancer risk assessment of hexavalent chromium based on updated mortality for Painesville chromate production workers". Journal of Exposure Science & Environmental Epidemiology. 26 (2): 224–31. doi:10.1038/jes.2015.77. PMC 4756268. PMID 26669850.
- ^ Milosevic-Popovich, Danijela (2018). "Advancements in Brush Plated Metal Matrix Composites". SIFCO ASC. Archived from the original on 2020-07-23. Retrieved 2020-07-23.
- ^ A.C. Tan (30 November 1992). Tin and Solder Plating in the Semiconductor Industry. Springer Science & Business Media. p. 122. ISBN 978-0-412-48240-3. Archived from the original on 1 August 2020. Retrieved 16 May 2019.
- ^ Todd, Robert H.; Allen, Dell K.; Alting, Leo (1994). "Surface Coating". Manufacturing Processes Reference Guide. Industrial Press. pp. 454–458. ISBN 0-8311-3049-0. Archived from the original on 2013-10-09.
- ^ {{{1}}} patent {{{2}}}
- ^ chitsaz, M. R. "Parthian Battery" (PDF). www.sid.ir. Iran University of Science & Technology, School of Architecture & Urban Studies, Tehran. Retrieved 2020-10-16.
- ^ A galvanic element from the Parthian period
- ^ "Debunking the So-Called "Baghdad Battery"". Tales of Times Forgotten (in الإنجليزية الأمريكية). 2020-03-08. Retrieved 2021-10-10.
- ^ "The history of galvanotechnology in Russia" (in الروسية). Archived from the original on March 5, 2012.
- ^ Birmingham Museums trust catalogue, accession number: 1889S00044
- ^ Thomas, John Meurig (1991). Michael Faraday and the Royal Institution: The Genius of Man and Place. Bristol: Hilger. p. 51. ISBN 0750301457.
- ^ Beauchamp, K. G. (1997). Exhibiting Electricity. IET. p. 90. ISBN 9780852968956.
- ^ Hunt, L. B. (March 1973). "The early history of gold plating". Gold Bulletin. 6 (1): 16–27. doi:10.1007/BF03215178.
- ^ Stelter, M.; Bombach, H. (2004). "Process Optimization in Copper Electrorefining". Advanced Engineering Materials. 6 (7): 558. doi:10.1002/adem.200400403.
- ^ Feynman, Richard (1985). "Chapter 6: The Chief Research Chemist of the Metaplast Corporation". Surely You're Joking, Mr. Feynman!.
- ^ Metal Finishing: Guidebook and Directory. Issue 98. Vol. 95. 1998. p. 588.
- ^ Kushner, Arthur S. (December 1, 2006). "Hull Cell 101". Products Finishing. Archived from the original on March 13, 2010.
- ^ Bard, Allan; Inzelt, György; Scholz, Fritz (2012). "Haring–Blum Cell". Electrochemical Dictionary. Springer. p. 444. doi:10.1007/978-3-642-29551-5_8. ISBN 978-3-642-29551-5.
- ^ Wendt, Hartmut; Gerhard, Kreyse (1999). Electrochemical Engineering: Science and Technology in Chemical and Other Industries. Springer. p. 122. ISBN 3540643869.
المراجع
- Dufour, Jim (2006). An Introduction to Metallurgy (5th ed.). Cameron.[بحاجة لمُعرِّف الكتاب]
وصلات خارجية
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- CS1 الروسية-language sources (ru)
- Short description is different from Wikidata
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with hatnote templates targeting a nonexistent page
- All articles lacking reliable references
- Articles lacking reliable references from October 2020
- Pages with missing ISBNs
- طلاء المعادن