لقاح كوڤيد-19
| جزء من سلسلة عن |
| جائحة ڤيروس كورونا 2019-2020 |
|---|
|
لقاح كوڤيد-19 هو مفترض لقاح ضد مرض ڤيروس كورونا 2019 (COVID-19). على الرغم من عدم اكتمال أي لقاح للتجارب السريرية ، هناك محاولات عديدة جارية لتطوير مثل هذا اللقاح. في أواخر فبراير 2020 ، قالت منظمة الصحة العالمية (WHO) إنها لا تتوقع أن يصبح اللقاح ضد ڤيروس كورونا 2 المرتبط بالمتلازمة التنفسية الحادة الوخيمة (SARS-CoV-2) ،الفيروس المسبب ، متاحًا في أقل من 18 شهرًا.[1]أشار التحالف من أجل ابتكارات التأهب للوباء (CEPI) – الذي ينظم صندوقًا عالميًا دولار للاستثمار والتطوير السريع لمرشحي اللقاح[2] يشار في أبريل إلى أن اللقاح قد يكون متاحًا بموجب بروتوكولات الاستخدام في حالات الطوارئ في أقل من 12 شهرًا أو بحلول أوائل عام 2021.[3]
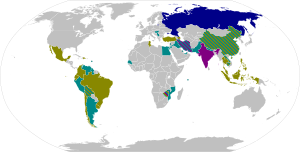
في أبريل 2020 ، كان هناك 115 مرشحًا لقاحا قيد التطوير,[3][4] مع بدء خمسة في مرحلتين من مراحل التجارب السريرية في البشر.[5][6] كان خمسة لقاحات مرشحين في دراسات السلامة المرحلة الأولى في أبريل.[3]
مشروعات 2020
تم تحديد مرض ڤيروس كورونا 2019 في ديسمبر 2019.[7] انتشر تفشي كبير في جميع أنحاء العالم في عام 2020 ، مما أدى إلى استثمارات كبيرة ونشاط بحثي لتطوير لقاح .[7][8] تستخدم العديد من المنظمات الجينوم المنشور لتطوير لقاحات محتملة ضد ڤيروس كورونا 2 المرتبط بالمتلازمة التنفسية الحادة الوخيمة (SARS-CoV-2).[7][9][10][11] في الولايات المتحدة ، أعلنت إدارة الغذاء والدواء عزمها على "استخدام كل المرونة التنظيمية التي يمنحها لها الكونغرس لضمان التطوير الأكثر كفاءة وفي الوقت المناسب للقاحات لمكافحة COVID-19."[12]
وتشارك حوالي 100 منظمة أو شركة في تطوير اللقاح.[4] تم تسجيل خمسمائة دراسة سريرية في جميع أنحاء العالم ، في جميع مراحل تطوير اللقاحات والمرشحات العلاجية لـ COVID ‑ 19 ، في سجل التجارب السريرية لمنظمة الصحة العالمية ، اعتبارًا من مارس 2020.[13]
في أوائل مارس 2020 ، أعلن التحالف من أجل ابتكارات التأهب للوباء (CEPI) عن هدف تمويلي بقيمة 2 مليار دولار أمريكي في شراكة عالمية بين مؤسسات عامة وخاصة وخيرية ومنظمات المجتمع المدني لتسريع تطوير لقاحات COVID-19 ، مع تعهدات حتى الآن من حكومات الدنمارك وفنلندا وألمانيا والنرويج والمملكة المتحدة.[2] ذكر في أبريل ، فإن متطلبات مبادرة CEPI لتطوير اللقاحات هي السرعة والقدرة التصنيعية والنشر على نطاق واسع والوصول العالمي.[3]
منصات التكنولوجيا
في أبريل ، أفاد علماء CEPI أن 10 منصات تقنية مختلفة كانت قيد البحث والتطوير خلال أوائل عام 2020 لإنشاء لقاح فعال ضد COVID-19.[3] تشمل أهداف المنصة الرئيسية المتقدمة في دراسات السلامة للمرحلة الأولى ما يلي:
- الحمض النووي ( (الحمض النووى الريبوزي منقوص الأكسجين) DNA و (حمض ريبي نووي)RNA (مطور المرحلة الأولى ومرشح اللقاح: Moderna، mRNA-1273)
- ناقل فيروسي (مطور المرحلة الأولى ومرشح اللقاح: CanSino Biologics ، فيروسات غدانية النمط 5 الناقل)
- جسيم شبيه بالفيروس يشارك في تناسخ الحمض النووي الريبي منقوص الأكسجين (مطور المرحلة الأولى ومرشح اللقاح: معهد شنتشن جينو-المناعة الطبي، LV-SMENP)
وفقًا لـ CEPI ، تقدم المنصات القائمة على الحمض النووي الريبوزي منقوص الأكسجين) أو مرسال الحمض النووي الريبي وعدًا كبيرًا لتغيير وظائف المستضد COVID ‑ 19 للحصول على استجابات مناعية قوية ، ويمكن تقييمها وتنقيتها بسرعة لتحقيق الاستقرار على المدى الطويل ، وإعدادها للقدرة الإنتاجية على نطاق واسع.[3] تركز المنصات الأخرى التي يتم تطويرها في عام 2020 على الپپتيدات والبروتينات المؤتلفة والفيروسات الموهنة الحية والفيروسات المعطلة.[3]
بشكل عام ، تقنيات اللقاحات التي يتم تطويرها لـ COVID-19 ليست مثل اللقاحات المستخدمة بالفعل لمنع الأنفلونزا ، بل تستخدم استراتيجيات "الجيل التالي" من أجل الدقة في آليات العدوى COVID-19 ، مع التعجيل بالتنمية للوقاية من العدوى في النهاية بلقاح جديد.[3] تم تصميم منصات اللقاحات قيد التطوير أيضًا لمعالجة آليات القابلية للإصابة بـ COVID-19 في مجموعات فرعية سكانية محددة ، مثل كبار السن أو الأطفال أو النساء الحوامل أو الأشخاص الذين يعانون من ضعف جهاز المناعة.[3]
تصنف CEPI مراحل تطوير اللقاحات على أنها إما "استكشافية" (تخطيط وتصميم مرشح ، مع عدم وجود تقييم في الجسم الحي حتى الآن) ، أو "ما قبل السريرية" (في التقييم الحي مع التحضير لتصنيع مركب لاختباره في البشر) ، أو بدء المرحلة الأولى دراسات السلامة في الأشخاص الأصحاء.[3]
اللقاحات المرشحة
كما أفاد علماء CEPI في أبريل ، فإن حوالي 115لقاحًا مرشحًا إجماليًا هم في المراحل الأولى من التطوير إما كمشاريع نشطة مؤكدة أو في تطوير "استكشافي" أو "قبل سريري".[3] في أبريل بعد نشر تقرير CEPI ، بدأت المرحلة الأولى والثانية عشوائية ، وبدأت التجارب التدخلية للجرعات وتقييم الآثار الجانبية في ووهان ، الصين على اللقاح المرشح ،جدول Ad5-nCoV (CanSino Biologics ,[5] وفي إنجلترا على المرشح ، ChAdOx1 nCoV-19.[6] دخل خمسة مرشحين آخرين للقاحات فقط المرحلة الأولى من الاختبارات البشرية ، حتى منتصف أبريل.[3][4]
تختبر تجارب المرحلة الأولى في المقام الأول من أجل السلامة والجرعات الأولية في بضع عشرات من الأشخاص الأصحاء ، في حين تقوم تجارب المرحلة الثانية – بعد النجاح في المرحلة الأولى – بتقييم الاستمناع ، ومستويات الجرعات (الفعالية المستندة إلى الواصمات الحيوية ) والآثار السلبية للقاح المرشح ، عادةً بالمئات من الناس.[14][15] تجري تجربة المرحلة الأولى والثانية اختبارات أولية للسلامة والاستمناع، وعادة ما يتم توزيعها بشكل عشوائي ، والمضبوطة بالدواء الغفل ، وفي مواقع متعددة ، مع تحديد جرعات أكثر دقة وفعالية.[15] تشمل تجارب المرحلة الثالثة عادةً عددًا أكبر من المشاركين ، بما في ذلك مجموعات التجارب المقارنة ، وفعالية اختبار اللقاح للوقاية من المرض ، مع مراقبة الآثار الجانبية بالجرعة المثلى.[14][15]
تجارب سريرية بدأت في 2020
| اللقاح المرشح المطورون والرعاة |
التقنية | المرحلة الحالية (المشاركون) التصميم |
المرحلة المكتملة[أ] (المشاركين) الاستجابة المناعية, الاثار الجانبية |
موقع التجربة السريرية | المدة[ب] | ت.إ.ط. | التصريح الكامل |
|---|---|---|---|---|---|---|---|
| توزيناميران بيونتك, فوسان فارما, فايزر |
رنا معدل | ? (43,448) عشوائية, مضبوطة بدواء غفل تم الإعلان عن النتائج الإيجابية من التحليل المؤقت في 18 نوفمبر 2020[22] وتم نشره في 10 كانون الأول (ديسمبر) 2020 تبلغ نسبة الفعالية الإجمالية 95٪. [23][24] |
المرحلة 1–II (45) بلغت الاستجابة القوية للرابط RBD IgG و الجسم المضاد المعادل ذروتها بعد 7 أيام من جرعة معززة ، واستجابات CD4 + و CD8 + خلية T ، وقوة تحمل غير محددة. "التأثيرات الضائرة": رد فعل تحسسي يهدد الحياة لدى المعرضين للإصابة,[25] تعتمد على الجرعة ومتوسطة بما في ذلك الألم في موقع الحقن ، والتعب ، والصداع ، والقشعريرة ، وآلام العضلات والمفاصل ، والحمى[26] |
62 في الولايات المتحدة ، ألمانيا | Apr 2020 – Nov 2020[27][28] | موافق عليه المملكة المتحدة: MHRA;[29] البحرين: NHRA;[30] السعودية العربية: SFDA[31] معلق |
موافق عليه
كندا: صحة كندا |
| أزد1222 جامعة أوكسفورد, أسترازِنـِكا |
ناقلات الفيروس الغداني الشمبانزي المعدل
(ChAdOx1) |
المرحلة 3 (30٬000) تدخلي دراسة عشوائية مضبوطة بدواءغفل من أجل الفعالية والأمان والاستمناع.[45] Brazil (5,000)[46]> تم الإعلان عن النتائج الإيجابية من التحليل المؤقت لأربع تجارب جارية في 23 نوفمبر 2020[47][48] and p تم نشره في 8 ديسمبر 2020.[49] كانت الفعالية الإجمالية 70٪ ، وتتراوح من 62٪ إلى 90٪ مع أنظمة جرعات مختلفة ، مع ملف تعريف أمان راجعه النظراء.[49] |
المرحلة 1–II (543) الأجسام المضادة الخاصة بالسبايك في اليوم 28 ؛ الأجسام المضادة المعادلة بعد جرعة معززة في اليوم 56. "" تأثيرات ضارة "": ألم في موقع الحقن ، صداع ، حمى ، قشعريرة ، ألم عضلي ، الشعور بالتعب في أكثر من 60٪ من المشاركين ؛ باراسيتامول سمح لبعض المشاركين بزيادة التحمل[50] |
20 في المملكة المتحدة ، ساو باولو ، الهند | May 2020 – Aug 2021 | معلق الهند: DCGI;[51] كندا;[37] سويسرا: Swissmedic[36] |
|
| BBIBP-CorV سينوفارم: معهد بكين للمنتجات البيولوجية ، معهد ووهان للمنتجات البيولوجية |
السارس المعطل 2 (خلايا فيرو) | المرحلة 3 (48٬000) عشوائية ، مزدوجة التعمية ، متوازية مضبوطة بدواءالغفل ، لتقييم السلامة والفعالية الوقائية في الإمارات العربية المتحدة ، البحرين ، الأردن,[53] and Argentina[54] [55] تم الإعلان عن النتائج الإيجابية من التحليل المؤقت في 9 ديسمبر 2020.[56][57] |
المرحلة 1–II (320) تحييد الأجسام المضادة في اليوم 14 بعد حقنتين ؛ "التأثيرات الضائرة": ألم في موضع الحقن وحمى ، تكون خفيفة وتنتهي من تلقاء نفسها ؛ لا آثار خطيرة[58] |
جياوزو , | Jul 2020 – Jul 2021 في ابو ظبي | موافق عليه الصين,[59] البحرين,[60] و دولة الامارات المتحدة[61] | موافق عليه الامارات المتحدة[62] |
| Ad5-nCoV كانسينو الحيوية, معهد بكين للتكنولوجيا الحيوية التابع لأكاديمية العلوم الطبية العسكرية ، NPO بيتروفاكس[63][ج] |
ناقلات الفيروسات الغدانية المؤتلفة من النوع 5 | المرحلة 3 (40,000) عالمية متعددة المراكز ، عشوائية ، مزدوجة التعمية ، خاضعة للتحكم بدواء الغفل لتقييم الفعالية والأمان والمناعة في المكسيك,[65] باكستان,[66] روسيا (500),[63] المملكة السعودية العربية[67][68] |
المرحلة 2 (508) تحييد الجسم المضاد واستجابات الخلية التائية. "التأثيرات الضائرة": معتدلة على مدى 7 أيام: 74٪ يعانون من الحمى والألم والتعب[69] |
الصين, | Mar. – Dec. 2020, الصين; Sep. 2020 – Dec. 2021, باكستان; |
||
| كورونافاك[70][71][72] سينوفاك |
السارس المعطل 2 | المرحلة 3 (33,620) مزدوجة التعمية ، عشوائية ، خاضعة للتحكم بدواءالغفل لتقييم الفعالية والأمان في البرازيل(15000);[73] شيلي (3,000);[74] إندونيسيا (1,620); تركيا (13,000)[75] أوقفت البرازيل تجارب المرحلة الثالثة مؤقتًا في 10 نوفمبر بعد انتحار أحد المتطوعين في التجارب قبل استئنافها في 11 نوفمبر.[76] |
المرحلة 2 (600) الاستمناع الذي ينتج عنه انقلاب مصلي 92٪ بجرعة أقل و 98٪ بجرعة أعلى بعد 14 يومًا ؛ "التأثيرات الضائرة": خفيف في الشدة ، ألم في موقع الحقن[77] |
22 في الصين; 22 في البرازيل;[78] باندونغ, اندونيسيا;[79] تركيا[80] |
|
موافق عليه الصين[81] | |
| Gam-COVID-Vac (سبوتنيك ف) معهد بحوث الجمالية للأوبئة والأحياء الدقيقة؛ الاسم التجاري: سبوتنيك ف |
ناقل فيروسي غير متكاثر | المرحلة 3 (40,000) عشوائية مزدوجة التعمية ، مضبوطة بدواء غفل لتقييم الفعالية ، والمناعة ، والسلامة[82] |
المرحلة 1–II (76) |
موسكو, پونه[84] | Jun 2020[83] – May 2021 | موافق عليه روسيا: وزارة الصحة[85] |
|
| mRNA-1273 موديرنا, المعهد الوطني للحساسية والأمراض المعدية, الهيئة الطبية الحيوية المتقدمة |
تشتت الجسيمات النانوية الدهنية التي تحتوي على رنا معدل | المرحلة 3 (30٬000) Interventional; randomized, placebo-controlled study for efficacy, safety, and immunogenicity. تم الإعلان عن النتائج الإيجابية من التحليل المؤقت في 15 نوفمبر 2020.[88] |
المرحلة 1 (45) استجابة الجسم المضاد المعتمد على الجرعة وفقًا لجدول جرعتين ؛ مدة بقاء غير محددة. التأثيرات الضائرة: سخونة ، تعب ، صداع ، ألم عضلي ، وألم في موضع الحقن.[89][90] |
84في الولايات المتحدة | July 2020 – October 2022 | معلق الولايات المتحدة: ادارة الغذاء والدواء[91] الاتحاد الاوروبي: EMA, المملكة المتحدة: MHRA[92] كندا[37] سويسرا: Swissmedic[36] |
|
| Ad26.COV2.S[93][94][95] | ناقل فيروسي غير متكاثر | المرحلة 3 (60٬000) عشوائية ، مزدوجة التعمية ، خاضعة للتحكم بدواءالغفل تم الإيقاف مؤقتًا في 13 أكتوبر 2020 ، بسبب مرض غير مبرر في أحد المشاركين.[96] أعلنت شركة Johnson & Johnson ، في 23 أكتوبر ، أنها تستعد لاستئناف المحاكمة في الولايات المتحدة.[97][98] |
المرحلة 1–II (1٬045) |
291 في الولايات المتحدة والأرجنتين والبرازيل وتشيلي وكولومبيا والمكسيك وبيرو والفلبين وجنوب أفريقيا وأوكرانيا | Jul 2020 – 2023 | معلق كندا[37] |
|
| NVX-CoV2373 نوفافاكس |
جسيمات نانوية بروتين سارس- CoV-2 المؤتلفة مع مادة مساعدة | المرحلة 3 (15٬000) تجربة عشوائية ، معمية من جهة المراقب ،مضبوطة بدواء غفل[100] |
المرحلة 1–II (131) |
المملكة التحدة, كلكتا[102] | Sep 2020 – Jan 2021 | ||
| BBV152 (Covaxin)
بهارات للتكنولوجيا الحيوية, المجلس الهندي للبحوث الطبية |
السارس الغير فعال | Phase III (25,800)
عشوائية ، مزدوجة التعمية ، مضبوطة بدواء غفل [103] |
في انتظار تقرير المرحلة الأولى والثانية | الهند | Nov 2020 – Mar 2022 | معلق الهند: DCGI[104] |
|
| CoVLP[105] | جسيمات نباتية شبيهة بالفيروس معاد تجميعها مع مادة GSK المساعدة | Phase II–III (30,612)
حدث مدفوع ، عشوائي ، مراقب أعمى ، خاضع للتحكم بدواء الغفل[106] |
Phase I (180)
كانت الأجسام المضادة متعادلة في اليوم 42 بعد الحقن الأول (اليوم 21 بعد الحقن الثاني) عند مستويات 10 أضعاف تلك الخاصة بالناجين من COVID-19.[107][108] |
كندا | Nov 2020 – Apr 2022 | ||
| شركة اهونو زيفي لونجكوم بيوفارما للدوائيات | الوحدة الفرعية للبروتين المؤتلف | المرحلة 2 (900) تدخلي عشوائية ، مزدوجة التعمية ، خاضعة للتحكم بدواء الغفل [109] |
المرحلة 1 (50) |
تشونگچينگ | Jun 2020 – Sep 2021 | ||
| CVnCoV كيورڤاك, CEPI |
رنا المعدل | المرحلة 2 (691) مراقب أعمى جزئيًا ، متعدد المراكز ، مضبوطة ، تأكيد الجرعة[111] |
المرحلة 1 (168) |
خنت, 3 في المانيا | Jun 2020 – Aug 2021 | ||
| INO-4800 إينوفيو, CEPI,مراكز كوريا الوطنية , المعهد الدولي للقاحات |
تسليم بلازميد الدنا بواسطة electroporation | المرحلة 1–II (40) |
في انتظار تقرير المرحلة الأولى | 3 في الولايات المتحدة, سيول | Apr – Nov 2020 | ||
| EpiVacCorona فيكتور |
لقاح يعتمد على مستضدات الببتيد | المرحلة 1–II (100) دراسة عشوائية بسيطة ، معمية ، مضبوطة بدواء الغفل ، للسلامة ، نشوءالتفاعل والمناعة[114] |
في انتظار تقرير المرحلة الأولى والثانية | روسيا | Jul 2020[114] – ? | ||
| غير مسمي الأكاديمية الصينية للعلوم الطبية |
السارس الغير فعال | المرحلة 1–II (942) عشوائية ، مزدوجة التعمية ، أحادية المركز ، خاضعة للتحكم بالغفل |
چنگدو | Jun 2020 – Sep 2021 | |||
| AG0301-COVID‑19 شركة AnGes |
بلازميد دنا | المرحلة 1–II (30) غير عشوائية ، مركز واحد ، جرعتان |
أوساكا | Jun 2020 – Jul 2021 | |||
| Lunar-COV19/ARCT-021[118][119] | مرسال الحمض النووي الريبي | المرحلة 1–II (92) عشوائية ، مزدوجة التعمية |
سنغافورة | Aug 2020 – ? | |||
| COVID‑19/aAPC معهد شنتشن للمناعة الوراثية الطبي |
ناقل Lentiviral مع minigene يعدل aAPCs | المرحلة 1 (100) |
شنژن | Mar 2020 – 2023 | |||
| LV-SMENP-DC معهد شنتشن للمناعة الوراثية الطبي[121] |
ناقل Lentiviral مع minigene معدل DCs | المرحلة 1 (100) |
شنژن | Mar 2020 – 2023 | |||
| LNP-nCoVsaRNA MRC وحدة التجارب السريرية في إمپريال كولدج لندن |
مرسال الحمض النووي الريبي | المرحلة 1 (105) تجربة عشوائية ، مع دراسة تصعيد الجرعة (15) ودراسة سلامة موسعة (200 على الأقل)) |
4 في المملكة المتحدة | Jun 2020 – Jul 2021 | |||
| GX-19 جينيكسن كونسورتيوم,[126] المعهد الدولي للقاحات |
الدنا | المرحلة 1 (40) |
سيول | Jun 2020 – Jun 2022 | |||
| SCB-2019 [129] گلاكسو سميث كلاين |
وحدة فرعية سبايك بروتين ثلاثي مع مادة GSK المساعدة | المرحلة 1 (150) |
برث | Jun 2020 – Mar 2021 | |||
| COVAX-19 فاكسين Pty Ltd[131] |
البروتين المؤتلف | المرحلة 1 (40) |
أدليد | Jun 2020 – Jul 2021 | |||
| غير مسمي أكاديمية جيش التحرير الشعبى الصينى للعلوم العسكرية والفاكس للتكنولوجيا الحيوية |
مرسال الحمض النووي الريبي | المرحلة 1 (168) |
2 في الصين | Jun 2020 – Dec 2021 | |||
| SARS-CoV-2 Sclamp/V451 جامعة كوينزلاند , ساينوس للصحة, CEPI, Seqirus |
استقر المشبك الجزيئي بروتين سبايك مع MF59 | المرحلة 1 (120) عشوائية ، مزدوجة التعمية ، خاضعة للتحكم بالغفل ، نطاق الجرعة |
بريزبين | Jul – Oct 2020 |
- ^ Latest Phase with published results.
- ^ The range from the actual start date of Phase I to the estimated primary completion date of Phase III, when available.
- ^ Serum Institute of India will be producing the ChAdOx1 nCoV-19 vaccine for India[39] and other low and middle income countries.[40]
- ^ Oxford name: ChAdOx1 nCoV-19. Manufacturing in Brazil to be carried out by Oswaldo Cruz Foundation.[41]
- ^ Manufacturing partnership with the National Research Council of Canada and Canadian Center for Vaccinology, Halifax, Nova Scotia[64]
- ^ South Korean Phase I–II in parallel with Phase I in the US
الأبحاث ما قبل السريرية

في أبريل ، أصدرت منظمة الصحة العالمية بيانًا يمثل العشرات من علماء اللقاحات حول العالم ، وتعهدت بالتعاون لتسريع تطوير لقاح ضد COVID‑19.[135] يشجع تحالف منظمة الصحة العالمية التعاون الدولي بين المنظمات التي تطور مرشحي اللقاحات ، ووكالات التنظيم والسياسات الوطنية ، والمساهمين الماليين ، وجمعيات الصحة العامة ، والحكومات من أجل تصنيع لقاح ناجح في نهاية المطاف بكميات كافية لإمداد جميع المناطق المتضررة ، ولا سيما البلدان منخفضة الموارد.[3] يظهر تحليل الصناعة لتطوير اللقاح تاريخياً معدلات فشل 84-90٪.[3][136]
نظرًا لأن COVID-19 هو هدف جديد للفيروسات لا يزال يتم اكتشاف الخصائص ويتطلب تقنيات لقاحات مبتكرة واستراتيجيات تطوير ، فإن المخاطر المرتبطة بتطوير لقاح ناجح عبر جميع خطوات البحث قبل السريري والسريري عالية.[3] لتقييم احتمالية فعالية اللقاح ، يتم تطوير محاكاة حاسوبية غير مسبوقة ونماذج حيوانية جديدة خاصة بـ COVID-19 ، ولكن هذه الطرق لا تزال غير مجربة بخصائص غير معروفة لفيروس COVID-19 ، ويتم تنظيمها متعددة الجنسيات خلال عام 2020.[3] من بين المرشحين المؤكدين للقاحات النشطة ، يتم تطوير حوالي 70 ٪ من قبل الشركات الخاصة ، مع المشاريع المتبقية قيد التطوير من قبل الأكاديميات والتحالفات الحكومية والمنظمات الصحية..[3] Mمعظم مطوري اللقاحات هم شركات صغيرة أو فرق بحث جامعية مع خبرة قليلة في تصميم اللقاحات الناجح وقدرة محدودة على تكاليف التجارب السريرية المتقدمة والتصنيع بدون شراكة من قبل شركات الأدوية متعددة الجنسياs.[3] يشمل التوزيع الجغرافي العام لتطوير لقاح COVID-19 منظمات في الولايات المتحدة وكندا ، حيث تمتلك معًا حوالي 46 ٪ من أبحاث اللقاحات النشطة في العالم ، مقارنة بـ 36 ٪ في البلدان الآسيوية ، بما في ذلك الصين ، و 18 ٪ في أوروبا.[3]
في أوائل أبريل ، ذكر علماء CEPI أن 115 مرشحًا للقاح قيد التطوير إما كمشاريع "استكشافية / قبل سريرية" أو في تجارب السلامة للمرحلة الأولى في المشاركين من البشر[3]يستمد الجدول أدناه من تتبع المصادر العامة لإحراز تقدم بشأن مرشحي اللقاحات الناشئة المقرر إجراؤه في تجارب المرحلة الأولى في عام 2020.[4]
تجارب المرحلة الأولى المجدولة في 2020
لن يحصل العديد من مرشحي اللقاحات قيد التصميم أو التطوير قبل السريري لـ COVID-19 في عام 2020 على الموافقة على الدراسات البشرية بسبب السمية أو عدم الفعالية للحث على الاستجابات المناعية أو فشل الجرعات في حيوانات المختبر ، أو بسبب نقص التمويل.[137][138] احتمال نجاح مرشح لقاح الأمراض المعدية لتخطي الحواجز قبل السريرية والوصول إلى المرحلة الأولى من الاختبار البشري هو 41-57 ٪ .[137]
يمثل الالتزام بإجراء أول اختبار على البشر لمرشح اللقاح تكلفة رأسمالية كبيرة لمطوري اللقاحات ، والتي تقدر بنحو 14 إلى 25 مليون دولار أمريكي لبرنامج نموذجي للمرحلة الأولى ، ولكن ربما تصل إلى 70 مليون دولار أمريكي.[137][139] على سبيل المقارنة ، خلال جائحة فيروس ايبولا 2013-16 ، كان 37 مرشحًا لقاح قيد التطوير ، ونجح واحد فقط في الحصول على ترخيص بتكلفة إجمالية لتأكيد الفعالية في تجارب المرحلة الثانية بنحو مليار دولار أمريكي .[137]
| كوڤيد-19: التجارب من مرحلة واحدة المجدولة في 2020 | ||
|---|---|---|
| اللقاح المرشح
(المطور) |
التكنولوجيا | تاريخ البدء المعلن |
| لم يسمى
(سينوفاتش ؛ داينافاكس) |
الفيروس المعطل (الفورمالديهايد المعطل + الشب) | أبريل |
| NVX-CoV2373
(نوفافاكس) |
وحدة البروتين ، الجزيئات النانوية | مايو |
| BNT162
(بيونتك; فوسن فارما; فايزر) |
رنا | أبريل–مايو |
| DPX-COVID-19
(IMV, Inc., |
الوحدة الفرعية للبروتين ، والتوصيل القائم على الدهون | منتصف-2020 |
| PittCoVacc | وحدة البروتين ، صفائف ميكرونيدل | منتصف-2020 |
| لم يسمى | وحدة البروتين ، بروتين S | منتصف-2020 |
| لم يسمى | رنا; تنشيط صغير للرنا | منتصف-2020 |
| CureVac
(CEPI) |
رنا, مرسال الحمض الريبي النووي | منتصف-2020 |
| LUNAR-COV19
(اركترس للدوائيات, |
رنا
, مرسال الحمض الريبي النووي |
منتصف-2020 |
| لم يسمى | وحدة البروتين ، بروتين S | منتصف-2020 |
| لم يسمى
(بيولوجيا كوبرا, معهد كارولينسكا) |
بلازميد الدنا | منتصف-2020 |
| لم يسمى
(Medicago, Inc.) |
الجسيمات الشبيهة بالفيروسات المشتقة من النباتات | يوليو–أغسطس |
| لم يسمى | ناقل فيروسي غير متناسخ | سبتمبر |
| لم يسمى
(العلوم الحيوية SK , حكومة ساسكاتشوان |
الوحدات الفرعية لمستضد COVID-19 | سبتمبر |
| CoroFlu | فيروس الانفلونزا المفيد ذاتيا | أواخر 2020 |
| لم يسمى
(تاكيس; علوم الدنا التطبيقية ; ايفيفاكس) |
دنا | أواخر 2020 |
| AdCOVID
(Altimmune; جامعة ألاباما في برمنغهام ) |
ناقل فيروسي غير متناسخ; عبر الانف | أواخر 2020 |
| لم يسمى
(فاكسارت; ايمرجنت للحلول الحيوية) |
ناقل فيروسي غير متناسخ; فموي | أواخر 2020 |
| لم يسمى
( لقاحات VBI; مجلس البحوث الوطني الكندي) |
فيروس كورونا الشامل | مع نهاية السنة |
أبحاث بمساعدة الحاسوب الفائق
في مارس 2020 ، قامت الحكومة الأمريكية والصناعة وثلاث جامعات بتجميع الموارد للوصول إلى أجهزة الكمبيوتر العملاقة من آيبيإم ، إلى جانب موارد الحوسبة السحابية من منشأة هيوليت باكارد و امازون و مايكروسوفت و جوجل .[140][141] Tيتم استخدام اتحاد الحوسبة عالية الأداء COVID-19 للتنبؤ بانتشار الأمراض ، ونمذجة اللقاحات المحتملة ، وفحص آلاف المركبات الكيميائية لتصميم لقاح أو علاج COVID-19 .[140][141]
اتحاد إضافي من مايكروسوفت ، وست جامعات (بما في ذلك معهد مساتشوستس للتكنولوجيا ، وهو عضو في الاتحاد الأول) ، والمركز الوطني لتطبيقات الحواسيب العملاقة في إلينوي ، يعملون تحت رعاية C3.ai ، وهي شركة أسسها مطور برامج الملياردير توماس سيبل يقوم حاليًا بتجميع موارد الكمبيوتر العملاق لنفس الاستخدامات الموضحة أعلاه ، إلى جانب تطوير البروتوكولات الطبية وتعزيز استراتيجيات الصحة العامة حول العالم ، بالإضافة إلى اعطاء منح كبيرة للباحثين الذين يقترحون استخدام الذكاء الاصطناعي لتنفيذ مهام مماثلة بحلول مايو . يسمى الكونسورتيوم معهد التحول الرقمي C3.ai. .[142][143]
لقاحات غير محددة
بعض اللقاحات لها تأثيرات غير متجانسة ، تسمى أيضًا التأثيرات غير المحددة. هذا يعني أنه يمكن أن يكون لديهم فوائد تتجاوز المرض الذي يمنعونه .[144] لقاح مكافحة السل ، لقاح عصية كالمت-گيران ، هو مثال يتم اختباره لتحديد ما إذا كان له تأثير وقائي ضد COVID-19 ، وفقًا للتأكيدات التي تفيد بأن وفيات COVID-19 كانت أقل في البلدان التي تعطي لقاح عصية كالمت-گيران الروتيني .[145]
في مارس 2020 ، بدأت تجربة عشوائية من لقاح عصية كالمت-گيران للحد من مرض COVID-19 في هولندا ، سعياً لتجنيد 1000 من العاملين في مجال الرعاية الصحية[146] تسعى تجربة عشوائية أخرى في أستراليا إلى ادراج 4170 عاملاً في الرعاية الصحية .[147][148] سيتم توظيف 700 عامل رعاية صحية آخر من بوسطن وهيوستن في تجربة أخرى ,[149] و 900 عامل رعاية صحية في مصر في تجربة مسجلة بواسطة جامعة في القاهرة .[150]
في 12 أكتوبر 2020، أعلنت شركة جونسون آند جونسون تعليقها بصفة مؤقتة تجاربها السريرية للقاح كوڤيد-19 بعد إصابة أحد المتطوعين في الدراسة بمرض لا تفسير له، مما أدى إلى تعطل أحد أكبر الجهود المبذولة لاحتواء الوباء العالمي. وقالت الشركة في بيان إن مرض المتطوع يخضع لمراجعة وتقييم لجنة مستقلة لمراقبة البيانات والسلامة، فضلاً عن أطباء الشركة وأطباء السلامة.[151]
وأضافت الشركة، إن مثل هذا التعليق المؤقت يعد أمراً طبيعياً في حالة التجارب الكبرى، التي يمكن أن تشمل عشرات الآلاف من الأشخاص، وقالت إن تعليق الدراسة، من حيث إعطاء جرعات اللقاح المتوقع، يختلف عن التوقف التنظيمي الذي تطلبه السلطات الصحية.
وتأتي خطوة جونسون أند جونسون بعد إجراء مماثل اتخذته شركة أسترازنكا في سبتمبر 2020، والتي سبق أن علقت تجارب مراحل متأخرة من لقاحها التجريبي لڤيروس كورونا، تطوره بالتعاون مع جامعة أكسفورد، بسبب مرض لا يمكن تفسيره لأحد المتطوعين في الدراسة البريطانية.
وعلى الرغم من استئناف التجارب في بريطانيا والبرازيل وجنوب أفريقيا والهند، لا تزال التجارب الأمريكية معلقة بسبب المراجعة التنظيمية.
وكانت جونسون آند جونسون قد أعلنت في سبتمبر 2020 أن لقاحها التجريبي لكوڤيد-19 حفز استجابة مناعية قوية ضد ڤيروس كورونا المستجد في تجاربة سريرية، من مرحلة مبكرة إلى مرحلة متأخرة، بعد ذلك بدأت الشركة إجراء تجربة نهائية تشمل 60.000 شخص، وكان من المتوقع إعلان نتائجها قبل نهاية 2020 أو أوائل عام 2021.
ورفضت الشركة الإفصاح عن المرض بسبب مخاوف تتعلق بالخصوصية، وقالت إن بعض المشاركين في الدراسات يحصلون على دواء وهمي، ولم يكن واضحاً دائماً إذا كان الشخص الذي يعاني من شيء ضار خطير في تجربة سريرية قد حصل على دواء وهمي أم علاج.
في 21 أكتوبر 2020، أعلنت أسترازِنـِكا عن استمرار تجاربها السريرية على لقاح كوڤيد-19 بعد وفاة متطوع في البرازيل، التي تُجريها الشركة بالتعاون مع جامعة أكسفورد.[152] كان المتطوع، طبيب عمره 28 سنة، يعمل منذ مارس 2020 في علاج مرضى كوونا. وفي الوقت نفسه، ذكرت صحيفة برازيلية أن المتطوع قد تلقى علاجاً وهمياً وليس اللقاح الخاضع للتجارب.[153]
لقاحات قيد التطوير
في 2 مارس 2021، أعلنت شركة مرك الأمريكية تعاونها مع منافستها جونسون أند جونسون لتطوير لقاح خاص لڤيروس كورونا ذي الجرعة الواحدة.[154]
يمتد تاريخ مرك في صناعة اللقاحات لمائة عام. ففي الولايات المتحدة، تعتبر هي المورد الوحيد للقاح الأطفال الثلاثي الذي يحمي من الحصبة والنكاف والحصبة الألمانية. كما أنها طورت لقاح للوقاية من ڤيروس الورم الحليمي البشري، وحصلت على موافقة إدارة الغذاء والدواء على لقاح إيبولا في عام 2019. لكن الشركة، التي تصنع اللقاحات في ولاية كارولينا الشمالية وپنسلفانيا وأماكن أخرى) فشلت في سعيها لتطوير لقاح لفيروس كورونا. حيث أعلنت في 25 يناير أنها أوقفت العمل على لقاحين تجريبيتين للڤيروس بعد فشلهما في تحفيز ما يكفي من الأجسام المضادة في المرحلة الأولى من التجارب السريرية.
تبحث شركة جونسون وجونسون عن ضم طاقات تصنيع مساعدة حول العالم لكي يمكنها إنتاج جرعات من اللقاح على نطاق عالمي. وكشفت عن أكثر من 6 شراكات تصنيع في 4 قارات، قالت إنها تم اختيارها من أكثر من 100 مرشح. وقالت الشركة إنها ستشحن فورًا ما يقرب من 4 ملايين جرعة في الولايات المتحدة، وما مجموعه 20 مليونًا بنهاية مارس 2021، و100 مليون جرعة بحلول نهاية يونيو كمراحل لتحقيق هدفها المتمثل في تصنيع مليار جرعة في جميع أنحاء العالم بحلول نهاية العام.
كما أعلنت شركة سانوفي الفرنسية (التي فشل لقاحها في التجارب السريرية) أنها ستساعد هي الأخرى جونسون وجونسون في خطوات الإنتاج النهائية والتعبئة في القوارير في أوروپا، حيث تبلغ الطاقة المتوقعة من مصنع سانوفي في فرنسا 12 مليون جرعة في الشهر.
تستغرق عملية التصنيع وقتًا طويلاً حيث تقوم الشركة بتخمير دفعات كبيرة من لقاحها في مفاعلات حيوية (تستغرق خطوة التخمير هذه من 6 إلى 8 أسابيع). ثم يجب وضع اللقاح في صيغته النهائية واختبار نقاءه والقيام بملء وتعبئة وغلق وتغليف زجاجات اللقاح (الأمر الذي يستغرق من 5 إلى 6 أسابيع أخرى).
في الولايات المتحدة وأوروپا، خلقت عملية التعبئة والتغليف النهائية هذه اختناقات في جميع أنحاء الصناعة. لذا ستساعد المساهمات في عمليات الانتاج، والمساهمات في عمليات التعبئة والتغليف النهائية في زيادة الطاقة الانتاجية وتسريع توفير ملايين الجرعات الإضافية من تلك اللقاحات.
اللقاح الكوبي
 مقالة مفصلة: لقاح عبد الله
مقالة مفصلة: لقاح عبد الله
في 22 يونيو 2021، أعلنت مجموعة دوائية حكومية كوبيةأنّ عبد الله، اللّقاح التجريبي الذي يطوّره أحد مختبراتها لمكافحة ڤيروس كورونا في سابقة في أمريكا اللاتينية، أظهر أنّه فعّال ضدّ كوڤيد-19 بنسبة 92.28 بالمئة.[155]
وفي تغريدة على تويتر قالت مجموعة بيوكوبافارما، التي يتبع لها "مركز الهندسة الوراثية والتكنولوجيا الحيوية"، إنّ "عبد الله، اللّقاح الذي يطوّره مركز الهندسة الوراثية والتكنولوجيا الحيوية، يظهر فعالية بنسبة 92.28 بالمئة بعد 3 جرعات".
وبلغ هذا اللّقاح التجريبي المرحلة النهائية من التجارب السريرية ومن المتوقّع أن يحصل في أواخر يونيو أو مطلع يوليو على ترخيص رسمي من السلطات الكوبية باستخدامه. وسارع الرئيس الكوبي ميگل دياز-كانل إلى تهنئة بلاده على هذا الإنجاز. وفي تغريدة على تويتر، قال دياز-كانيل الذي تخضع بلاده لحظر أميركي إنّ "علماءنا في معهد فينلاي ومركز الهندسة الوراثية والتكنولوجيا الحيوية الذين يواجهون جائحتين (كوڤيد والحظر) تغلّبوا على كلّ الصعاب وأعطونا لقاحين فعّالين للغاية: سوبيرانا 2 وأبدالا".
وكان معهد فينلاي للّقاحات أعلن السبت أنّ لقاح "سوبيرانا 2" الذي يطوّره يؤمّن فعالية بنسبة 62 بالمئة بعد تناول الجرعة الثانية من ثلاث جرعات يجب أن يتلقّاها المرء لتحصينه بالكامل ضدّ كوفيد-19.
وقال يومها مدير المعهد فيثنتي بيريز للصحفيين إنّ هذه النتيجة "مريحة" لأنّها تشمل النسخ المتحوّرة من الفيروس المنتشرة حالياً في كوبا.
ومن المتوقّع أن يحصل هذا اللقاح التجريبي أيضاً على الترخيص الرسمي باستخدامه قريباً.
وإذا حصل هذان اللّقاحان على التراخيص كما هو متوقّع ستصبح كوبا أول دولة في أمريكا اللاتينية تطوّر لقاحات مضادّة لكوڤيد-19 وتنتجها على الرّغم من الصعوبات، التي يواجهها علماؤها بسبب الحظر الأمريكي المفروض عليها منذ 1962 والذي تم تشديده في عهد رئيس الولايات المتّحدة السابق دونالد ترامب. وبسبب هذا الحظر باشرت كوبا منذ الثمانينيات بتطوير أدويتها الخاصة. وثمانية من اللّقاحات الـ13، التي تستخدمها الجزيرة في حملة التلقيح، محليّة الصنع.
وحدّدت الحكومة الكوبية هدفاً يقضي بتلقيح 70 بالمئة من سكان البلاد البالغ عددهم 11.2 مليون نسمة بحلول أغسطس، على أن يتم تلقيح الجميع قبل نهاية السنة. واشتق اسم اللقاح من مسرحية عبد الله التي ألفها شاعر كوبا الشهير خوسيه مارتي الراحل عام 1895 عن 42 عاماً، والمعروف بميله للعرب وتمجيدهم في كثير من قصائده، إلى درجة جعل معظم أبطال قصائده منهم، كبطل المسرحية الشعرية التي ألفها في شبابه، وجعل من شاب مصري من النوبة بطلها، واسمه عبدالله.
اللقاح البخاخة-الصيني
في 5 ديسمبر 2022، أعلنت السلطات الوطنية الصينية عن اعتماد بخاخة لقاح لكوڤيد-19. البخاخة طورها يوين كوك-يونگ، أستاذ الأحياء الدقيقة في جامعة هونگ كونگ وفريقه بالتعاون مع جامعة شيامن في البر الرئيسي وشركة أدوية صينية.
وقال يوين: "المعنى الأكبر هو أن هونگ كونگ صنعت لقاحًا بنفسها لأول مرة وحصلت على موافقة من إدارة المنتجات الطبية الوطنية لاستخدامها في حالات الطوارئ في النهاية". بدأت جامعة هونگ كونگ وجامعة شيامن وشركة وانتاي الصينية للأدوية ومقرها بكين تجارب سريرية على لقاح رذاذ لأنف في مارس 2022، بعد أن أعطتها سلطات البر الرئيسي الضوء الأخضر. وأكدت شركة الأدوية في بيانها أن لقاح رذاذ الأنف حصل على موافقة لاستخدامه في حالات الطوارئ في البر الرئيسي.[156]
قال يوين إنه سيكون قرارًا تجاريًا يخص شركة وانتاي في أن تقرر تقديم طلبًا للاستخدام الطارئ للقاح في المدينة.
وقالت الشركة إن المرحلة الثالثة من التجارب السريرية للقاح الجديد، والتي أجريت في جنوب أفريقيا والفلپين وكولومبيا وڤيتنام، قد اكتملت وتم الحصول على المعلومات الأساسية. كما تم النتهاء من تحليل البيانات الرئيسية التي جُمعت الشهر الماضي، نوفمبر 2022. تم الانتهاء من أول مرحلتين من التجارب السريرية في البر الرئيسي وفي هونگ كونگ. وُجد أن اللقاح آمناً في المراحل السريرية الثلاثة.
أظهر اللقاح في المرحلة الثالثة أن فعالية تزيد عن 80% ضد متغير أوميكرون على السكان الذين تم تلقيحهم في وقت سابق بلقاح معطل، وكان فعالًا بنسبة 55% في السكان غير الملقحين. تهدف لقاحات الأنف، بدخولها الجسم بنفس طريقة الڤيروس، إلى بناء مناعة في الغشاء المخاطي الذي يبطن الأنف والفم.
يمكن أن يمنع هذا من إصابة الأشخاص في المقام الأول - ويحتمل أيضًا أن يمنع الأشخاص الذين أصيبوا بكوڤيد-19 من نقل العدوى للآخرين.
قال يوين إن ميزة لقاح رذاذ الأنف، الذي استخدم ڤيروس الإنفلونزا كناقل في التصميم، هو أنه يمكن أن يحفز المناعة الجهازية ليس في الدم، ولكن في الأغشية المخاطية للأنف والحنجرة، وبالتالي يمنع ڤيروس كورونا من الوصول لنقطة الإصابة لدخول الجسم. يُعطى اللقاح بواسطة محقنة ذات طرف خاص مصمم لإخراج رذاذ.
واقترحت جامعة هونگ كونگ أن المجموعات ذات الأولوية للقاح الجديد يمكن أن تشمل كبار السن والمجموعات المعرضة لخطر الإصابة بأمراض كامنة. لم يتم تغطية الأطفال الصغار في التجارب السريرية. وقال يوين أن لقاح الأنف سيكون بمثابة مكمل، ولكن ليس كبديل للقاح التقليدي. وقالت شركة وانتاي للأدوية في بكين إنها تخطط لإنتاج 200 مليون جرعة من اللقاح في الأشهر الستة المقبلة.
وصرح مكتب الصحة في هونگ كونگ أنه لم يتلق أي طلب للاستخدم الطاريء. قالت شركة البيانات الصحية Airfinity and Nature في سبتمبر إن حوالي 100 لقاح من لقاح كوڤيد-19 للأنف قيد التطوير في جميع أنحاء العالم، مع اختبار حوالي 20 على البشر.
لقاحات مستخدمة
 مقالة مفصلة: مقارنة لقاحات كوڤيد-19
مقالة مفصلة: مقارنة لقاحات كوڤيد-19
|
|
| مطور/راعي اللقاح | بلد المنشأ | النع (التكنولوجيا) | الجرعات، الفترات الفاصلة | درجة حرارة التهزين | المرحلة الحالية (المشاركون) | التصريح |
|---|---|---|---|---|---|---|
| لقاح فايزر-بيونتك (Comirnaty) بيونتك، فايزر |
الولايات المتحدة، ألمانيا | الرنا (modRNA في الجسيمات النانوية الدهنية) |
2 جرعة 3 – 4 أسابيع |
-70±10 °س (ULT) |
المرحلة 3 (43,448) عشوائية، خاضعة للتحكم الوهمي. |
الطواريء (35)
|
| لقاح سپوتنيك ڤ معهد گماليا لأبحاث علم الأوبئة وعلم الأحياء الدقيقة |
روسيا | ناقل ڤيروسي غداني (مؤشب Ad5 وAd26) |
2 جرعة 3 أسابيع |
-18 °س (المجمد) |
المرحلة 3 (40,000) عشوائية مزدوجة التعمية، تحت سيطرة وهمية لتقييم الفعالية، والمناعة، والسلامة.[224] |
الطواريء (43)
|
| لقاح أكسفورد-أسترازِنـِكا (Covishield) جامعة أكسفورد، أسترازِنـِكا، CEPI |
المملكة المتحدة، السويد | ناقل ڤيروسي غداني (ChAdOx1) |
2 جرعة 4 – 12 أسبوع |
2 – 8 °س |
المرحلة 3 (30٬000) تدخلية، عشوائية، تحت سيطرة وهمية للتقييم الفعالية، والمناعة، والسلامة.[45] |
الطواريء (33)
|
| BBIBP-CorV سينوفارم: معهد بكين للمنتجات الحيوية، معهد ووهان للمنتجات الحيوية |
الصين | سارس‑كوڤ‑2 خامل (خلايا ڤيرو) |
2 جرعة 3 – 4 أسابيع |
2 – 8 °س |
المرحلة 3 (48٬000) عشوائية، مزدوجة التعمية، موازية، تحت سيطرة وهمية، لتقييم السلامة والفعالية الوقائية. |
الطواريء (22)
|
| كوروناڤاك[70][71][359] سينوڤاك |
الصين | سارس‑كوڤ‑2 [[لقاح خامل|خامل (خلايا ڤيرو) |
2 جرعة 2 أسبوع |
2 – 8 °س |
المرحلة 3 (33,620) مزدوجة التعمية، عشوائية، خاضعة للتحكم الوهمي لتقييم الفعالية والسلامة. |
الطواريء (19)
|
| لقاح مودرنا مودرنا، NIAID، BARDA، CEPI |
الولايات المتحدة | رنا (modRNA في الجسيمات الدهنية) |
2 جرعة 4 أسابيع |
-20±5 °س (المجمد) |
المرحلة 3 (30٬000) تدخلية؛ دراسة عشوائية تحت سيطرة وهمية، من أجل الفعالية والسلامة والمناعة. |
الطواريء (9)
|
| لقاح جونسون أند جونسون[397][398] يانسن للأدوية (جونسون أند جونسون)، BIDMC |
الولايات المتحدة، هولندا | ناقل ڤيروسي غداني (مؤشب Ad26) |
1 جرعة [400] | 2 – 8 °س [400] | المرحلة 3 (40,000) عشوائية، مزدوجة التعمية، تحت سيطرة وهمية. |
الطواريء (7)
|
| BBV152 (Covaxin) بارات بيوتك، المجلس الهندي للأبحاث الطبية |
الهند | سارس‑كوڤ‑2 خامل (خلايا ڤيرو) |
2 جرعة 4 أسابيع |
2 – 8 °س |
المرحلة 3 (25٬800) عشوائية، مراقبة-معماة، تحت سيطرة وهمية.[415] |
الكامل (0)
|
| Ad5-nCoV (Convidicea) كانسينو، بيولجيكس، معهد بكين للتقنية الحيوية |
الصين | ناقل ڤيروسي غداني مؤشب Ad5) |
1 جرعة[418] | 2 – 8 °س[418] | المرحلة 3 (40,000) عالمية متعددة المراكز، عشوائية، مزدوجة التعمية، تحت سيطرة وهمية لتقييم الفعالية والسلامة والمناعة. |
الكامل (0)
|
| إپيڤاككورونا معهد ڤكتور |
روسيا | وحدة فرعية (پپتيدي) |
2 جرعة 3 – 4 أسابيع |
2 – 8 °س |
المرحلة 3 (40,000) عشوائية مزدوجة التعمية، تحت سيطرة وهمية لتقييم الفعالية، والمناعة، والسلامة. |
|
| CoviVac[427] مركز تشوماكوڤ في الأكاديمية الروسية للعلوم |
روسيا | سارس‑كوڤ‑2 خامل |
2 جرعة 2 أسبوع |
2 – 8 °س |
المرحلة 3 (3٬000) مزدوجة التعمية، عشوائية، تحت سيطرة وهمية لتقييم الفعالية والسلامة. |
الطواريء (1)
الكامل (0)
|
| ZF2001 (RBD-دايمر)[16] آنهوي ژيفيْ لونگكوم للأدوية |
الصين | وحدة فرعية (مؤشب) | 3 جرعات 30 يوم |
المرحلة 3 (29,000) عشوائية، مزدوجة التعمية، تحت سيطرة وهمية[431] |
الكامل (0)
|
اللقاح الروسي
 مقالة مفصلة: Gam-COVID-Vac
مقالة مفصلة: Gam-COVID-Vac
أجازت الجهات التنظيمية الروسية لقاح سپوتنيك-ڤي للاستخدام المحلي في أوائل أغسطس بعد تجارب أولية بشرية على نطاق محدود. ويجري اختبار اللقاح حالياً على 40 ألف شخص في روسيا في تجربة بدأت في 26 أغسطس 2020.
وعلى نحو منفصل، نقلت وكالة الإعلام الروسية، عن هيئة حماية حقوق المستهلك الروسيةالقول، إن موسكو أتمت تجارب سريرية للقاح ثان محتمل لكوڤيد-19 طوره معهد ڤيكتور في سيبيريا. وكان المعهد قد انتهى في سبتمبر 2020 من مرحلة التجارب الأولية البشرية وتعرف بالمرحلة 2.
في 30 سبتمبر 2020، أعلنت روسيا أنها أبرمت اتفاقاً مع مصر لإمدادها بخمسة وعشرين مليون جرعة من لقاحها ڤيروس كورونا الروسي (سپوتنيك-ڤي). وحسب صندوق الثروة السيادي الروسي، سيتم توريد جرعات اللقاح إلى مصر عبر شركة فاركو المصرية للأدوية.[435]
وأفاد الصندوق، بأن الاتفاق يأتي بعد اتفاقات أُبرمت في وقت سابق مع المكسيك لتوريد 32 مليون جرعة ومع البرازيل لتوريد ما يصل إلى 50 مليون جرعة ومع الهند لتوريد 100 مليون جرعة وأيضاً مع أوزبكستان ونيبال.
فايزر-بيونتك
في 8 ديسمبر 2020، تداولت أخبار عن وفاة 6 أشخاص خلال التجارب التي أجريت على لقاح فايزر وبيونتك المضاد المضاد لڤيروس كورونا المستجد. في اليوم التالي، 9 ديسمبر، أصدرت إدارة الغذاء والدواء الأمريكية بياناً رسمياً حول الأسباب الحقيقة لوفاة الضحايا، منهاإصابة أحد الأشخاص بالسمنة وتصلب الشرايين، ووفاته بعد ثلاثة أيام من تناول الجرعة الأولى من العقار، فيما أصيب المتطوع الثاني المتوفى بسكتة قلبية بعد 60 يوماً من الجرعة الثانية، وأضافت: "توفى من بين المتلقين للقاح اثنان تلقوا لقاح وهمي، وجاءت الوفاة نتيجة نوبة قلبية وسكتة دماغية، فيما يجري تحديد سبب وفاة شخصين آخرين"، وأكدت أنه لا توجد حالات من الوفيات الست مرتبطة باللقاح، وأضافت أن متلقي اللقاح يبدأون في إنتاج الأجسام المضادة لكورونا، خلال 10 أيام من حصولهم على الجرعة الأولى.[436] [437]
في يوليو 2021، بدأت الشركتان المصنعتان في إجراءات الحصول على تصريح من أجل جرعة ثالثة.
وقالت الشركتان، إنّ "(فايزر) و(بايونتيك) لاحظتا أنّ هناك نتائج مشجّعة للتجارب الجارية على جرعة ثالثة من اللقاح الحالي"، وأضافتا أنّهما تتّجهان "لتقديم هذه البيانات إلى إدارة الغذاء والدواء الأميركية ووكالة الأدوية الأوروبية وسواهما من السلطات التنظيميّة في الأسابيع المقبلة".
وتابع بيان الشركتين "تُظهر البيانات الأولية للدراسة أنّ جرعة تحصين تُعطى بعد 6 أشهر على الجرعة الثانية" توفّر "مستويات عالية من الأجسام المضادّة" للفيروس، بما في ذلك ضدّ المتحوّرة "بيتا" التي ظهرت في جنوب أفريقيا. وهذه المستويات "أعلى بنسبة 5 إلى 10 مرّات" من تلك التي شوهدت بعد تلقّي الجرعتين الأوليين.
كما لفتتا إلى أنّ لقاحهما أظهر نتائج جيّدة في المختبر ضدّ المتحوّرة "دلتا"، وبالتالي فإنّ جرعة ثالثة ستكون قادرة على تعزيز المناعة ضدّ هذه المتحوّرة أيضاً. وقالتا، إنّ هناك اختبارات جارية "لتأكيد هذه الفرضيّة".[438]
اللقاح الصيني

في 13 ديسمبر 2020، أوقفت بيرو، كإجراء احترازي، التجارب السريرية للقاح طوره المختبر الصيني سينوفارم، بعد اكتشاف مشكلات عصبية لدى أحد المتطوعين، وقرر المعهد الوطني للصحة تعليق التجارب السريرية بهدف حماية المتطوعين في المرحلة الثالثة من التجارب، بعد أن تعرض أحد المتطوعين لصعوبات في تحريك ساقيه جراء وعكة صحية أصابته.[439]
في 27 يناير 2021، أعلنت جامعة كايتانو هيرديا في پيرو، التي تجرب على تجارب لقاح سينوفارم الصيني المضاد لڤيروس كورونا، أن متطوعة توفيت بالالتهاب الرئوي المرتبط بكورونا.[440] وقالت الجامعة المشاركة في الدراسة بإرشادات من هيئة الرقابة الصحية في پيرو إنها كشفت طبيعة مشاركة المتطوعة في التجربة وتوصلت إلى أنها كانت في مجموعة اللقاح الوهمي. وقالت الجامعة في بيان "من المهم أن نؤكد أن وفاة المتطوعة المشاركة لم تكن بسبب اللقاح لأنها تلقت اللقاح الوهمي وعليه فإننا سنقدم تقريراً للهيئة الرقابية المعنية وللهيئات المعنية بأخلاقيات البحث وسنواصل مسار هذه المرحلة الثالثة للتجربة". وقال جيرمان ملقة كبير الباحثين بالجامعة لرويترز في اتصال تليفوني إن المتطوعة التي توفيت كانت تعاني من السكري. وقال إن الباحثين في التجربة أعدوا جرعتين حتى الآن للقاح وللقاح الوهمي لنحو 12.000 متطوعاً وإنهم الآن يتابعون الاستجابات. وقال "إنها تتقدم دون انتكاسات. هذه الأمور من الممكن أن تحدث. كوڤيد مرض يسبب الوفاة". وقالت الجامعة في بيانها إن المتطوعة "حصلت على كل الرعاية المقررة لعلاج هذا المرض والمضاعفات التي عانت منها وكانت تقاتل من أجل البقاء على قيد الحياة لأكثر من أسبوع". وأضاف البيان "إنها خسارة مؤلمة ونقدم التعازي لأسرتها".
الفاعلية على السلالات المتحورة
أظهرت دراسة أجرتها السلطات الصحّية البريطانية أنّ لقاحي "فايزر" و"أسترازينيكا"، المضادين لفيروس كورونا، فعّالان ضد النسخة الهندية من هذا الفيروس، وبنفس نسبة فعاليتهما تقريبًا ضد النسخة الإنگليزية المتحورة منه.
ووفقًا للدراسة التي أجرتها وكالة "الصحة العامة في إنگلترا» بين 5 أبريل و16 مايو ، فإن لقاح فايزر وفر بعد أسبوعين من تلقي الجرعة الثانية فاعلية بنسبة 88 في المائة ضد المتحور الهندي، وبنسبة 93 في المائة ضد المتحور الإنگليزي، فيما بلغت فاعلية لقاح أسترازينيكا بعد أسبوعين من تلقي الجرعة الثانية 60 في المائة ضد المتحور الهندي، و66 في المائة ضد المتحور الإنگليزي.[441]
القيود المحتملة
من المحتمل أن اللقاحات قيد التطوير لن تكون آمنة أو فعالة. .[442] وجدت إحدى الدراسات أنه بين عامي 2006 و 2015 ، كان معدل نجاح الحصول على الموافقة من المرحلة الأولى لتجارب المرحلة الثالثة الناجحة هو 16.2٪ للقاحات,[136] ويشير CEPI إلى معدل نجاح محتمل بنسبة 10٪ فقط لمرشحي اللقاح في تطوير 2020 .[3]
قد يؤدي التطور السريع والعاجل لإنتاج لقاح لوباء COVID-19 إلى زيادة المخاطر ومعدل الفشل في توصيل لقاح آمن وفعال .[3] تشير الأبحاث المبكرة لتقييم فعالية اللقاح باستخدام نماذج نماذج حيوانية محددة ل COVID-19 ، مثل إنزيم محول للأنجيوتنسين 2 - الفئران المعدلة وراثيًا ، والحيوانات المختبرية الأخرى ، والثدييات العليا ، إلى الحاجة إلى تدابير احتواء من المستوى الثالث للسلامة البيولوجية للتعامل مع الفيروسات الحية ، والتنسيق الدولي لضمان إجراءات السلامة الموحدة.[3] ذكر تقرير CEPI الصادر في أبريل 2020: "ستكون هناك حاجة إلى تنسيق وتعاون دوليين قويين بين مطوري اللقاحات والمنظمين وصناع السياسات والممولين وهيئات الصحة العامة والحكومات لضمان إمكانية تصنيع المرشحين الواعدين للقاحات المتأخرة بكميات كافية وتزويدها بشكل منصف إلى جميع المناطق المتضررة ، وخاصة المناطق منخفضة الموارد[3]
في حين أن لقاح الإنفلونزا يتم إنتاجه بكميات كبيرة عن طريق حقن الفيروس في بيض الدجاج ، فإن هذه الطريقة لن تنجح في لقاح COVID ‑ 19 ، حيث لا يمكن لفيروس سارس - CoV - 2 التكاثر داخل البيض .[443]
جدل حول دراسات "التحدي"
خلال حالة الطوارئ العالمية لوباء COVID-19 ، يتم النظر في الاستراتيجيات لتسريع المسار الزمني لترخيص لقاح ضد COVID ‑ 19 ، خاصة عن طريق ضغط (لبضعة أشهر) المدة الطويلة عادة لتجارب المرحلة II-III ( عادة ، سنوات عديدة) .[444][445][446] بعد إثبات أولي لسلامة وفعالية اللقاح المرشح في حيوانات المختبر والبشر الأصحاء ، يمكن تنفيذ دراسات "التحدي" الخاضعة للرقابة لتجاوز بحث المرحلة الثالثة النموذجية ، مما يوفر مسارًا سريعًا لترخيص لقاح للوقاية على نطاق واسع من COVID-19 19.[444][447] تم تنفيذ دراسات التحدي سابقًا لأمراض أقل فتكًا من عدوى COVID-19 ، مثل الأنفلونزا الشائعة وحمى التيفوئيد والكوليرا والملاريا .[445]
يتضمن تصميم دراسة التحدي أولاً ، اختبار مرشح اللقاح بالتزامن للاستمناع والسلامة في حيوانات المختبر والمتطوعين البالغين الأصحاء (100 أو أقل) – والتي عادة ما تكون عملية متسلسلة باستخدام الحيوانات أولاً – وثانيًا ، تقدم جرعتها الفعالة بسرعة إلى تجربة واسعة النطاق للمرحلة الثانية والثالثة في متطوعين منخفضي المخاطر غير مصابين سابقًا (مثل الشباب) ، والذين قد يصابون بعد ذلك عمداً بـ COVID ID 19 للمقارنة مع مجموعة يتم التحكم فيها بدواء الغفل .[444][445][447] بعد التحدي ، سيتم مراقبة المتطوعين عن كثب في العيادات بموارد منقذة للحياة ، إذا لزم الأمر.[444][445] [448] يشبه التطوع لدراسة تحدي اللقاح أثناء جائحة COVID-19 خدمة الطوارئ لموظفي الرعاية الصحية للأشخاص المصابين بـ 19 من COVID أو رجال الإطفاء أو المتبرعين بالأعضاء, .[444]
على الرغم من أن الدراسات التحدي هي مشكوك فيها أخلاقيا ويرجع ذلك إلى مخاطر غير معروفة للمتطوعين من الممكن COVID-19 تعزيز المرض وما إذا كان اللقاح تلقى له السلامة على المدى الطويل (بين التحذيرات الأخرى)، قد يكون الدراسات التحدي هو الخيار الوحيد المتاح باسم COVID-19 يتفاقم الوباء ، وفقًا لبعض خبراء الأمراض المعدية,[444][445][447] لإنتاج لقاح فعال بسرعة يقلل الملايين من الوفيات المتوقعة في جميع أنحاء العالم من عدوى COVID-19 .[444][449]
الوضع القانوني
في 4 فبراير 2020 ، نشر وزير الصحة والخدمات الإنسانية الأمريكي أليكس عازار إشعارًا بموجب قانون الاستعداد العام والتأهب للطوارئ للتدابيرالطبية المضادة ل COVID-19 ، والتي تغطي "أي لقاح يستخدم لعلاج وتشخيص وعلاج ومنع ، أو التخفيف من COVID ‑ 19 ، أو انتقال السارس- CoV-2 أو فيروس يتحول منه "، وذكر أن الإعلان يستبعد" مطالبات المسؤولية التي تدعي الإهمال من قبل الشركة المصنعة في إنشاء لقاح ، أو الإهمال من قبل مقدم الرعاية الصحية في وصف الجرعة الخاطئة ، غياب سوء السلوك المتعمد "..[450] لإعلان ساري المفعول في الولايات المتحدة حتى 1 أكتوبر 2024 .
التاريخ
تم إنتاج اللقاحات ضد العديد من الأمراض التي تسببها الفيروسات التاجية للاستخدام الحيواني ، بما في ذلك فيروس التهاب الشعب الهوائية المعدية في الطيور وفيروس كورونا في الكلاب وفيروسات تاجية القطط .[451]
كانت المشاريع السابقة لتطوير لقاحات ضد الفيروسات في عائلة ڤيروسات تاجية التي تؤثر على البشر تهدف إلى المتلازمة التنفسية الحادة الوخيمة (سارس)ومتلازمة الشرق الأوسط التنفسية (ميرس). تم اختبار اللقاحات المضادة للسارس.[452]و ميرس[453] في النماذج الحيوانية غير البشرية. اعتبارا من عام 2020 ، لا يوجد علاج أو لقاح وقائي لمرض السارس ثبت أنه آمن وفعال في البشر .[454][455] وفقا مطبوعات بحثية نشرت في 2005 و 2006 ، كان تحديد وتطوير لقاحات وأدوية جديدة لعلاج السارس أولوية بالنسبة للحكومات ووكالات الصحة العامة في جميع أنحاء العالم .[456][457][458]
كما لا يوجد لقاح مثبت ضد ميرس .[459] عندما انتشر ميرس، كان يعتقد أن أبحاث السارس الحالية قد توفر نموذجًا مفيدًا لتطوير اللقاحات والعلاجات ضد عدوى فيروس كورونا المرتبط بمتلازمة الشرق الاوسط التنفسية .[454][460] حتى مارس 2020 ، كان هناك لقاح واحد (قائم على الحمض النووي) لمتلازمة الشرق الأوسط التنفسية أنهى المرحلة الأولى من التجارب السريرية على البشر ,[461] وثلاثة أخرى قيد التقدم ، وكلها لقاحات فيروسية ، واثنان متجهان للفيروسات الغدية (ChAdOx1-MERS ، BVRS-GamVac) ، وواحدة موجهة MVA (MVA-MERS-S) .[462]
المعلومات المغلوطة
روجت منشورات وسائل التواصل الاجتماعي لنظرية مؤامرة تدعي أن الفيروس وراء COVID-19 معروف وأن اللقاح متوفر بالفعل. تشير براءات الاختراع التي استشهد بها العديد من منشورات وسائل التواصل الاجتماعي إلى براءات الاختراع الموجودة للتسلسل الجيني واللقاحات لسلالات أخرى من فيروسات التاجية مثل الڤيروس التاجي المرتبط بالمتلازمة التنفسية الحادة الوخيمة.[463][464]
توزيع اللقاح
قال المدير العام لمنظمة الصحة العالمية الدكتور تدروس أدهانوم إن لقاحات فيروس كورونا المستجد ستكون من الموارد المحدودة فيما تبقى من العام الجاري، بما يستدعي استخدامها بشكل استراتيجي. وأشار المدير العام للمنظمة، في مؤتمر صحفي بمقر المنظمة في جنيف مساء يوم الاثنين 22 فبراير 2021، إلى أن قادة مجموعة السبع قد تعهدوا بتقديم أكثر من 4 مليارات دولار لآلية (كوڤاكس)، الهادفة إلى ضمان التوزيع العادل للقاحات كورونا، كما أعلنوا اعتزامهم تشاطر اللقاح مع الآلية. ولفت إلى أن الدول الغنية ماتزال تقوم بإبرام عقود ثنائية مع الشركات المصنعة للقاحات، بما يقلل من حصول (كوڤاكس) على الجرعات حتى لو توفرت لديها الأموال.[465]
في 10 يونيو 2021، تعهُّد الرئيس الأميركي جو بايدن بالتبرع بعدد 500 مليون جرعة من لقاح "فايزر"،
في 11 يونيو 2021، قال بوريس جونسون إن بريطانيا ستقدم ما لا يقل عن 100 مليون جرعة من اللقاحات الفائضة لديها إلى الدول الأفقر حالاً، بحسب ما نقلته وكالة "رويترز" للأنباء.[466]
الآثار المترتبة
الدينية
في 5 أبريل 2021، أعلنت السلطات السعودية أنها ستسمح فقط للأشخاص الذين تلقوا اللقاح المضاد لڤيروس كورونا بأداء مناسك العمرة والصلاة في المسجد الحرام في مكة المكرمة خلال شهر رمضان. وقالت وزارة الحج والعمرة في بيان إن منح تصاريح أداء مناسك العمرة والصلوات في المسجد الحرام في مكة، وكذلك زيارة المسجد النبوي في المدينة المنورة، سيكون "بدءًا من الأول من رمضان للأشخاص المحصنين". وأوضحت ان التصاريح ستُمنح لكل شخص "محصّن حاصل على جرعتين من لقاح فيروس كورونا، أو محصّن أمضى 14 يوماً بعد تلقيه الجرعة الأولى من اللقاح، أو محصن متعاف من الإصابة". وتابعت ان السلطات ستعتمد على تطبيق هاتفي للتأكد من صحة المعلومات، مشيرة إلى أن حجز تصاريح أداء مناسك العمرة والصلوات والزيارة سيكون من خلال تطبيقين أيضا "وذلك بحجز الخانة الزمنية المتاحة". وبينما أكّدت الوزارة على تويتر أنّ هذه الإجراءات ستطبّق خلال شهر رمضان فقط، لم يحدد البيان على وكالة الأنباء الحكومية المدة الزمنية واكتفى بالقول انها ستبدأ في اليوم الأول من رمضان.[467]
وفي أكتوبر 2020، فتحت السعودية المسجد الحرام في مكة أمام المصلين للمرة الأولى بعد إغلاق استمر سبعة أشهر، كما استأنفت مناسك العمرة، مع تخفيف سلطات المملكة للقيود المفروضة للحد من جائحة كوڤيد-19. كما شملت الإجراءات الاحترازية غير المسبوقة فريضة الحج التي اقتصر أداؤها عام 2020 على حوالى 10 آلاف حاج، جميعهم من داخل المملكة، في حين شهد العام الذي سبق أداء حوالى 2.5 مليون حاج الفريضة.
وتجذب العمرة التي يمكن أداؤها في أي وقت طوال العام، ملايين المسلمين من جميع أنحاء العالم كل عام ولكن تم تعليقها في مارس 2020 في إطار إجراءات احترازية غير مسبوقة اتُخذت للحدّ من تفشّي الجائحة. وتزور حشود كبيرة المسجد الحرام في مكة لأداء العمرة والمسجد النبوي في المدينة المنورة خلال شهر الصوم الذي يحل منتصف الشهر الحالي.
وشهدت السعودية ارتفاعاً في الإصابات ڤيروس كورونا في الاسابيع الأخيرة. وسجلت السعودية أكثر من 390 ألف إصابة بالڤيروس منذ بداية ظهوره من بينها أكثر من 6.700 حالة وفاة، وهو الرقم الاعلى في منطقة الخليج. وقدمت المملكة التي يبلغ عدد سكانها نحو 34 مليونا أكثر من خمسة ملايين لقاح حتى أوائل أبريل 2021.
انظر أيضاً
- جائحة ڤيروس كورونا 2019–2020
- مرض ڤيروس 2019
- ڤيروس كورونا 2 المرتبط بالمتلازمة التنفسية الحادة الوخيمة
- لقاح جائحة الإنفلونزا 2009
- مرض تنفسي
- تطوير دواء كوڤيد-19
- أبحاث إعادة استخدام الأدوية لعلاج كوڤيد-19
- مراحل الأبحاث السريرية
المصادر
- ^ Grenfell, Rob; Drew, Trevor (17 February 2020). "Here's Why It's Taking So Long to Develop a Vaccine for the New Coronavirus". ScienceAlert. Archived from the original on 28 February 2020. Retrieved 26 February 2020.
- ^ أ ب "CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19". Coalition for Epidemic Preparedness Innovations, Oslo, Norway. 6 March 2020. Retrieved 23 March 2020.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك ل م Thanh Le, Tung; Andreadakis, Zacharias; Kumar, Arun; Gómez Román, Raúl; Tollefsen, Stig; Saville, Melanie; Mayhew, Stephen (9 April 2020). "The COVID-19 vaccine development landscape". Nature Reviews Drug Discovery. doi:10.1038/d41573-020-00073-5. ISSN 1474-1776.
- ^ أ ب ت ث ج ح "COVID-19 Treatment and Vaccine Tracker" (PDF). Milken Institute. 21 April 2020. Retrieved 21 April 2020.
{{cite web}}: Unknown parameter|lay-url=ignored (help) - ^ أ ب Angus Liu (10 April 2020). "China's CanSino Bio advances COVID-19 vaccine into phase 2 on preliminary safety data". FiercePharma (in الإنجليزية). Retrieved 2020-04-13.
- ^ أ ب "University of Oxford commences clinical trial for vaccine candidate (ChAdOx1 nCoV-19) Targeting COVID-19". Trial Site News (in الإنجليزية الأمريكية). 31 March 2020. Retrieved 13 April 2020.
- ^ أ ب ت Fauci AS, Lane HC, Redfield RR (March 2020). "Covid-19 - Navigating the Uncharted". The New England Journal of Medicine. 382 (13): 1268–1269. doi:10.1056/nejme2002387. PMC 7121221. PMID 32109011.
- ^ Gates B (February 2020). "Responding to Covid-19 - A Once-in-a-Century Pandemic?". The New England Journal of Medicine. doi:10.1056/nejmp2003762. PMID 32109012.
- ^ Steenhuysen, Julie; Kelland, Kate (24 January 2020). "With Wuhan virus genetic code in hand, scientists begin work on a vaccine". Reuters. Archived from the original on 25 January 2020. Retrieved 25 January 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Duddu, Praveen (19 February 2020). "Coronavirus outbreak: Vaccines/drugs in the pipeline for Covid-19". Clinical Trials Arena. Retrieved 19 February 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Lee, Jaimy (1 April 2020). "These nine companies are working on coronavirus treatments or vaccines — here's where things stand". MarketWatch. Retrieved 2 April 2020.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)CS1 maint: url-status (link) - ^ "Coronavirus (COVID-19) Update: FDA Continues to Facilitate Development of Treatments" (Press release). U.S. Food and Drug Administration (FDA). 19 March 2020. Retrieved 7 April 2020.
- ^ Cheng, Matthew P.; Lee, Todd C. Lee; Tan, Darrell H.S.; Murthy, Srinivas (26 March 2020). "Generating randomized trial evidence to optimize treatment in the COVID-19 pandemic". Canadian Medical Association Journal: cmaj.200438. doi:10.1503/cmaj.200438.
- ^ أ ب "Vaccine Safety - Vaccines". www.vaccines.gov. US Department of Health and Human Services. Retrieved 13 April 2020.
- ^ أ ب ت "The drug development process". US Food and Drug Administration. 4 January 2018. Retrieved 12 April 2020.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةlondon - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةwho-tracker - ^ أ ب ت ث "Regulatory Decision Summary – Pfizer-BioNTech COVID-19 Vaccine". Health Canada, Government of Canada. 9 December 2020. Retrieved 9 December 2020.
- ^ أ ب "Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults". ClinicalTrials.gov (Registry). United States National Library of Medicine. 30 April 2020. NCT04368728. Archived from the original on 11 October 2020. Retrieved 14 July 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04368728" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults". EU Clinical Trials Register (Registry). European Union. 14 April 2020. EudraCT 2020-001038-36. Archived from the original on 22 April 2020. Retrieved 22 April 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "EudraCT-2020-001038-36" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Pfizer and BioNTech Announce Publication of Results from Landmark Phase 3 Trial of BNT162b2 COVID-19 Vaccine Candidate in The New England Journal of Medicine". Pfizer. Retrieved 11 December 2020 – via Business Wire.
- ^ Lovelace Jr B (18 November 2020). "Pfizer says final data analysis shows Covid vaccine is 95% effective, plans to submit to FDA in days". CNBC.
- ^ "Pfizer and BioNTech Announce Publication of Results from Landmark Phase 3 Trial of BNT162b2 COVID-19 Vaccine Candidate in The New England Journal of Medicine". Pfizer. Retrieved 11 December 2020 – via Business Wire.
- ^ FDA Review of Efficacy and Safety of Pfizer-BioNTech COVID-19 Vaccine Emergency Use Authorization Request. 10 December 2020. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. https://www.fda.gov/media/144337/download. Retrieved on 11 December 2020. هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ Tiggle, Nick (9 December 2020). "Covid-19 vaccine: Allergy warning over new jab". BBC News. Retrieved 9 December 2020.
- ^ Mulligan MJ, Lyke KE, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. (October 2020). "Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults". Nature. 586 (7830): 589–593. doi:10.1038/s41586-020-2639-4. PMID 32785213. S2CID 221126922.
- ^ Michael Erman (2020-11-18). "Pfizer ends COVID-19 trial with 95% efficacy, to seek emergency-use authorization". Reuters. Retrieved 2020-11-18.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةNYT-20201120 - ^ أ ب "UK medicines regulator gives approval for first UK COVID-19 vaccine". Medicines and Healthcare Products Regulatory Agency, Government of the UK. 2 December 2020. Retrieved 2 December 2020.
- ^ "Bahrain becomes second country to approve Pfizer COVID-19 vaccine". Al Jazeera. Retrieved 5 December 2020.
- ^ "Coronavirus: Saudi Arabia approves Pfizer COVID-19 vaccine for use". Al Arabiya English. 2020-12-10. Retrieved 2020-12-10.
- ^ O'Neill N (2020-11-20). "Pfizer applies for emergency FDA approval of COVID-19 vaccine". New York Post. Retrieved 2020-11-22.
- ^ "Pfizer-BioNTech apply for EU emergency authorization for COVID-19 vaccine". www.msn.com. Retrieved 2020-12-01.
- ^ Salud, Secretaría de. "233. Firma secretario de Salud convenio con Pfizer para fabricación y suministro de vacuna COVID-19". gob.mx (in الإسبانية). Retrieved 2020-12-03.
- ^ "Cleared in UK, Pfizer first in India to apply for emergency use". The Indian Express. 6 December 2020.
- ^ أ ب ت Swissmedic reviews vaccine candidates from Moderna, Pfizer, AstraZeneca. Retrieved 10 December 2020.
- ^ أ ب ت ث ج ح خ "Drug and vaccine authorizations for COVID-19: List of applications received". Health Canada, Government of Canada. 9 December 2020. Retrieved 9 December 2020.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماة:0 - ^ "AstraZeneca & Serum Institute of India sign licensing deal for 1 million doses of Oxford vaccine". The Economic Times. Retrieved 2020-06-15.
- ^ "Covid-19 vaccine: Serum Institute signs up for 100 million doses of vaccines for India, low and middle-income countries". The Financial Express. 7 August 2020.
- ^ Walsh N, Shelley J, Duwe E, Bonnett W (27 July 2020). "The world's hopes for a coronavirus vaccine may run in these health care workers' veins". CNN. São Paulo. Archived from the original on 3 August 2020. Retrieved 3 August 2020.
- ^ أ ب ت "Investigating a Vaccine Against COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 26 May 2020. NCT04400838. Archived from the original on 11 October 2020. Retrieved 14 July 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04400838" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19". EU Clinical Trials Register (Registry). European Union. 21 April 2020. EudraCT 2020-001228-32. Archived from the original on 5 October 2020. Retrieved 3 August 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "EudraCT-2020-001228-32" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب O'Reilly P (26 May 2020). "A Phase III study to investigate a vaccine against COVID-19". ISRCTN (Registry). doi:10.1186/ISRCTN89951424. ISRCTN89951424. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "ISRCTN89951424" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "A Phase III Randomized, Double-blind, Placebo-controlled Multicenter Study in Adults to Determine the Safety, Efficacy, and Immunogenicity of AZD1222, a Non-replicating ChAdOx1 Vector Vaccine, for the Prevention of COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 12 May 2020. NCT04383574. Archived from the original on 23 August 2020. Retrieved 26 August 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04516746" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Trial of Oxford COVID-19 vaccine starts in Brazil". Jenner Institute. Archived from the original on 9 September 2020. Retrieved 26 August 2020.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةAZ-ph3-nr - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةOx-ph3-nr - ^ أ ب "Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK - The Lancet". Retrieved 9 December 2020.
- ^ Folegatti PM, Ewer KJ, Aley PK, Angus B, Becker S, Belij-Rammerstorfer S, et al. (July 2020). "Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial". Lancet. 396 (10249): 467–78. doi:10.1016/S0140-6736(20)31604-4. PMC 7445431. PMID 32702298.
{{cite journal}}: Unknown parameter|lay-url=ignored (help) - ^ "After Pfizer, Pune's Serum Institute seeks nod for emergency use of its Oxford vaccine". The Indian Express. 7 December 2020.
- ^ أ ب ت Chen W, Al Kaabi N (18 July 2020). "A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)". Chinese Clinical Trial Registry. Retrieved 15 August 2020.
- ^ Yang Y. "A Study to Evaluate The Efficacy, Safety and Immunogenicity of Inactivated SARS-CoV-2 Vaccines (Vero Cell) in Healthy Population Aged 18 Years Old and Above". clinicaltrials.gov. Clinical Trials. Archived from the original on 14 September 2020. Retrieved 15 September 2020.
- ^ "Clinical Trial to Evaluate the Efficacy, Immunogenicity and Safety of the Inactivated SARS-CoV-2 Vaccine (COVID-19)". clinicaltrials.gov. Retrieved 28 September 2020.
- ^ "Bahrain allows Sinopharm COVID-19 vaccine candidate use in frontline workers". www.msn.com. Retrieved 2020-11-03.
- ^ "UAE: Ministry of Health announces 86 per cent vaccine efficacy". GulfNews. Retrieved 9 December 2020.
- ^ Cornwell, Alexander (9 December 2020). "UAE says Sinopharm vaccine has 86% efficacy against COVID-19". Reuters. Retrieved 9 December 2020.
- ^ Xia S, Duan K, Zhang Y, Zhao D, et al. (13 August 2020). "Effect of an Inactivated Vaccine Against SARS-CoV-2 on Safety and Immunogenicity Outcomes: Interim Analysis of 2 Randomized Clinical Trials". JAMA. 324 (10): 951–960. doi:10.1001/jama.2020.15543. PMC 7426884. PMID 32789505.
- ^ "China Sinopharm's COVID-19 vaccine taken by about 1 million people in emergency use". CNA. Retrieved 2020-11-22.
- ^ "Coronavirus: Bahrain allows Sinopharm vaccine candidate use in frontline workers". Al Arabiya English. 2020-11-03. Retrieved 2020-11-22.
- ^ "Coronavirus: UAE authorises emergency use of vaccine for frontline workers". The National. Retrieved 2020-11-24.
- ^ Dou, Eva; Schemm, Paul (2020-12-09). "Coronavirus vaccine from China's Sinopharm is 86% effective, UAE officials say". Washington Post. ISSN 0190-8286. Retrieved 2020-12-09.
- ^ أ ب ت ث "Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 13 November 2020. NCT04540419. Retrieved 17 November 2020.
- ^ "The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19". National Research Council, Government of Canada. 2020-05-12. Archived from the original on 22 May 2020. Retrieved 2020-05-22.
- ^ Martinez, Ana Isabel (3 November 2020). "CanSino Biologics delivers COVID-19 vaccine to Mexico for late-stage trial". Reuters. Retrieved 4 November 2020.
- ^ Ng, Eric (28 October 2020). "China's CanSino trials Covid-19 vaccine in 'high disease burden' nations". South China Morning Post. Retrieved 4 November 2020.
- ^ Nafisa, Eltahir (9 August 2020). "CanSino to start Phase III trial of COVID-19 vaccine in Saudi". Reuters. Retrieved 4 November 2020.
- ^ Gou J. "Phase III Trial of A COVID-19 Vaccine of Adenovirus Vector in Adults 18 Years Old and Above". clinicaltrials.gov. Archived from the original on 18 September 2020. Retrieved 17 September 2020.
- ^ أ ب Zhu F, Guan X, Li Y, Huang J, Jiang T, Hou L, et al. (July 2020). "Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial". Lancet. 396 (10249): 479–88. doi:10.1016/s0140-6736(20)31605-6. ISSN 0140-6736. PMID 32702299.
{{cite journal}}: Unknown parameter|lay-url=ignored (help) خطأ استشهاد: وسم<ref>غير صالح؛ الاسم "zhu7-20" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب ت "Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 12 May 2020. NCT04383574. Archived from the original on 11 October 2020. Retrieved 14 July 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04383574" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 2 July 2020. NCT04456595. Archived from the original on 11 October 2020. Retrieved 3 August 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCname= nct04456595=" معرف أكثر من مرة بمحتويات مختلفة. - ^ PT. Bio Farma (10 August 2020). "A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia". Registri Penyakit Indonesia. Retrieved 15 August 2020.
- ^ "Tests show coronavirus vaccine by China's Sinovac is safe, says Brazil's Butantan Institute". Archived from the original on 29 October 2020. Retrieved 29 October 2020.
- ^ "Chile initiates clinical study for COVID-19 vaccine". Archived from the original on 11 October 2020. Retrieved 29 October 2020.
- ^ "Randomized, Double-Blind, Placebo-Controlled Phase III Clinical Trial For Evaluation of Efficacy and Safety of SARS-CoV-2 Vaccine (Vero Cell), Inactivated". clinicaltrials.gov. 8 October 2020. Archived from the original on 20 October 2020. Retrieved 22 October 2020.
- ^ "Brazil Clears Sinovac Trial to Resume Two Days After Halting It". Bloomberg.com. 2020-11-11. Retrieved 2020-11-11.
- ^ Zhang Y, Zeng G, Pan H, Li C, Hu Y, Chu K, et al. (November 2020). "Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18–59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial". The Lancet Infectious Diseases. 0. doi:10.1016/S1473-3099(20)30843-4. PMID 33217362. S2CID 227099817.
- ^ "Doria says it guarantees purchase of 100 million doses of CoronaVac..." Archived from the original on 1 November 2020. Retrieved 29 October 2020.
- ^ Indonesia CN. "Fakta Terbaru Uji Klinis Vaksin Covid-19 di Bandung". teknologi (in الإندونيسية). Archived from the original on 11 October 2020. Retrieved 2020-08-26.
- ^ Diela, Tabita; Nangoy, Fransiska (6 December 2020). "Indonesia receives first COVID vaccine from China's Sinovac". Reuters. Retrieved 8 December 2020.
- ^ Huizhong Wu (2020-12-06). "China prepares large-scale rollout of domestically-produced coronavirus vaccines". The Globe and Mail. Retrieved 2020-12-07.
- ^ "Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19". clinicaltrials.gov. Archived from the original on 12 September 2020. Retrieved 11 September 2020.
- ^ أ ب Logunov DY, Dolzhikova IV, others (2020). "Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia". The Lancet. 396 (10255): 887–97. doi:10.1016/s0140-6736(20)31866-3. ISSN 0140-6736. PMC 7471804. PMID 32896291. S2CID 221472251.
- ^ "Clinical trial: 17 volunteers given Russia's Sputnik V Covid-19 vaccine in Pune". The Indian Express. 6 December 2020.
- ^ أ ب Burki TK (November 2020). "The Russian vaccine for COVID-19". The Lancet. Respiratory Medicine. 8 (11): e85–e86. doi:10.1016/S2213-2600(20)30402-1. PMID 32896274. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "burki" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب "A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 14 July 2020. NCT04470427. Archived from the original on 11 October 2020. Retrieved 27 July 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04470427" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب Palca J (27 July 2020). "COVID-19 vaccine candidate heads to widespread testing in U.S." NPR. Archived from the original on 11 October 2020. Retrieved 27 July 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "palca" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Promising Interim Results from Clinical Trial of NIH-Moderna COVID-19 Vaccine". National Institutes of Health (NIH). 15 November 2020.
- ^ Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, et al. (mRNA-1273 Study Group) (July 2020). "An mRNA Vaccine against SARS-CoV-2 – Preliminary Report". New England Journal of Medicine. 383 (20): 1920–1931. doi:10.1056/NEJMoa2022483. PMC 7377258. PMID 32663912.
{{cite journal}}: Unknown parameter|lay-url=ignored (help) - ^ Jackson LA, Anderson EJ, Rouphael NG, Roberts PC, Makhene M, Coler RN, et al. (mRNA-1273 Study Group) (July 2020). "An mRNA Vaccine against SARS-CoV-2 – Preliminary Report Supplementary appendix". New England Journal of Medicine. doi:10.1056/NEJMoa2022483. PMID 32663912.
- ^ Lovelace Jr B (2020-11-30). "Moderna says new data shows Covid vaccine is more than 94% effective, plans to ask FDA for emergency clearance later Monday". CNBC. Retrieved 2020-11-30.
- ^ Kitching C (2020-12-01). "Moderna coronavirus vaccine could get UK approval within two weeks, says expert". Daily Mirror. Retrieved 2020-12-01.
- ^ "A Study of Ad26.COV2.S in Adults". ClinicalTrials.gov, US National Library of Medicine. 2020-08-04. Archived from the original on 16 September 2020. Retrieved 2020-08-23.
- ^ Sadoff, Jerry; Le Gars, Mathieu; Shukarev, Georgi; Heerwegh, Dirk; Truyers, Carla; de Groot, Anna Marit; Stoop, Jeroen; Tete, Sarah; et al. (2020-09-25). Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial. doi:. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://medrxiv.org/lookup/doi/10.1101/2020.09.23.20199604. Retrieved on 27 September 2020. - ^ "A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants". ClinicalTrials.gov. US National Library of Medicine. Archived from the original on 26 September 2020.
- ^ "Johnson & Johnson pauses its coronavirus vaccine trial because of a volunteer's 'unexplained illness.'". The New York Times. 13 October 2020. Archived from the original on 24 October 2020. Retrieved 25 October 2020.
{{cite news}}: Cite uses deprecated parameter|authors=(help) - ^ Burton TM, Loftus P (23 October 2020). "Pivotal Studies of Covid-19 Vaccines From AstraZeneca, J&J Resuming". The Wall Street Journal. Archived from the original on 26 October 2020. Retrieved 26 October 2020.
- ^ Johnson CY (24 October 2020). "Johnson & Johnson, AstraZeneca coronavirus vaccine trials set to resume". The Washington Post. Archived from the original on 26 October 2020. Retrieved 26 October 2020.
- ^ "Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant". ClinicalTrials.gov (Registry). United States National Library of Medicine. 30 April 2020. NCT04368988. Archived from the original on 14 July 2020. Retrieved 14 July 2020.
- ^ "A Study Looking at the Effectiveness, Immune Response, and Safety of a COVID-19 Vaccine in Adults in the United Kingdom - Full Text View - ClinicalTrials.gov". Retrieved 2020-11-22.
- ^ Keech C, Albert G, Cho I, Robertson A, Reed P, Neal S, et al. (September 2020). "Phase 1–2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine". The New England Journal of Medicine. doi:10.1056/NEJMoa2026920. PMC 7494251. PMID 32877576.
- ^ Yengkhom, Sumati (23 November 2020). "Three Kolkata institutes queue up for corona vaccine trials | Kolkata News - Times of India". The Times of India.
- ^ "An Efficacy and Safety Clinical Trial of an Investigational COVID-19 Vaccine (BBV152) in Adult Volunteers - Full Text View - ClinicalTrials.gov". clinicaltrials.gov. Retrieved 2020-11-26.
- ^ Dwivedi, Sukirti; Dey, Stela (8 December 2020). "Bharat Biotech Seeks Emergency Use Approval For Covaxin". NDTV.com.
- ^ "GSK, Medicago launch phase 2/3 clinical trials of plant-derived COVID-19 vaccine". PMLive. 2020-11-13. Retrieved 2020-11-16.
- ^ Medicago (2020-11-18). "Randomized, Observer-Blind, Placebo-Controlled, Phase 2/3 Study to Assess the Safety, Efficacy, and Immunogenicity of a Recombinant Coronavirus-Like Particle COVID-19 Vaccine in Adults 18 Years of Age or Older".
{{cite journal}}: Cite journal requires|journal=(help) - ^ Ward BJ, Gobeil P, Séguin A, Atkins J, Boulay I, Charbonneau P, et al. (November 2020). "Phase 1 trial of a Candidate Recombinant Virus-Like Particle Vaccine for Covid-19 Disease Produced in Plants". MedRxiv: 2020.11.04.20226282. doi:10.1101/2020.11.04.20226282. S2CID 226255762.
- ^ Medicago (2020-10-21). "A Randomized, Partially-Blinded, Dose-Ranging Phase 1 Study to Assess the Safety, Tolerability, and Immunogenicity of a Recombinant Coronavirus-Like Particle COVID 19 Vaccine in Adults 18–55 Years of Age".
{{cite journal}}: Cite journal requires|journal=(help) - ^ "A Randomized, Blinded, Placebo-controlled Trial to Evaluate the Immunogenicity and Safety of a Recombinant New Coronavirus Vaccine (CHO Cell) With Different Doses and Different Immunization Procedures in Healthy People Aged 18 to 59 Years". ClinicalTrials.gov (Registry). United States National Library of Medicine. 10 July 2020. NCT04466085. Archived from the original on 28 July 2020. Retrieved 26 August 2020.
- ^ "A Study to Evaluate the Safety, Reactogenicity and Immunogenicity of Vaccine CVnCoV in Healthy Adults". ClinicalTrials.gov, US National Library of Medicine. 26 June 2020. NCT04449276. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "A Dose-Confirmation Study to Evaluate the Safety, Reactogenicity and Immunogenicity of Vaccine CVnCoV in Healthy Adults". ClinicalTrials.gov, US National Library of Medicine. 17 August 2020. NCT04515147. Archived from the original on 23 August 2020. Retrieved 28 August 2020.
- ^ "Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers". ClinicalTrials.gov (Registry). United States National Library of Medicine. 7 April 2020. NCT04336410. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea". International Vaccine Institute. 2020-04-16. Retrieved 2020-04-23.
- ^ أ ب ت ث ج ح خ "Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 22 September 2020. NCT04368988. Retrieved 16 November 2020. خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "NCT04527575" معرف أكثر من مرة بمحتويات مختلفة. - ^ "Safety and Immunogenicity Study of an Inactivated SARS-CoV-2 Vaccine for Preventing Against COVID-19". ClinicalTrials.gov (Registry). United States National Library of Medicine. 2 June 2020. NCT04412538. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Study of COVID-19 DNA Vaccine (AG0301-COVID19)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 9 July 2020. NCT04463472. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "About AnGes – Introduction". AnGes, Inc. Archived from the original on 11 October 2020. Retrieved 1 August 2020.
- ^ "CTI and Arcturus Therapeutics Announce Initiation of Dosing of COVID-19 STARR™ mRNA Vaccine Candidate, LUNAR-COV19 (ARCT-021) in a Phase 1/2 study". UK BioIndustry Association. 2020-08-13. Archived from the original on 11 October 2020. Retrieved 2020-08-23.
- ^ "Ascending Dose Study of Investigational SARS-CoV-2 Vaccine ARCT-021 in Healthy Adult Subjects". clinicaltrials.gov. Archived from the original on 11 October 2020. Retrieved 2020-08-23.
- ^ "Safety and Immunity of Covid-19 aAPC Vaccine". ClinicalTrials.gov (Registry). United States National Library of Medicine. 9 March 2020. NCT04299724. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ أ ب "About Us". Shenzhen Genoimmune Medical Institute. Archived from the original on 11 October 2020. Retrieved 1 August 2020.
- ^ "Immunity and Safety of Covid-19 Synthetic Minigene Vaccine". ClinicalTrials.gov (Registry). United States National Library of Medicine. 19 February 2020. NCT04276896. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ Ward D, McCormack S (22 May 2020). "Clinical trial to assess the safety of a coronavirus vaccine in healthy men and women". ISRCTN (Registry). doi:10.1186/ISRCTN17072692. ISRCTN17072692.
- ^ "Safety and Immunogenicity Study of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Adults". ClinicalTrials.gov (Registry). United States National Library of Medicine. 24 June 2020. NCT04445389. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "S. Korea's Genexine begins human trial of coronavirus vaccine". Reuters. 2020-06-19. Archived from the original on 11 October 2020. Retrieved 2020-06-25.
- ^ "Genexine consortium's Covid-19 vaccine acquires approval for clinical trails in Korea". 11 June 2020. Retrieved 1 August 2020.
- ^ "SCB-2019 as COVID-19 Vaccine". ClinicalTrials.gov (Registry). United States National Library of Medicine. 28 May 2020. NCT04405908. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Clover Biopharmaceuticals starts Phase I Covid-19 vaccine trial". Clinical Trials Arena. 2020-06-20. Archived from the original on 11 October 2020. Retrieved 2020-06-25.
- ^ "About Us". Clover Biopharmaceuticals. Archived from the original on 11 October 2020. Retrieved 1 August 2020.
- ^ "Monovalent Recombinant COVID19 Vaccine (COVAX19)". ClinicalTrials.gov (Registry). United States National Library of Medicine. 1 July 2020. NCT04453852. Archived from the original on 11 October 2020. Retrieved 14 July 2020.
- ^ "Vaxine". Archived from the original on 11 October 2020. Retrieved 1 August 2020.
- ^ "A Phase I clinical trial to evaluate the safety, tolerance and preliminary immunogenicity of different doses of a SARS-CoV-2 mRNA vaccine in population aged 18–59 years and 60 years and above". Chinese Clinical Trial Register (Registry). 24 June 2020. ChiCTR2000034112. Archived from the original on 11 October 2020. Retrieved 6 July 2020.
- ^ "A Study on the Safety, Tolerability and Immune Response of SARS-CoV-2 Sclamp (COVID-19) Vaccine in Healthy Adults". ClinicalTrials.gov (Registry). United States National Library of Medicine. 3 August 2020. NCT04495933. Archived from the original on 11 October 2020. Retrieved 4 August 2020.
- ^ "UQ-CSL V451 Vaccine". www.precisionvaccinations.com (in الإنجليزية الأمريكية). Retrieved 2020-12-11.
- ^ "Public statement for collaboration on COVID-19 vaccine development". World Health Organization. 2020-04-13. Retrieved 2020-04-20.
- ^ أ ب "Clinical Development Success Rates 2006-2015" (PDF). BIO Industry Analysis. June 2016.
- ^ أ ب ت ث "Estimating the cost of vaccine development against epidemic infectious diseases: a cost minimisation study". The Lancet - Global Health. 6: e1386–96. 17 October 2018. doi:10.1016/S2214-109X(18)30346-2.
{{cite journal}}: Cite uses deprecated parameter|authors=(help) - ^ Strovel J, Sittampalam S, Coussens NP, Hughes M, Inglese J, Kurtz A, et al. (July 1, 2016). "Early Drug Discovery and Development Guidelines: For Academic Researchers, Collaborators, and Start-up Companies". Assay Guidance Manual. Eli Lilly & Company and the National Center for Advancing Translational Sciences. PMID 22553881.
- ^ DiMasi JA, Grabowski HG, Hansen RW (May 2016). "Innovation in the pharmaceutical industry: New estimates of R&D costs". Journal of Health Economics. 47: 20–33. doi:10.1016/j.jhealeco.2016.01.012. hdl:10161/12742. PMID 26928437.
- ^ أ ب Shankland, Stephen. "Sixteen supercomputers tackle coronavirus cures in US". CNET (in الإنجليزية). Retrieved 2020-03-23.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب "Homepage of The COVID-19 High Performance Computing Consortium". Retrieved 2020-03-28.
- ^ "C3.ai, Microsoft, and Leading Universities Launch C3.ai Digital Transformation Institute". 2020-03-26. Retrieved 2020-03-28.
- ^ Broad, William (2020-03-26). "A.I. Versus the Coronavirus". The New York Times. Retrieved 2020-03-28.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Kleinnijenhuis, J; van Crevel, R; Netea, MG (January 2015). "Trained immunity: consequences for the heterologous effects of BCG vaccination". Transactions of the Royal Society of Tropical Medicine and Hygiene. 109 (1): 29–35. doi:10.1093/trstmh/tru168. PMID 25573107.
- ^ de Vrieze, Jop (March 23, 2020). "Can a century-old TB vaccine steel the immune system against the new coronavirus?". Science. doi:10.1126/science.abb8297. Retrieved 11 April 2020.
- ^ "EudraCT 2020-000919-69". EU Clinical Trials Register. European Union. Retrieved 11 April 2020.
- ^ "Murdoch Children's Research Institute to trial preventative vaccine for COVID-19 healthcare workers". www.mcri.edu.au (in الإنجليزية). Murdoch Children's Research Institute. Retrieved 11 April 2020.
- ^ "BCG Vaccination to Protect Healthcare Workers Against COVID-19 - Full Text View - ClinicalTrials.gov". clinicaltrials.gov (in الإنجليزية). US National Library of Medicine, National Institutes of Health. Retrieved 11 April 2020.
- ^ "BCG Vaccine for Health Care Workers as Defense Against SARS-COV2 - Full Text View - ClinicalTrials.gov". clinicaltrials.gov (in الإنجليزية). US National Library of Medicine, NIH. Retrieved 18 April 2020.
- ^ "Application of BCG Vaccine for Immune-prophylaxis Among Egyptian Healthcare Workers During the Pandemic of COVID-19 - Full Text View - ClinicalTrials.gov". clinicaltrials.gov (in الإنجليزية). US National Library of Medicine, NIH. Retrieved 18 April 2020.
- ^ "لقاح فيروس كورونا: جونسون آند جونسون تعلق تجاربها بسبب إصابة متطوع بمرض "لا تفسير له"". بي بي سي. 2020-10-13. Retrieved 2020-10-13.
- ^ "نكسة للقاح أوكسفورد بعد وفاة متطوع في التجارب السريرية". العربية نت. 2020-10-21. Retrieved 2020-10-21.
- ^ "AstraZeneca COVID-19 vaccine trial Brazil volunteer dies, trial to continue". رويترز. 2020-10-21. Retrieved 2020-10-21.
- ^ "Biden to announce 'historic partnership': Merck will help make Johnson & Johnson coronavirus vaccine, officials say". واشنطن پوست. 2021-03-01. Retrieved 2021-03-01.
- ^ "في معركة كورونا.. لقاح "عبدالله" يدخل على الخط بفعالية كبيرة". سكاي نيوز عربية. 2021-06-22. Retrieved 2021-06-22.
- ^ "Nasal spray Covid-19 vaccine co-developed by Hong Kong scientists approved for emergency use in mainland China in 'historic breakthrough'". scmp. 2022-12-05. Retrieved 2022-12-05.
- ^ Farge, Emma; Revill, John (5 January 2021). "WHO recommends two doses of Pfizer COVID-19 vaccine within 21–28 days". Reuters. Geneva. Retrieved 5 March 2021.
- ^ Keaten, Jamey (8 January 2021). "WHO: Amid short supplies, vaccine doses can be 6 weeks apart". Associated Press. Geneva. Retrieved 6 March 2021.
- ^ "COVID vaccine: Moderna shots can be 6 weeks apart, WHO says". Deutsche Welle. 26 January 2021. Retrieved 6 March 2021.
- ^ "Coronavirus (COVID-19) Update: FDA Allows More Flexible Storage, Transportation Conditions for Pfizer-BioNTech COVID-19 Vaccine" (Press release). Food and Drug Administration (FDA). 25 February 2021. Retrieved 5 March 2021.
- ^ أ ب "Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Healthcare Providers" (PDF). Pfizer. 25 February 2021. Retrieved 25 February 2021.
- ^ "Albania to start COVID-19 immunisation with Pfizer vaccine in January – report". Seenews.
- ^ "ANDORRA COVID-19". govern.ad. Retrieved 19 February 2021.
- ^ "Coronavirus en la Argentina: La ANMAT aprobo el uso de emergencia de la vacuna Pfizer". La Nación (in الإسبانية). Retrieved 23 December 2020.
- ^ Overheid, Aruba (7 January 2021). "COVID-19 vaccine update". government.aw. Retrieved 19 February 2021.
- ^ "Bahrain becomes second country to approve Pfizer COVID-19 vaccine". Al Jazeera. Retrieved 5 December 2020.
- ^ "Pfizer vaccine approved for region but Health Ministry wants more info". Trinidad and Tobago Newsday. 6 January 2021. Retrieved 24 February 2021.
- ^ "Chile approves Pfizer-BioNTech Covid-19 vaccine for emergency use". The Straits Times. 17 December 2020. Retrieved 17 December 2020.
- ^ "Colombia regulator approves Pfizer-BioNTech vaccine for emergency use". Reuters. 6 January 2021. Retrieved 6 January 2021.
- ^ "Costa Rica authorizes Pfizer-BioNTech coronavirus vaccine". The Tico Times. 16 December 2020. Retrieved 16 December 2020.
- ^ "Arcsa autoriza ingreso al país de vacuna Pfizer-BioNTech para el Covid-19 – Agencia Nacional de Regulación, Control y Vigilancia Sanitaria" (in الإسبانية). Retrieved 17 December 2020.
- ^ "Use of vaccine approved". Government of Hong Kong. 25 January 2021. Retrieved 15 February 2021.
- ^ "Iraq grants emergency approval for Pfizer COVID-19 vaccine". MSN. Retrieved 27 December 2020.
- ^ "Israeli Health Minister 'pleased' as FDA approves Pfizer COVID-19 vaccine". The Jerusalem Post. Retrieved 28 December 2020.
- ^ "Jordan approves Pfizer-BioNTech Covid vaccine". France 24. 15 December 2020. Retrieved 15 December 2020.
- ^ "Kuwait authorizes emergency use of Pfizer-BioNTech COVID-19 vaccine". Arab News. 13 December 2020. Retrieved 15 December 2020.
- ^ "Liechtenstein – COVID19 Vaccine Tracker". covid19.trackvaccines.org. Retrieved 19 February 2021.
- ^ "Mexico Approves Pfizer Vaccine for Emergency Use as Covid Surges". Bloomberg. 12 December 2020. Retrieved 12 December 2020.
- ^ "Mexico authorizes emergency use of Pfizer-BioNTech coronavirus vaccine". The Economic Times. 12 December 2020. Retrieved 14 January 2021.
- ^ "FIRST VACCINES ARRIVE IN MONACO – COVID-19 vaccination campaign begins tomorrow / Actualités / Coronavirus (Covid-19) / Policy & Practice / Portail du Gouvernement – Monaco". en.gouv.mc. Retrieved 19 February 2021.
- ^ "Robust assessment ahead of Medsafe approval of vaccine". Ministry of Health. 3 February 2021. Retrieved 6 February 2021.
- ^ "North Macedonia Kicks Off COVID-19 Vaccinations As Serbia Looks To Highlight Regional Efforts". RadioFreeEurope/RadioLiberty. Retrieved 19 February 2021.
- ^ "Oman issues licence to import Pfizer BioNTech Covid vaccine – TV". Reuters. 15 December 2020. Retrieved 16 December 2020.
- ^ "Panama approves Pfizer's COVID-19 vaccine – health ministry". Yahoo! Finance. Retrieved 16 December 2020.
- ^ "PH authorizes Pfizer's COVID-19 vaccine for emergency use". CNN Philippines. 14 January 2021. Retrieved 14 January 2021.
- ^ "Qatar, Oman to receive Pfizer-BioNTech COVID-19 vaccine this week". Reuters. Retrieved 24 December 2020.
- ^ أ ب ت ث ج "Public Health (Emergency Authorisation of COVID-19 Vaccine) Rules, 2021" (PDF). Government of Saint Vincent and the Grenadines. 11 February 2021. Retrieved 12 February 2021.
- ^ "Singapore approves use of Pfizer's COVID-19 vaccine". AP NEWS. 14 December 2020. Retrieved 15 December 2020.
- ^ "Suriname begins coronavirus vaccination campaign with donated doses". Reuters. 23 February 2021. Retrieved 28 February 2021.
- ^ "Comirnaty Product information" (in الألمانية). Retrieved 31 January 2021. [Due to incomplete clinical data at the time of the assessment of the authorization application, the Comirnaty medicinal product is authorized for a limited period (Art. 9a Medicinal Products Act).]
- ^ "Dubai approves the Pfizer-BioNTech vaccine which will be free of charge". Emirates Woman. 23 December 2020. Retrieved 28 December 2020.
- ^ Decree of Ministry of Health of Ukraine on approval Covishield and Comirnaty vaccines
- ^ "Information for Healthcare Professionals on Pfizer/BioNTech COVID-19 vaccine". Medicines & Healthcare products Regulatory Agency (MHRA). 8 December 2020. Retrieved 13 December 2020.
- ^ "Conditions of Authorisation for Pfizer/BioNTech COVID-19 vaccine". Medicines & Healthcare products Regulatory Agency (MHRA). 3 December 2020. Retrieved 13 December 2020.
- ^ "Interior Applauds Inclusion of Insular Areas through Operation Warp Speed to Receive COVID-19 Vaccines" (Press release). United States Department of the Interior (DOI). 12 December 2020. Retrieved 13 January 2021.
 هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ Dorman B (6 January 2021). "Asia Minute: Palau Administers Vaccines to Keep Country Free of COVID". Hawaii Public Radio. Retrieved 13 January 2021.
- ^ "FDA Takes Key Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for First COVID-19 Vaccine" (Press release). U.S. Food and Drug Administration (FDA). 11 December 2020. Retrieved 11 December 2020.
 هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ McElwee, Joshua J. (11 December 2020). "Vatican to offer coronavirus vaccine to residents and staff in early 2021". National Catholic Reporter. Retrieved 9 February 2021.
- ^ Menichetti, Massimiliano (11 December 2020). "In Vaticano parte il piano vaccinale anticovid". vatican.va (Press release). Retrieved 9 February 2021.
- ^ أ ب "Status of COVID-19 Vaccines within WHO EUL/PQ evaluation process" (PDF). World Health Organization (WHO).
- ^ "WHO issues its first emergency use validation for a COVID-19 vaccine and emphasizes need for equitable global access". World Health Organization (WHO) (Press release). 31 December 2020. Retrieved 6 January 2021.
- ^ "Comirnaty". Therapeutic Goods Administration. 25 January 2021. Retrieved 25 January 2021.
- ^ Australian Public Assessment Report for BNT162b2 (mRNA). Therapeutic Goods Administration (TGA). Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. https://www.tga.gov.au/sites/default/files/auspar-bnt162b2-mrna-210125.pdf. Retrieved on 25 January 2021. - ^ "Vacina da Pfizer é a 1ª a obter registro definitivo no Brasil" (in البرتغالية البرازيلية). G1. 23 February 2021. Retrieved 23 February 2021.
- ^ "Comirnaty EPAR". European Medicines Agency (EMA). Retrieved 23 December 2020.
- ^ "Questions and Answers: COVID-19 vaccination in the EU". European Commission. 21 December 2020. Retrieved 21 December 2020.
- ^ "Comirnaty". Union Register of medicinal products. Retrieved 8 January 2021.
- ^ "COVID-19: Bóluefninu Comirnaty frá BioNTech/Pfizer hefur verið veitt skilyrt íslenskt markaðsleyfi". Lyfjastofnun (in الأيسلندية). Retrieved 26 December 2020.
- ^ "Japan approves Pfizer's COVID-19 vaccine, 1st for domestic use". Nikkei Asia. 14 February 2021. Retrieved 14 February 2021.
- ^ "Malaysia's NPRA Approves Pfizer Covid-19 Vaccine". CodeBlue. 8 January 2021. Retrieved 25 February 2021.
- ^ Lim I (8 January 2021). "Khairy: Malaysia can use Pfizer's Covid-19 vaccine now as conditional registration granted". The Malay Mail. Retrieved 8 January 2021.
- ^ "Status på koronavaksiner under godkjenning per 21.12.20". Statens legemiddelverk (in النرويجية بوكمال). Retrieved 26 December 2020.
- ^ "Coronavirus: Saudi Arabia approves Pfizer COVID-19 vaccine for use". Al Arabiya English. 10 December 2020. Retrieved 10 December 2020.
- ^ Zimmer C, Corum J, Wee S (10 June 2020). "Coronavirus Vaccine Tracker". The New York Times. Retrieved 12 December 2020.
- ^ "Serbia leads region in expecting COVID-19 vaccines within days". BalkanInsight. 21 December 2020. Retrieved 26 December 2020.
- ^ "First shipment of Pfizer-BioNTech vaccine arrives in Serbia". Serbian government website. 22 December 2020. Retrieved 26 December 2020.
- ^ Lee, Kyung-eun (27 February 2021). "S. Korea begins rolling out Pfizer vaccines on second day of national vaccination program". Arirang News. Retrieved 28 February 2021.
- ^ Kim, Han-joo (5 March 2021). "S. Korea approves Pfizer's COVID-19 vaccine amid immunization push". Yonhap News Agency. Retrieved 5 March 2021.
- ^ "An Open Study of the Safety, Tolerability and Immunogenicity of the Drug "Gam-COVID-Vac" Vaccine Against COVID-19". ClinicalTrials.gov. United States National Library of Medicine. 17 June 2020. NCT04436471. Retrieved 5 March 2021.
- ^ Jones, Ian; Roy, Polly (2 February 2021). "Sputnik V COVID-19 vaccine candidate appears safe and effective". The Lancet. 397 (10275): 642–643. doi:10.1016/S0140-6736(21)00191-4. PMC 7906719. PMID 33545098.
- ^ Sagdiev, Rinat; Ivanova, Polina (16 November 2020). "Russia focuses on freeze-dried vaccine doses as transport fix". Reuters. Moscow. Retrieved 5 March 2021.
- ^ "Clinical Trial of Efficacy, Safety, and Immunogenicity of Gam-COVID-Vac Vaccine Against COVID-19". ClinicalTrials.gov. Archived from the original on 12 September 2020. Retrieved 11 September 2020.
- ^ "Covid19: National Pharmaceuticals Agency registers Sputnik V vaccine". Algeria Press service. 10 January 2021.
- ^ "Argentina has registered the Sputnik V vaccine based on Russian clinical trial data" (Press release). Gamaleya Center. Retrieved 1 January 2021.
- ^ "Armenia approves Russia's Sputnik V coronavirus vaccine -Russia's RDIF". Reuters. 1 February 2021. Retrieved 1 February 2021.
- ^ "Bahrain authorises Sputnik V COVID-19 vaccine for emergency use – Bahrain TV". Reuters. 10 February 2021. Retrieved 19 February 2021.
- ^ "Belarus registers Sputnik V vaccine, in first outside Russia – RDIF". Reuters. 21 December 2020. Retrieved 22 December 2020.
- ^ "Ministerio de Salud de Bolivia – Bolivia y Rusia firman contrato para adquirir 5,2 millones de dosis de la vacuna Sputnik-V contra la COVID-19". minsalud.gob.bo. Retrieved 1 January 2021.
- ^ أ ب "COVID-19: Egypt authorises Sputnik V, AstraZeneca virus jabs". Gulf News. Retrieved 24 February 2021.
- ^ "Sputnik V authorised in Gabon" (Press release). Gamaleya Center. Retrieved 17 February 2021.
- ^ "Ghana approves Russia's Sputnik V vaccine for emergency use – RDIF". Reuters. 20 February 2021.
- ^ "Guatemala to receive Russia's Sputnik vaccine in coming weeks". Reuters. 24 February 2021.
- ^ "Guinea Begins Administering Russia's Sputnik V Covid-19 Vaccine". Africa news. 31 December 2020.
- ^ "Russia's Sputnik V vaccine expands its reach in Latin America". CNN. 3 March 2021.
- ^ "Honduras approves use of Sputnik V vaccine against COVID-19". Xinhua News Agency. 25 February 2021.
- ^ "Iran approves Russian coronavirus vaccine Sputnik V". Reuters. 26 January 2021.
- ^ "Sputnik V authorized in Iraq" (Press release). PharmiWeb.com. 4 March 2021.
- ^ "Jordan approves Russia's Sputnik V vaccine for use against COVID-19" (Press release). Reuters. 10 March 2021.
- ^ "Kazakhstan begins mass vaccination by Russian Sputnik V". 1 February 2021. Retrieved 19 February 2021.
- ^ "Morocco, Kenya approve Russian coronavirus vaccine for use - RDIF". 10 March 2021. Retrieved 12 March 2021.
- ^ أ ب "Laos declares Covid-19 vaccinations safe, more to be inoculated next week | The Star". The Star. Malaysia. Retrieved 19 February 2021.
- ^ "Lebanon authorises emergency use of Russia's Sputnik V vaccine". Reuters. 5 February 2021.
- ^ "Mexico, Germany warm to Russia's Sputnik V virus vaccine". The Jakarta Post. 3 February 2021.
- ^ "Mongolia Approves Russia's Sputnik V Coronavirus Vaccine – RDIF". Urdu Point. 9 February 2021.
- ^ "Montenegro and St. Vincent approve Russia's Sputnik V vaccine – RDIF". Reuters. 12 February 2021.
- ^ "Morocco orders one million doses of Russia's Sputnik V vaccine". Yabiladi. 11 March 2021.
- ^ "Myanmar registers Russia's Sputnik V COVID-19 vaccine". TASS. Retrieved 19 February 2021.
- ^ "Nicaragua approves Russian COVID-19 vaccine". wsoctv. 3 February 2021.
- ^ "NRussia's Sputnik V COVID 19 vaccine registered in North Macedonia". TASS. 7 March 2021.
- ^ "Govt okays Russian vaccine for 'emergency use'". Dawn. 24 January 2021.
- ^ "Palestine has become the first country in the Middle East to register Sputnik V vaccine". RFID. 11 January 2021.
- ^ "Paraguay approves Russia's Sputnik V vaccine: RDIF". Reuters. 15 January 2021. Retrieved 15 January 2021.
- ^ أ ب ت "Sputnik V vaccine registered in Bosnia and Herzegovina's Republika Srpska". TASS. 5 February 2021. Retrieved 8 February 2021.
- ^ "San Marino buys the Sputnik vaccine: "First doses already in the next few days"". Unioneonline. 20 February 2021.
- ^ "Agencija odobrila uvoz ruske vakcine Sputnjik V u Srbiju". N1 (in الصربية). 31 December 2020.
- ^ "Sputnik V approved for use in Slovakia". rdif.ru. Retrieved 1 March 2021.
- ^ "Sri Lanka approves Russia's Sputnik V vaccine". The Hindu. 4 March 2021.
- ^ "Sputnik V vaccine authorized in Tunisia" (Press release). Gamaleya Center. Retrieved 30 January 2021.
- ^ "UAE approves Russia's Sputnik vaccine for emergency use". Khaleej Times. 21 January 2021. Retrieved 21 January 2021.
- ^ "Uruguay to start covid 19 Vaccination in April 2021". India Blooms.
- ^ "Venezuela firma contrato para la adquisición de la vacuna rusa Sputnik V" (in الإسبانية). Reuters. 29 December 2020.
- ^ أ ب "Vietnam approves US, Russia Covid-19 vaccines for emergency use". VnExpress. Retrieved 26 February 2021.
- ^ أ ب "Covid-19: Zimbabwe authorises Sputnik V, Sinovac vaccines for emergency use". news24.com. 9 March 2021.
- ^ أ ب ت "Angola, Congo Republic and Djibouti approve Russia's Sputnik V vaccine". Reuters. 3 March 2021.
- ^ "Hungarian drug regulator approves Sputnik V vaccine: website". The Moscow Times. 7 February 2021.
- ^ "Sputnik V registered in Kyrgyzstan". Gamaleya Center (Press release). 23 February 2021.
- ^ "Syria authorizes use of Sputnik-V". Roya. 22 February 2021.
- ^ "Turkmenistan is the first in Central Asia to have registered "Sputnik V" vaccine". Orient. 18 January 2021.
- ^ "Uzbekistan Certifies Russia's Sputnik Vaccine For Mass Use". Agence France-Presse (Barron's). 17 February 2021.
- ^ "AstraZeneca & Serum Institute of India sign licensing deal for 1 million doses of Oxford vaccine". The Economic Times. Retrieved 15 June 2020.
- ^ "Covid-19 vaccine: Serum Institute signs up for 100 million doses of vaccines for India, low and middle-income countries". The Financial Express. 7 August 2020.
- ^ Walsh N, Shelley J, Duwe E, Bonnett W (27 July 2020). "The world's hopes for a coronavirus vaccine may run in these health care workers' veins". São Paulo: CNN. Archived from the original on 3 August 2020. Retrieved 3 August 2020.
- ^ Gallagher, James; Triggle, Nick (30 December 2020). "Covid-19: Oxford-AstraZeneca vaccine approved for use in UK". BBC. Retrieved 5 March 2020.
- ^ قالب:Cite techreport
- ^ Sediqi, Abdul Qadir (7 February 2021). "First doses of COVID-19 vaccine arrive in Afghanistan from India". Reuters. Retrieved 24 February 2021.
- ^ "India donates 500,000 COVID vaccines to Afghanistan". Al Jazeera. Retrieved 24 February 2021.
- ^ "Argentine regulator approves AstraZeneca/Oxford COVID-19 vaccine". Reuters. 30 December 2020. Retrieved 30 December 2020.
- ^ "Bahrain approves Oxford/AstraZeneca coronavirus vaccine produced in India". Saudigazette. 25 January 2021. Retrieved 30 January 2021.
- ^ "Oxford University-Astrazeneca vaccine: Bangladesh okays it for emergency use". The Daily Star. Retrieved 6 January 2021.
- ^ "Bangladesh approves Oxford-AstraZeneca COVID-19 vaccine". aa.com.tr. Retrieved 6 January 2021.
- ^ أ ب McGeever J, Fonseca P (17 January 2021). "Brazil clears emergency use of Sinovac, AstraZeneca vaccines, shots begin". Reuters. Retrieved 17 January 2021.
- ^ "La República Dominicana aprueba la vacuna de AstraZeneca contra la covid-19". Agencia EFE (in الإسبانية). 31 December 2020.
- ^ "Ecuador approves use of AstraZeneca vaccine for COVID-19". Reuters. 24 January 2021. Retrieved 30 January 2021.
- ^ "El Salvador greenlights AstraZeneca, Oxford University COVID-19 vaccine". Reuters. 30 December 2020.
- ^ "Guyana gets first batch of COVID-19 vaccines; CARICOM Secretariat to get 100 doses". 10 February 2021. Retrieved 19 February 2021.
- ^ "Nurse administers first shot of AstraZeneca ( ChAdOx1 nCoV-19, ) vaccine to Brinnet Bernarai at Georgetown Public Hospital Corporation – PAHO/WHO | Pan American Health Organization". paho.org. Retrieved 19 February 2021.
- ^ أ ب Schmall E, Yasir S (3 January 2021). "India Approves Oxford-AstraZeneca Covid-19 Vaccine and 1 Other". The New York Times. Retrieved 3 January 2021.
- ^ "BPOM Terbitkan Izin Penggunaan Darurat Vaksin Covid-19 AstraZeneca". Kompas.com. Retrieved 10 February 2021.
- ^ أ ب "Iraq approves Sinopharm, AstraZeneca vaccines". Big News Network.com. Retrieved 30 January 2021.
- ^ https://www.bbc.com/news/world-africa-56239136
- ^ https://www.voanews.com/covid-19-pandemic/kenya-receives-1m-vaccine-doses-will-distribute-health-workers-first
- ^ "Maldives starts training healthcare workers on COVID-19 vaccine distribution – Xinhua | English.news.cn". Xinhua News Agency. Retrieved 19 February 2021.
- ^ AfricaNews (26 January 2021). "Mauritius begins vaccinating frontline health workers against covid-19". Africanews. Retrieved 24 February 2021.
- ^ "Mexico approves AstraZeneca COVID-19 vaccine, minister says". Reuters. 5 January 2021. Retrieved 14 January 2021.
- ^ "Myanmar launches nationwide COVID-19 vaccination program". Xinhua News. 27 January 2021.
- ^ "Nepal approves AstraZeneca COVID vaccine for emergency use – government statement". Reuters. 15 January 2021.
- ^ "Wetin we sabi about NAFDAC approval of Oxford AstraZeneca vaccine use for Nigeria". BBC News Pidgin. Retrieved 24 February 2021.
- ^ "Pakistan approves AstraZeneca COVID-19 vaccine for emergency use". 16 January 2021.
- ^ "Philippine regulator approves emergency use of AstraZeneca vaccine". Reuters. 28 January 2021. Retrieved 28 January 2021.
- ^ https://www.afro.who.int/news/rwanda-receives-covid-19-vaccines-through-covax
- ^ أ ب "AstraZeneca and Moderna vaccines to be administered in Saudi Arabia". Gulf News. Retrieved 19 January 2021.
- ^ "Sri Lanka approves vaccine amid warnings of virus spread". AP NEWS. 22 January 2021. Retrieved 22 January 2021.
- ^ https://www.unicef.org/sudan/stories/covid-19-vaccination-sudan
- ^ https://www.unicef.org/press-releases/sudan-receives-first-delivery-covid-19-vaccines-over-800000-doses
- ^ "Suriname begins coronavirus vaccination campaign with donated doses". Reuters. 23 February 2021. Retrieved 28 February 2021.
- ^ "Taiwan grants emergency authorisation for AstraZeneca COVID-19 vaccine". Reuters. 20 February 2021. Retrieved 13 March 2021.
- ^ "Thai Food and Drug registers COVID-19 vaccine developed by AstraZeneca". Pattaya Mail. 23 January 2021.
- ^ https://www.togofirst.com/en/health/1602-7300-covid-19-first-vaccination-campaign-to-soon-begin
- ^ https://www.africanews.com/2021/03/10/uganda-starts-covid-19-vaccinations/
- ^ "COVID-19: AstraZeneca vaccine certified for use in Ukraine". covid.unian.info (in الإنجليزية). Retrieved 10 March 2021.
- ^ "Information for Healthcare Professionals on COVID-19 Vaccine AstraZeneca". Medicines and Healthcare products Regulatory Agency (MHRA). 30 December 2020. Retrieved 4 January 2021.
- ^ "Oxford University/AstraZeneca vaccine authorised by UK medicines regulator" (Press release). Department of Health and Social Care. 30 December 2020. Retrieved 30 December 2020.
- ^ "Conditions of Authorisation for COVID-19 Vaccine AstraZeneca". Medicines and Healthcare products Regulatory Agency (MHRA). 30 December 2020. Retrieved 4 January 2021.
- ^ "Vietnam approves AstraZeneca COVID-19 vaccine, cuts short Communist Party congress". CNA. Retrieved 5 February 2021.
- ^ "Interim recommendations for use of the AZD1222 (ChAdOx1-S (recombinant)) vaccine against COVID-19 developed by Oxford University and AstraZeneca". World Health Organization (WHO). Retrieved 27 February 2021.
- ^ "AstraZeneca/Oxford Covid-19 Vaccine Gets Emergency Approval From WHO". Forbes. Retrieved 16 February 2021.
- ^ "AstraZeneca coronavirus vaccine approved for use in Australia by TGA". ABC News. 16 February 2021. Retrieved 16 February 2021.
- ^ "TGA provisionally approves AstraZeneca's COVID-19 vaccine". Therapeutic Goods Administration (TGA). 16 February 2021. Retrieved 16 February 2021.
- ^ "Regulatory Decision Summary – AstraZeneca COVID-19 Vaccine". Health Canada. 26 February 2021. Retrieved 26 February 2021.
- ^ "COVID-19 Vaccine AstraZeneca: Pending EC decision". European Medicines Agency (EMA). 28 January 2021. Retrieved 29 January 2021.
- ^ "EMA recommends COVID-19 Vaccine AstraZeneca for authorisation in the EU". European Medicines Agency (EMA) (Press release). 29 January 2021. Retrieved 29 January 2021.
- ^ "European Commission authorises third safe and effective vaccine against COVID-19". European Commission (Press release). 29 January 2021. Retrieved 29 January 2021.
- ^ أ ب "EU-Kommissionen har i dag udstedt en betinget markedsføringstilladelse til AstraZeneca COVID-19- vaccine. Tilladelsen gælder i Danmark". Lægemiddelstyrelsen (in الدانمركية). Retrieved 12 March 2021.
- ^ "The Icelandic Medicines Agency have issued a conditional marketing authorisation for the AstraZeneca COVID-19 vaccine". covid.is. Retrieved 12 March 2021.
- ^ أ ب "Malaysia's NPRA Approves AstraZeneca, Sinovac Covid-19 Vaccines". CodeBlue. 2 March 2021. Retrieved 7 March 2021.
- ^ أ ب Sipalan, Joseph; Donovan, Kirsten (3 March 2021). "Malaysia approves Sinovac, AstraZeneca COVID-19 vaccines for use". Reuters. Retrieved 7 March 2021.
- ^ "The European Commission has now approved the AstraZeneca COVID-19 vaccine. This means that the vaccine is approved for use in Norway". vg. Retrieved 12 March 2021.
- ^ Kim, Han-joo (10 February 2021). "S. Korea approves AstraZeneca's COVID-19 vaccine for all adults". Yonhap News Agency. Retrieved 10 February 2021.
- ^ Maresca, Thomas (10 February 2021). "South Korea approves AstraZeneca COVID-19 vaccine". United Press International. Retrieved 10 February 2021.
- ^ Xia, Shengli; Zhang, Yuntao; Wang, Yanxia; Wang, Hui; Yang, Yunkai; Gao, George; et al. (15 October 2020). "Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial". The Lancet Infectious Diseases. 21 (1): 39–51. doi:10.1016/S1473-3099(20)30831-8. PMC 7561304. PMID 33069281.
- ^ Elbahrawy, Farah; Lyu, Dong; Omar, Abeer; Che, Claire; Paton, James (9 December 2020). "China State-Backed Covid Vaccine Has 86% Efficacy, UAE Says". Bloomberg News. Retrieved 5 March 2020.
CNBG's vaccine can be transported and stored at normal refrigerated temperatures.
- ^ Biannchi, Walter (21 February 2021). "Argentina approves Sinopharm COVID-19 vaccine for emergency use". Reuters. Retrieved 23 February 2021.
- ^ "Bolivia begins inoculation with Sinopharm jabs | The Star". The Star. Malaysia. Retrieved 28 February 2021.
- ^ Rinith T (4 February 2021). "Health Ministry grants Emergency Use Authorization to China's Sinopharm vaccine". Khmer Times. Retrieved 4 February 2021.
- ^ "Dominica: Melissa Skerrit receives the Sinopharm COVID-19 vaccine". WIC News. 4 March 2021. Retrieved 7 March 2021.
- ^ "Egypt licenses China's Sinopharm COVID-19 vaccine for emergency use: health minister – Xinhua | English.news.cn". Xinhua News Agency.
- ^ "Sinopharm vaccine rollout starts this weekend". Stabroek News. 6 March 2021. Retrieved 7 March 2021.
- ^ "Hungary signs deal for Chinese Sinopharm's COVID-19 vaccine, first in EU". National Post.
- ^ "Iran Launches Phase Two of Mass Inoculation Campaign". Financial Tribune. 22 February 2021. Retrieved 23 February 2021.
- ^ "First batch of Chinese Sinopharm vaccine arrives in Jordan". Roya News. Retrieved 9 January 2021.
- ^ Crean, Rosabel. "China donates 50,000 doses of Sinopharm vaccine to Lebanon | News , Lebanon News | THE DAILY STAR". Daily Star. Retrieved 2 March 2021.
- ^ "Macau receives first batch of COVID-19 vaccines". IAG. 7 February 2021. Retrieved 24 February 2021.
- ^ "Covid-19: Morocco authorizes use of the Sinopharm vaccine". en.yabiladi.com.
- ^ Reuters Staff (6 March 2021). "Mozambique expects to vaccinate 16 million against coronavirus by 2022". Reuters (in الإنجليزية). Retrieved 7 March 2021.
{{cite web}}:|author=has generic name (help) - ^ Poudel, Arjun. "China's Shinopharm vaccine gets emergency use authorisation in Nepal". Kathmandu Post. Retrieved 19 February 2021.
- ^ Shahzad A (19 January 2021). "Pakistan approves Chinese Sinopharm COVID-19 vaccine for emergency use". Reuters.
- ^ "Peru grants 'exceptional' approval for Sinopharm COVID-19 vaccine – government sources". Reuters. 27 January 2021.
- ^ Asala, Kizzi. "Senegal Kicks Off COVID-19 Vaccination Campaign with China's Sinopharm". Africanews. Retrieved 23 February 2021.
- ^ "Serbia Becomes First European Nation To Use China's Sinopharm Vaccine". RadioFreeEurope/RadioLiberty.
- ^ Sequera, Vivian (1 March 2021). "Venezuela approves use of China's Sinopharm coronavirus vaccine". Reuters. Retrieved 2 March 2021.
- ^ Mutsaka, Farai (18 February 2021). "Zimbabwe starts administering China's Sinopharm vaccines". The Star. Retrieved 20 February 2021.
- ^ "Bahrain approves China's Sinopharm coronavirus vaccine". Arabian Business Industries. 13 December 2020.
- ^ Kuo L. "China approves Sinopharm coronavirus vaccine, the country's first for general use". The Washington Post.
- ^ "President Ramkalawan and First Lady receives second dose SinoPharm Vaccine". statehouse.gov.sc. Retrieved 5 February 2021.
- ^ Wee S (9 December 2020). "Chinese Covid-19 Vaccine Gets Key Push, but Doubts Swirl". The New York Times. Retrieved 12 December 2020.
- ^ "Coronavirus: UAE authorises emergency use of vaccine for frontline workers". The National. Retrieved 24 November 2020.
- ^ PT. Bio Farma (10 August 2020). "A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia". Registri Penyakit Indonesia. Retrieved 15 August 2020.
- ^ "Sinovac says COVID-19 vaccine effective in preventing hospitalization, death". Reuters. 5 February 2021. Retrieved 5 March 2021.
- ^ Tan, Yvette (14 January 2021). "Covid: What do we know about China's coronavirus vaccines?". BBC. Retrieved 5 March 2020.
- ^ Aliyev J. "Azerbaijan kicks off COVID-19 vaccination". Anadolu Agency. Retrieved 7 February 2021.
- ^ "Bolívia autoriza uso de vacinas Sputnik V e CoronaVac contra covid-19". noticias.uol.com.br (in البرتغالية البرازيلية). Retrieved 6 January 2021.
- ^ Chanritheara, Torn. "Cambodia Approves AstraZeneca and Sinovac Vaccines for COVID-19 Emergency Use". Cambodianess. Retrieved 12 February 2021.
- ^ "Chile aprueba el uso de emergencia de la vacuna china de Sinovac contra covid-19". France 24. 20 January 2021. Retrieved 30 January 2021.
- ^ Aliyev J. "Colombia approves emergency use of CoronaVac vaccine". Anadolu Agency. Retrieved 7 February 2021.
- ^ "Anticovid vaccines run out as Dominican Republic awaits arrival of more doses" (in الإنجليزية). DominicanToday. Retrieved 10 March 2021.
- ^ "Ecuador signs agreement with Sinovac for 2 million COVID-19 vaccine: minister". National Post. Retrieved 26 February 2021.
- ^ "Use of Sinovac vaccine authorised". Government of Hong Kong. 18 February 2021. Retrieved 19 February 2021.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةStraitsTimes20210111 - ^ "BPOM Grants Emergency Use Authorization for Sinovac Vaccine". Tempo. 11 January 2021. Retrieved 11 January 2021.
- ^ أ ب ت Liu R (6 February 2021). "China approves Sinovac Biotech COVID-19 vaccine for general public use". Reuters. Retrieved 7 February 2021.
- ^ أ ب Barrera, Adriana (11 February 2021). "Mexico approves China's CanSino and Sinovac COVID-19 vaccines". Reuters. Retrieved 11 February 2021.
- ^ "Philippines approves Sinovac's COVID-19 vaccine for emergency use". Reuters. 22 February 2021.
- ^ Thepgumpanat, Panarat (22 February 2021). "Thailand allows emergency use of Sinovac's COVID-19 vaccine". Reuters. Retrieved 23 February 2021.
- ^ "Tunisia approva vaccino cinese Sinovac" (in الإيطالية). Agenzia Nazionale Stampa Associata (in Italian). 5 March 2021. Retrieved 7 March 2021.
- ^ "Turkey to begin COVID-19 vaccine jabs by this weekend". Anadolu. 11 January 2021. Retrieved 11 January 2021.
- ^ Zinets, Natalia (9 March 2021). "Ukraine approves China's Sinovac COVID-19 vaccine". Reuters (in الإنجليزية). Retrieved 10 March 2021.
- ^ "Safety and Immunogenicity Study of 2019-nCoV Vaccine (mRNA-1273) for Prophylaxis of SARS-CoV-2 Infection (COVID-19)". ClinicalTrials.gov. United States National Library of Medicine. 16 March 2020. NCT04283461. Retrieved 5 March 2021.
- ^ "WHO experts issue recommendations on Moderna COVID-19 vaccine". Reuters. Geneva. 26 January 2021. Retrieved 5 March 2021.
- ^ قالب:Cite techreport
- ^ "Regulatory Decision Summary – Moderna COVID-19 Vaccine". Health Canada, Government of Canada. 23 December 2020. Retrieved 23 December 2020.
- ^ "Israeli Ministry of Health Authorizes COVID-19 Vaccine Moderna for Use in Israel". modernatx.com. 4 January 2021. Retrieved 4 January 2021.
- ^ "Singapore becomes first in Asia to approve Moderna's COVID-19 vaccine". Reuters. 3 February 2021. Retrieved 3 February 2021.
- ^ "Swissmedic grants authorisation for the COVID-19 vaccine from Moderna" (Press release). Swiss Agency for Therapeutic Products (Swissmedic). 12 January 2020. Retrieved 12 January 2020.
- ^ "Information for Healthcare Professionals on COVID-19 Vaccine Moderna". Medicines and Healthcare products Regulatory Agency (MHRA). 8 January 2021. Retrieved 8 January 2021.
- ^ "Conditions of Authorisation for COVID-19 Vaccine Moderna". Medicines and Healthcare products Regulatory Agency (MHRA). 8 January 2021. Retrieved 9 January 2021.
- ^ "FDA Takes Additional Action in Fight Against COVID-19 By Issuing Emergency Use Authorization for Second COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Press release). Retrieved 18 December 2020.
- ^ Oliver SE, Gargano JW, Marin M, Wallace M, Curran KG, Chamberland M, et al. (December 2020). "The Advisory Committee on Immunization Practices' Interim Recommendation for Use of Moderna COVID-19 Vaccine – United States, December 2020" (PDF). MMWR. Morbidity and Mortality Weekly Report. 69 (5152): 1653–56. doi:10.15585/mmwr.mm695152e1. PMID 33382675. S2CID 229945697.
- ^ "COVID-19 Vaccine Moderna EPAR". European Medicines Agency (EMA). Retrieved 20 January 2021.
- ^ "European Commission authorises second safe and effective vaccine against COVID-19". European Commission (Press release). Retrieved 6 January 2021.
- ^ "EMA recommends COVID-19 Vaccine Moderna for authorisation in the EU" (Press release). European Medicines Agency. 6 January 2021. Retrieved 6 January 2021.
- ^ "COVID-19 Vaccine Moderna". Union Register of medicinal products. Retrieved 14 January 2021.
- ^ أ ب "Endnu en vaccine mod COVID-19 er godkendt af EU-Kommissionen". Lægemiddelstyrelsen (in الدانمركية). Retrieved 7 January 2021.
- ^ "COVID-19: Bóluefninu COVID-19 Vaccine Moderna frá hefur verið veitt skilyrt íslenskt markaðsleyfi". Lyfjastofnun (in الأيسلندية). Retrieved 7 January 2021.
- ^ "Status på koronavaksiner under godkjenning per 6. januar 2021". Statens legemiddelverk (in النرويجية بوكمال). Retrieved 7 January 2021.
- ^ "A Study of Ad26.COV2.S in Adults". ClinicalTrials.gov. 4 August 2020. Archived from the original on 16 September 2020. Retrieved 23 August 2020.
- ^ "A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants". ClinicalTrials.gov. US National Library of Medicine. Archived from the original on 26 September 2020.
- ^ قالب:Cite techreport
- ^ أ ب Ledford H (29 January 2021). "J&J's one-shot COVID vaccine offers hope for faster protection". Nature. doi:10.1038/d41586-021-00119-7. PMID 33526898.
- ^ "Bahrain first to approve Johnson & Johnson COVID-19 vaccine for emergency use". Reuters. 25 February 2021. Retrieved 25 February 2021.
- ^ "Bahrain becomes 1st nation to grant J&J shot emergency use". ABC News. 25 February 2021. Retrieved 25 February 2021.
- ^ "Johnson & Johnson COVID-19 vaccine becomes 4th to receive Health Canada approval | CBC News" (in الإنجليزية الأمريكية). Canadian Broadcasting Corporation. Retrieved 5 March 2021.
- ^ "Coronavirus: South Africa rolls out vaccination programme". BBC News. 17 February 2021. Retrieved 19 February 2021.
- ^ "FDA Issues Emergency Use Authorization for Third COVID-19 Vaccine". U.S. Food and Drug Administration (FDA) (Press release). 27 February 2021. Retrieved 27 February 2021.
- ^ https://www.fda.gov/media/146303/download
- ^ "WHO approves J&J's COVID-19 vaccine for emergency listing". Channel News Asia. March 13, 2021. Retrieved March 13, 2021.
- ^ https://www.jnj.com/johnson-johnson-single-shot-covid-19-vaccine-granted-conditional-marketing-authorization-by-european-commission
- ^ "European Commission authorises fourth safe and effective vaccine against COVID-19". European Commission (Press release). 11 March 2021.
- ^ أ ب "EU-Kommissionen har i dag udstedt en betinget markedsføringstilladelse til Johnson & Johnsons COVID-19- vaccine. Tilladelsen gælder i Danmark". Lægemiddelstyrelsen (in الدانمركية). Retrieved 12 March 2021.
- ^ "The Icelandic Medicines Agency have issued a conditional marketing authorisation". covid.is. Retrieved 12 March 2021.
- ^ "The European Commission has now approved the Johnson & Johnson vaccine. This means that the vaccine is approved for use in the EU and Norway". vg. Retrieved 12 March 2021.
- ^ "Whole-Virion Inactivated SARS-CoV-2 Vaccine (BBV152) for COVID-19 in Healthy Volunteers". ClinicalTrials.gov. NCT04471519.
- ^ أ ب "Covishield and Covaxin: What we know about India's Covid-19 vaccines". BBC. 4 March 2021. Retrieved 5 March 2020.
The two doses are given four weeks apart. The vaccine can be stored at 2C to 8C.
- ^ "An Efficacy and Safety Clinical Trial of an Investigational COVID-19 Vaccine (BBV152) in Adult Volunteers". ClinicalTrials.gov. NCT04641481. Retrieved 26 November 2020.
- ^ "Iran issues permit for emergency use for three other COVID-19 vaccines: Official". IRNA English (in الإنجليزية). 17 February 2021.
- ^ Manral, Karan (4 March 2021). "Zimbabwe approves Covaxin, first in Africa to okay India-made Covid-19 vaccine". Hindustan Times. Retrieved 6 March 2021.
{{cite news}}: CS1 maint: url-status (link) - ^ أ ب Peshimam, Gibran; Farooq, Umar (8 February 2021). "CanSinoBIO's COVID-19 vaccine 65.7% effective in global trials, Pakistan official says". Reuters. Islamabad. Retrieved 5 March 2021.
its single-dose regimen and normal refrigerator storage requirement could make it a favourable option for many countries
- ^ "CanSino's COVID-19 vaccine approved for military use in China". Nikkei Asia. Retrieved 24 December 2020.
- ^ "More Than 2.7 Million People Have Gotten Vaccines: Covid-19 Tracker". Bloomberg L.P. Retrieved 24 December 2020.
- ^ Shahzad, Asif (12 February 2021). "Pakistan approves Chinese CanSinoBIO COVID vaccine for emergency use". Reuters. Retrieved 12 February 2021.
- ^ Benedyczak, Jakub (12 February 2021). Russia's Problems in the Vaccine Race. Polish Institute of International Affairs. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. https://pism.pl/publications/Russias_Problems_in_the_Vaccine_Race. Retrieved on 6 March 2021. "the Sputnik V and EpiVacCorona can be transported and stored at temperatures of +2 to + 8° C" - ^ "О регистрации вакцины ФБУН ГНЦ ВБ "Вектор" Роспотребнадзора "ЭпиВакКорона"". Rospotrebnadzor (in الروسية). 14 October 2020.
- ^ "Russia's EpiVacCorona vaccine post-registration trials started". The Pharma Letter. 18 November 2020.
- ^ "Turkmenistan registers vaccines for the prevention of infectious diseases". Turkmenistan Today. 29 January 2021.
- ^ "Russian vaccine "EpiVacCorona" was registered in Turkmenistan". EN24. 29 January 2021.
- ^ "Briefing with Deputy Prime Minister Tatyana Golikova, Health Minister Mikhail Murashko and Head of Rospotrebnadzor Anna Popova". Government of Russia. 18 January 2021. Retrieved 20 February 2021.
- ^ Ryumin, Alexander (20 February 2021). "Russia registers its third COVID-19 vaccine CoviVac". TASS. Moscow. Retrieved 6 March 2021.
- ^ أ ب Ivanova, Polina (8 February 2021). "Russia approves its third COVID-19 vaccine, CoviVac". Reuters. Moscow. Retrieved 5 March 2021.
The CoviVac shot is given in two doses, 14 days apart. It is transported and stored at normal fridge temperatures, of 2 to 8 degrees Celsius (35.6 to 46.4 Fahrenheit), Deputy Prime Minister Tatiana Golikova said in a government briefing in January.
- ^ "Russia approves its third COVID-19 vaccine, CoviVac". Reuters. 20 February 2021.
- ^ أ ب "A Phase III Clinical Trial to Determine the Safety and Efficacy of ZF2001 for Prevention of COVID-19". ClinicalTrials.gov.
- ^ "China's CAS COVID-19 vaccine induces immune response in mid-stage tests". Reuters. Beijing. 23 December 2020. Retrieved 8 March 2021.
- ^ Mamatkulov, Mukhammadsharif (1 March 2021). "Uzbekistan approves Chinese-developed COVID-19 vaccine". Reuters. Retrieved 2 March 2021.
- ^ "Uzbekistan certifies Chinese vaccine to fight against COVID-19". China Daily. 2 March 2021. Retrieved 8 March 2021.
- ^ "روسيا ستمد مصر بلقاح كورونا". جريدة الشروق الجزائرية. 2020-09-30. Retrieved 2020-09-30.
- ^ "واشنطن: وفاة 6 أشخاص شاركوا في تجارب لقاح فايزر ضد كورونا". مصراوي. 2020-12-09. Retrieved 2020-12-09.
- ^ "رد رسمي على وفاة 6 أشخاص في تجارب لقاح "فايزر" و"بيونتك"". سكاي نيوز عربية. 2020-12-09. Retrieved 2020-12-09.
- ^ "تحالف «فايزر» يتجه لطلب التصريح لجرعة ثالثة من لقاحه". الشرق الأوسط. 2021-07-09. Retrieved 2021-07-09.
- ^ "بيرو تعلق التجارب السريرية للقاح صيني بعد «حادثة خطيرة»". جريدة الشرق الأوسط. 2020-12-13. Retrieved 2020-12-13.
- ^ "البيرو: وفاة امرأة متطوعة خضعت لتجربة لقاح "سينوفارم" الصيني ضد كوفيد-19". مونت كارلو الدولية. 2021-01-27. Retrieved 2021-01-27.
- ^ "«فايزر» و«أسترازينيكا» فعالان ضد «المتحور الهندي»". الشرق الأوسط. 2021-05-24. Retrieved 2021-05-24.
- ^ Thorp, H. Holden (27 March 2020). "Underpromise, overdeliver". Science. 367 (6485): 1405. doi:10.1126/science.abb8492. PMID 32205459.
- ^ Yeung, Jessie (29 March 2020). "Millions of chickens are used to make vaccines each year. But that won't work for coronavirus". CNN. Retrieved 2020-04-04.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help)CS1 maint: url-status (link) - ^ أ ب ت ث ج ح خ Eyal, Nir; Lipsitch, Marc; Smith, Peter G. (31 March 2020). "Human challenge studies to accelerate coronavirus vaccine licensure". The Journal of Infectious Diseases (in الإنجليزية). doi:10.1093/infdis/jiaa152.
- ^ أ ب ت ث ج Callaway, Ewen (2020-03-26). "Should scientists infect healthy people with the coronavirus to test vaccines?". Nature (in الإنجليزية). 580: 17–17. doi:10.1038/d41586-020-00927-3.
- ^ Eric Boodman (13 March 2020). "Coronavirus vaccine clinical trial starting without usual animal data". STAT. Retrieved 19 April 2020.
- ^ أ ب ت Cohen, Jon (31 March 2020). "Speed coronavirus vaccine testing by deliberately infecting volunteers? Not so fast, some scientists warn". Science Magazine. Retrieved 19 April 2020.
- ^ Callaway, Ewen (2020-03-26). "Should scientists infect healthy people with the coronavirus to test vaccines?". Nature (in الإنجليزية). 580 (7801): 17. doi:10.1038/d41586-020-00927-3. PMID 32218549.
- ^ "The global impact of COVID-19 and strategies for mitigation and suppression" (PDF). Imperial College COVID-19 Response Team. 26 March 2020. doi:10.25561/77735. Retrieved 19 April 2020.
- ^ Azar, Alex (February 4, 2020). "Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19".
- ^ Cavanagh D (December 2003). "Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus". Avian Pathology. 32 (6): 567–82. doi:10.1080/03079450310001621198. PMID 14676007.
- ^ Gao W, Tamin A, Soloff A, D'Aiuto L, Nwanegbo E, Robbins PD, et al. (December 2003). "Effects of a SARS-associated coronavirus vaccine in monkeys". Lancet. 362 (9399): 1895–6. doi:10.1016/S0140-6736(03)14962-8. PMC 7112457. PMID 14667748.
- ^ Kim E, Okada K, Kenniston T, Raj VS, AlHajri MM, Farag EA, et al. (October 2014). "Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice". Vaccine. 32 (45): 5975–82. doi:10.1016/j.vaccine.2014.08.058. PMC 7115510. PMID 25192975.
- ^ أ ب Jiang S, Lu L, Du L (January 2013). "Development of SARS vaccines and therapeutics is still needed". Future Virology. 8 (1): 1–2. doi:10.2217/fvl.12.126. PMC 7079997. PMID 32201503.
- ^ "SARS (severe acute respiratory syndrome)". National Health Service. 5 March 2020. Archived from the original on 9 March 2020. Retrieved 31 January 2020.
- ^ Greenough TC, Babcock GJ, Roberts A, Hernandez HJ, Thomas WD, Coccia JA, et al. (February 2005). "Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice". The Journal of Infectious Diseases. 191 (4): 507–14. doi:10.1086/427242. PMC 7110081. PMID 15655773.
- ^ Tripp RA, Haynes LM, Moore D, Anderson B, Tamin A, Harcourt BH, et al. (September 2005). "Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins". Journal of Virological Methods. 128 (1–2): 21–8. doi:10.1016/j.jviromet.2005.03.021. PMC 7112802. PMID 15885812.
- ^ Roberts A, Thomas WD, Guarner J, Lamirande EW, Babcock GJ, Greenough TC, et al. (March 2006). "Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters". The Journal of Infectious Diseases. 193 (5): 685–92. doi:10.1086/500143. PMC 7109703. PMID 16453264.
- ^ Shehata, Mahmoud M.; Gomaa, Mokhtar R.; Ali, Mohamed A.; Kayali, Ghazi (20 January 2016). "Middle East respiratory syndrome coronavirus: a comprehensive review". Frontiers of Medicine. 10 (2): 120–136. doi:10.1007/s11684-016-0430-6. PMC 7089261. PMID 26791756.
- ^ Butler D (October 2012). "SARS veterans tackle coronavirus". Nature. 490 (7418): 20. Bibcode:2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444.
- ^ Modjarrad K, Roberts CC, Mills KT, Castellano AR, Paolino K, Muthumani K, et al. (September 2019). "Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial". The Lancet. Infectious Diseases. 19 (9): 1013–1022. doi:10.1016/S1473-3099(19)30266-X. PMID 31351922.
- ^ Yong CY, Ong HK, Yeap SK, Ho KL, Tan WS (2019). "Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus". Frontiers in Microbiology. 10: 1781. doi:10.3389/fmicb.2019.01781. PMC 6688523. PMID 31428074.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Kertscher, Tom (23 January 2020). "No, there is no vaccine for the Wuhan coronavirus". PolitiFact. Poynter Institute. Archived from the original on 7 February 2020. Retrieved 7 February 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ McDonald, Jessica (24 January 2020). "Social Media Posts Spread Bogus Coronavirus Conspiracy Theory". FactCheck.org. Annenberg Public Policy Center. Archived from the original on 6 February 2020. Retrieved 8 February 2020.
{{cite web}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ "الصحة العالمية: لقاحات كورونا ستكون من الموارد المحدودة". مصراوي. 2021-02-22. Retrieved 2021-02-23.
- ^ "مجموعة السبع بصدد التبرع بمليار جرعة من لقاح «كورونا» للدول الفقيرة". الشرق الأوسط. 2021-06-11. Retrieved 2021-06-11.
- ^ "السعودية ستسمح فقط لمن تلقوا لقاح كورونا بأداء العمرة خلال رمضان". مونت كارلو الدولية. 2021-04-05. Retrieved 2021-04-05.
وصلات خارجية
- "COVID-19 Vaccine Tracker". Regulatory Focus.
خطأ استشهاد: وسوم <ref> موجودة لمجموعة اسمها "lower-alpha"، ولكن لم يتم العثور على وسم <references group="lower-alpha"/>
- CS1 errors: unsupported parameter
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- CS1 maint: url-status
- CS1 الإسبانية-language sources (es)
- CS1 الإندونيسية-language sources (id)
- CS1 errors: deprecated parameters
- CS1 الألمانية-language sources (de)
- CS1 البرتغالية البرازيلية-language sources (pt-br)
- CS1 الدانمركية-language sources (da)
- CS1 الأيسلندية-language sources (is)
- CS1 النرويجية بوكمال-language sources (nb)
- CS1 الصربية-language sources (sr)
- CS1 errors: generic name
- CS1 الإيطالية-language sources (it)
- CS1 الروسية-language sources (ru)
- CS1 maint: unflagged free DOI
- Short description is different from Wikidata
- Portal-inline template with redlinked portals
- Pages with empty portal template
- مقالات ينقصها مصادر موثوقة
- مقالات ينقصها مصادر موثوقة from March 2021
- Portal templates with default image
- لقاحات كوڤيد-19
- لقاحات
- كوڤيد-19
- أبحاث طبية