الكيمياء الحيوية
| جزء من سلسلة عن |
| الكيمياء الحيوية |
|---|
 |
الكيمياء الحيوية Biochemistry، هي أحد فروع العلوم الطبيعية التى تختص بدراسة كل ما هو متعلق بحياة الكائنات الحية سواء كانت كائنات دقيقة (بكتيريا، فطريات، طحالب) أو راقية كالإنسان والحيوان والنبات. ويوصف علم الكيمياء الحيوية أحياناً بأنه علم كيمياء الحياة وذلك نظراً لارتباط الكيمياء الحيوية بالحياة فقد ركز العلماء في هذا المجال على البحث في كيمياء الكائنات الحية على اختلاف أنواعها عن طريق دراسة المكونات الخلوية لهذه الكائنات من حيث التراكيب الكيميائية لهذه المكونات ومناطق تواجدها ووظائفها الحيوية فضلاً عن دراسة التفاعلات الحيوية المختلفة التى تحدث داخل هذه الخلايا الحية من حيث البناء والتخليق، أو من حيث الهدم وانتاج الطاقة.
ونظراً لتشعب فروع علم الكيمياء الحيوية فانه تم تقسيمها إلى ثلاثة اتجاهات رئيسية وهي:
1- دراسة التركيب الكيميائي لمكونات الخلايا من حيث النوع والكم، وسمى هذا المجال بالكيمياء الحيوية التركيبية Biochemical Anabolism.
2- دراسة فزيولوجية لمكونات الخلايا الحية والتحولات الغذائية وانتاج الطاقة، و سمى هذا المجال بالكيمياء الحيوية الفسيولوجية والحركية Physiological Biochemistry & Kinetic Biochemstry.
3- دراسة وظيفة المركبات الحيوية داخل الخلايا و العلاقة بينها وبين وظائف الاعضاء والأنسجة، وسمى هذا المجال بالكيمياء الحيوية الوظيفية Functional Biochemstry.
المونوميرات والپوليميرات
للكربوهيدرات مونوميرات تسمى بالسكريات الأحادية. بعض من هذه السكريات الأحادية يحتوي على الگلوكوز.
الكيمياء الحيوية تتضمن أيضاً دراسة التركيبِ ووظيفة المكوّنات الخلوية، مثل البروتينات، الكربوهيدرات، الدهون، الأحماض النووية، والجزيئات الحيوية الأخرى. ركّزتْ كيمياء حيويةُ مؤخراً بشكل مُحدّد أكثرُ على كيمياءِ الأنزيمات التي تَوسّطَ الكثير من العمليات والتفاعلات الحيوية، وعلى خواص البروتينات.
تتكون الكيمياء الحيوية عامة من دراسة المركبات الحيوية:-
- الكربوهيدرات.
- الاحماض الامينية والبروتينات.
- الأحماض النووية.
- الانزيمات.
- الدهون.
- الاستقلاب .
- الهرمونات.
- الفيتامينات.
الكربوهيدرات
 مقالة مفصلة: الكربوهيدرات
مقالة مفصلة: الكربوهيدرات
يدرس المتخصصون في الكيمياء الحيوية الجزيئات والتفاعلات الكيميائية المُحَفَّزة مِن قبل الإنزيمات التي تسهم في كل العمليات الحيوية ضمن الكائن الحي. يقدم علم الأحياء الجزيئي تخطيطا ووصفا للعلاقة الداخلية بين الكيمياء الحيوية، وعلم الأحياء، وعلم الوراثة.
الدهون

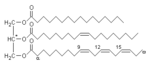
تتألف الدهون من مجموعة متنوعة من الجزيئات وتعتبر إلى حد ما حصيلة لمركبات غير قابلة للذوبان في الماء نسبياً أو غير قطبية من أصل حيوي، وتشمل الشموع، الأحمض الدهنية، الدهون الفسفورية المشتقة من الأحماض الأمينية، دهون سفينجولية، دهون سكرية وترپنويدت (مثل الرتينويدات والسترويدات). بعض الدهون عبارة عن جزيئات أليفاتية، بينما يمتلك البعض الآخر تركيبات حلقية. بعضها عبارة عن مركبات حلقية، بينما البعض الآخر غير حلقي. بعضها مرن، وبعضها الآخر صلب.[3]
عادة ما تتكون الدهون من جزيء واحد من الگليسرول مرتبط بجزيئات أخرى. في ثلاثيات الگليسريد، الجزء الأكبر من الدهون، يوجد جزيء واحد من الگليسرول وثلاث أحماض أمينية. في هذه الحالة، تعتبر الأحماض الدهنية مونمورات، وقد تكون مشبعة (لا يوجد روابط مزدوجة في سلسلة الكربون) أو غير مشبعة (يوجد رابطة ثنائية أو أكثر في سلسلة الكربون).[4]
لمعظم الدهون خاصية قطبية بالإضافة إلى أن معظمها غير قطبي. بصفة عامة، معظم تركيبها يكون غير قطبي أو كاره للماء، مما يعني أنها لا تتفاعل بشكل جيد مع المذيبات القطبية مثل الماء. الجزء الآخر في تركيبها يكون قطبياً أو (محب للماء ويميل للارتباط مع المذيبات القطبية مثل الماء. يؤدي هذا إلى جعل جزيئاتها مزدوجة الألفة (لديها جزيئات محبة للماء وكارهة للماء). في حالة الكولسترول، المجموعة القطبية هي a mere -OH (هيدروكسيل أو كحول). في حالة الدهون الفسفورية، المجموعات القطبية تعتبر أكبر وأكثر قطبية، كما موضح أدناه.[5]
الدهون هي جزء لا يتجزأ من النظام الغذائي اليومي للفرد. معظم الزيوت ومنتجات الألبان التي نستخدمها للطهي والغذاء مثل الزبد، الجبن، والسمن.. الخ، تتكون من دهون. الزيوت النباتية غنية polyunsaturated fatty acid (PUFA). الأغذية التي تحتوي على دهون تخضع لعملية الهضم داخل الجسم ويتم تكسيرها إلى أحماض أمينية وگليسرول، وهي المنتجات النهائية لتحلل الدهن. الدهون، وخاصة الدهون الفسفورية، تستخدم أيضاً في المستحضرات الدوائية المختلفة، سواء co-solubilisers (على سبيل المثال في in parenteral infusions) أو كناقل دواء (على سبيل المثال، في liposome أو الجسم الحامل).
الپروتينات
 مقالات مفصلة: الپروتينات
مقالات مفصلة: الپروتينات- حمض أميني
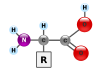
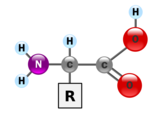
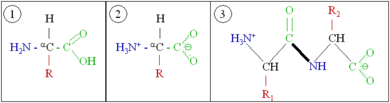
الپروتينات عبارة عن جزيئات ضخمة- پوليمرات ثنائية كبيرة- مكونة من مونومرات تسمى بالأحماض الأمينية. يتألف الحمض الأميني من ذرة كربون مرتبطة بمجموعة أمين، —NH2، مجموعة حمض الكربوكسيل، —COOH (although these exist as —NH3+ و—COO− تحت ظروف فسيولوجية)، ذرة هيدروجينة بسيطة، سلسلة جانبية عادة ما يرمز لها بالحرف "—R". تحتلف السلسلة الجانبية "R" لكل حمض أميني حيث يوجد منه نوع قياسي. مجموعة "R" هذه تجعل كل حمض أميني مختلف عن الآخر، وخصائص السلاسل الجانبية تؤثر بشكل كبير على جميع التشكل ثلاثي الأبعاد للللپروتين. لبعض الأحماض الأمينية وظائف تقوم بها بنفسها أو في شكل معدل؛ على سبيل المثال، وظائف الگلوتامات كناقل عصبي هام. يمكن أن ترتبط الأحماض الأمينيةعن طريق رابطة پپتيدية. في عملية التخليق المبلمهة هذه، يتم نزع جزيء الماء وتربط الرابطة الپپتيدية النيتروجين بمجموعة أمينية من حمض أميني واحد مع جزيء كربون من مجموعة حمض كربوكسيلي آخر. الجزيء الناتج يسمى ثنائي الپپتيد، وامتدادات قصيرة من الأحماض الأمينية (عادة، أقل من ثلاثين) تسمى الپپتيدات أو عديدة الپپتيد. ويطلق على الامتدادات الأطول الپروتينات. على سبيل المثال، ألبومين پروتين مصل الدم الرئيسي يحتوي على بقايا 585 حمض أميني.[6]

للپروتينات أدوار بنيوية و/أو وظيفية. على سبيل المثال، تحركات أستين وميوسين الپروتينات هي المسئول الأساسي عن تقلص عضلات الجسم. السمة الرئيسية المميزة للكثير من الپروتينات هي ارتباطها المتخصص مع جزيء مجموعة جزيئات محددة؛ وقد يكون صارمة في اختيارها لتلك الجزيئات. الأجسام المضادة هي مثال على الپروتينات التي ترتبط بنوع محدد من الجزيئات. في واقع الأمر، فإن assay]] (ELISA)، الذي يستخدم الأجسام المضادة، يعتبر واحداً من أكثر الاختبارات حساسية في الطب الحديث والذي يستخدم للتعرف على الجزيئات الثنائية المختلفة. رغم كونها انزيمات إلا أنها قد تكون أكثر الپروتينات أهمية. كل تفاعل في الخلية الحية تقريباً، يتطلب انزيماً لتخفيض طاقة التنشيط في التفاعل. تتعرف هذه الجزيئات على جزيئات متفاعلة محددة تسمى الركائز؛ تقوم بعدها بتحفيز التفاعل بينها. بتخفيض طاقة التنشيط، يقوم الانزيم بتسريع هذا التفاعل بمعدل 1011 أو أكثر؛ لو تم التفاعل بشكل طبيعي فإنه سيستغرق أكثر من 3.000 سنة ليكتمل بشكل تلقائي، لكنه لا يستغرق أكثر من ثانية واحدة بمساعدة الانزيم. لا تستخدم الانزيمات نفسها في هذه العملية، وتكون حرة في تحفيز نفس التفاعل مع مجموعة جديدة من الركائز. استخدام المعدلات المختلفة، قد يعمل على تنظيم نشاط الانزيم، مما يتيح السيطرة على الكيمياء الحيوية للخلية بشكل كامل.
عادة ما يوصف تركيب الپروتينات في تسلسل هرمي من أربع مستويات. التركيب الرئيسي للپروتين يتالف من التسلسل الخطي للأحماض الأمينية؛ على سبيل المثال "ألانين-گليسين-تريپتوفان-سيرين-گلوتامات-أسپارجين-گليسين-ليسين-…". أما التركيب الثانوي فهو المعني بالمورفولوجيا الموضعية (المورفولوجيا هي دراسة التركيب). بعض توليفات الأحماض الأمينية تميل إلى التجعد على شكل لفافة تسمى لولب ألفا أو على شكل لوحة تسوحى لوحة بيتا؛ يمكن رؤية بعض لوالب ألفا في مخطط الهيموگلبين أعلاه. البنية الثلاثية هي الشكل ثلاثي الأبعاد الكامل للپروتين. يتم التعرف على هذا الشكل عن طريق تسلسل الأحماض الأمينية. في واقع الأمر، فإن تغير واحد يمكن أن يؤدي إلى تغير التركيب بالكامل. سلسلة ألفا في الهيموگلوبين تحتوي على بقايا 146 حمض أميني؛ استبدال بقايا الگلوتامات عند الموضع 6 مع بقايا الڤالين يغير سلوك الهيموگلوبين بشكل كبير مما يؤدي إلى الإصابة مرض الخلايا المنجلية. وأخيراً، التركيب الرباعي هو التركيب المعني بتركيب الپروتين الوحدات الفرعية الپپتيدية المتعددة، مثل الهيموگلوبين مع وحداته الفرعية الأربعة. لا تمتلك جميع الپروتينات أكثر من وحدة فرعية.[7]
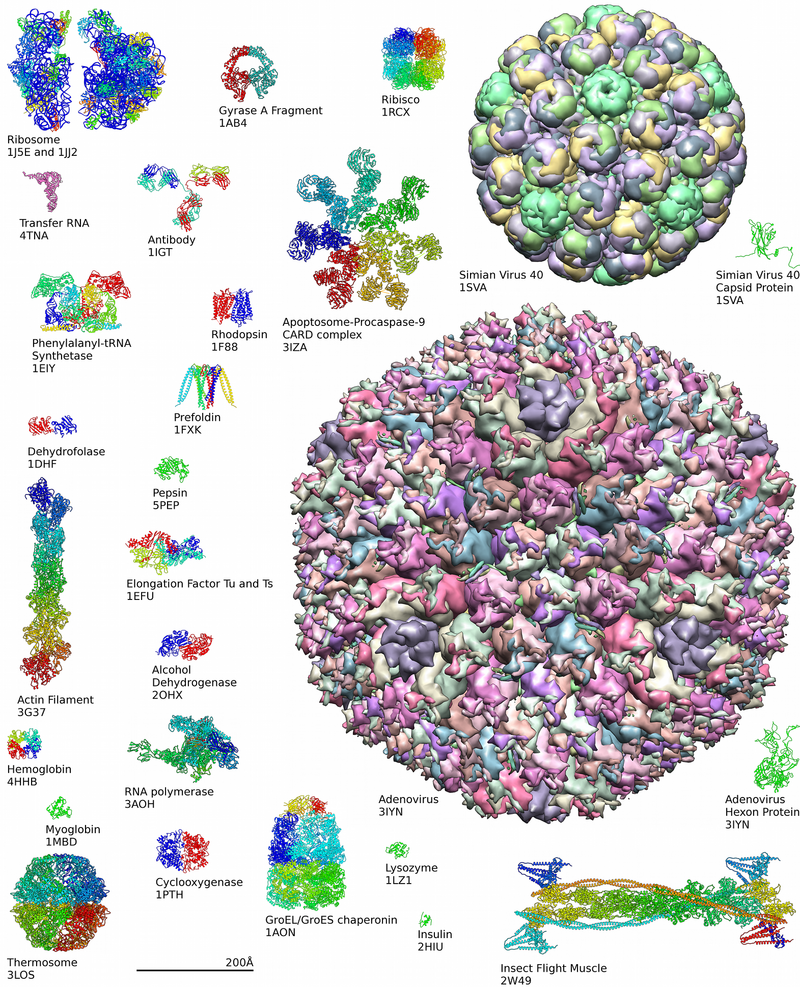
الپروتينات المستخلصة عادة ما تنقسم في الأمعاء الدقيقة إلى أحماض أمينية مفردة أو ثنائيات الپپتيد، ثم تمتص. عندها يمكنها الارتباط لصنع پروتينات جديدة. المنتجات الوسيطة لتصنيع السكريات، دورة حمض السيتريك، ومسار فوسفات الپنتوز يمكن أن تستخدم لصنع الأحماض الأمينية العشرين جميعها، وتمتلك معظم الجراثيم والنباتات جميع الانزيمات اللازمة لتخليقها. إلا أن البشر والثدييات الأخرى يمكنهم تخليق نصف الأحماض الأمينية الأساسية فقط. لا يمكنهم تخليق الآيزوليوسين، الليوسين، الليسين، المثيونين، الفنايلألانين، الثريونين، التريپتوفانن والڤالين. وتعتبر هذه الأحماض أحماض أمينية أسياسية، حيث أنها أساسية to ingest them. تمتلك الثدييات انزيمات لتخليق الألانين، الأسپارتات، السيستين، الگلوتامات، الگلوتامين، الگليسين، الپرولين، السيرين، والتيروسين، الأحماض الأمينية الغير أساسية. بينما يمكن للثدييات تخليق الأرگنين والهيستيدين، لا يمكنهم إنتاجها بكميات كافية للحيوانات النامية، اليافعة، لذلك، عادة ما تعتبر أحماض أمينية أساسية.
إذا ما أزيلت هذه المجموعة من الحمض الأميني، ستخلف وراءها هيكل كربوني يسمى حمض كيتو-ألفا. الانزيمات المسماة بناقلات الأمين يمكنها أن تنقل المجموعة الأمينية بسهولة من حمض أميني واحد (جاعلة منها حمض كيتو-ألفا) إلى حمض كيتو-ألفا آخر، كما هو الحال بالنسبة للكثير من المسارات، الوسائط الناتجة من المسارات الكيميائية الحيوية الأخرى تتحول إلى هيكل حمض كيتو-ألفا، ثم تضاف مجموعة أمينية، عادة عن طريق نقل الأمين. بعد ذلك قد ترتبط الأحماض الأمينية معاً لصنع الپروتين.[8]
تستخدم عملية مشابهة لتكسير الپروتينات. أولاً يتم تحللها إلى الأحماض الأمينية المكونة لهاً. الأمونيا الحرة (NH3)، والمتواجدة في الدم على هيئة أيون أمونيوم (NH4+)، تعتبر سامة على أشكال الحياة. ومن ثم يجب أن تكون هناك طريقة ملائمة لإفرازها. التكتيكات المختلفة المتعلقة في مختلف أنواع الحيوانات، تعتمد على احتياجات الحيوان. العضيات وحيدة الخلية تطلق الأمونيا إلى البيئة المحيطة. وبشكل مشابه، يمكن أن تطلق الأسماك العظمية الأمونيا إلى الماء حيث يخفف بسرعة. بصفة عامة، تحول الثدييات الأمونيا إلى بول، عن طريق الجهاز البولي.[9]
لتحديد ما إذا كان الپروتينات مرتبطان، أو بمعنى آخر لتقرير ما إذا كانا متماثلان أم لا، يستخدم العلماء طرق مقارنة التسلسل. طرق مثل التراصفات التسلسلية والتراصفات الهيكلية تعتبر أدوات قوية لمساعدة العلماء على تحديد التناددات بين الجزيئات المرتبطة.[10] تكمن أهمية إيجاد التنادد بين پروتينات وراء تشكيل النمط التطوري لعائلات الپروتين. بتحديد كيفية تشابه تسلسلات اثنين من الپروتينات، يجدر بنا معرفة بنيتهما وبالتالي وظيفتيهما.
الأحماض النووية
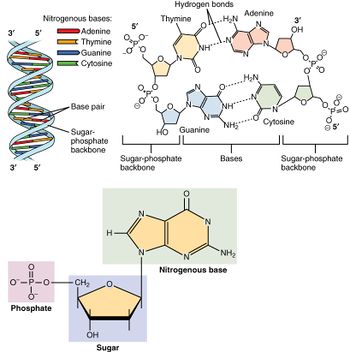
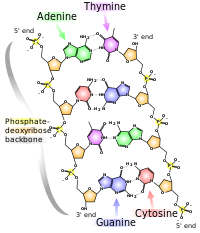
الأحماض النووية، التي سميت بهذا الاسم بسبب انتشارها في نواة الخلية، هو الاسم العام لعائلة من ثنائيات الپوليمرات. وهي عبارة عن جزيئات ضخمة كيميائية حيوية معقدة ذات وزن جزيئي عالي التي يمكنها نقل المعلومات الوراثية في جميع الخلايا الحية والعكس.[11] تسمى هذه المونومرات بالنيوكليوتايدات، ويتكون كل نيوكليوتايد من ثلاثة مكونات: قاعدة غير متجانسة الحلقة نيتروجينية (سواء پيورين أو پيريميدين)، سكر پنتوزي، ومجموعة فوسفات.[12]
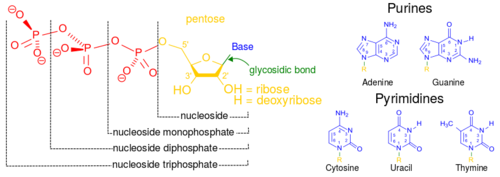
أكثر الأحماض الأمينية شيوعاً هي حمض نووى ريبوزي منقوص الأكسجين (دنا) وحمض ريبي نووي (رنا).[13] مجموعة الفوسفات والسكر في كل نيوكليوتاد ترتبط ببعضها البعض لتشكل العمود الفقري للحمض النووي، بينما يقوم تسلسل القواعد النيتروجينية بتخزين المعلومات. أكثر القواعد النيتروجينية شيوعاً هي الأدنين، السيتوسين، الگوانين، الثيمين، والوراسيل. القواعد النيتروجينية في كل ضفيرة من الحمض النووي ستشكل روابط هيدروجينية مع قواعد نيتروجنية أخرى محددة في ضفيرة تكميلية من الحمض النووي (مشابهة للسوستة). يرتبط الأدنين مع الثيمين واليوراسيل؛ ويرتبط الثايمين مع الأدنين فقط؛ ويمكن للسيتوسين والگوانين الارتباط مع بعضهما البعض فقط.
بصرف النظر عن المادة الوراثية للخلية، عادة ما تلعب الأحماض النووي دور الرسل الثانوية، حيث يشكلون جزيئاً قاعدياً لثلاثي فوسفات الأدنوسين، جزيئ أساسي حامل للطاقة في جميع العضيات الحية.[14] كذلك، قد تختلف القواعد النيتروجينية الموجودة في الحمضين النويين؛ يتواجد الأدنين، السيتوسين، والگوانين في كلاً من الرنا والدنا، بينما يوجد الثيمين في الدنا فقط واليوراسيل في الرنا فقط.
الاستقلاب
 مقالة مفصلة: استقلاب
مقالة مفصلة: استقلاب
الكربوهيدرات كمصدر طاقة
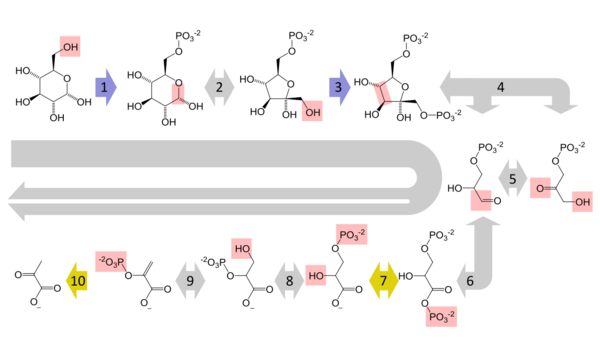
الگلوكوز هو المصدر الرئيسي للطاقة في معظم أشكال الحياة. على سبيل المثال، تتكسر عديدات السكريد إلى مونومراتها (يزيل فوسفوريلاز الگليكوجين بقايا الگلوكوز من الگليكوجين). تنقسم ثنائيات السكريد مثل اللاكتوز أو لاسكروز إلى مكونين من أحادي السكريد.
تحلل الگلوكوز (اللاهوائي)
يُستقلب الگلوكوز بشكل رئيسي بواسطة مسار بالغ الأهمية من عشر خطوات يسمى تحلل الگلوكوز، وتتجلى نتيجته النهائية في تكسر جزيء الگلوكوز إلى جزيئين من پيروڤيك. ينتج عن هذا أيضاً جزيئين صافيين من ثلاثي فوسفات الأدنوسين، وحدة الطاقة في الخلايا، مع اثنين من مكافئات الحد من تحويل NAD+ (nicotinamide adenine dinucleotide: oxidised form) إلى NADH (nicotinamide adenine dinucleotide: reduced form). لا تتطلب هذه العملية وجود الأكسجين؛ إذا لم يكن الأكسجين متوافراً (أو لم تتمكن الخلية من استخدام الأكسجين)، يتم تخزين NAD عن طريق تحويل الپيروڤيك إلى اللاكتات (حمض اللبنيك) (كما يحدث في البشر) أو إيثانول وثاني أكسيد الكربون (كما يحدث في الخميرة). أحاديات السكريد الأخرى مثل الگلاكتوز والفركتوز يمكن تحويلها إلى وسائط مسار الگليكوليتيك.[15]
الهوائي
في الخلايا الهوائية عند وجود كمية كافية من الأكسجين، كما يحدث في معظم الخلايا البشرية، يتم استقلاب المزيد من الپيروڤيك. ويتحول إلى أسيتيل مرافق الإنزيم-أ، مما ينتج ذرة كربون واحدة كمنتج متخلف عن ثاني أكسيد الكربون، مولداً مكافئ حد آخر، NADH. بعد ذلك يدخل جزيئا الأسيتيل مرافق الإنزيم-أ (من جزيء گلوكوز واحد) إلى حلقة حمض الستريك، منتجاً جزئين آخرين من ثلاثي فوسفات الأدنوسين، ستة جزيئات إضافية من NADH وجزئين reduced (ubi)quinones (عن طريق FADH2 كعامل مرافق لرابط الانزيم، ومطلقاً ذرات الكربون المتبقية على هيئة ثاني أكسيد الكربون. بعد ذلك، تُلقم جزيئات NADH والكوينول داخل مركبات الانزيم في السلسلة التنفسية، في نهاية المطاف يقوم نظام نقل الإلكترون بتحويل الإلكترونيات إلى أكسجين وحفظ الطاقة المطلقة على هيئة متدرج پروتوني على الغشاء (غشاء المتقدرة الداخلي في حقيقيات النوى). بالتالي، يتم اختزال الأكسجين إلى ماء ويعاد انتاج original electron acceptors NAD+ والكوينول. يفسر هذا سبب استنشاق البشر الأكسجين وطردهم ثاني أكسيد الكربون أثناء التنفس. الطاقة الناتجة عن تحويل الإلكترونات من حالات الطاقة المرتفعة في تحويل NADH والكوينول أولاً إلى متدرج پروتوني ثم تحويله إلى ثلاثي فوسفات الأدنوسين عن طريق سينثاز ثلاثي فوسفات الأدنوسين. يؤدي هذا إلى توليد 28 جزيئ إضافي من ثلاثي فوسفات الأدنوسين (8 من NADH + 4 من 2 كوينول)، أي يتم تحويل 32 جزيئ ثلاثي فوسفات الأدنوسين لكل گلوكوز متحلل (2 من تحلل الگلوكوز + 2 من دورة السيترات).[16] من الواضح أن استخدام الأكسجين للأكسدة الكاملة للگلوكوز يمد العضيات بكمية الطاقة أكبر من أي عملية استقلاب غير معتمدة على الأكسجين ويعتقد أن الحياة المعقدة لم تظهر إلا بعد تراكم كميات كبيرة من الأكسجين في الغلاف الجوي للأرض.
تخليق الگلوكوز
في الفقاريات، تتقلص العضلات الهيكلية بشدة (أثناء رفع الأثقال أو العدو على سبيل المثال) عندما لا تحصل على كمية كافية من الأكسجين تلبي احتياجاتها من الطاقة، ومن ثم تتحول إلى استقلاب لا هوائي، محولة الگلوكوز إلى لاكتتات. يعيد الكبد توليد الگلوكوز، باستخدام عملية تسمى تخليق الگلوكوز. لا تعتبر هذه العملية معاكسة بشكل تام لعملية تحلل الگلوكوز، حيث تتطلب في الواقع ثلاث أضعاف كمية الطاقة الناتجة عن تحلل الگلوكوز (يتم استخدام ستة جزيئات من ثلاثي فوسفات الأدنوسين، مقارنة باثنتين ناتجتين عن تحلل الگلوكوز). على غرار التفاعلات الموضحة أعلان، قد يخضع الگلوكوز المنتج بعد ذلك لتحلل الگلوكوز في الأنسجة التي تحتاج للطاقة، ليتم تخزينها على هيئة گليكوجين (أو نشا في النباتات)، أو تتحول إلى أحادي السكريد أو ترتبط di- or oligosaccharides. المسارات المجمعة لتحلل الگلوكوز أثناء التدريب، تنقل اللاكتات عبر تيار الدم إلى الكبد، عملية تخليق الگليكوجين اللاحقة وإطلاق الگلوكوز في تيار الدم يطلق عليها دورة كوري.[17]
تصف الكيمياء الحيوية استقلاب الخلية (الهدم والبناء) لها على نطاق واسع. كما تَتضمّنُ فروع أخرى مِنْ الكيمياء الحيويةِ دراسة الشفرة الجينية (دنا، رنا)، التخليق الحيوي للپروتين، تركيب غشاء خلية، ونقل الإشارة ضمن وبين الخلايا الحية.
العلاقة بالعلوم الحيوية "الجزيئية" الأخرى
يستخدم الباحثون في مجال الكيمياء الحيوية تقنيات محددة منشأها الكيمياء الحيوية، لكن تزايد الجمع بين هذه التقنيات والتقنيات والأفكار التي تطورت في تخصص علم الوراثة، علم الأحياء الجزيئي والفيزياء الحيوية. لا يوجد خط فاصل بين هذه التخصصات من حيث المحتوى والتقنية. اليوم، يمكن استخدام مصطلح علم الأحياء الجزيئي والكيمياء الحيوية بالتبادل.
انظر أيضاً
قوائم
مواضيع متعلقة
- كيمياء حيوية بديلة
- علاج نفسي أحيائي
- علم البيئة الكيميائي
- نظرية اللاتوازن الكيميائي
- نمذجة حيوية حاسوبية
- علم الأحياء الجزيئي
- طب جزيئي
- قياسيات تناسبية
كتب
وصلات خارجية
- الكيمياء الحيوية للجميع
- The Virtual Library of Biochemistry and Cell Biology
- Biochemistry, 5th ed. Full text of Berg, Tymoczko, and Stryer, courtesy of NCBI.
- Biochemistry, 2nd ed. Full text of Garrett and Grisham.
- Costa Rican Biotechnology Society
- Cell Biochemistry
- Biochemistry (the scientific jounal).
قائمة العائلات الكيميائية الحيوية | |
|---|---|
| النشويات | |
| الدهون | |
| الأحماض الأمينية | |
| الپروتينات | |
| أخرى | |
- ^ Stryer (2007), p. 328.
- ^ Voet (2005), Ch. 12 Lipids and Membranes.
- ^ Fromm and Hargrove (2012), pp. 22–27.
- ^ Voet (2005), pp. 382–385.
- ^ Voet (2005), pp. 385–389.
- ^ Metzler (2001), p. 58.
- ^ Fromm and Hargrove (2012), pp. 35–51.
- ^ Fromm and Hargrove (2012), pp. 279–292.
- ^ Sherwood (2012), p. 558.
- ^ Fariselli (2007), pp. 78–87.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةVoet_2005 - ^ Saenger (1984), p. 84.
- ^ Tropp (2012), pp. 5–9.
- ^ Knowles (1980), pp. 877–919.
- ^ Fromm and Hargrove (2012), pp. 163–180.
- ^ Voet (2005), Ch. 17 Glycolysis.
- ^ Fromm and Hargrove (2012), pp. 183–194.