قياس اتحادية العناصر
قياس اتحادية العناصر أو المعروفة ب حساب العناصر المتفاعلة (إنگليزية: Stoichiometry) هي فرع من فروع الكيمياء والهندسة الكيميائية التي تتعامل مع كميات المواد التي تدخل في التفاعلات وينتج منها مركبات بواسطة تفاعل كيميائي. وتعريفه بشكل أساسي هو أنه يعين كمية العناصر في المركبات وكذك كمية العناصر في المواد الداخلة في التفاعل ، وذلك طبقا لمبدأ توازن الكتلة. وتختلف نسب المواد المتفاعلة بحسب خصائصها الكيميائية وعلى الأخص تكافؤها.
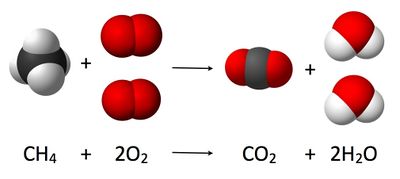
على سبيل المثال سندرس تفاعل كيميائي حيث يتفاعل الميثان مع الأكسجين في تفاعل الاحتراق الكامل ، فإن 16 جرام من غاز الميثان يحتاج إلى 64 جرام من الأوكسجين. فيتكون 44 جرام من ثنائي أكسيد الكربون و36 جرام من الماء ، طبقا للمعادلة (أنظر أيضا معادلة كيميائية) :
تعطي معادلة التفاعل أبسط نسب للمواد الداخلة في التفاعل ونسب المواد الناتجة من التفاعل. ونقرأ المعادلة كالآتي: يتفاعل 1 جزيئ من الميثان مع 2 جزيئ من الأكسجين ، وينتجان جزيئ واحد من ثاني أكسيد الكربون و 2 جزيئ ماء.
ولكن الكيميائي يحب أن يتعامل مع كميات المواد بالجرام وابتكر أيضا استخدام المول للتعبير عن الكميات المتفاعلة والناتجة. فبالنسبة إلى قراءة المعادلة السابقة باستخدام مول ، (ويحتوي 1 مول من المادة عدد أفوجادرو من الجسيمات أو الجزيئات) ، فنقول : يتفاعل 1 مول من غاز الميثان مع 2 مول من الأكسجين فينتجا 1 مول من ثاني أكسيد الكربون و 2 مول من الماء.
ونحسب المول عن طريق الكتلة الذرية للعنصر ، وإذا كان لدينا مركبا كيميائيا مثلما في حالة تفاعلنا هنا يكون المول للميثان مثلا هو مجموع كتل الذرات في جزيئه. أي 12 جرام للكربون و 4. 1 جرام هيدروجين فيكون 1 مول من الميثان وزنه 16 جرام.
وعندما نحسب كمية المواد الداخلة في التفاعل ، والمواد الناتجة من التفاعل ، نجد الآتي :
- المواد الداخلة في التفاعل = 16 + 64 = 80 g
- المواد الخارجة من التفاعل = 44 + 36 = 80 g
وهما متساويان حيث أن كمية كل منهما 80 جرام.
- في التفاعل السابق وضعنا للأكسجين الكمية 64 جرام ، وهي عبارة عن 2 مول من الأكسجين ، حيث 1 مول من الأكسجين يساوي == 16 + 16 == 32 جرام.
- بالمثل بالنسبة للماء : 1 مول ماء يعادل (16 جرام أكسجين + 2. 1 جرام هيدروجين) 18 جرام ، وينتج 2 مول ماء من التفاعل ، أي 2. 18 = 36 جرام.
تفاعل الهيدروجين والأكسجين
{مقالة رئيسية: مخلوط هيدروجين وأكسجين}
يتفاعل 2 مول من الهيدروجين مع 1 مول من الأكسجين وينتج عن التفاعل 2 مول من الماء :
معادلة التفاعل:
ملحوظة : مخلوط الهيدروجين والأكسجين بتلك النسبة 1:2 هو مخلوط انفجاري يتفاعل بشدة لأنه تفاعل يُصدر حرارة ، وتصل سرعة الانفجار 2820 متر/ثانية. وهو عملية احتراق
بعض الأمثلة الأخرى
طرق القياس
لكل تفاعل كيميائي له نسب مميزة للمواد الداخلة في التفاعل والمواد الناتجة من التفاعل. وتعين تلك النسب عمليا بالتجربة. ويلعب فيها التكافؤ دورا أساسيا إذ أنه يبين نسب العناصر المختلفة في كل مادة. وتبين من التجربة أن حساب العناصر المتفاعلة يسهل عند استخدام وحدة مول للتعبير عن كمية كل مادة داخلة في التفاعل ,وكذلك المواد النتجة منه. يبنى حساب المول على أساس الكتلة الذرية لكل عنصر ، ومنها نستنتج الكتلة الجزيئية.
سنأخذ مثال تكون الماء
يتكون الماء من تفاعل الهيدروجين والأكسجين :
- تكافؤ الهيدروجين : 1
- تكافؤ الأكسجين: 2
- أي أن ذرتين من الهيدروجين تتحدان مع ذرة من الأكسجين ويتكون جزيئ الماء
- .
وبالتالي يتفاعل 2 مول من الهيدروجين مع 1 مول من الأكسجين ويكوّنا 2 مول ماء (أنظر معادلة التفاعل أعلاه).
هذا معناه أن 2. 2 جرام هيدروجين (غاز) يتحدوا مع 2. 16 جرام أكسجين فيتكون 36 جرام ماء. 1 مولماء = 18 جرام.
ويمكن تعيين تكافؤ كل عنصر من الجدول الدوري للعناصر. كما توجد جداول للكتلة الذرية لكل العناصر.
تاريخ
ان من ابتكر مصطلح قياس اتحادية العناصر أو حساب العناصر المتفاعلة هو الكيميائي الألماني إرميا ريختر في عام 1792 لوصف وقياس نسب الجمع بين العناصر الكيميائية حسب الكتلة. منذ ذلك الحين توسع نطاق استخدام المصطلح ليشمل الجمع بين نسب المواد في أي تفاعل كيميائي. درس ريختر الرياضيات مع الفيلسوف إيمانويل كانت ، وكتب أطروحة عن استخدام الرياضيات في الكيمياء. وأعرب عن اقتناعه بأنه قد يكون وصف كل التغيرات الكيميائية من حيث النسب الكاملة في عدد بسيط. وطرح قانون النسب المتبادل ، مشيرا إلى أن اثنين من العناصر الكيميائية إذا توحد بشكل منفصل مع عنصر ثالث ، فإن النسبة التي توحدة مع العنصر الثالث ستكون نفسه أو مضاعفات في نسبة التي تتحد مع بعضها البعض.
حسابات عناصر متفاعلة مختلفة في تفاعلات متنافسة
Often, more than one reaction is possible given the same starting materials. The reactions may differ in their stoichiometry. For example, the methylation of benzene (), through a Friedel-Crafts reaction using as catalyst, may produce singly methylated , doubly methylated , or still more highly methylated products, as shown in the following example,
In this example, which reaction takes place is controlled in part by the relative concentrations of the reactants.
معامل العناصر المتفاعلة
In layman's terms, the stoichiometric coefficient (or stoichiometric number in the IUPAC nomenclature[1]) of any given component is the number of molecules which participate in the reaction as written.
For example, in the reaction CH4 + 2 O2 → CO2 + 2 H2O, the stoichiometric coefficient of CH4 would be 1 and the stoichiometric coefficient of O2 would be 2.
In more technically-precise terms, the stoichiometric coefficient in a chemical reaction system of the i–th component is defined as
or
where Ni is the number of molecules of i, and ξ is the progress variable or extent of reaction (Prigogine & Defay, p. 18; Prigogine, pp. 4–7; Guggenheim, p. 37 & 62).
The extent of reaction ξ can be regarded as a real (or hypothetical) product, one molecule of which is produced each time the reaction event occurs. It is the extensive quantity describing the progress of a chemical reaction equal to the number of chemical transformations, as indicated by the reaction equation on a molecular scale, divided by the Avogadro constant (it is essentially the amount of chemical transformations). The change in the extent of reaction is given by dξ = dnB/νB, where νB is the stoichiometric number of any reaction entity B (reactant or product) an dnB is the corresponding amount.[2]
مصفوفة العناصر المتفاعلة
In complex reactions, stoichiometries are often represented in a more compact form called the stoichiometry matrix. The stoichiometry matrix is denoted by the symbol, .
If a reaction network has reactions and participating molecular species then the stoichiometry matrix will have corresponding rows and columns.
For example, consider the system of reactions shown below:
- S1 → S2
- 5S3 + S2 → 4S3 + 2S2
- S3 → S4
- S4 → S5.
This systems comprises four reactions and five different molecular species. The stoichiometry matrix for this system can be written as:
where the rows correspond to S1, S2, S3, S4 and S5, respectively. Note that the process of converting a reaction scheme into a stoichiometry matrix can be a lossy transformation, for example, the stoichiometries in the second reaction simplify when included in the matrix. This means that it is not always possible to recover the original reaction scheme from a stoichiometry matrix.
Often the stoichiometry matrix is combined with the rate vector, v to form a compact equation describing the rates of change of the molecular species:
العناصر الغازية المتفاعلة
Gas stoichiometry is the quantitative relationship (ratio) between reactants and products in a chemical reaction with reactions that produce gases. Gas stoichiometry applies when the gases produced are assumed to be ideal, and the temperature, pressure, and volume of the gases are all known. The ideal gas law is used for these calculations. Often, but not always, the standard temperature and pressure (STP) are taken as 0 °C and 1 bar and used as the conditions for gas stoichiometric calculations.
Gas stoichiometry calculations solve for the unknown volume or mass of a gaseous product or reactant. For example, if we wanted to calculate the volume of gaseous NO2 produced from the combustion of 100 g of NH3, by the reaction:
- 4NH3 (g) + 7O2 (g) → 4NO2 (g) + 6H2O (l)
we would carry out the following calculations:
There is a 1:1 molar ratio of NH3 to NO2 in the above balanced combustion reaction, so 5.871 mol of NO2 will be formed. We will employ the ideal gas law to solve for the volume at 0 °C (273.15 K) and 1 atmosphere using the gas law constant of R = 0.08206 L · atm · K−1 · mol−1 :
Gas stoichiometry often involves having to know the molar mass of a gas, given the density of that gas. The ideal gas law can be re-arranged to obtain a relation between the density and the molar mass of an ideal gas:
- and
وبذلك:
| where: | |
| = absolute gas pressure | |
| = gas volume | |
| = number of moles | |
| = universal ideal gas law constant | |
| = absolute gas temperature | |
| = gas density at and | |
| = mass of gas | |
| = molar mass of gas |
نسب الهواء-الوقود الحسابية للوقودات الشائعة
| الوقود | حسب الكتلة [3] | By volume [4] | نسبة الوقود حسب الكتلة |
|---|---|---|---|
| جاسولين | 14.6 : 1 | — | 6.8% |
| غاز طبيعي | 17.2 : 1 | 9.7 : 1 | 5.8% |
| Propane (LP) | 15.67 : 1 | 23.9 : 1 | 6.45% |
| Ethanol | 9 : 1 | — | 11.1% |
| Methanol | 6.47 : 1 | — | 15.6% |
| Hydrogen | 34.3 : 1 | 2.39 : 1 | 2.9% |
| Diesel | 14.5 : 1 | 0.094 : 1 | 6.8% |
Gasoline engines can run at stoichiometric air-to-fuel ratio, because gasoline is quite volatile and is mixed (sprayed or carburetted) with the air prior to ignition. Diesel engines, in contrast, run lean, with more air available than simple stoichiometry would require. Diesel fuel is less volatile and is effectively burned as it is injected, leaving less time for evaporation and mixing. Thus, it would form soot (black smoke) at stoichiometric ratio.
المصادر
وصلات خارجية
جامعة بليموث -قياس اتحادية العناصر
حساب العناصر المتفاعلة التعليمية من جامعة كارنيجي ميلون
المصادر
- ^ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). XML on-line corrected version: http://goldbook.iupac.org (2006-) created by M. Nic, J. Jirat, B. Kosata; updates compiled by A. Jenkins. ISBN 0-9678550-9-8. doi:10.1351/goldbook. Entry: "stoichiometric number".
- ^ IUPAC Compendium of Chemical Terminology 2nd Edition (1997)
- ^ John B. Heywood: "Internal Combustion Engine Fundamentals page 915", 1988
- ^ North American Mfg. Co.: "North American Combustion Handbook", 1952
اقرأ أيضا
- معادلة التفاعل
- تركيز
- معدل التفاعل
- ثابت معدل التفاعل
- توازن ترموديناميكي
- توازن دينامي
- مول
- جزء مولي
- كتلة مولية
- نظام حركة حرارية