ألمنيوم
ساهم بشكل رئيسي في تحرير هذا المقال
|
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
معدني رمادي فضي الخطوط الطيفية للألومنيوم | |||||||||||||||||||||||||
| الخصائص العامة | |||||||||||||||||||||||||
| الاسم، الرمز، الرقم | ألومنيوم, Al, 13 | ||||||||||||||||||||||||
| النطق | UK: /ˌælj[invalid input: 'ʉ']ˈmɪniəm/ ( AL-ew-MIN-ee-əm; | ||||||||||||||||||||||||
| تصنيف العنصر | فلز بعد انتقالي | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 13, 3, p | ||||||||||||||||||||||||
| الوزن الذري القياسي | 26.9815386(13) | ||||||||||||||||||||||||
| التوزيع الإلكتروني | [Ne] 3s2 3p1 2, 8, 3 | ||||||||||||||||||||||||
| التاريخ | |||||||||||||||||||||||||
| التوقع | أنطوان لاڤوازييه[1] (1787) | ||||||||||||||||||||||||
| أول عزل | فريدريش ڤولر[1] (1827) | ||||||||||||||||||||||||
| سُمّي من قِبل | همفري ديڤي[1] (1807) | ||||||||||||||||||||||||
| الخصائص الطبيعية | |||||||||||||||||||||||||
| الطور | صلب | ||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 2.70 g·cm−3 | ||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 2.375 گ·سم−3 | ||||||||||||||||||||||||
| نقطة الانصهار | 933.47 ك, 660.32 °C, 1220.58 °F | ||||||||||||||||||||||||
| نقطة الغليان | 2792 ك, 2519 °س, 4566 °ف | ||||||||||||||||||||||||
| حرارة الانصهار | 10.71 كج·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | 294.0 كج·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية المولية | 24.200 ج·مول−1·ك−1 | ||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخصائص الذرية | |||||||||||||||||||||||||
| حالات الأكسدة | 3, 2[2], 1[3] (أكسيد أمفوتيري) | ||||||||||||||||||||||||
| سالبية كهربية | 1.61 (مقياس پولنگ) | ||||||||||||||||||||||||
| طاقات التأين (المزيد) |
الأولى: 577.5 كج·مول−1 | ||||||||||||||||||||||||
| الثانية: 1816.7 كج·مول−1 | |||||||||||||||||||||||||
| الثالثة: 2744.8 كج·مول−1 | |||||||||||||||||||||||||
| نصف القطر الذري | 143 پم | ||||||||||||||||||||||||
| نصف قطر تساهمي | 121±4 pm | ||||||||||||||||||||||||
| نصف قطر ڤان در ڤالز | 184 pm | ||||||||||||||||||||||||
| متفرقات | |||||||||||||||||||||||||
| البنية البلورية | مكعب موسطن وجهياً | ||||||||||||||||||||||||
| الترتيب المغناطيسي | مغناطيسية مسايرة[4] | ||||||||||||||||||||||||
| المقاومية الكهربائية | (20 °C) 28.2 nΩ·m | ||||||||||||||||||||||||
| ناقلية حرارية | 237 W·m−1·K−1 | ||||||||||||||||||||||||
| التمدد الحراري | (25 °س) 23.1 µm·م−1·ك−1 | ||||||||||||||||||||||||
| سرعة الصوت (قضيب رفيع) | (د.ح.غ.) (مدرفل) 5,000 م·ث−1 | ||||||||||||||||||||||||
| معامل ينگ | 70 گپا | ||||||||||||||||||||||||
| معامل القص | 26 گپا | ||||||||||||||||||||||||
| معامل الحجم | 76 گپا | ||||||||||||||||||||||||
| نسبة پواسون | 0.35 | ||||||||||||||||||||||||
| صلادة موس | 2.75 | ||||||||||||||||||||||||
| صلادة ڤيكرز | 167 MPa | ||||||||||||||||||||||||
| صلادة برينل | 245 مپا | ||||||||||||||||||||||||
| رقم تسجيل كاس | 7429-90-5 | ||||||||||||||||||||||||
| أكثر النظائر استقراراً | |||||||||||||||||||||||||
| المقالة الرئيسية: نظائر ألومنيوم | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
الألومِنْيوم فلز خفيف الوزن، لونه فضِّي ويمكن تشكيله بسهولة في أي شكل. ويمكن أن يدلفن أو يُطرق إلى ألواح سميكة لاستخدامه في الدَّبابات المصفحة، أو إلى رقائق رهيفة تستخدم في لف بعض أنواع الحلوى. ويمكن سحبه على شكل أسلاك أو تصنيعه في شكل علب. والألومنيوم لا يصدأ، ويقاوم التآكل بفعل الظروف الجويَّة أو المواد الكيميائية.
والألومنيوم النَّقي لَيِّن وصلابته محدودة. ولهذا السَّبب فإنَّ منتجي الألومنيوم عادة ما يُكوِّنون سبائك من الألومنيوم، التي تتكوّن من الألومنيوم المضاف إليه كميات قليلة من النُّحاس والمغنسيوم والزنك وعناصر أُخرى. وتضيف هذه العناصر قوة وصفات أُخرى إلى الألومنيوم لتجعله فلزا نافعًا جدا. وفي الحقيقة فإنَّ العالم يستخدم الألومنيوم أكثر من أي فلز آخر، عدا الحديد والصُّلب.
ويُستخدم الجزء الأكبر من سبائك الألومنيوم في صناعة مواد التعبئة لمنتجات مختلفة مثل علب المشروبات وأغطية الأواني الزجاجية والأكياس ورقائق التغليف، وفي تعليب الأغذية.
وتستخدم صناعة الإنشاءات المعمارية سبائك الألومنيوم، لصناعة مواسير المجاري المنزلية، والقطاعات المختلفة في المساكن والأسقف والجدران للمباني، وكذلك مواسير الأسلاك الكهربائية والإطارات الخارجية للنوافذ. وتُستخدم كميات كبيرة من الألومنيوم في تصنيع وسائل النقل، مثل الطائرات والسَّيارات والسُّفن وعربات السكك الحديدية.كما يستخدم الألومنيوم في العديد من المنتجات الكهربائية، وأسلاك الهاتف. وتحتوي العديد من المنتجات الأخرى على الألومنيوم. ومن هذه المنتجات أواني المطبخ ومضارب الجولف، وإبر الخياطة وعلب الدهان والثلاجات الكهربائية ووقود الصواريخ وسَحَّابات الملابس.
والألومنيوم أكثر العناصر الفلزية الموجودة في القشرة الأرضية وثالث العناصر وفرة بصفة عامة بعد الأكسجين والسليكون. ويكوِّن الألومنيوم حوالي 8% من القشرة الأرضية. وهو بعكس بعض الفلزات الأخرى مثل الذَّهب والفضة فإنه لا يوجد مطلقًا بحالة نقية (غير متحدة) في الطَّبيعة، لكنه يوجد دائمًا متحدًا مع عناصر أخرى. ولم يتوفر للإنسان وسيلة لفصل الألومنيوم عن العناصر المتحدة به حتى القرن التاسع عشر. وفي هذا الوقت طوَّر العلماء طُرقًا لفصل الألومنيوم وإنتاجه في حالة نَقِيَّة. ومنذ ذلك الحين تم استخدام هذه الطُّرق لإنتاج الألومنيوم.
الألمنيوم أو الألومنيوم عنصر في الجدول الدوري وفلز خفيف يرمز له بالرمز Al. وهو مستخدم في صناعة الطائرات نظرا لخفته. و هو من أكثر المعادن تواجداً على سطح الكرة الأرضية في الهواء والماء والتربة.
ومن خواصه خفة الوزن، غير ممغنط، يشبه الفضة في اللون، جيد التوصيل للحرارة والكهرباء.
ولا يستخدم بمفرده وإنما يضاف إليه معادن أخرى لكي تحسن من خواصه. يستخدم على نطاق واسع في منتجات عديدة في حياتنا اليومية في أدوات المطبخ، الأثاث، لعب الأطفال، مزيلات العرق، أدوية عسر الهضم، أجزاء في الطائرات والصواريخ، رقائق الألومنيوم الشهيرة بالفويل التي تستخدم في المطبخ للف الأطعمة
الانتاج والتنقية
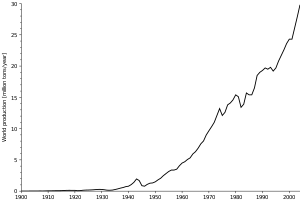
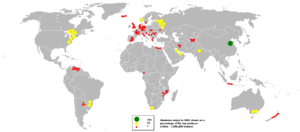
الطاقة الكهربائية تمثل نحو 20% إلى 40% من ثمن انتاج الألومنيوم, على حسب موقع فرن الصهر. Smelters tend to be situated where electric power is both plentiful and inexpensive, such as جنوب أفريقيا, الجزيرة الجنوبية في نيوزيلندا, أستراليا, جمهورية الصين الشعبية, الشرق الأوسط, روسيا, كويبك وBritish Columbia في كندا, وأيسلندا.
في 2005, جمهورية الصين الشعبية كانت أكبر منتج للألومنيوم بحصة قدرها نحو خمس انتاج العالم وتليها روسيا, كندا والولايات المتحدة، حسب British Geological Survey.
التدوير

مركبات الألمنيوم
الألمنيوم رمزه Al، عنصر معدني عدده الذري 13، يقع في الفصيلة IIIA من الجدول الدوري. وزنه الذري 26.9815، وتكافـؤه 3. ويكون أحادي التكافـؤ في مركباته التي درجة حرارتها مرتفـعة كأحادي كلوريد الألومنيوم AlCl وأحادي فلوريد الألمنيوم AlF. وهو أكثر المعادن وفرة في القشرة الأرضية، إذ يؤلف نحو 8 % منها، ويأتي في المرتبة الثالثة بعد الأكسجين والسيليكون. ولا يوجد حراً في الطبيعة لشدة إرجاعه، بل يكون متحداً في الكثير من الصخور السيليكاتية، ولا سيما في ضروب الفلدسبار (الفلسبار) والميكا والتورمالين وغيرها. كما يصادف في منتجات تَدَرُّك الصخور السيليكاتية كالغضار والصفّاح (النضيد) schist، وهو أندر وجوداً على هيئة أكسيد مميَّه (البوكسيت) أو غير مميَّه. ويعدّ البوكسيت الطبيعي أكثر فلزات (خامات) الألمنيوم استعمالاً في الوقت الحاضر.[5]
ذرة الألمنيوم
تتميز ذرة الألمنيوم باحتوائها في حالتها الأساسية على طبقة إلكترونية سطحية تحتوي على ثلاثة إلكترونات، وبذلك يكون تشكيله الإلكتروني في حالته الأساسية 1S2, 2S2, 2P6, 3S4, 2P1. وتوضح كمونات تشرد (تأين) إلكتروناته السطحية الأولـى (مقدرة بالإلكترون فلط) أنها أسهل نزعاً من الإلكترونات الأخرى: فالتشرد الأول 5.95، والتشرد الثاني 18.82، والتشرد الثالث 28.44، والتشرد الرابع 120.000.
وتعلِّل السهولة النسبية التي يمكن بها نزع الإلكترونات الثلاثة الخارجية: Al Š Al++++ 3e- الصفة الكهرجابية (الكهربائية الإيجابية) الشديدة للألمنيوم وانخفاضَ قيمة كمون الأكسدة والإرجاع العائد له (-1.67فلط).
تحضيره
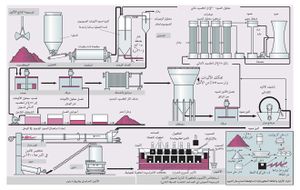
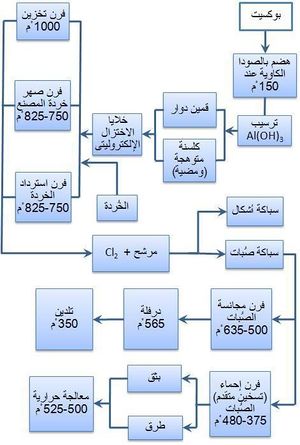
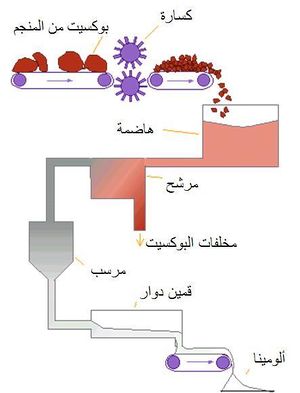
يتم الحصول على الألمنيوم من البوكسيت، وهو أكسيد ألمنيوم مميَّه. يتكون البوكسيت من الألُمين (50- 60%) Al2O3 والسيليس (3- 5%) وأكسيد التِتان (2- 4%) وأكسيد الحديد (20-30%). ويصعب في حالة الألمنيوم تطبيق الطرائق التقليدية المتبعة في استحصال المعادن، إذ يتم فيها تحضير المعدن (أو محلول له) مشوباً في بادئ الأمر ثم ينقّى من شوائبه، ذلك لأن الألمنيوم شديد القابلية للتأكسد. لذا تعتمد طرائق تحضيره على استحصال الألُمين بدرجة نقاوة عالية ثم تحليله كهربائياً.
ولتنقية الألُمين وفق طريقة باير الأكثر شيوعاً (الشكل 1) يُعالَج خام البوكسيت تحت ضغط مرتفع بمحلول الصود الكاوي (هيدروكسيد الصوديوم) المركّز الساخن فيذوب السيليس متحولاً إلى سيليكات، ويذوب أكسيد التِتان متحولاً إلى التيتانات، وتذوب أكاسيد الألمنيوم متحولة إلى ألومينات Na3AlO3 أو NaAlO2.
Al2O3+6NaOH Š 2Na3AlO3+3H2O
وأما أكسيد الحديد Fe2O3 فيترسب على شكل وحل أحمر.
يُفصل محلول ألومينات الصوديوم من الرواسب بالمرشِّح الضاغط ويرسَّب الألُمين من الرشاحة بالتبريد والتخفيف بالماء وإمرار غاز ثاني أكسيد الكربون الذي يتفاعل مع هدروكسيد الألمنيوم ويعجِّل بذلك في انفصال هيدروكسيد الألمنيوم:
Na3AlOنص الحرف السفلي3+3H2OŠAl(OH)3+3NaOH
يُفصل هدروكسيد الألمنيوم من المحلول بالترشيح ويتم غسله جيداً بالماء ثم يكلَّس في أفران دوّارة تبلغ درجة الحرارة فيها نحو 1000ْس للحصول على الألُمين الجاف:
2Al(OH)3 D Al2O3+3H2O
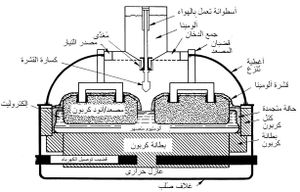
يُشحن الألُمين اللامائي الناتج إلى وحدات المعالجة بطريقة هول ـ هيرو (الشكل 1) حيث يُرجع بالتحليل الكهربائي في خلية (حمام) نموذجية تتألف من حوض فولاذي مستطيل مبطن بالآجر العازل والكربون يحوي متحللاً بالكهرباء (إلكتروليت) مؤلفاً من الألُمين والكريوليت المنصهر (الكريوليت ملح مضاعف لفلوريد الألمنيوم وفلوريد الصوديوم بنسبة جزيء من الأول إلى ثلاثة جزيئات من الثاني 3NaF, AlF3). ويغطي القعر الكربوني مَفْرش من الألمنيوم المصهور يعمل مهبطاً. وتعلق في المتحلل الكهربائي كتل من الكربون سبق تحميصها، ويُستخدم الكربون مصعداً لأنه لم تعرف حتى الآن مادة بديلة تقاوم المفعول الإئتكالي لمصهور الفلوريد ولأنه مرجِع متحلل بالكهرباء (كهرليتي) مناسب للألُمين. ويمر التيار المهبطي بالقعر الكربوني عن طريق قضبان فولاذية متصلة بالمهبط.
إن آلية التفاعلات التي تحدث داخل الخلية غير معروفة على وجه الدقة، وأبسط النظريات تفترض تأين (تشرد) الألُمين في درجات الحرارة العالية. وفي أثناء التحليل الكهربائي يتوضع الألمنيوم على المفرش المعدني أي المهبط، ويتحرر الأكسجين عند المصعد ليتفاعل مع الكربون معطياً ثنائي أكسيد الكربون CO2، كما يُرجع الكربون قسماً من CO2 إلى أحادي أكسيد الكربون CO بتفاعلات ثانوية. وبعد فواصل زمنية تراوح بين 24 و48 ساعة يُترك مصهور الألمنيوم يسيل من مثْعب (سيفون) siphon من أنبوب بشكل W متصل بالخلية.
يتطلب إجراء هول مقادير كبيرة من الطاقة الكهربائية (نحو 14000 كيلو واط/ساعة لاستحصال الطن الواحد) وتعتريه مشكلة التلوث بالفلوريد السام.
الطرق الحديثة لتحضير الألمنيوم
- طريقة «شركة ألمنيوم أمريكا» Aluminium Company of America: وهي طريقة أكثر فعالية لإنتاج الألمنيوم من البوكسيت، وفيها يتفاعل أكسيد الألمنيوم مع الكلور معطياً كلوريد الألمنيوم، وبالتحليل الكهربائي لهذا الأخير ينتج المعدنُ والكلور. وتمتاز خطة هذه الشركة بعدم استعمال الفلوريد وباستهلاك ثلث ما تتطلبه طريقة هول ـ هيرو من طاقة كهربائية.
- طريقة توث Toth: يُنتج معدن الألمنيوم في هذه الطريقة من الكاؤلان kaolin وضروب أخرى من الغضار الغني بأكسيد الألمنيوم، وفيه يكلَّس الغضار ويكلْوَر ثم يُفاعل كلوريد الألمنيوم الناتج بالمنغنيز المعدني فيعطي الألمنيوم وكلوريد المنغنيز. يحدث التفاعل في درجة حرارة منخفضة نسبياً (260ْ س) ويستعاد معدن المنغنيز وغاز الكلور من كلوريد المنغنيز بالتحليل الكهربائي لمصهوره، ويعاد استعمالهما في العملية. تعد طريقة توث أكثر فعالية وأقل كلفة من طريقة هول، فهي أقل استهلاكاً للطاقة ولا يستعمل فيها البوكسيت المستورد.
- الطريقة اللاكهربائية: وهي طريقة لا تستعمل فيها الكهرباء، بل يسخن مزيج خامات الألمنيوم مع وقود مشتق من الفحم الحجري في فرن مغلق، فتنتج سبائك خليطة من الألمنيوم والسيليسيوم Al-Si يمكن تنقيتها إلى الألمنيوم الصرف.
ومن طرائق التنقية للحصول على الألمنيوم الفائق النقاوة طريقة المحص بالمناطق zone refining التي تشتمل على انصهار وتبلور متكررين، وذلك بوضع العينة المراد تنقيتها في أنبوب ضيق طويل نسبياً وتمرر ببطء عبر فرن ذي مناطق قصيرة حارة وباردة بالتناوب، فيحدث الانصهار في المناطق الحارة ويحدث التبلور في المناطق الباردة. فعندما ينتقل القضيب عبر الفرن يمر تباعاً بجميع المناطق فتبقى الشوائب في المناطق المصهورة منتقلة إلى نهاية واحدة من القضيب.
وكثيراً ما يلجأ إلى هذه الطريقة للحصول على مواد نقية جداً وذلك عندما تكون الكميات صغيرة ومرتفعة التكاليف، إذ يمكن أن تبلغ من النقاء درجة لا يبقى فيها من الشوائب إلا 2،0 جزء بالمليون.
معدن الألمنيوم
الألمنيوم جسم صلب بلوري ذو لون أبيض فضي؛ تبلغ قوة شده عندما يكون مليّناً بالتحمية 463كغ/سم2، وعندما يكون مصفحاً بالبارد 1089كغ/سم.2 وهو غير سام وخفيف جداً، كثافته النسبية 2.708، ينصهر في الدرجة 660ْس، ويغلي في الدرجة 2450ْس، وهو معدن لين وكبير الاستطالة، ويمكن أن يستطيل بالشد إلـى مدى50% من طوله. وهو ناقل جيد للحرارة والكهرباء إذ تبلغ ناقليته ثلثي ناقلية النحاس، وهو عاكس ممتاز للأشعة فوق البنفسجية والمرئية وتحت الحمراء، ويمكن أن تصل درجة عكسه للأشعة تحت الحمراء إلـى 97%. يتكون على سطحه في حالته الطبيعة غشاء حافظ من أكسيد الألومنيوم Al2O3 يبلغ ثخنه 50 أنغستروماً (Aْ= 10-10 متر) يقيه من الائتكال العادي.
التطبيقات
الاستخدام العام


هي سبائك ـ خلائط alloys تحتوي على معادن كالنحاس والسيليسيوم والمغنسيوم والزنك، وتوجد منها ضروب كثيرة جداً تستعمل في سبك المقولبات وتشكيل المنتجات باللحم والطرق والتصفيح والسحب، ويمكن معالجة بعضها حرارياَ ولاسيما تقسيتها وتعتيقها. فالألمنيوم القاسي duralumin خليطة خفيفة عالية المقاومة. وهي تتألف من 95% من الألمنيوم و4% من النحاس و0.5% من المنجنيز 0.5% من السيليسيوم، وهي تقاوم الائتكال بالحموض وبماء البحر، وقابلة للطرق وتكتسب بعد التقسية مميزات ميكانيكية مهمة، وتستعمل قطعاً للطائرات وعربات السكك الحديدية والسفن والآلات المختلفة.
وتحتوي السبائك «ألمنيوم ـ مغنسيوم» 4- 8% من المغنسيوم و0.5- 1% من المنجنيز (ومنها الألوماغ alumag والدورالينوكس duralinox والمغناليوم magnalium)، وهي تستعمل، لمقاومتها الائتكال بالماء والمنتجات القلوية، في صنع السفن والحافلات وقوارير الغاز. وبإضافة 5- 9% من الزنك يُحصل على سبائك تُستعمل في صناعة الطائرات. فالسبيكة ـ الخليطة ذات 3% من المغنزيوم و0.3% من المنغنيز ذات قابلية جيدة للطَرق لذا تستعمل في صنع عناصر هياكل المركبات.
وتستعمل خلائط الألمنيوم ـ سيليسيوم في السبك لأن الخلائط التي تحتوي على 13% من السيليسيوم تكون مغايرة التحول eutectic ذات نقطة انصهار منخفضة وقابلية سيلان جيدة. وقد شاع استعمال الخلائط التي تحتوي على 10- 13% من السيليسيوم و1.5% من النحاس حداً أقصى و0.2- 1.5% من المغنزيوم و0.3% من المنغنيز «ألباكس» alpax في صنع السيارات (كتل المحركات، وظروف الأجهزة أو أحواضها، والمكابس) وفي صنع التجهيزات الكهربائية، وفي قولبة القطع سواء منها المعقدة الأشكال أو الضخمة.
سبائك الألومنيوم في التطبيقات الانشائية
 مقالة مفصلة: سبائك الألومنيوم
مقالة مفصلة: سبائك الألومنيوم
مسبوكات الألومنيوم يستعمل الألمنيوم في البناء والإنشاء، وفي التجهيزات الكيمياوية المقاومة للائتكال (مصانع إزالة الملوحة)، وفي أجزاء السيارات المقولبة بالسبك، وفي الصناعة الكهربائية (خطوط نقل الطاقة)، وفي صنع ألواح الحفر الضوئي، والمغانط الدائمة، وفي التقانة القَرِّية cryogenic technology، وفي صنع الآلات وتجهيزاتها الملحقة، وفي مختلف تجهيزات الإجرائيات الغذائية، وأنابيب المراهم ومعاجين الأسنان والحلاقة وغيرها. ويستعمل الألمنيوم مسحوقاً في الدهانات والأطلية، ووقوداً للصواريخ، وأحد مكونات المزائج الحارقة (الترميت thermite) للحْم المعادن، ووسيطاً؛ وفي الخرسانة الرغوية، وممعدناً في الفراغ، وكساءً ورقائق في التغليف والطبخ والطبع الزخرفي؛ وقشوراً في عزل ضروب الوقود السائل.
صفات سبائك الألومنيوم
تُستَخَدم كميَّات قليلة فقط من الألومنيوم في صناعة بعض المواد مثل الموصِّلات الكهربائية والمجوهرات ولوازم زخرفة المعدات والسيَّارات.
ويتم إنتاج معظم الألومنيوم في صورة سبائك تحتوي على 15% من واحد أو أكثر من العناصر الأخرى. وأكثر العناصر المستخدمة لتكوين سبائك الألومنيوم هي النُّحاس والمغنسيوم والمنجنيز والسليكون والقصدير والزنك. ويزيد النُّحاس والمغنسيوم من صلابة الألومنيوم وقوته. كما يساعد المغنسيوم على سهولة استخدام الألومنيوم كلحام.
ويساعد المنجنيز على مقاومة الألومنيوم للتآكل ويوفر له القوة. ويخفض السليكون درجة انصهار الألومنيوم ويجعل من السَّهل سّكُّه أو صَبُّه في قوالب.
يزيد القصدير من سهولة تشكيل الألومنيوم بآلات التشكيل. أما الزنك ـ خاصة عند مزجه بالمغنسيوم ـ فيعطي قوة إضافية للألومنيوم. ومن الممكن عمل سبائك من الألومنيوم وعناصر أخرى لإنتاج سبائك لها استخدامات خاصة. تشمل هذه العناصر البيزموت والبورون والكادميوم والكروم والكوبالت والحديد والرَّصاص والليثيوم والنيكل والصوديوم والتيتانيوم والفاناديوم والزركونيوم.
وللألومنيوم وسبائكه العديد من الصِّفات الخاصة والمهمة والمفيدة، ما يجعل منه فلزًا في غاية الأهمية. وتشمل هذه الصفات:
1- خفة الوزن
2- القوة
3- مقاومة الصَّدأ
4- توصيل التيَّار الكهربائي
5- توصيل الحرارة
6- عكس الضوء والحرارة.
خفة الوزن
الألومنيوم أحد أخف الفلزات وزنًا، ولذلك يُستبَدل الألومنيوم بالصُّلب في العديد من الاستخدامات. على سبيل المثال، تصنع بعض أجزاء الطَّائرات والسَّيارات الآن من الألومنيوم بدلاً من الصٌُّلب؛ نظرًا لأن المركَّبات الخفيفة الوزن تستهلك وقودًا أقلَّ. وكذلك فإنّ المنتجات التي تتمُّ تعبئتها في عبوات من الألومنيوم تكون تكاليف شحنها أقل من غيرها؛ لأنّ العبوات المصنوعة من هذا الفلز يكون وزنها أخف من العبوات المّصَنَّعة من فلزات أخرى. ويضاف فلز الليثيوم الخفيف الوزن إلى الألومنيوم لجعل سبائك الألومنيوم أخف وزنًا من غيرها.
القوة
على الرغم من أن الألومنيوم النقي ضعيف، فإنّ بعض سبائك الألومنيوم لها قوة الصُّلب. وتستخدم هذه السبائك في صناعة أجسام الطائرات وسيارات النقل وفي حواجز الأمان على الطُّرق، وفي بعض المنتجات الأخرى التي تحتاج إلى قوة كبيرة. وتفقد سبائك الألومنيوم جزءًا من قوتها تحت تأثير درجات الحرارة العالية إلا أنَّها على عكس العديد من الفلزات الأخرى تزداد قوتها تحت ضغط درجات الحرارة المنخفضة جدًا. وتُستخدم سبائك الألومنيوم بكثرة في أجهزة معالجة الغاز الطبيعي السائل الذي تصل درجة حرارته إلى ـ 162°م، ونقله وتخزينه.
مقاومة الصدأ
بعض الفلزات تتآكل إذا ما تعرَّضت للأُكسجين والماء وبعض المواد الكيميائية. وفي هذه الحالة يَحْدُث تفاعل كيميائي يسبب صدأً الفلز أو تغير لونه. ولكن عندما يتفاعل الألومنيوم مع الأكسجين فإنَّ الفلز يُكَوِّن طبقة غير مرئيَّة من مركب كيمـيائي يُسَمّى أكسـيد الألومنـيوم (Al2 O3). تحمي هذه الطبقة الألومنيوم من التآكل بفعل الأكسجين والماء والعديد من الكيميائيات. وهذه الصفة تجعل الألومنيوم مادة مهمة وقيِّمة للاستخدام خارج المنازل، ذلك لأن الفلز يقاوم فعل الرياح والصدأ والتلوث.
توصيل التَّيَّار الكهربائي
الألومنيوم والنُّحاس هما الفلزان الوحيدان اللذان يشيع استخدامهما كموصِّلات كهربائية. والألومنيوم أكثر قابلية للسَّحب والطَّرق من النُّحاس، مما يعني أنَّه أسهل في سحبه إلى أسلاك رفيعة. ونتيجة لذلك فإنَّ أسلاك الألومنيوم المقواة بالصُّلب، تُستخدم في جميع الكوابل الكهربائية الموجودة في محطات القوى الكهربائية العالية الجهد.
توصيل الحرارة
كان أول استخدام تجاري للألومنيوم هو استخدامه في صناعة أواني المطبخ. فآنية المطبخ المُصنعة من الألومنيوم تَسْخُن بسرعة وبطريقة متساوية. كما أنها تَبْرَد أيضًا بسرعة مما يجعلها شائعة الاستخدام في بعض الوحدات مثل عُلَب المشروبات وقوالب تصنيع الثلج.
عكس الضوء والحرارة
يعكس الألومنيوم حوالي 80% من الضوء الساقط عليه، ويُستخدم بكثرة في وحدات الإضاءة. ويعكس الألومنيوم كذلك الحرارة. فالمباني التي يتم تصنيعها بأسقف من الألومنيوم تعكس جزءًا كبيرًا من حرارة الشمس الساقطة عليها، وبالتالي تكون هذه المباني باردة نوعًا ما في الجو الحار. وحينما يضطر رجال الإطفاء للدخول والمرور خلال الحريق فإنّهم يرتدون ملابس خاصة، مغطاة بطلاء من الألومنيوم لعكس الحرارة.
صفات أخرى
الألومنيوم فلز لا مغنطيسي، مما يجعله مهمًّا ومفيدًا لحماية الأجهزة الكهربائية من التداخل المغنطيسي. فلا ينتج عن ارتطام الألومنيوم بفلز آخر أي شرارة، وعلى ذلك يمكن استخدامه بالقرب من المواد القابلة للاشتعال أو المتفجرات. والألومنيوم فلز غير سام ولذا يمكن تغليف الأغذية غير الحمضية في أوعية من الألومنيوم.ولكن يجب تجنب تلوث الأغذية بمركبات الألومنيوم، لأن العلماء لديهم بعض الشَّك في وجود علاقة بين تطور مرض ألزهايمر وكمية الألومنيوم في جسم الإنسان. ويمكن تشكيل الألومنيوم بأي طريقة من طرق تشكيل الفلزات، كما يمكن ربط الألومنيوم بالمسامير أو بَرْشَمَتُهُ أو لحامه أو ربطه بأي طريقة من الطرق المستخدمة مع الفلزات الأخرى. وأخيرًا فإنّ الألومنيوم يمكن إعادة استخدامه مرة أخرى.
الخواص
خواص الألمنيوم الكيمياوية
الألمنيوم معدن شديد الفعالية يتحد بالحرارة مع الهالوجينات والأكسجين والآزوت والكربون. ويطلق باحتراقه في الأكسجين كمية كبيرة من الحرارة وفق التفاعل:
2Al+3/2O2 " Al2O3
ويُرجع الكثير من الأكاسيد محرراً المعدن الآخر، وتسمى هذه الطريقة الإرجاع الحراري بالألمنيوم:
2Al+Fe2O3 " Al2O3+2Fe
تؤثر في الألمنيوم محاليل كلور الماء المركّزة والممدّة، ويؤثر فيه حمض الكبريت المركّز وحمض فوق الكلور الساخنان، ولا يتأثر بحمض الكبريت الممدد أو المركّز الباردين، ولا بحمض الآزوت المركّز. تؤثر فيه القلويات القوية بعنف ويتشكل ملح الألومينات. ويتأكسد بسرعة بالماء بدرجة 180ْس. وهو غير قابل للاشتعال إلا عندما يكون مسحوقاً.
النظائر
مصادر الألومنيوم
تحتوي معظم المعادن والصَّخور والتربة على الألومنيوم، إلا أنه يمكن تصنيع الألومنيوم بتكلفة منخفضة من خام البوكسيت فقط. ويطلق لفظ البوكسيت على أي معدن خام يحتوي على كميات كبيرة من هيدروكسيد الألومنيوم، وهو مرَكَّب مُكَوَّن من أكسيد الألومنيوم والماء ورمزه الكيميائي Al(OH)3ويُستخرج الألومنيوم من مُركَب أكسيد الألومنيوم الذي يطلق عليه أيضًا اسم ألومينا.
ومعظم البوكسيت يتكون من 30% إلى 60% ألومينا ومن 12 إلى 30% ماء. في الواقع إن كل الألومنيوم المنتج إنتاجاً تجارياً مستخلص من خامة البوكسيت (شكل 9) ، وتشتمل الخامات التجارية على نسب صغيرة متفاوتة من مواد مثل السليكا وأكسيد الحديد والتيتانيا (أكسيد التيتانيوم)، وأكاسيد معدنية أخرى.[6]
وخلافاً للعديد من الفلزات الأخرى، لا يختزل الألومنيوم مباشرة من الخامة، بل يعالج البوكسيت كيميائياً مع الصودا الكاوية تحت ضغط لإنتاج ألومينات الصوديوم، والتى يُرسَّب منها بعد ذلك هيدروكسيد الألومنيوم. ويُكَلّس هيدروكسيد الألومنيوم الناتج في قمائن دوارة في درجة الحرارة اللازمة لطرد الماء المرتبط به، لتكوين ألومينا تجارية نقية (Al2O3) (شكل 10). ونظراً لدرجات الحرارة العاليةالمستخدمة، والقدرة العالية للشحنة على الخدش والحك خاصة عند مرورها في الوصلات، يتطلب ذلك استخدام حراريات ملائمة، وأسلوب إنشاء سليم لبطانة هذه القمائن. ويشيع استخدام طوب من طين حرارى فائق الأداء على نطاق واسع لتبطين المنطقة المرتفعة درجة الحرارة ولبناء السدود التى تُقام لإطالة فترة احتجاز الشحنة ومنع تَمَوّرَها (اندفاعها) إلى خارج القمين. وفى القطاعات الأبرد من القمين يستخدم طوب الطين الحرارى عالى الأداء ويُعَمِّر لفترات طويلة في هذه المواضع.
ويتم اختزال الألومينا إلى فلز في خلايا الاختزال الإلكتروليتى والتى يشار إليها باسم الخلايا. وتبطن عادة بكتل أوعجينة الكربون. وتُنشأ قيعانها عادة من عجينة كربون تُدك في مكانها، مع وضع طبقة عازلة من الألومينا أو أى مادة أخرى في صورة مسحوق بين غلاف الصُلب الخارجى وحراريات الكربون. وقد استخدم طوب حرارى عازل بشكل جيد لهذا الغرض في بعض الإنشاءات (شكل 11 ).
أما مصاعد الكربون (الأنودات) المستخدمة في الخلايا، فقد تكون ذاتية التسوية أو سابقة التسوية. وعند استخدام الأنودات سابقة التسوية، يوقد عليها في أفران حَلَقِيّة أو قمائن نَفَقيّة مستمرة. وقد استخدم طوب طين حرارى عالى وفائق الأداء لسنوات عديدة لتبطين هذه المعدات، وما زال ينظر إليه على أنه معيار الجودة لهذه التطبيقات.
أما الأفران العاكسة المستخدمة لصهر الألومنيوم وتلك المستخدمة لتخزينه فتعتمد الحراريات المناسبة لها على عدة عوامل مثل تصميم الفرن ومعدل الصهر ونوعية الفلز أو الخردة المشحونة ونوعية السبائك المراد إنتاجها، بالإضافة إلى عوامل أخرى تعتمد على ظروف التشغيل. إن القيعان والجدران الجانبية حتى 350-400 مم فوق مستوى عتبة باب الفرن هى أحرج المناطق، ومن ثم فالاختيار الأمثل للحراريات في هذه المناطق ضرورى لتحسين اقتصاديات تشغيل هذه الأفران. أما مقاومة تفاعل التآكل والاختراق الحادث بفعل الألومنيوم السائل وسبائكه فهو أمر حيوى أيضاً، مثله مثل المقدرة على مقاومة الظروف الميكانيكية السيئة التى تتعرض لها بنية الفرن.
وقد تم تطوير أنواع معينة من طوب 85% ألومينا مترابط بفوسفات حتى يستخدم في تبطين أفران صهر الألومنيوم، ووجد أنها شديدة المقاومة للتفاعل مع سبائك الألومنيوم، ولديها مقاومة ممتازة لتراكم الكُدَارَة، وتمتاز أيضاً بمقاومة ميكانيكية جيدة في درجات حرارة التشغيل. والمِلاط المُعَدُّ من 85% ألومينا هو أفضل اختيار لصَف كل الأنواع المتنوعة من الطوب في القيعان والأجزاء السفلية من الجدران الجانبية لأفران صهر الألومنيوم. وعندما يفضل استخدام بطانات لاوصلية للقاع والجدارن الجانبية السفلية، تستخدم حراريات لدنة مترابطة بفوسفات وحراريات تُصب في العديد من الأفران.
التاريخ

قدماء اليونانيين والرومان استخدموا أملاح الألومنيوم كـ mordants للصباغة وكـ astringents لتغطية الجروح; ومازال ألوم يستعمل كـ styptic. وفي 1761 گويـْتون دي مورڤو اقترح تسمية الألوم القاعدي ألومين alumine.
حضَّر العالم الإنكليزي همفري ديڤي Humphry Davy الألمنيوم المشوب عام 1808 واكتشف الفرنسي بيير برتييه (1782-1861) Pierre Berthier فلزاً يحتوي على نسبة كبيرة من أكسيد الألومنيوم في منطقة «لي بو» Les Baux عام 1821 وأطلق عليه اسم بوكسيت نسبة إلى المنشأ. وفي عام 1825 عزل الدنمركي هانز كرستيان اورستد Christian Oersted الألمنيوم على هيئة مسحوق. وفي عام 1827 حصل فريدريش ڤولر (1800-1882) Friedrich Wohler على مسحوق الألمنيوم بإرجاع كلوريد الألومنيوم بالبوتاسيوم. وفي عام 1854 حسَّن الفرنسي هنري سانت ـ كليردوفيل Henri Saint-Claire Deville طريقة فوهلر مستعملاً الصوديوم عامل إرجاع، وقدَّم بذلك طريقة جديدة تُطبق عملياً على النطاق الصناعي وذلك بالتحليل الكهربائي لمضاعف كلوريد الألمنيوم والصوديوم المصهور.
وفي عام 1859 حصل سانت كليردوفيل على الألُمين من البوكسيت وكربونات الصوديوم، وأرجع الألُمين بالصوديوم للحصول على الألمنيوم. وفي عام 1861 اقترح الفرنسيان لوي لوشاتوليه Louis Le Chatelier وسانت كليردوفيل تحليلاً كهربائياً للكريوليت Na3AlF6 المصهور مع كلوريد الصوديوم.
وفي عام 1886 تقدم الفرنسي بول هيرو (1863- 1914) Paul Héroult بطلب ليسجل في فرنسة براءة بطريقة التحليل الكهربائي electrolysis للألُمين المصهور في الكريوليت المصهور بمصعد من الكربون، وذلك في الوقت نفسه الذي حصل فيه الأمريكي تشارلز مارتن هول (1863- 1914) Charles Martin Hall في الولايات المتحدة على براءة بطريقة صنع الألمنيوم بالتحليل الكهربائي للألُمين المصهور في حمام من فلوريدات الألمنيوم والمعادن القلوية. وفي عام 1890 تقدم النمسوي كارل جوزيف باير Karl Joseph Bayer بطريقة جديدة للحصول على الألُمين الصرف.
أشكال الألمنيوم المتوافرة
تطرح في الأسواق أشكال بنيوية من الألمنيوم من جميع الأنماط: صفائح وقضبان وأسلاك ورقائق وقشور ومسحوق، ويمكن طلي الألمنيوم بالتحليل الكهربائي بطبقة من أكسيد الألمنيوم بالتصعيد anodizing في متحلل بالكهرباء ملائم كمحلول حمض الكروم أو حمض الكبريت للحصول على ما يدعى الألمنيوم المُصَعَد anodized aluminium.
وكثيراً ما يسبك الألمنيوم مع معادن أخرى أو يُقْرَن ميكانيكياً بألياف البور والسفير sapphire أو بشعيرات بلورية معدنية موجهة محورياً. وقد تم بذلك الحصول على متانات بلغت 3743 كغ/سم2 في درجة 500ْس.
وتستعمل تقنية توضع البخار لتكوين غشاء من الألمنيوم على التيتانيوم والفولاذ يراوح ثخنه بين 5 و25 مكروناً.
أنظمة شحن مسحوق الألمنيوم
يجب أن تحمل عبوات مسحوق الألمنيوم عند شحنها في عربات السكك الحديدية والطائرات رقعاً كُتبت عليها عبارة «صلب لهوب». ولا يسمح بشحن رغاء الألمنيوم في حال كونه ندياً أو ساخناً في عربات السكك الحديدية والطائرات.
مشتقات الألمنيوم الرئيسة
ومن هذه المشتقات ما يلي:
أكسيد الألمنيوم أو الألُمين
يوجد الألُمين متبلوراً في الطبيعة فيعرف باسم الياقوت أو القُرُنْد corundum، ويتلون باللون الأحمر عندما يكون مشوباً بأكسيد الكروم فيسمى الياقوت الأحمر ruby، وتلونه بعض خلائط الأكاسيد التي يدخل فيها التيتانيوم باللون الأزرق معطية السفير sapphire. كما يصنع من مسحوقه حجر الصَّنْفَرة الشديد الصلابة والمستعمل في السحج والتمليس ويكون مميهاً في البوكسيت.
يمكن تحضير أكسيد الألمنيوم مسحوقاً أبيض أو كرات أو كتلاً، وتتغير خواصه باختلاف طريقة تحضيره، فتراوح كثافته النسبية بين 3.4 و4، وينصهر في الدرجة 2030ْس، وهو عديم الانحلال في الماء، وضعيف الانحلال في الحموض المعدنية والقلويات القوية، وغير قابل للاحتراق وغير سام.
ويُحصل عليه بمعالجة البوكسيت بالصود الكاوي ثم يحلل الناتج تحليلاً مائياً فيترسب أكسيد الألمنيوم المميه أو هدرات الألُمين التي تعطي أكسيد الألمنيوم اللامائي بالترشيح فالتكليس المزيل للماء. كما يُحضر من مياه فضلات مناجم الفحم التي تعطي كبريتات الألمنيوم التي ترجع بعدئذ إلى الألُمين.
يطرح الألُمين في الأسواق على درجات مختلفة من النقاء، فمنه التقني، والنقي كيمياوياً، والألياف، والعالي النقاء، والمصهور، والمكلس، ويعبأ في أكياس من الورق متعددة الأغلفة، كما يعبأ في براميل.
ومن أخطاره سمية غباره بالاستنشاق، ويكون من الخطر استنشاق هواء يزيد فيه غبار أكسيد الألمنيوم على 10مغ/م3.
وهو يستعمل في إنتاج الألمنيوم، وفي صنع أحجار السحج واللبنات المقاومة للحرارة والخزف والعوازل الكهربائية وحاملات الوسطاء والورق والجفنات والأدوات المخبرية، وفي امتزاز (تمزُّز) الغازات وبخار الماء، وفي التحليل الاستشرابي والمجوهرات الصنعية والألياف المقاومة للحرارة.
هيدروكسيد الألمنيوم
هيدروكسيد الألمنيوم Al2O3 ,3H2O أو Al(OH)3 مسحوق أبيض بلوري أو كرات أو حبيبات، كثافته النسبية 42،2، لا ينحل في الماء وينحل في الحموض المعدنية والصود الكاوي؛ وهو غير قابل للاشتعال.
يُحضر من البوكسيت بحل الخام في الصود الكاوي، ثم بتعديل محلول ألومينات الصوديوم الناتج فيترسب هيدروكسيد الألمنيوم.
يُطرح هدروكسيد الألمنيوم في الأسواق على درجتين من النقاء: التقني والنقي كيمياوياً، وذلك في أكياس أو براميل أو من دون عبوات.
ويستعمل هدروكسيد الألمنيوم في صنع الزجاج والخزف والألمنيوم الخالي من الحديد، وأملاح الألمنيوم، وفي صنع الألُمين المنشط، وأساساً للكّات العضوية، ومؤخراً للهب؛ كما يستعمل مسحوقه الشديد النعومة (0.1-0.6 من المكرون) عاملَ تقوية للمطاط، وطلاءً للورق، ومالئاً، وفي مواد التجميل.
هلام هيدروكسيد الألمنيوم
أو هلام الألُمين Al2O3,xH2O وهو راسب هلامي أبيض تتغير ثوابته بتغير تركيبه؛ كثافته النسبية 2.4 تقريباً، لا ينحل في الحموض ولا في القلوي، وهو غير سام، وغير قابل للاشتعال.
يُحضر بمعالجة محلول كبريتات الألمنيوم أو كلوريد الألمنيوم بالصود الكاوي أو كربونات الصوديوم أو النشادر؛ ويرسب من محلول ألومينات الصوديوم بالتحميض بثنائي أكسيد الكربون عادةً أو بالبذر seeding.
يُطرح هلام الألُمين في الأسواق على درجات مختلفة من النقاء منها التقني والنقي كيمياوياً.
ويُستعمل مرسخاً في الصباغة، كما يستعمل في تنقية المياه، وفي صنع الأقمشة الكتيمة، وفي صنع اللّكات، ووسطاً مرشحاً، وفي صنع الكيمياويات (أملاح الألمنيوم)، وفي التراكيب المزلقة، وفي صناعة الزجاج، والورق اللاصق، وفي تلميع الخزف، ومضاداً للحموض.
شب البوتاس أو مضاعف كبريتات الألمنيوم والبوتاسيوم المتبلورة
صيغته Al2(SO4)3,K2SO4, 24H2O ويكتب AlK(SO4)2,12H2O، هو بلورات بيضاء عديمة الرائحة ذات طعم قابض، كثافته النسبية 1.75، ينصهر في الدرجة 92ْس، ويفقد في الدرجة 64.5ْس 18H2O، ويغدو لا مائياً في الدرجة 200ْس، وينحل في الماء ولا ينحل في الغول، ومحاليله المائية حمضية، وهو غير قابل للاشتعال وغير سام.
يُحضر شب البوتاس من الألونيت alunite أو اللوسيت leucite، أو ببلورة محلول من كبريتات الألمنيوم وكبريتات البوتاسيوم.
ويُطرح في الأسواق على درجات مختلفة من النقاء منها التقني والمكتّل والمجروش والمسحوق.
ويستعمل مرسخاً في الصباغة، كما يستعمل في صنع الورق وعيدان الثقاب والدهانات، ووسيطاً في الدباغة، ووسيطاً لمنع نفوذ الماء، وفي تنقية المياه، وفي صنع أملاح الألمنيوم، ومضافاً غذائياً، ومسحوقاً للعجين (خميرة)، ومادة قابضة، ومقسياً إسمنتياً.
كلوريد الألمنيوم اللامائي
صيغته AlCl3، هو بلورات بيضاء أو مصفرّة تنحل في الماء، كثافته النسبية 2.44 في الدرجة 25ْس. ينصهر في الدرجة 190ْس (في ضغط 5،2 ضغط جوي)، يتصعد بسهولة في الدرجة 178ْس، ويتألف بخاره من جزيئات مضاعفة Al2Cl6.
يُحضر بتفاعل الكلور الغازي المنقى بمصهور الألمنيوم، أو بتفاعل البوكسيت مع فحم الكوك والكلور في الدرجة 875ْس تقريباً، ويشوبه كلوريد الحديد والألمنيوم الحر ومواد أخرى غير منحلة.
وهو سام إذا أُخذ عن طريق الفم أو جهاز التنفس، كما أنه مخرش شديد للأنسجة، ويتفاعل بعنف مع الماء مطلقاً غاز كلور الهدروجين HCl.
يستعمل وسيطاً في ألْكلة البنزن وكلوريد الإتيل والمواد الصيدلانية العضوية (وسيط فريدل ـ كرافتس) ومطاط البوتيل، وفي تكرير النفط، وفي تحضير راتنجات الفحوم الهدروجينية.
ويجب أن تحمل أوعيته عند شحنه في الجو رقعاً كتبت عليها كلمة «أكّال».
هدرات كلوريد الألمنيوم
صيغته AlCl3,6H2O، هو مسحوق بلوري متميع أبيض اللون أو أبيض مصفر، وهو عديم الرائحة تقريباً، وحلو الطعم، وطعمه قابض. كثافته النسبية 2.4، يتفكك بالتسخين، وينحل في الماء والغول.
يُحضر ببلورة الشكل اللامائي من محلوله في حمض كلور الماء.
ويطرح في الأسواق بأحد شكلين تقني ونقي كيمياوياً.
ويستعمل في صنع المواد الصيدلانية ومواد التجميل، والصبغات وحبيبات تغطية السقوف، والأوراق الخاصة والتصوير، والنسيج (الصوف).
سيليكات الألمنيوم
إن أياً من أنماط الغضار clay المتعددة التي تحتوي على نسب مختلفة من SiO2,Al2O3 تحضَّر اصطناعياً بتسخين كلوريد الألمنيوم في الدرجة 1000-1200ْس مع السيليس وبخار الماء. تبلغ بلوراتها سنتمتراً واحداً طولاً، وهي ذات متانة عالية، وتستعمل في تقوية اللِدان، كما أن لسيليكات الألمنيوم استعمالات الطين نفسها.
المخاطر الصحية
يكوّن المسحوق الناعم للألمنيوم خلائط لهوبة ومنفجرة في الهواء، لذلك لا يسمح باحتواء الهواء على أكثر من 10مغ من المسحوق في المتر المكعب، كما لا يسمح باحتواء الهواء على أكثر من 2مغ من أملاح الألمنيوم الحلولة.
| NFPA 704 |
|---|
| Fire diamond for aluminium shot |
مواضيع متعلقة
انظر أيضاً
- شركة مصر للألومنيوم
- سبائك الألومنيوم
- بطارية ألومنيوم
- Aluminium in Africa
- Aluminium foil
- Beverage can
- تصنيف:مركبات الألومنيوم
- تصنيف:شركات الألومنيوم
- Aluminium: The Thirteenth Element
- Aluminium–air battery
- Aluminium hydroxide
- Aluminium in Russia
- Institute for the History of Aluminium
- Panel edge staining
- The Aluminum Association
- Quantum clock
- List of countries by aluminium production
المصادر
- ^ أ ب ت "Aluminum". معمل لوس ألاموس الوطني. Retrieved 3 March 2013.
- ^ أول أكسيد الألومنيوم
- ^ يوديد الألومنيوم
- ^
Lide, D. R. (2000). "Magnetic susceptibility of the elements and inorganic compounds". [[CRC Handbook of Chemistry and Physics]] (PDF) (81st ed.). CRC Press. ISBN 0849304814.
{{cite book}}: URL–wikilink conflict (help) - ^ صلاح يحياوي. "الألمنيوم". الموسوعة العربية. Retrieved 2012-04-04.
- ^ وليد خليفة. "الحراريات المستخدمة في صناعة الفلزات (5)". نول. Retrieved 2012-03-28.
وصلات خارجية
- Aluminium as a traded commodity
- WebElements.com - Aluminium
- World production of primary aluminium, by country
- تاريخ الألومنيوم
- Electrolytic production
- Emedicine – Aluminium
- الفيلم القصير ALUMINUM (1941) متاح للتنزيل المجاني على أرشيف الإنترنت [more]
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
- CS1 errors: URL–wikilink conflict
- Ill-formatted IPAc-en transclusions
- Pages including recorded pronunciations
- Infobox element missing image
- Articles with hatnote templates targeting a nonexistent page
- عناصر كيميائية
- ألومنيوم
- مواد قابلة للتدوير
- وقود صواريخ
- موصلات كهربائية
- Pyrotechnic fuels
- صناعة الطائرات
- فلزات ضعيفة
- Airship technology
- فلزات بعد انتقالية
- عوامل مختزلة