مثامفتامين
المثامفتامين[note 1] (اختصار ن-مثيلأمفتامين methylamphetamine)، هو منبه قوي للجهاز العصبي المركزي يستخدم بشكل رئيسي كعقار ترفيهي وأقل شيوعاً كعلاج من الخط الثاني اضطراب فرط الحركة ونقص الانتباه والبدانة.[16] اكتشف المثامفتامين عام 1893 ويوجد متصاوغين انعكاسيين: لڤو-مثامفتامين levo-methamphetamine ودكسترو-مثامفتامين dextro-methamphetamine.[note 2] يشير المثامفتامين بشكل دقيق إلى مادة كيميائية معينة، قاعدة حرة راسيمية، وهي عبارة عن خليط متساوي من اللڤو-مثامفتامين والدكسترو-مثامفتامين في أشكالها الأمينية النقية. وهو نادراً ما يوصف لعلاج المشكات التي نطوي على السمية العصبية البشرية ويحتمل استخدامه كمنشط جنسي طبيعي وعقار مبهج، واستخدامات أخرى، بالإضافة لتوافر عقاقير بديلة أكثر أمناً وذات فعالية علاجية مماثلة. الدكسترو-مثامفتامين هو منبه أكثر قوة على الجهاز العصبي المركزي من اللڤو-مثامفتامين.
يتم الاتجار بكل من المثامفتامين والدكسترو-مثامفتامين بشكل غير مشروع ويباعا لإمكانية استخدامهما كعقاقير ترفيهية. يوجد أعلى انتشار للاستخدام الغير قانوني للمثامفتامين في مناطق من آسيا، أوقيانوسيا، وفي الولايات المتحدة، حيث يصنف المثامفتامين الترفيهي، اللڤو-مثامفتامين، والدكسترو-مثامفتامين ضمن أدوية الجدول الثاني الخاضعة للرقابة. في الولايات المتحدة، يتوافر اللڤو-مثامفتامين كدواء متاح بدون وصفة كمستنشق مزيل لاحتقان الأنف.[note 3] دولياً، يتم تقييد أو حظر إنتاج المثامفتامين أو توزيعه أو حيازته في العديد من البلدان، بسبب وضعه ضمن أدوية الجدول الثاني بموجب اتفاقية الأمم المتحدة الخاصة المؤثرات العقلية. في حين أن الديكسترو-مثامفتامين أكثر فعالية، فإن المثامفتامين الراسيمي ينتج أحياناً بطريقة غير مشروعة بسبب السهولة النسبية لتركيبه ومحدودية توافر المركبات الطليعية الكيميائية..
في الجرعات الصغيرة إلى المتوسطة، قد يؤدي المثامفتامين إلى تعديل المزاج، زيادة الانتباه ولتركيز والطاقة للأشخاص المرهقين، تقليل الشهية، والمساعدة في خسارة الوزن. في الجرعات الكبيرة نسبياً، قد يحفز الذهان، انحلال العضلات الهيكلية، الصرع ونزيف المخ. الاستخدام المزمن للجرعات العالية قد يؤدي إلى تحولات مزاجية سريعة غير متوقعة، الذهان المنبه (على سبيل المثال، جنون الارتياب، الهلاوس، الهذيان، والأوهام) والسلوك العدواني. في الاستخدام الترفيهي، أُبلغ عن قدرة المثامفتامين على زيادة الطاقة |لتعديل الحالة المزاجية وزيادة الرغبة الجنسية لدرجة أن المستخدمين قادرون على ممارسة النشاط الجنسي بشكل مستمر لعدة أيام.[20] يعرف أن هناك احتمالية كبيرة للإدمان على المثامفتامين (أي احتمال كبير أن يؤدي الاستخدام الطويل أو بجرعات عالية إلى تعاطي المخدرات القهري) واحتمالية كبيرة للاعتياد (أي أن هناك احتمال كبير لحدوث الأعراض الانسحابية عند التوقف عن استخدام المثامفتامين). قد يؤدي الاستخدام الترفيهي المفرط للمثامفتامين إلى الأعراض الانسحابية ما بعد الحادة، التي قد تستهل لشهور ما بعد فترة الأعراض الانسحابية الاعتيادية. على عكس الأمفتامين، فإن المثامفتامين هو مادة سامة عصبياً على العصبونات الدوپامينية في الدماغ المتوسط.[21] كما تبين أنه يؤدي إلى أضرار في عصبونات السروتونين في الجهاز العصبي المركزي.[22][23] يتضمن هذا الضرر تغييرات سلبية في بنية المخ ووظيفته، مثل تقلص حجم المادة الرمادية في مختلف مناطق المخ وتغييرات سلبية في دلالات السلامة الأيضية.[23]
ينتمي المثامفتامين إلى صفي الأمفتامينات والفنثلامينات البديلة. ويرتبط المثامفتامين بثنائي مثيل الفنثيلامينات كمتزامر بنيوي لهذه المركبات، والتي تتشارك الصيغة الكيميائية المشتركة: C10H15N1.
الاستخدامات
الطبية
في الولايات المتحدة، اعتمدت ادارة الغذاء والدواء هيدروكلوريد الدكسترو-مثامفتامين، تحت الاسم التجاري "دسوكسين" Desoxyn، لعلاج اضطراب فرط الحركة وصعوبة الانتباه والبدانة سواء للبالغين أو الأطفال؛[24][25] إلا أن ادارة الغذاء والدواء قد أشارت أيضاً إلى وجوب مقارنة الفائدة العلاجية المحدودة للمثافتامين بالمخاطر الكامنة المرتبطة باستخدامه.[24] ويوصف المثافتامين أحياناً للاستخدام بدون تصريح لعلاج النوم القهري narcolepsy وفرط النوم مجهول السبب idiopathic hypersomnia.[26][27] في الولايات المتحدة يتوافر الشكل الدوراني للمثامفتامين في بعض منتجات مضادات احتقان الأنف المتاحة بدون وصفة طبية.[note 3]
لارتباط المثامفتامين باساءة الاستخدام المحتملة المرتفعة، فقد نظم هذا العقار بموجب قانون المواد المراقبة وهو مدرج ضمن الجدول الثاني في الولايات المتحدة.[24] يستلزم توزي هيدروكلوريد المثافتامين في الولايات المتحدة وضع علامة تحذيرية على العبوة تشير إلى احتمال اساءة استخدامه كعقار ترفيهي وتسببه في الإدمان.[24]
الترفيهية
غالباً ما يستخدم المثامفتامين بشكل ترفيهي لتأثيراته المبهجة والمنبهة القوية وكمنشط جنسي أيضاً.[20]
حسب فيلم ناشيونال جيوگرافيك الوثائقي عن المثامفتامين، فإن هناك ثقافة فرعية تعرف بثقافة المخدرات والجنس والتي تعتمد بشكل كامل على الأنشطة الجنسية واستخدام المثامفتامين.[20] ممارسو هذه الثقافة الفرعية، والذين يتألفون من مستخدمي المثامفتامين من الذكور والمزدوجين جنسياً، يتقابلون عن طريق المواعدة على الإنترنت ويمارسون الجنس.[20] بسبب تأثيراته المنبهة والمبهجة ولتأثيره المؤخر للقذف، ومع الاستخدام المتكرر، أحياناً يستمر المشاركون في حفلات المخدرات والجنس تلك في ممارسة الأنشطة الجنسية بشكل مستمر لعدة أيام.[20] وعادة ما يكون الانهيار الذي يلي استخدام المثامفتامين بهذه الطريقة قوياً، ويتمثل في فرط النوم hypersomnia (النوم لفترات طويلة في النهار).[20] تنتشر ثقافات المخدرات والجنس في المدن الأمريكية الكبرى مثل سان فرانسيكو ومدينة نيويورك.[20][28]
موانع الاستخدام
يُحظر استخدام المثامفتامين للأشخاص الذين لديهم تاريخ سابق لاضطراب تعاطي المخدرات، أمراض القلب، أو التهيج أو القلق الحاد، أو للأشخاص الذين يعانون من فرط ضغط الدم.[24] أعلنت ادارة الغذاء والدواء عدم وجوب استخدام المثامفتامين للأشخاص الذين سبق وأن عانوا من ردود فعل تحسسية مفرطة للمنبهات الأخرى في الماضي أو يتناولون حالياً مستقبلات الأكسيداز أحادي الأمين.[24] كما أوصت ادارة الغذاء والدواء الأشخاص المصابين بالاضطراب ثنائي القطب، الاضطراب الاكتئابي، ضغط الدم المرتفع، متلازمة رينو، نوبات الصرع، مشكلات في الغدة الدرقية، التشنجات اللاإرادية، أو متلازمة توريت، بمراقبة الأعراض أثناء استخدامهم المثامفتامين.[24] نظراً لاحتمال تسبب المثامفتامين بتوقف النمو، توصي ادارة الأغذية والأدوية بمراقبة نمو طول ووزن الأطفال والمراهقين أثناء العلاج.[24]
الآثار الجانبية
الجسمانية
قد تتضمن الآثار الجسمانية للمثامفتامين فقدان الشهية، فرط التحسس، توسع الحدقة، الجلد المتورد، التعرق الزائد، الحركة الزائدة، جفاف الفم وصرير الأسنان (يؤدي إلى "فم الميث")، الصداع، اضطراب دقات القلب (عادة ما تكون على شكل تسرع القلب، أو بطء القلب)، تسرع التنفس، ارتفاع ضغط الدم، الإسهال، الإمساك، زغللة العين، الدوار، الارتجاف، الخدار، الرعاش، جفاف البشرة، حب الشباب، والمظهر الشاحب.[24][29]
فم الميث

قد يفقد مستخدمو ومدمنو المثامفتامين أسنانهم بشكل غير طبيعي وسريع، بغض النظر عن طريق تعاطيه، جراء الإصابة بحالة تُعرف بشكل غير رسمي بفم الميث.[30] بصفة عامة، تكون الحالة أقوى عند المتاطين الذين يستخدمون العقار عن طريق الحقن، بدلاً من ابتلاعه أو تدخينه أو استنشاقه.[30] حسب الجمعية الأمريكية لطب الأسنان، فإن فم الميث "قد يكون مزيج من التغيرات النفسية والفسيولوجية الناجمة عن العقار مما يتسبب في جفاف الفم، ضعف صحة الفم لفترات طويلة، الاستهلاك المتكرر للمشروبات المكربنة الغنية بالسعرات الحرارية وصرير الأسنان".[30][31] نظراً لأن جفاف الفم هو أيضاً أحد الآثار الجانبية الشائعة للمنشطات الأخرى، والتي لا يُعرف عنها أنها تسهم في نخر الأسنان الشديد، يشير العديد من الباحثين إلى أن نخر الأسنان المرتبط بالمتامفتامين يرجع إلى اختيارات المتعاطين الأخرى. ويقترحوا أن هذا التأثير الجانبي مبالغ فيه وأنه تم وضعه في إطار معين من أجل إنشاء نموذج نمطي للمتعاطين الحاليين ليستخدم كرادع للمتعاطين الجدد.[32]
العدوى المنقولة جنسياً
وُجد أن المثافتامين مرتبط بترددات أعلى من الاتصال الجنسي غير آمن بين الشركاء الجنسيين المصابين بمتلازمة نقص المناعة المكتسبة (الإيدز) أو المجهولين، ويرتبط بشكل أكثر وثوقاً مع المصابين بالإيدز.[33] تشير هذه النتائج إلى أن تعاطي المثامفتامين وممارسة الجماع الشرجي غير الآمن هي سلوكيات مخاطرة مشتركة وسلوكيات قد تزيد من خطر انتقال ڤيروس نقص المناعة البشرية بين الرجال المثليين وثنائيي الجنس.[33] يتيح استخدام المثامفتامين للمتعاطين من كلا الجنسين المشاركة في نشاط جنسي طويل، مما قد يسبب تقرحات وتآكل في الأعضاء التناسلية وكذلك القساح (الانتصاب المستمر) لدى الرجال.[24][34] كما قد يتسبب المثامفتامين في حدوث تقرحات وسحجات في الفم جراء صرير الأسنان، مما يزيد من خطر العدوى المنقولة جنسياً.[24][34]
إلى جانب انتقال ڤيروس نقص المناعة البشرية عن طريق الاتصال الجنسي، قد ينتقل الڤيروس أيضاً بين المتعاطين الذين يستخدمون حقن مشتركة.[35] ويشابه مستوى مشاركة الحق بين متعطي المثامفتامين لنظيره بين متعاطي المخدرات الأخرى عن طريق الحقن.[35]
نفسياً
قد تتضمن الآثار النفسية للمثامفتامين الابتهاج، الانزعاج، تغيرات في الرغبة الجنسية، اليقظة، التوجس والتركيز، انخفاض الإحساس بالتعب، الأرق أو السهاد، الثقة في النفس، الاختلاط بالآخرين، التهيج، الضجر، هوس العظمة، والسلوكيات المتكررة والموسوسة.[24][29][36] السمة المميزة للمثامفتامين والمنبهات ذات العلاقة هو "punding"، هو النشاط المتكرر الغير موجه لهدف ما.[37] كما يرتبط تعاطي المثامفتامين بشكل كبير بالقلق، الاكتئاب، ذهان الأمفتامين amphetamine psychosis، الانتحار والسلوكيات العنيفة.[38]
التسمم العصبي والاستجابة المناعية العصبية

على عكس الأمفتامين، فالمثامفتامين سام عصبياً بشكل مباشر على عصبونات الدوپامين في حيوانات التجارب والبشر على حد سواء.[21][22][23] علاوة على ذلك، ترتبط السمية العصبية للمثامفتامين بزيادة خطر الإصابة بمرض پاركنسن، و التأثير الذي ينشأ جزئياً من خلال الإفراط في إنتاج العصارة الخلوية والتشابكية أنواع الأكسجين التفاعلية والتأكسد الذاتي للدوپامين.[42][43][44][45][46] بالإضافة للسمية العصبية الدوپامينية، فقد أشارت مراجعة الأدلة في البشر إلى أن استخدام جرعة عالية من المثامفتامين قد تكون سامة عصبياً لعصبونات السروتونين.[23] وثبت أن ارتفاع درجة الحرارة الأساسية يرتبط بزيادة التأثيرات السمية العصبية للمثامفتامين.[47] نتيجة للسمية العصبية لعصبونات الدوپامين المحفزة من المثامفتامين، فقد يؤدي الاستخدام المزمن إلى الأعراض الانسحابية ما بعد الحادة التي تستمر لأشهر ما بعد فترة الانسحاب التقليدية.[43]
كما توصلت دراسات التصوير بالرنين المغناطيسي على متعاطي المثامفتامين دليلاً على الضمور العصبي، أو تغيرات معاكسة في اللدونة العصبية في بنية ووظيفة المخ.[23] وبشكل خاص، تبين أن المثامفتامين يتسبب في فرط كثافة وتضخم خلايا المادة البيضاء، انكماش ملحوظ في الحـُصين، وتراجع المادة الرمادية في القشرة الحزامية، القشرة الشمية، وparalimbic cortex لدى متعاطي المثامفتامين.[23] علاوة على ذلك، تقترح الأدلة أن التغيرات الحادة في مستوى العلامات الحيوية للسلامة والتخليق الأيضي لمستخدمي العقار لأغراض ترفيهية، مثل انخفاض مستويات N-acetylaspartate والكرياتين وارتفاع مستويا الكولين والميوإنوسيتول.[23]
وتبين أن المثامفتامين ينشط TAAR1 في الخلايا النجمية البشرية ونتيجة لذلك يتولد cAMP.[48] ويبدو أن تنشيط TAAR1 في الخلايا النجمية يعمل كآلية يقوم من خلالها المثامفتامين بتخفيف مستويات EAAT2 (SLC1A2) العشائي المرتبط بالمثامفتامين ووظائفه في هذه الخلايا.[48]
يرتبط المثامفتامين وينشط الأنواع افرعية من مستقبلات سيگما، σ1 وσ2، في المخ.[41][49] ينشط مستقبل سيگما عن طريق تنشيط المثامفتامين للسمية العصبية المحفزة بالمثامفتامين من خلال تيسير فرط الحرارة، زيادة تخليق الدوپامين وإطلاقه، التأثير على تنشيط الخلايا الدبقية الصغيرة، وتعديل تدفق إشارة الاستموات وتشكيل أنواع الأكسجين التفاعلية.[41][49]
توصلت دراسة عُقدت في 2015 إلى أن السلوك الناجم عن استخدام المثامفتامين يحدث جزئياً جراء التأثيرات السمية العصبية للعقار. التحفيز الزائد، الإجهاد التأكسدي، المرونة الأيضية، خلل UPS، نترنتة الپروتين، ضغط الشبكة الهيولية الباطنة، تعبير p53، وعمليات أخرى تسهم في هذه السمية العصبية.[50]
الجرعة الزائدة
قد تتسبب الجرعة الزائدة من المثامفتاتمين في مجموعة متنوعة من الأعراض.[4][24] ينتج عن الجرعة الزائدة المتوسطة من المثامفتامين الأعراض التالية: اضطراب نظم القلب، التشوش، صعوبة أو عسر التبول، ارتفاع أو انخفاض ضغط الدم، ارتفاع درجة حرارة الجسم، ردود الفعل المفرطة و/أو فرط الاستجابة، آلام العضلات، الهياج، تسرع التنفس، الرعاش، تقطع البول، وعدم القدرة على التبول.[4][29] أما الجرعات الزائدة الكبيرة من المثامفتامين فتتسبب في أعراض مثل العصف الأدريناليني، ذهان المثامفتامين، انخفاض كمية البول أو انقطاعه، الصدمة القلبية، نزيف المخ، هبوط الدورة الدموية، الحمى المفرطة (أي الارتفاع الخطر لدرجة حرارة الجسم)، فرط ضغط الدم الرئوي، الفشل الكلوي، الانحلال السريع للعضلات، متلازمة السروتونين، وأحد أشكال النمطية ("تكرار الأفعال والأقوال").[sources 1] ومن المرجح أيضاً أن تتسبب الجرعة الزائدة من المثامفتامين في تلف بسيط في المخ بسبب السمية العصبية الدوپامينية والسروتونينية.[21][23] عادة ما يسبق الموت بالمثامفتامين تشنجات وإغماءة.[24]
الذهان
قد يؤدي تعاطي المثامفتامين إلى ذهان المنبهات الذي ينتج عنه مجموعة من الاعراض (مثل جنون الارتياب، الهلوسات، الهذيان، والأوهام).[4][54] تشير إحدى مراجعات مؤسسة كوكرين حول العلاج بالأمفتامين، الدكسترو-أمفتامين، والذهان المرتبط بتعاطي المثامفتامين إلى أن حوالي 5-15% من المتعاطين يفشلون في التعافي الكامل.[54][55] كما تؤكد المراجعة نفسها، بناءاً على تجربة واحدة على الأقل، أن مضادات الذهان تعتبر علاجاً فعالاً لأعراض ذهان الأمفتامين الحاد.[54] كما قد يتطور ذهان الأمفتامين أحياناً كأثر جانبي للعلاج.[56]
علاج الطوارئ
يعالج التسمم الحاد للمثامفتامين بعلاج الأعراض وقد تشمل العلاجات في البداية إعطاء الفحم المنشط والمهدئات.[4] ليس هناك أدلة كافية لجدوى الديال الدموي أو الديال الپريتوني في حالات التسمم بالمثامفتامين.[24] قد تزيد الإبالة الحمضية القسرية (على سبيل المثال، مع ڤيتامين سي) من خطر الحماض المتفاقم، أو قد تتسبب في حدوث النوبات أو انحلال الربيدات.[4] قد يشير ارتفاع الدم إلى خطر حدوث النزيف السحائي (أي نزيف في المخ)، وفي الحالات الحادة، عادة ما يعالج بالفنتولامين أو النيتروپروسيد الوريدي.[4] غالباً ما ينخفض ضغط الدم تدريجياً بعد التهدئة باستخدام البنزوديازپين وتوفير البيئة الهادئة للمريض.[4]
تكون مضادات الذهان مثل الهالوپريدول مفيدة لعلاج التهيج والذهان نتيجة الجرعات الزائدة من المثامفتامين.[57][58] حاصرات بيتا ذات الخصائص المحبة للدهون والمخترقة للجهاز العصبي المركزي مثل المتوپرولول واللابتالول قد تكون مفيدة لعلاج تسمم الجهاز العصبي المركزي والتسمم القلبي الوعائي.[59] اللابتالول، حاصر ألفا وبيتا المختلط، مفيد بشكل خاص في علاج اضطراب نظم القلب وارتفاع ضغط الدم الناجم عن المثامفتامين.[57] لم يتم الإبلاغ عن ظاهرة "تحفيز ألفا unopposed" مع استخدام حاصرات بيتا لعلاج سمية المثامفتامين.[57]
الإدمان
| مسرد الإدمان والإعتياد [60][61][62][63] | |
|---|---|
| |
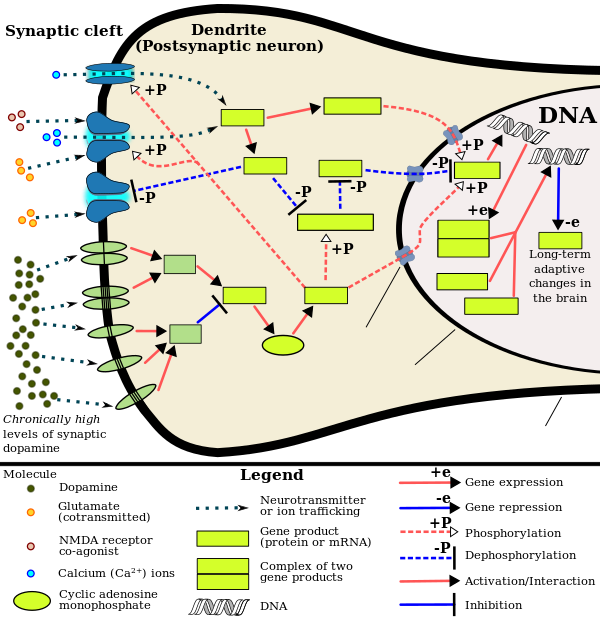
تنطوي الأنماط الحالية للإدمان الناجم عن تعطي العقاقير المزمنة على تغييرات في التعبير الجيني في أجزاء معينة من المخ، وخاصة النوية المتكئة nucleus accumbens.[71][72] أكثر عوامل النسخ أهمية[note 4] التي تُنتج هذه التغييرات هي عناصر استجابة ΔFosB، cAMP المرتبطة بالپروتين (CREB)، وعامل كاپا ب النووي (NFκB).[72] يلعب ΔFosB دوراً أساسياً في تطور إدمان المخدرات، حيث أن التعبير المفرط في العصبونات الشوكية الوسطى من النوع-د1 في النويات المتكئة هو شرطاً ضرورياً وكافياً[note 5] بالنسبة لمعظم التكيفات السلوكية والعصبية التي تنشأ من الإدمان.[61][72][74] بمجرد ما يصبح تعبير ΔFosB مفرطاً بما يكفي، تُحفز حالة الإدمان التي تصبح أكثر خطورة مع زيادة تعبير ΔFosB.[61][74] كما يلعب هذا الپروتين دوراً في إدمان الكحوليات، القنبيات، الكوكايين، فنيدات المثيل، النيكوتين، أشباه الأفيونيات، الفنسيكليدين، الپروپوفول، والأمفتامينات البديلة، وغيرها.[72][74][75][76][77]
ΔJunD، عامل النسخ، وG9a، إنزيم هيستون مثيلترانسفيراز، يعارضان مباشرة تحريض ΔFosB في النويات المتكئة (أي، يعارضان زيادة تعبيره).[61][72][78] قد يمنع التعبير المفرط الكافي لـΔJunD في النويات المتكئة مع الناقلات الڤيروسية بشكل كامل العديد من التغيرات العصبية والسلوكية في حالة التعاطي المزمن للمخدرات (أي، التغيرات التي تحدث بواسطة ΔFosB).[72] كما يلعب ΔFosB دوراً هاماً في تنظيم الاستجابات السلوكية للمكافئة الطبيعية، مثل الطعام المستساغ والجنس والتدريبات.[72][75][79] وحيث أن المكافآت الطبيعية والأدوية المدمنة يحفزان تعبير الپروتين ΔFosB (أي، يتسببان في إنتاج المخ للمزيد من هذا الپروتين)، قد يؤدي الاكتساب المزمن لهذه المكافآت إلى حالة مرضية مماثلة للإدمان.[72][75] ΔFosB هو العامل الأكثر أهمية في إدمان الأمفتامين وإدمان الجنس الناجم عن الأمفتامين، وهي سلوكيات جنسية قهرية تنتج عن النشاط الجنسي المفرط واستخدام الأمفتامين.[note 6][75][80] يرتبط هذا النوع من إدمان الجنس (أي، السلوك الجنسي القهري الذي تحفزه المخدرات)، بمتلازمة خلل تنظيم الدوپامين التي تحدث لدى بعض المرضى الذين يناولن الأدوية الدوپامينية، مثل الأمفتامين والمثامفتامين.[75][79][80]
العوامل اللاجينية في إدمان المثامفتامين
يعتبر إدمان المثامفتامين مستديماً بالنسبة للعديد من الأفراد، حيث يعود 61% من الأفراد الذين خضعوا للعلاج للإدمان خلال عام واحد.[81] نصف هؤلاء تقريباً يستمرون في إدمان المثامفتايمن على مدار عشرة أعوام، في حين يقلل النصف الآخر من تعاطيهم ابتداءً من سنة إلى أربع سنوات بعد التعاطي الأولي.[82]
يشير الإدمان المستديم إلى تغيرات طويلة المدى في التعبير الجيني قد يحدث في بعض مناطق المخ، وقد يسهم بشكل بارز في النمط الظاهري للإدمان. تبين مؤخراً الدور المحوري الذي تلعبه آليات التخلق في حدوث التغيرات الدائمة في التعبير الجيني بالمخ.[83]
لخصت مراجعة من عام 2015[84] عدد من الدراسات المتعلقة بتعاطي المثامفتامين المزمن في القوارض. ورُصدت تغيرات تخلقية في مناطق "المكافأة"، التي تشمل المنطقة السقيفية البطنانية ventral tegmental area، النوى المتكئة nucleus accumbens، الجسم المخطط الظاهري، الحـُصين، والقشرة الأمام جبهية. يتسبب التعاطي المزمن للمثامفتامين في حدوث عمليات أستلة ونزع أستلة وميثلة الهيستون. كما لوحظ ميثلة الدنا الجيني في بعض مناطق المخ. تتسبب التغيرات التخلقية المختلفة في زيادة وإنخفاض تنظيم بعض الجينات الهامة في الإدمان. على سبيل المثال، يتسبب التعاطي المزمن للمثامفتامين في ميثلة الليسين في الموضع 4 من الهيستون 3 الواقع في محفز جينات c-fos ومستقبل C-C chemokine 2 (ccr2)، وتنشيط هذه الجينات في النويات المتكئة (NAc).[84] يشتهر c-fos بأهميته في الإدمان.[85] كما يعتبر الجين ccr2 من الجينات الهامة في الإدمان، حيث أن التعطيل الطفري لهذا الجين يضعف الإدمان.[84]
في الفئران المدمنة على المثامفتامين، التنظيم التخلقي عن طريق تقليل أستلة الهيستونات، في العصبونات الداخلية بالمخ، يتسبب في تقليل نسخ مستقبلات الگلوتامات.[86] تلعب مستقبلات الگلوتامات دوراً هاماً في تنظيم التأثيرات المعززة للعقاقير المخدرة.[87]
العلاج
حالياً، يعتبر العلاج السلوكي المعرفي هو العلاج السريري الأكثر فاعلية لحالات الإدمان على المنبهات النفسية بصفة عامة.[88] حتى مايو 2014، لا توجد معالجة دوائية لإدمان المثامفتامين.[89][90][91] يعالج إدمان المثامفتامين عن طريق تنشيط مستقبلات الدوپامين ومستقبلات NMDA المتواجدة معاً [note 7] في النويات المتكئة.[66][67] تثبط أيونات المغنسيوم مستقبلات NMDA بحصر مستقبلات قنوات الكالسيوم.[92][93]
الاعتياد والأعراض الانسحابية
من المتوقع أن يتطور تحمل العقاقير مع الاستخدام المنتظم للمثامفتامين، وعند استخدامه لأغراض ترفيهية، يتطور التحمل بشكل سريع.[94][95] بالنسبة للمعتادين على تعاطين، ترتبط أعراض الانسحاب بشكل إيجابي مع مستوى تحمل العقاقير.[96] يستمر الاكتئاب الناتج عن انسحاب المثامفتامين لفترة أطول، ويكون أكثر حدة عن الاكتئاب الناتج عن انسحاب الكوكايين.[97]
تبعاً لمراجعة كوكران القائمة عن الإدمان والأعراض الانسحابية للعقاقير للمستخدمين الترفيهيين للمثامفتامين، ""عند التوقف المفاجئ للمتعاطين المزمنين بقوة عن استخدام [المثامفتامين]، يبلغ الكثيرون عن متلازمة انسحاب محدودة المدة تحدث خلال 24 ساعة من آخر جرعة لهم".[96] تكونالأعراض الانسحابية لدى المستخدمين المزمنين، بجرعات عالية، متكررة، وتحدث في أكثر من 87.6% من الحالات، وتستمر لثلاثة أو أربعة أسابيع مع حدوث مرحلة "تحطم" خلال الأسبوع الأول.[96] وتشمل الأعراض الانسحابية للمثامفتامين القلق، الحنين للمخدر، الانزعاج، الإعياء، زيادة الشهية، فرط الحركة أو قلة الحركة، عدم الاكتراث، الأرق أو فرط النوم، والأحلام الصافية أو الواعية.[96]
يتواجد المثامفتامين في مجرى دم الأم ويمكن أن ينتقل إلى الجنين عن طريق المشية وقد يُفرز في حليب الثدي.[97] قد يعاني الأطفال المولودين لأمهات يتعاطين المثامفتامين من متلازمة انسحاب حديثي الولادة، التي ترتبط بأنماط اضطراب النوم، نقص التغذية، الارتجاف، وفرط التوتر.[97] تكون هذه المتلازمة معتدلة نسبياً ولا تتطلب التدخل الطبي سوى في 4% من الحالات.[97]
| شكل اللدونة العصبية أو اللدونة السلوكية |
نوع المُعزز | المصادر | |||||
|---|---|---|---|---|---|---|---|
| الأفيونيات | المنبهات النفسية | الأغذية الغنية بالدهون أو السكريات | الجماع الجنسي | التمرينات الرياضية (الهوائية) |
التعزيز البيئي | ||
| تعبير ΔFosB في النويات المكتئة D1-type MSNs |
↑ | ↑ | ↑ | ↑ | ↑ | ↑ | [75] |
| اللدونة السلوكية | |||||||
| زيادة الجرعة | نعم | نعم | نعم | [75] | |||
| الوعي-المتبادل للمنبه النفسي |
نعم | غير قابل للتطبيق | نعم | نعم | ضعيفة | ضعيفة | [75] |
| المنبه النفسي الإدارة الذاتية |
↑ | ↑ | ↓ | ↓ | ↓ | [75] | |
| المنبه النفسي التفضيل المكاني المشروط |
↑ | ↑ | ↓ | ↑ | ↓ | ↑ | [75] |
| إعادة سلوك البحث عن المخدرات | ↑ | ↑ | ↓ | ↓ | [75] | ||
| اللدونة الكيميائية-العصبية | |||||||
| فسفرة CREB في النوية المتكئة |
↓ | ↓ | ↓ | ↓ | ↓ | [75] | |
| استجابة الدوپامين في النوية المتكئة |
لا | نعم | لا | نعم | [75] | ||
| تاشير الدوپامين في الجسم المخطط | ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD1, ↓DRD2, ↑DRD3 | ↑DRD2 | ↑DRD2 | [75] | |
| التأشير الشبه أفيوني الداخلي المتغير | لا يوجد تغير أو ↑μ-مستقبلات أفيونية |
↑μ ↑κ-مستقبلات أفيونية |
↑μ-مستقبلات أفيونية | ↑μ-مستقبلات أفيونية | لا يوجد تغير | لا يوجد تغير | [75] |
| تغيرات في الپپتيدات الشبه أفيونية في الجسم المخطط | ↑دينورفين لا يوجد تغير: إنكفالين |
↑دينورفين | ↓إنكفالين | ↑دينورفين | ↑دينورفين | [75] | |
| اللدونة التشابكية للمسار الوسطي الطرفي | |||||||
| عددالزوائد الشجرية في النوية المتكئة | ↓ | ↑ | ↑ | [75] | |||
| كثافة الشوكة التغصنية في النوية المتكئة |
↓ | ↑ | ↑ | [75] | |||
التفاعلات
يستقلب المثامفتامين عن طريق الإنزيم الكبدي CYP2D6، ولذلك ستطيل مستقبلات CYP2D6 من عمر النصف الحيوي للمثامفتامين.[98] كما يتفاعل المثامفتامين مع مستقبلات الأوكسيداز أحادي الأمين (MAOIs)، وحيث أن كلاً من مستقبلات الأوكسيداز أحادي الأمين والمثامفتامين يزيدان من كاتيكولامينات الپلازما؛ لذلك، فإن استخدامهمما بشكل متزامن يشكل خطراً.[24] قد يخفض المثامفتامين من تأثيرات العقاير المهدئة والمسببة للاكتئاب ويزيد من تأثيرات مضادات الاكتئاب والمنبهات الأخرى أيضاً.[24] قد يتعارض المثامفتامين مع تأثير خافضات ضغط الدم ومضادات الذهان بسبب تأثيراته على الجهاز القلبي الوعائي والإدراك، على التوالي.[24] درجة حموضة المحتوى المعوي والبول تؤثر على امتصاص وإفراز المثامفتامين.[24] تقلل المواد الحمضية بشكل خاص من امتصاص المثامفتامين وتزيد من إدرار البول، بينما تفعل المواد القلوية العكس.[24] بسبب تأثير درجة الحموضة على امتصاص المثامفتامين، تُعرف مضخات مضخة الپروتون، والتي تقلل الحموضة الهضمية، بتفاعلها مع المثامفتامين.[24]
علم الأدوية

الحركة الدوائية
يُعرف المثامفتامين ناهضة كاملة|كناهضة كاملة قوية المستقبل المرتبط بالأمين الأثري 1 (TAAR1)، a مستقبل مقترن بالپروتين ج (GPCR) الذي ينظم نظم الكاتيكولامين في المخ.[99][100] يزيد تنشيط TAAR1 من إناج أحادي فوسفات الأدينوزين الحلقي (cAMP) أو يثبط بالكامل أو يعكس اتجاه نقط ناقل الدوپامين (DAT)،ناقل النورإپينفرين (NET)، ناقل السيروتونين (SERT).[99][101] عندما يرتبط المثامفتامين مع TAAR1، فإنه يحفز فسفرة الناقل عن طريق تأشير پروتين كيناز أ (PKA) وپروتين كيناز ج (PKC)، مما يؤدي في النهاية إلى الالتقام الداخلي أو يعكس وظيفة ناقلات أحادي الأمين.[99][102] كما يُعرف بأن المثامفتامين يزيد الكالسيوم الخلوي، التأثير المرتبط بفسفرة ناقل الدوپامين عن طريق مسار التأشير العتمد-Ca2+/calmodulin-dependent protein kinase (CAMK)، والذي يؤدي بدوره إلى إطلاق الدوپامين.[103][104][105] كما تبين أن TAAR1 يقلل من معدل إطلاق العصبونات عن طريق التنشيط المباشر لـG protein-coupled inwardly-rectifying potassium channels.[106][107][108] ويبدو أن تنشيط TAAR1 بواسطة المثامفتامين في الخلايا النجمية يعدل سلبياً التعبير الغشائي ووظيفة EAAT2، أحد أنواع ناقلات الگلوتامات.[48]
بالإضافة لناقلات أحادي الأمين في غشاء الپلازما، يمنع المثامفتامين امتصاص ويحث على تدفق الناقلات العصبية وغيرها من الركائز في الناقلات أحادية الأمين الحويصلي، VMAT1 وVMAT2.[109] في العصبونات، يحفز المثامفتامين تدفق الناقلات العصبية أحادية الأمين بواسطة VMAT2، مما يؤدي إلى تدفق أحاديات الأمين من الحويصلات التشابكية إلى العصارة الخلوية للعصبون قبل-التشابكي.[110] الناقلات الأخرى التي يُثبطها المثامفتامين هي SLC22A3 وSLC22A5.[109] SLC22A3 هو ناقل أحادي الأمين خارج الخلايا العصبية يوجد في الخلايا النجمية، وSLC22A5 هو ناقل الكارنتين شديد الألفة.[100][111]
كما يعد المثامفتامين ناهضة المستقبلات الأدرينالينية ألفا-2 ومستقبلات سيگما مع ألفة أبر للارتباط بمستقبلات سيگما-1 عن سيگما-2، ويثبط أوكسيداز أحادي الأمين أ (MAO-A) وأوكسيداز أحادي الأمين ب (MAO-B).[41][100][49] تنشيط مستقبل سيگما بواسطة المثامفتامين يعزز تأثيراته المنبهة للجهاز العصبي المركزي ويعزز السمية العصبية في المخ.[41][49] كما يُعرف المثامفتامين بقدرته على تثبيط إنزيم الكبدي CYP2D6.[98] الدكسترومثامفتامين هو منبه نفسي أكثر قوة (أقوى بحوالي عشرة أضعاف على دوپامين الجسم المخطط)، لكن لـِڤومثامفتامين يتمتع بتأثيرات محيطية أكبر، وعمر نصفي أطول، وتأثيرات ممتدة المفعول ملموسة بين المدمنين.[112][113][114] عند تناوله بجرعات عالية، قد تحفز مصاوغات المثامفتامين السلوك النمطي وذهان المثامفتانين،[113] لكن التاثيرات الديناميكية-النفسية للـِڤومثامفتامين تظل لفترات أقصر.[114]
الكشف عنه في السوائل الحيوية
غالباً ما يقاس المثامفتامين والأمفتامين في البول أو الدم كجزء من اختبار المخدرات للرياضيين، عند التقدم للوظائف، تشخيص التسمم، وفي الطب الشرعي.[115][116][117][118] قد تستخدم التقنيات اليدوانية للمساعدة في التمييز بين مصدر العقاقير لتحديد ما إذا تم الحصول عليها بطريقة غير مشروعة أو بطريقة مشروعة عن طريق وصفة طبية أو كدواء أولي.[119] يتطلب الفصل اليدواني لتقييم الدور المحتمل للـِڤومثامفتامين، وهو مادة فعالة في بعض مزيلات احتقان الأنف،[note 3] والذي قد يؤدي إلى الحصول على نتيجة إيجابية عند إجراء التحليل.[119][120][121] يمكن أن تؤدي مكملات الزنك الغذائية إلى إخفاء وجود المثامفتامين أو العقاقير الأخرى في البول.[122]
الكيمياء
المثامفتامين هو مركب يدواني من متواكبين ضوئيين، دكسترومثامفاتمين ولـِڤومثامفتامين. في درجة حرارة الغرفة، تكون القاعدة الحرة للمثامفتامين عبارة عن سائر نقي عديم اللون ذو رائحة تشبه رائحة أوراق إبرة الراعي.[10] وهو ينحل في ثنائي إيثيل الإيثر والإيثانول وكذلك يمتزج مع الكلوروفورم.[10] في المقابل، فإن أملاح كلوريد المثامفتامين تكون عديمة الرائحة وذات مذاق مر.[10] تتراوح نقطة ذبوانه بين 170-175 °س، وعند درجة حرارة الغرفة، يتواجد كبلورات بيضاء أو مسحوق بلوري أبيض اللون.[10] كما تذوب أملاح الكلوريد بحرية في الإيثانول والماء.[10]
الانحلال
ترتبط فترة التعرض للتبييض والتركيز مع تكسر المثامفتامين.[123] تبين أن المثامفتامين في التربة يعتبر ملوثاً دائماً.[124] يتحلل المثامفتامين بنسبة كبيرة في غضون 30 يوم في دراسة على العوامل الحيوية تحت التعرض للضوء في مياه الصرف الصحي.[125]
التركيب
يمكن تحضير المثامفتامين الراسيمي من الفنيل أسيتون سواء بطريقة لوكارت [126] أو بإضافة أمين اختزالي.[127] في تفاعل لوكارت، تتفاعل إحدى مكافئات الفنيل أسيتون مع مكافئين للـN-مثيل فرواليد لإنتاج أميد فورميل المثامفتامين بالإضافة لثاني أكسيد الكربون والمثيل أمين كمنتجات جانبية.[127] في هذا التفاعل، يتشكل كاتيون الإمينيوم كوسيط يتم اختزاله بواسطة المكافئ الثانوي للـ N-مثيل فورماليد.[127] بعد ذلك، يتحلل أميد الفورميل الوسيط مائياً تحت الظروف المائية الحمضية لإنتاج المثامفتامين كمنتج نهائي.[127] بدلاً من ذلك، قد يتفاعل الفنيل أسيتون مع المثيل أمين تحت ظروف اختزالية لإنتاج المثامفتامين.[127]
التاريخ، المجتمع والثقافة

اكتشف الأمفتامين قبل اكتشاف المثامفتامين، وتم تخليقه لأول مرة عام 1886 في ألمانيا بواسطة الكيميائي الألماني لازار إدليانو الذي أطلق عليه اسم فنيل أيزوپروپيلأمين phenylisopropylamine.[130][131] بعد فترة قصيرة، تم تخليق المثامفتامين من الإفدرين عام 1893 بواسطة الكيميائي الياباني ناگاي ناگايوشي.[132] بعد ثلاثة عقود، عام 1919، تم تخليق هيدروكلوريد المثامفتامين بواسطة الصيدلي أكيرا أوگوتا عن طريق اختزال الإفدرين باستخدام الفسفور الأحمر واليود.[133]
أثناء الحرب العالمية الثانية، كان المثامفتامين يباع على شكل أقراص تحت الاسم التجاري پريڤيتين Pervitin (عدم الخلط بينه وبين الپرڤتيون {{إنج1|Perviton، مرادف الفناتين)، وكان ينتج في شركة تملر للأدوية ومقرها برلين. كان يستخدم بكثرة من جميع فروع القوات المسلحة ڤرماخت للرايخ الثالث، وكان منتشراً بشكل خاص بين طياري لوفتڤافه (القوات الجوية الألمانية)، لآثار المنبهة المحسنة للآداء ولتسببه في اليقظة لفترات طويلة.[134][135] أصبح الپريڤيتين معروفاً بين القوات الألمانية باسم "أقراص- ستوكا" (Stuka-Tabletten) وأقراص-"هرمان گورينگ" (Hermann-Göring-Pillen). كانت آثاره الجانبية خطرة للغاية لدرجة أن الجيش قلص استخدامه بشكل حاد عام 1940.[136] ويقول المؤرخ لوكاز كامينسكي "عادة ما كان الجندي الذي يذهب للمعركة وهو مستخدماً للپريڤيتين يجد نفسه غير قادر على الأداء بشكل فعال لليوم أو اليومين التاليين. كان عليه أن يتعافى من الآثار الجانبية". "تحول سلوك بعض الجنود إلى العنف الشديد، وارتكبوا جرائم حرب ضد المدنيين؛ وهاجم آخرون ضباطهم".[136]
الأوبترول Obetrol، الذي حازت على براءة اختراعه شركة أوبترول للأدوية في الخمسينيات وكان مخصصاً لعلاج البدانة، كان من أول العلامات التجارية لمنتجات المثامفتامين الصيدلانية.[137] بسبب الآثار النفسية والمنبهة للمثامفتامين، أصبح الأوبترول أقراص الحمية الأكثر انتشاراً في أ مريكا في فترة الخمسينيات والستينيات.[137] وفي النهائية، بسبب خصائص الإدمان المعروفة للدواء، بدأت الحكومات في تنظيم إنتاج وتوزيع المثامفتامين بشكل مشدد.[131] على سبيل المثال، في الولايات المتحدة في أوائل السبعينيات، أصبح المثامفتامين ضمن أدوية أدوية الجدول الثاني المراقبة بموجب قانون المواد المراقبة.[138] حالياً، يباع المثامفتامين تحت الاسم التجاري دسوكسين Desoxyn المملوك لشركة الأدوية الدنماركية لوندبك.[139] اعتباراً من يناير 2013، بيعت العلامة التجارية دسوكسين لشركة الأدوية الإيطالية ريكورداتي.[140]
الوضع القانوني
يخضع إنتاج، توزيع، بيع، وحيازة المثامفتامين لقيود أو يعتبر غير قانونياً في الكثير من الولايات القضائية.[141][142] وُضع المثامفتامين في الجدول الثاني من اتفاقية الأمم المتحدة للمؤثرات العقلية.[142]
الأبحاث
اقترح، استناداً لأبحاث على الحيوانات، أن الكالسيتريول، المستقلب النشط لڤيتامين د، يمكن أن يشكل حماية قوية ضد آثار انخفاض DA- و5-HT التي تسببها الجرعات السامة من المثامفتامين.[143]
انظر أيضاً
- بريكنگ باد، مسلسل تلفزيوني يدور حول تخليق المثامفتامين بطريقة غير قانونية.
- وجوه المث، مشروع للوقاية من المخدر.
- المثامفتامين في الولايات المتحدة
- مشروع مث مونتانا، منظمة مقرها مونتانا تهدف للحد من تعاطي المثامفتامين بين المراهقين.
- معمل رولينگ مث، معمل متنقل يستخدم لإنتاج المثامفتامين بطريقة غير قانونية.
- يا با، أقراص من جنوب شرق آسيا تحتوي على مزيد من المثامفتامين والكافيين.
الهوامش
- ^ Synonyms and alternate spellings include: N-methylamphetamine, desoxyephedrine, Syndrox, Methedrine, and Desoxyn.[11][12][13] Common slang terms for methamphetamine include: speed, meth, crystal, crystal meth, glass, shards, ice, and tic[14] and, in New Zealand, "P".[15]
- ^ Enantiomers are molecules that are mirror images of one another; they are structurally identical, but of the opposite orientation.
Levomethamphetamine and dextromethamphetamine are also known as L-methamphetamine, (R)-methamphetamine, or levmetamfetamine (International Nonproprietary Name [INN]) and D-methamphetamine, (S)-methamphetamine, or metamfetamine (INN), respectively.[11][17] - ^ أ ب ت The active ingredient in some OTC inhalers in the United States is listed as levmetamfetamine, the INN and USAN of levomethamphetamine.[18][19]
- ^ Transcription factors are proteins that increase or decrease the expression of specific genes.[73]
- ^ In simpler terms, this necessary and sufficient relationship means that ΔFosB overexpression in the nucleus accumbens and addiction-related behavioral and neural adaptations always occur together and never occur alone.
- ^ The associated research only involved amphetamine, not methamphetamine; however, this statement is included here due to the similarity between the pharmacodynamics and aphrodisiac effects of amphetamine and methamphetamine.
- ^ NMDA receptors are voltage-dependent ligand-gated ion channels that requires simultaneous binding of glutamate and a co-agonist (D-serine or glycine) to open the ion channel.[92]
- Image legend
- ^ (Text color) Transcription factors
هوامش المصادر
المصادر
- ^ أ ب Rau T, Ziemniak J, Poulsen D (2015). "The neuroprotective potential of low-dose methamphetamine in preclinical models of stroke and traumatic brain injury". Prog. Neuropsychopharmacol. Biol. Psychiatry. 64: 231–6. doi:10.1016/j.pnpbp.2015.02.013. PMID 25724762.
In humans, the oral bioavailability of methamphetamine is approximately 70% but increases to 100% following intravenous (IV) delivery (Ares-Santos et al., 2013).
- ^ "Toxicity". Methamphetamine. National Center for Biotechnology Information.
{{cite encyclopedia}}:|work=ignored (help) - ^ أ ب Riviello, Ralph J. (2010). Manual of forensic emergency medicine : a guide for clinicians. Sudbury, Mass.: Jones and Bartlett Publishers. p. 41. ISBN 978-0-7637-4462-5.
- ^ أ ب ت ث ج ح خ د ذ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةSchep - ^ Sellers EM, Tyndale RF (2000). "Mimicking gene defects to treat drug dependence". Ann. N. Y. Acad. Sci. 909 (1): 233–246. Bibcode:2000NYASA.909..233S. doi:10.1111/j.1749-6632.2000.tb06685.x. PMID 10911933.
Methamphetamine, a central nervous system stimulant drug, is p-hydroxylated by CYP2D6 to less active p-OH-methamphetamine.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFDA Pharmacokinetics - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFMO - ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةFMO3-Primary - ^ "Properties: Predicted – EP|Suite". Methmphetamine.
{{cite encyclopedia}}:|work=ignored (help) - ^ أ ب ت ث ج ح "Chemical and Physical Properties". Methamphetamine. National Center for Biotechnology Information.
{{cite encyclopedia}}:|work=ignored (help) - ^ أ ب "Methamphetamine". Drug profiles. European Monitoring Centre for Drugs and Drug Addiction (EMCDDA). 8 January 2015. Retrieved 27 November 2018.
The term metamfetamine (the International Non-Proprietary Name: INN) strictly relates to the specific enantiomer (S)-N,α-dimethylbenzeneethanamine.
- ^ "Identification". Methamphetamine. University of Alberta. 8 February 2013.
{{cite encyclopedia}}:|work=ignored (help) - ^ "Methedrine (methamphetamine hydrochloride): Uses, Symptoms, Signs and Addiction Treatment". Addictionlibrary.org. Retrieved 16 January 2016.
- ^ "Meth Slang Names". MethhelpOnline. Retrieved 1 January 2014.
- ^ "Methamphetamine and the law".
- ^ Yu S, Zhu L, Shen Q, Bai X, Di X (March 2015). "Recent advances in methamphetamine neurotoxicity mechanisms and its molecular pathophysiology". Behav. Neurol. 2015: 1–11. doi:10.1155/2015/103969. PMC 4377385. PMID 25861156.
In 1971, METH was restricted by US law, although oral METH (Ovation Pharmaceuticals) continues to be used today in the USA as a second-line treatment for a number of medical conditions, including attention deficit hyperactivity disorder (ADHD) and refractory obesity [3].
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Levomethamphetamine. National Center for Biotechnology Information. Retrieved 27 November 2018.
{{cite encyclopedia}}:|work=ignored (help) - ^ "Part 341 – cold, cough, allergy, bronchodilator, and antiasthmatic drug products for over-the-counter human use". Code of Federal Regulations Title 21: Subchapter D – Drugs for human use. April 2015.
Topical nasal decongestants --(i) For products containing levmetamfetamine identified in 341.20(b)(1) when used in an inhalant dosage form. The product delivers in each 800 milliliters of air 0.04 to 0.150 milligrams of levmetamfetamine.
{{cite encyclopedia}}:|website=ignored (help) - ^ "Identification". Levomethamphetamine. National Center for Biotechnology Information.
{{cite encyclopedia}}:|work=ignored (help) - ^ أ ب ت ث ج ح خ San Francisco Meth Zombies (TV documentary). National Geographic Channel. August 2013. ASIN B00EHAOBAO.
- ^ أ ب ت Malenka RC, Nestler EJ, Hyman SE (2009). "15". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 370. ISBN 978-0-07-148127-4.
Unlike cocaine and amphetamine, methamphetamine is directly toxic to midbrain dopamine neurons.
- ^ أ ب Yu S, Zhu L, Shen Q, Bai X, Di X (2015). "Recent advances in methamphetamine neurotoxicity mechanisms and its molecular pathophysiology". Behav Neurol. 2015: 1–11. doi:10.1155/2015/103969. PMC 4377385. PMID 25861156.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ أ ب ت ث ج ح خ د Krasnova IN, Cadet JL (May 2009). "Methamphetamine toxicity and messengers of death". Brain Res. Rev. 60 (2): 379–407. doi:10.1016/j.brainresrev.2009.03.002. PMC 2731235. PMID 19328213.
Neuroimaging studies have revealed that METH can indeed cause neurodegenerative changes in the brains of human addicts (Aron and Paulus, 2007; Chang et al., 2007). These abnormalities include persistent decreases in the levels of dopamine transporters (DAT) in the orbitofrontal cortex, dorsolateral prefrontal cortex, and the caudate-putamen (McCann et al., 1998, 2008; Sekine et al., 2003; Volkow et al., 2001a, 2001c). The density of serotonin transporters (5-HTT) is also decreased in the midbrain, caudate, putamen, hypothalamus, thalamus, the orbitofrontal, temporal, and cingulate cortices of METH-dependent individuals (Sekine et al., 2006) ...
Neuropsychological studies have detected deficits in attention, working memory, and decision-making in chronic METH addicts ...
There is compelling evidence that the negative neuropsychiatric consequences of METH abuse are due, at least in part, to drug-induced neuropathological changes in the brains of these METH-exposed individuals ...
Structural magnetic resonance imaging (MRI) studies in METH addicts have revealed substantial morphological changes in their brains. These include loss of gray matter in the cingulate, limbic and paralimbic cortices, significant shrinkage of hippocampi, and hypertrophy of white matter (Thompson et al., 2004). In addition, the brains of METH abusers show evidence of hyperintensities in white matter (Bae et al., 2006; Ernst et al., 2000), decreases in the neuronal marker, N-acetylaspartate (Ernst et al., 2000; Sung et al., 2007), reductions in a marker of metabolic integrity, creatine (Sekine et al., 2002) and increases in a marker of glial activation, myoinositol (Chang et al., 2002; Ernst et al., 2000; Sung et al., 2007; Yen et al., 1994). Elevated choline levels, which are indicative of increased cellular membrane synthesis and turnover are also evident in the frontal gray matter of METH abusers (Ernst et al., 2000; Salo et al., 2007; Taylor et al., 2007). - ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع غ ف ق ك "Desoxyn Prescribing Information" (PDF). United States Food and Drug Administration. December 2013. Retrieved 6 January 2014.
- ^ Hart CL, Marvin CB, Silver R, Smith EE (February 2012). "Is cognitive functioning impaired in methamphetamine users? A critical review". Neuropsychopharmacology. 37 (3): 586–608. doi:10.1038/npp.2011.276. PMC 3260986. PMID 22089317.
- ^ Mitler MM, Hajdukovic R, Erman MK (1993). "Treatment of narcolepsy with methamphetamine". Sleep. 16 (4): 306–317. PMC 2267865. PMID 8341891.
- ^ Morgenthaler TI, Kapur VK, Brown T, Swick TJ, Alessi C, Aurora RN, Boehlecke B, Chesson AL Jr, Friedman L, Maganti R, Owens J, Pancer J, Zak R, Standards of Practice Committee of the American Academy of Sleep Medicine (2007). "Practice parameters for the treatment of narcolepsy and other hypersomnias of central origin". Sleep. 30 (12): 1705–11. PMC 2276123. PMID 18246980.
- ^ Nelson, Lewis S.; Lewin, Neal A.; Howland, Mary Ann; Hoffman, Robert S.; Goldfrank, Lewis R.; Flomenbaum, Neal E. (2011). Goldfrank's toxicologic emergencies (9th ed.). New York: McGraw-Hill Medical. p. 1080. ISBN 978-0-07-160593-9.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ أ ب ت ث Westfall DP, Westfall TC (2010). "Miscellaneous Sympathomimetic Agonists". In Brunton LL, Chabner BA, Knollmann BC (eds.). Goodman & Gilman's Pharmacological Basis of Therapeutics (12th ed.). New York: McGraw-Hill. ISBN 978-0-07-162442-8.
{{cite book}}: External link in|sectionurl=|sectionurl=ignored (|section-url=suggested) (help) - ^ أ ب ت Hussain F, Frare RW, Py Berrios KL (2012). "Drug abuse identification and pain management in dental patients: a case study and literature review". Gen. Dent. 60 (4): 334–345. PMID 22782046.
- ^ "Methamphetamine Use (Meth Mouth)". American Dental Association. Archived from the original on June 2008. Retrieved 15 December 2006.
{{cite web}}: Check date values in:|archivedate=(help) - ^ Hart CL, Marvin CB, Silver R, Smith EE (February 2012). "Is cognitive functioning impaired in methamphetamine users? A critical review". Neuropsychopharmacology. 37 (3): 586–608. doi:10.1038/npp.2011.276. PMC 3260986. PMID 22089317.
- ^ أ ب Halkitis PN, Pandey Mukherjee P, Palamar JJ (2008). "Longitudinal Modeling of Methamphetamine Use and Sexual Risk Behaviors in Gay and Bisexual Men". AIDS and Behavior. 13 (4): 783–791. doi:10.1007/s10461-008-9432-y. PMC 4669892. PMID 18661225.
- ^ أ ب Patrick Moore (June 2005). "We Are Not OK". VillageVoice. Retrieved 15 January 2011.
- ^ أ ب "Methamphetamine Use and Health | UNSW: The University of New South Wales – Faculty of Medicine" (PDF). Archived from the original (PDF) on 16 August 2008. Retrieved 15 January 2011.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب O'Connor PG (February 2012). "Amphetamines". Merck Manual for Health Care Professionals. Merck. Retrieved 8 May 2012.
- ^ Rusinyak, Daniel E. (2011). "Neurologic manifestations of chronic methamphetamine abuse". Neurologic Clinics. 29 (3): 641–655. doi:10.1016/j.ncl.2011.05.004. PMC 3148451. PMID 21803215.
- ^ Darke S, Kaye S, McKetin R, Duflou J (May 2008). "Major physical and psychological harms of methamphetamine use". Drug Alcohol Rev. 27 (3): 253–262. doi:10.1080/09595230801923702. PMID 18368606.
- ^ أ ب Beardsley PM, Hauser KF (2014). Glial modulators as potential treatments of psychostimulant abuse. Advances in Pharmacology. Vol. 69. pp. 1–69. doi:10.1016/B978-0-12-420118-7.00001-9. ISBN 9780124201187. PMC 4103010. PMID 24484974.
Glia (including astrocytes, microglia, and oligodendrocytes), which constitute the majority of cells in the brain, have many of the same receptors as neurons, secrete neurotransmitters and neurotrophic and neuroinflammatory factors, control clearance of neurotransmitters from synaptic clefts, and are intimately involved in synaptic plasticity. Despite their prevalence and spectrum of functions, appreciation of their potential general importance has been elusive since their identification in the mid-1800s, and only relatively recently have they been gaining their due respect. This development of appreciation has been nurtured by the growing awareness that drugs of abuse, including the psychostimulants, affect glial activity, and glial activity, in turn, has been found to modulate the effects of the psychostimulants
{{cite book}}:|journal=ignored (help) - ^ Loftis JM, Janowsky A (2014). Neuroimmune basis of methamphetamine toxicity. International Review of Neurobiology. Vol. 118. pp. 165–197. doi:10.1016/B978-0-12-801284-0.00007-5. ISBN 9780128012840. PMC 4418472. PMID 25175865.
Collectively, these pathological processes contribute to neurotoxicity (e.g., increased BBB permeability, inflammation, neuronal degeneration, cell death) and neuropsychiatric impairments (e.g., cognitive deficits, mood disorders)
{{cite book}}:|journal=ignored (help)
"Figure 7.1: Neuroimmune mechanisms of methamphetamine-induced CNS toxicity" - ^ أ ب ت ث ج Kaushal N, Matsumoto RR (March 2011). "Role of sigma receptors in methamphetamine-induced neurotoxicity". Curr Neuropharmacol. 9 (1): 54–57. doi:10.2174/157015911795016930. PMC 3137201. PMID 21886562.
σ Receptors seem to play an important role in many of the effects of METH. They are present in the organs that mediate the actions of METH (e.g. brain, heart, lungs) [5]. In the brain, METH acts primarily on the dopaminergic system to cause acute locomotor stimulant, subchronic sensitized, and neurotoxic effects. σ Receptors are present on dopaminergic neurons and their activation stimulates dopamine synthesis and release [11–13]. σ-2 Receptors modulate DAT and the release of dopamine via protein kinase C (PKC) and Ca2+-calmodulin systems [14].
σ-1 Receptor antisense and antagonists have been shown to block the acute locomotor stimulant effects of METH [4]. Repeated administration or self administration of METH has been shown to upregulate σ-1 receptor protein and mRNA in various brain regions including the substantia nigra, frontal cortex, cerebellum, midbrain, and hippocampus [15, 16]. Additionally, σ receptor antagonists ... prevent the development of behavioral sensitization to METH [17, 18]. ...
σ Receptor agonists have been shown to facilitate dopamine release, through both σ-1 and σ-2 receptors [11–14]. - ^ Carvalho M, Carmo H, Costa VM, Capela JP, Pontes H, Remião F, Carvalho F, Bastos Mde L (August 2012). "Toxicity of amphetamines: an update". Arch. Toxicol. 86 (8): 1167–1231. doi:10.1007/s00204-012-0815-5. PMID 22392347.
- ^ أ ب Cruickshank CC, Dyer KR (July 2009). "A review of the clinical pharmacology of methamphetamine". Addiction. 104 (7): 1085–1099. doi:10.1111/j.1360-0443.2009.02564.x. PMID 19426289.
- ^ Thrash B, Thiruchelvan K, Ahuja M, Suppiramaniam V, Dhanasekaran M (2009). "Methamphetamine-induced neurotoxicity: the road to Parkinson's disease" (PDF). Pharmacol Rep. 61 (6): 966–977. doi:10.1016/s1734-1140(09)70158-6. PMID 20081231.
- ^ Sulzer D, Zecca L (February 2000). "Intraneuronal dopamine-quinone synthesis: a review". Neurotox. Res. 1 (3): 181–195. doi:10.1007/BF03033289. PMID 12835101.
- ^ Miyazaki I, Asanuma M (June 2008). "Dopaminergic neuron-specific oxidative stress caused by dopamine itself". Acta Med. Okayama. 62 (3): 141–150. doi:10.18926/AMO/30942. PMID 18596830.
- ^ Yuan J, Hatzidimitriou G, Suthar P, Mueller M, McCann U, Ricaurte G (March 2006). "Relationship between temperature, dopaminergic neurotoxicity, and plasma drug concentrations in methamphetamine-treated squirrel monkeys". The Journal of Pharmacology and Experimental Therapeutics. 316 (3): 1210–1218. doi:10.1124/jpet.105.096503. PMID 16293712.
- ^ أ ب ت • Cisneros IE, Ghorpade A (October 2014). "Methamphetamine and HIV-1-induced neurotoxicity: role of trace amine associated receptor 1 cAMP signaling in astrocytes". Neuropharmacology. 85: 499–507. doi:10.1016/j.neuropharm.2014.06.011. PMC 4315503. PMID 24950453.
TAAR1 overexpression significantly decreased EAAT-2 levels and glutamate clearance ... METH treatment activated TAAR1 leading to intracellular cAMP in human astrocytes and modulated glutamate clearance abilities. Furthermore, molecular alterations in astrocyte TAAR1 levels correspond to changes in astrocyte EAAT-2 levels and function.
• Jing L, Li JX (August 2015). "Trace amine-associated receptor 1: A promising target for the treatment of psychostimulant addiction". Eur. J. Pharmacol. 761: 345–352. doi:10.1016/j.ejphar.2015.06.019. PMC 4532615. PMID 26092759.TAAR1 is largely located in the intracellular compartments both in neurons (Miller, 2011), in glial cells (Cisneros and Ghorpade, 2014) and in peripheral tissues (Grandy, 2007)
- ^ أ ب ت ث Rodvelt KR, Miller DK (September 2010). "Could sigma receptor ligands be a treatment for methamphetamine addiction?". Curr Drug Abuse Rev. 3 (3): 156–162. doi:10.2174/1874473711003030156. PMID 21054260.
- ^ Yu S, Zhu L, Shen Q, Bai X, Di X (2015). "Recent advances in methamphetamine neurotoxicity mechanisms and its molecular pathophysiology". Behavioural Neurology. 2015: 1–11. doi:10.1155/2015/103969. PMC 4377385. PMID 25861156.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Albertson TE (2011). "Amphetamines". In Olson KR, Anderson IB, Benowitz NL, Blanc PD, Kearney TE, Kim-Katz SY, Wu AH (eds.). Poisoning & Drug Overdose (6th ed.). New York: McGraw-Hill Medical. pp. 77–79. ISBN 978-0-07-166833-0.
- ^ Oskie SM, Rhee JW (11 February 2011). "Amphetamine Poisoning". Emergency Central. Unbound Medicine. Retrieved 11 June 2013.
- ^ Isbister GK, Buckley NA, Whyte IM (September 2007). "Serotonin toxicity: a practical approach to diagnosis and treatment" (PDF). Med. J. Aust. 187 (6): 361–365. PMID 17874986.
- ^ أ ب ت Shoptaw SJ, Kao U, Ling W (2009). Shoptaw SJ, Ali R (eds.). "Treatment for amphetamine psychosis". Cochrane Database Syst. Rev. (1): CD003026. doi:10.1002/14651858.CD003026.pub3. PMID 19160215.
A minority of individuals who use amphetamines develop full-blown psychosis requiring care at emergency departments or psychiatric hospitals. In such cases, symptoms of amphetamine psychosis commonly include paranoid and persecutory delusions as well as auditory and visual hallucinations in the presence of extreme agitation. More common (about 18%) is for frequent amphetamine users to report psychotic symptoms that are sub-clinical and that do not require high-intensity intervention ...
About 5–15% of the users who develop an amphetamine psychosis fail to recover completely (Hofmann 1983) ...
Findings from one trial indicate use of antipsychotic medications effectively resolves symptoms of acute amphetamine psychosis. - ^ Hofmann FG (1983). A Handbook on Drug and Alcohol Abuse: The Biomedical Aspects (2nd ed.). New York: Oxford University Press. p. 329. ISBN 978-0-19-503057-0.
- ^ Berman SM, Kuczenski R, McCracken JT, London ED (February 2009). "Potential adverse effects of amphetamine treatment on brain and behavior: a review". Mol. Psychiatry. 14 (2): 123–142. doi:10.1038/mp.2008.90. PMC 2670101. PMID 18698321.
- ^ أ ب ت Richards JR, Albertson TE, Derlet RW, Lange RA, Olson KR, Horowitz BZ (May 2015). "Treatment of toxicity from amphetamines, related derivatives, and analogues: a systematic clinical review". Drug Alcohol Depend. 150: 1–13. doi:10.1016/j.drugalcdep.2015.01.040. PMID 25724076.
- ^ Richards JR, Derlet RW, Duncan DR (September 1997). "Methamphetamine toxicity: treatment with a benzodiazepine versus a butyrophenone". Eur. J. Emerg. Med. 4 (3): 130–135. doi:10.1097/00063110-199709000-00003. PMID 9426992.
- ^ Richards JR, Derlet RW, Albertson TE. "Treatment & Management". Methamphetamine Toxicity. WebMD. Retrieved 20 April 2016.
{{cite encyclopedia}}:|website=ignored (help) - ^
{{cite book}}: Empty citation (help) - ^ أ ب ت ث Nestler EJ (December 2013). "Cellular basis of memory for addiction". Dialogues Clin. Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410.
Despite the importance of numerous psychosocial factors, at its core, drug addiction involves a biological process: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type [nucleus accumbens] neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement ... Another ΔFosB target is cFos: as ΔFosB accumulates with repeated drug exposure it represses c-Fos and contributes to the molecular switch whereby ΔFosB is selectively induced in the chronic drug-treated state.41. ... Moreover, there is increasing evidence that, despite a range of genetic risks for addiction across the population, exposure to sufficiently high doses of a drug for long periods of time can transform someone who has relatively lower genetic loading into an addict.
- ^ "Glossary of Terms". Mount Sinai School of Medicine. Department of Neuroscience. Retrieved 9 February 2015.
- ^ Volkow ND, Koob GF, McLellan AT (January 2016). "Neurobiologic Advances from the Brain Disease Model of Addiction". N. Engl. J. Med. 374 (4): 363–371. doi:10.1056/NEJMra1511480. PMID 26816013.
Substance-use disorder: A diagnostic term in the fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5) referring to recurrent use of alcohol or other drugs that causes clinically and functionally significant impairment, such as health problems, disability, and failure to meet major responsibilities at work, school, or home. Depending on the level of severity, this disorder is classified as mild, moderate, or severe.
Addiction: A term used to indicate the most severe, chronic stage of substance-use disorder, in which there is a substantial loss of self-control, as indicated by compulsive drug taking despite the desire to stop taking the drug. In the DSM-5, the term addiction is synonymous with the classification of severe substance-use disorder. - ^ أ ب ت Renthal W, Nestler EJ (September 2009). "Chromatin regulation in drug addiction and depression". Dialogues Clin. Neurosci. 11 (3): 257–268. PMC 2834246. PMID 19877494.
[Psychostimulants] increase cAMP levels in striatum, which activates protein kinase A (PKA) and leads to phosphorylation of its targets. This includes the cAMP response element binding protein (CREB), the phosphorylation of which induces its association with the histone acetyltransferase, CREB binding protein (CBP) to acetylate histones and facilitate gene activation. This is known to occur on many genes including fosB and c-fos in response to psychostimulant exposure. ΔFosB is also upregulated by chronic psychostimulant treatments, and is known to activate certain genes (eg, cdk5) and repress others (eg, c-fos) where it recruits HDAC1 as a corepressor. ... Chronic exposure to psychostimulants increases glutamatergic [signaling] from the prefrontal cortex to the NAc. Glutamatergic signaling elevates Ca2+ levels in NAc postsynaptic elements where it activates CaMK (calcium/calmodulin protein kinases) signaling, which, in addition to phosphorylating CREB, also phosphorylates HDAC5.
Figure 2: Psychostimulant-induced signaling events - ^ Broussard JI (January 2012). "Co-transmission of dopamine and glutamate". J. Gen. Physiol. 139 (1): 93–96. doi:10.1085/jgp.201110659. PMC 3250102. PMID 22200950.
Coincident and convergent input often induces plasticity on a postsynaptic neuron. The NAc integrates processed information about the environment from basolateral amygdala, hippocampus, and prefrontal cortex (PFC), as well as projections from midbrain dopamine neurons. Previous studies have demonstrated how dopamine modulates this integrative process. For example, high frequency stimulation potentiates hippocampal inputs to the NAc while simultaneously depressing PFC synapses (Goto and Grace, 2005). The converse was also shown to be true; stimulation at PFC potentiates PFC–NAc synapses but depresses hippocampal–NAc synapses. In light of the new functional evidence of midbrain dopamine/glutamate co-transmission (references above), new experiments of NAc function will have to test whether midbrain glutamatergic inputs bias or filter either limbic or cortical inputs to guide goal-directed behavior.
- ^ أ ب Kanehisa Laboratories (10 October 2014). "Amphetamine – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
Most addictive drugs increase extracellular concentrations of dopamine (DA) in nucleus accumbens (NAc) and medial prefrontal cortex (mPFC), projection areas of mesocorticolimbic DA neurons and key components of the "brain reward circuit". Amphetamine achieves this elevation in extracellular levels of DA by promoting efflux from synaptic terminals. ... Chronic exposure to amphetamine induces a unique transcription factor delta FosB, which plays an essential role in long-term adaptive changes in the brain.
- ^ أ ب Cadet JL, Brannock C, Jayanthi S, Krasnova IN (2015). "Transcriptional and epigenetic substrates of methamphetamine addiction and withdrawal: evidence from a long-access self-administration model in the rat". Mol. Neurobiol. 51 (2): 696–717. doi:10.1007/s12035-014-8776-8. PMC 4359351. PMID 24939695.
Figure 1
{{cite journal}}: External link in|quote= - ^ أ ب ت Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB serves as one of the master control proteins governing this structural plasticity. ... ΔFosB also represses G9a expression, leading to reduced repressive histone methylation at the cdk5 gene. The net result is gene activation and increased CDK5 expression. ... In contrast, ΔFosB binds to the c-fos gene and recruits several co-repressors, including HDAC1 (histone deacetylase 1) and SIRT 1 (sirtuin 1). ... The net result is c-fos gene repression.
Figure 4: Epigenetic basis of drug regulation of gene expression - ^ أ ب ت Nestler EJ (December 2012). "Transcriptional mechanisms of drug addiction". Clin. Psychopharmacol. Neurosci. 10 (3): 136–143. doi:10.9758/cpn.2012.10.3.136. PMC 3569166. PMID 23430970.
The 35-37 kD ΔFosB isoforms accumulate with chronic drug exposure due to their extraordinarily long half-lives. ... As a result of its stability, the ΔFosB protein persists in neurons for at least several weeks after cessation of drug exposure. ... ΔFosB overexpression in nucleus accumbens induces NFκB ... In contrast, the ability of ΔFosB to repress the c-Fos gene occurs in concert with the recruitment of a histone deacetylase and presumably several other repressive proteins such as a repressive histone methyltransferase
- ^ Nestler EJ (October 2008). "Review. Transcriptional mechanisms of addiction: role of DeltaFosB". Philos. Trans. R. Soc. Lond., B, Biol. Sci. 363 (1507): 3245–3255. doi:10.1098/rstb.2008.0067. PMC 2607320. PMID 18640924.
Recent evidence has shown that ΔFosB also represses the c-fos gene that helps create the molecular switch—from the induction of several short-lived Fos family proteins after acute drug exposure to the predominant accumulation of ΔFosB after chronic drug exposure
- ^ Hyman SE, Malenka RC, Nestler EJ (July 2006). "Neural mechanisms of addiction: the role of reward-related learning and memory". Annu. Rev. Neurosci. 29: 565–598. doi:10.1146/annurev.neuro.29.051605.113009. PMID 16776597.
- ^ أ ب ت ث ج ح خ د Robison AJ, Nestler EJ (November 2011). "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11): 623–637. doi:10.1038/nrn3111. PMC 3272277. PMID 21989194.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 4: Signal Transduction in the Brain". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 94. ISBN 978-0-07-148127-4.
- ^ أ ب ت Ruffle JK (November 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". Am. J. Drug Alcohol Abuse. 40 (6): 428–437. doi:10.3109/00952990.2014.933840. PMID 25083822.
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص ض ط ظ ع Olsen CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Similar to environmental enrichment, studies have found that exercise reduces self-administration and relapse to drugs of abuse (Cosgrove et al., 2002; Zlebnik et al., 2010). There is also some evidence that these preclinical findings translate to human populations, as exercise reduces withdrawal symptoms and relapse in abstinent smokers (Daniel et al., 2006; Prochaska et al., 2008), and one drug recovery program has seen success in participants that train for and compete in a marathon as part of the program (Butler, 2005). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al., 2006; Aiken, 2007; Lader, 2008).
- ^ Kanehisa Laboratories (29 October 2014). "Alcoholism – Homo sapiens (human)". KEGG Pathway. Retrieved 31 October 2014.
- ^ Kim Y, Teylan MA, Baron M, Sands A, Nairn AC, Greengard P (February 2009). "Methylphenidate-induced dendritic spine formation and DeltaFosB expression in nucleus accumbens". Proc. Natl. Acad. Sci. U.S.A. 106 (8): 2915–2920. Bibcode:2009PNAS..106.2915K. doi:10.1073/pnas.0813179106. PMC 2650365. PMID 19202072.
- ^ Nestler EJ (January 2014). "Epigenetic mechanisms of drug addiction". Neuropharmacology. 76 Pt B: 259–268. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
- ^ أ ب {{{author}}}, Sex, drugs, and rock 'n' roll: hypothesizing common mesolimbic activation as a function of reward gene polymorphisms, [[{{{publisher}}}]], March 2012.
- ^ أ ب Pitchers KK, Vialou V, Nestler EJ, Laviolette SR, Lehman MN, Coolen LM (February 2013). "Natural and drug rewards act on common neural plasticity mechanisms with ΔFosB as a key mediator". J. Neurosci. 33 (8): 3434–3442. doi:10.1523/JNEUROSCI.4881-12.2013. PMC 3865508. PMID 23426671.
Drugs of abuse induce neuroplasticity in the natural reward pathway, specifically the nucleus accumbens (NAc), thereby causing development and expression of addictive behavior. ... Together, these findings demonstrate that drugs of abuse and natural reward behaviors act on common molecular and cellular mechanisms of plasticity that control vulnerability to drug addiction, and that this increased vulnerability is mediated by ΔFosB and its downstream transcriptional targets. ... Sexual behavior is highly rewarding (Tenk et al., 2009), and sexual experience causes sensitized drug-related behaviors, including cross-sensitization to amphetamine (Amph)-induced locomotor activity (Bradley and Meisel, 2001; Pitchers et al., 2010a) and enhanced Amph reward (Pitchers et al., 2010a). Moreover, sexual experience induces neural plasticity in the NAc similar to that induced by psychostimulant exposure, including increased dendritic spine density (Meisel and Mullins, 2006; Pitchers et al., 2010a), altered glutamate receptor trafficking, and decreased synaptic strength in prefrontal cortex-responding NAc shell neurons (Pitchers et al., 2012). Finally, periods of abstinence from sexual experience were found to be critical for enhanced Amph reward, NAc spinogenesis (Pitchers et al., 2010a), and glutamate receptor trafficking (Pitchers et al., 2012). These findings suggest that natural and drug reward experiences share common mechanisms of neural plasticity
- ^ Brecht ML, Herbeck D (June 2014). "Time to relapse following treatment for methamphetamine use: a long-term perspective on patterns and predictors". Drug Alcohol Depend. 139: 18–25. doi:10.1016/j.drugalcdep.2014.02.702. PMC 4550209. PMID 24685563.
- ^ Brecht ML, Lovinger K, Herbeck DM, Urada D (2013). "Patterns of treatment utilization and methamphetamine use during first 10 years after methamphetamine initiation". J Subst Abuse Treat. 44 (5): 548–56. doi:10.1016/j.jsat.2012.12.006. PMC 3602162. PMID 23313146.
- ^ Nestler EJ (January 2014). "Epigenetic mechanisms of drug addiction". Neuropharmacology. 76 Pt B: 259–68. doi:10.1016/j.neuropharm.2013.04.004. PMC 3766384. PMID 23643695.
- ^ أ ب ت Godino A, Jayanthi S, Cadet JL (2015). "Epigenetic landscape of amphetamine and methamphetamine addiction in rodents". Epigenetics. 10 (7): 574–80. doi:10.1080/15592294.2015.1055441. PMC 4622560. PMID 26023847.
- ^ Cruz FC, Javier Rubio F, Hope BT (December 2015). "Using c-fos to study neuronal ensembles in corticostriatal circuitry of addiction". Brain Res. 1628 (Pt A): 157–73. doi:10.1016/j.brainres.2014.11.005. PMC 4427550. PMID 25446457.
- ^ Jayanthi S, McCoy MT, Chen B, Britt JP, Kourrich S, Yau HJ, Ladenheim B, Krasnova IN, Bonci A, Cadet JL (July 2014). "Methamphetamine downregulates striatal glutamate receptors via diverse epigenetic mechanisms". Biol. Psychiatry. 76 (1): 47–56. doi:10.1016/j.biopsych.2013.09.034. PMC 3989474. PMID 24239129.
- ^ Kenny PJ, Markou A (May 2004). "The ups and downs of addiction: role of metabotropic glutamate receptors". Trends Pharmacol. Sci. 25 (5): 265–72. doi:10.1016/j.tips.2004.03.009. PMID 15120493.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 15: Reinforcement and Addictive Disorders". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. p. 386. ISBN 978-0-07-148127-4.
Currently, cognitive–behavioral therapies are the most successful treatment available for preventing the relapse of psychostimulant use.
- ^ Stoops WW, Rush CR (May 2014). "Combination pharmacotherapies for stimulant use disorder: a review of clinical findings and recommendations for future research". Expert Rev Clin Pharmacol. 7 (3): 363–374. doi:10.1586/17512433.2014.909283. PMC 4017926. PMID 24716825.
Despite concerted efforts to identify a pharmacotherapy for managing stimulant use disorders, no widely effective medications have been approved.
- ^ Perez-Mana C, Castells X, Torrens M, Capella D, Farre M (September 2013). "Efficacy of psychostimulant drugs for amphetamine abuse or dependence". Cochrane Database Syst. Rev. 9 (9): CD009695. doi:10.1002/14651858.CD009695.pub2. PMID 23996457.
To date, no pharmacological treatment has been approved for [addiction], and psychotherapy remains the mainstay of treatment. ... Results of this review do not support the use of psychostimulant medications at the tested doses as a replacement therapy
- ^ Forray A, Sofuoglu M (February 2014). "Future pharmacological treatments for substance use disorders". Br. J. Clin. Pharmacol. 77 (2): 382–400. doi:10.1111/j.1365-2125.2012.04474.x. PMC 4014020. PMID 23039267.
- ^ أ ب Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 5: Excitatory and Inhibitory Amino Acids". In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York, USA: McGraw-Hill Medical. pp. 124–125. ISBN 978-0-07-148127-4.
At membrane potentials more negative than approximately −50 mV, the Mg2+ in the extracellular fluid of the brain virtually abolishes ion flux through NMDA receptor channels, even in the presence of glutamate. ... The NMDA receptor is unique among all neurotransmitter receptors in that its activation requires the simultaneous binding of two different agonists. In addition to the binding of glutamate at the conventional agonist-binding site, the binding of glycine appears to be required for receptor activation. Because neither of these agonists alone can open this ion channel, glutamate and glycine are referred to as coagonists of the NMDA receptor. The physiologic significance of the glycine binding site is unclear because the normal extracellular concentration of glycine is believed to be saturating. However, recent evidence suggests that D-serine may be the endogenous agonist for this site.
- ^ Nechifor M (March 2008). "Magnesium in drug dependences". Magnes. Res. 21 (1): 5–15. PMID 18557129.
- ^ O'Connor, Patrick. "Amphetamines: Drug Use and Abuse". Merck Manual Home Health Handbook. Merck. Retrieved 26 September 2013.
- ^ Pérez-Mañá C, Castells X, Torrens M, Capellà D, Farre M (2013). Pérez-Mañá, Clara (ed.). "Efficacy of psychostimulant drugs for amphetamine abuse or dependence". Cochrane Database Syst. Rev. 9: CD009695. doi:10.1002/14651858.CD009695.pub2. PMID 23996457.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب ت ث Shoptaw SJ, Kao U, Heinzerling K, Ling W (2009). Shoptaw SJ (ed.). "Treatment for amphetamine withdrawal". Cochrane Database Syst. Rev. (2): CD003021. doi:10.1002/14651858.CD003021.pub2. PMID 19370579.
The prevalence of this withdrawal syndrome is extremely common (Cantwell 1998; Gossop 1982) with 87.6% of 647 individuals with amphetamine dependence reporting six or more signs of amphetamine withdrawal listed in the DSM when the drug is not available (Schuckit 1999) ... Withdrawal symptoms typically present within 24 hours of the last use of amphetamine, with a withdrawal syndrome involving two general phases that can last 3 weeks or more. The first phase of this syndrome is the initial "crash" that resolves within about a week (Gossop 1982;McGregor 2005)
- ^ أ ب ت ث Winslow BT, Voorhees KI, Pehl KA (2007). "Methamphetamine abuse". American Family Physician. 76 (8): 1169–1174. PMID 17990840.
- ^ أ ب "Enzymes". Methamphetamine. University of Alberta. 8 February 2013.
{{cite encyclopedia}}:|work=ignored (help) - ^ أ ب ت Miller GM (January 2011). "The emerging role of trace amine-associated receptor 1 in the functional regulation of monoamine transporters and dopaminergic activity". J. Neurochem. 116 (2): 164–176. doi:10.1111/j.1471-4159.2010.07109.x. PMC 3005101. PMID 21073468.
- ^ أ ب ت "Targets". Methamphetamine. University of Alberta. 8 February 2013.
{{cite encyclopedia}}:|work=ignored (help) - ^ Borowsky B, Adham N, Jones KA, Raddatz R, Artymyshyn R, Ogozalek KL, Durkin MM, Lakhlani PP, Bonini JA, Pathirana S, Boyle N, Pu X, Kouranova E, Lichtblau H, Ochoa FY, Branchek TA, Gerald C (July 2001). "Trace amines: identification of a family of mammalian G protein-coupled receptors". Proc. Natl. Acad. Sci. U.S.A. 98 (16): 8966–8971. Bibcode:2001PNAS...98.8966B. doi:10.1073/pnas.151105198. PMC 55357. PMID 11459929.
- ^ Xie Z, Miller GM (July 2009). "A receptor mechanism for methamphetamine action in dopamine transporter regulation in brain". J. Pharmacol. Exp. Ther. 330 (1): 316–325. doi:10.1124/jpet.109.153775. PMC 2700171. PMID 19364908.
- ^ Maguire JJ, Davenport AP (2 December 2014). "TA1 receptor". IUPHAR database. International Union of Basic and Clinical Pharmacology. Retrieved 8 December 2014.
- ^ Underhill SM, Wheeler DS, Li M, Watts SD, Ingram SL, Amara SG (July 2014). "Amphetamine modulates excitatory neurotransmission through endocytosis of the glutamate transporter EAAT3 in dopamine neurons". Neuron. 83 (2): 404–416. doi:10.1016/j.neuron.2014.05.043. PMC 4159050. PMID 25033183.
AMPH also increases intracellular calcium (Gnegy et al., 2004) that is associated with calmodulin/CamKII activation (Wei et al., 2007) and modulation and trafficking of the DAT (Fog et al., 2006; Sakrikar et al., 2012).
- ^ Vaughan RA, Foster JD (September 2013). "Mechanisms of dopamine transporter regulation in normal and disease states". Trends Pharmacol. Sci. 34 (9): 489–496. doi:10.1016/j.tips.2013.07.005. PMC 3831354. PMID 23968642.
AMPH and METH also stimulate DA efflux, which is thought to be a crucial element in their addictive properties [80], although the mechanisms do not appear to be identical for each drug [81]. These processes are PKCβ– and CaMK–dependent [72, 82], and PKCβ knock-out mice display decreased AMPH-induced efflux that correlates with reduced AMPH-induced locomotion [72].
- ^ Ledonne A, Berretta N, Davoli A, Rizzo GR, Bernardi G, Mercuri NB (July 2011). "Electrophysiological effects of trace amines on mesencephalic dopaminergic neurons". Front. Syst. Neurosci. 5: 56. doi:10.3389/fnsys.2011.00056. PMC 3131148. PMID 21772817.
inhibition of firing due to increased release of dopamine; (b) reduction of D2 and GABAB receptor-mediated inhibitory responses (excitatory effects due to disinhibition); and (c) a direct TA1 receptor-mediated activation of GIRK channels which produce cell membrane hyperpolarization.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ mct (28 January 2012). "TAAR1". GenAtlas. University of Paris. Retrieved 29 May 2014.
• tonically activates inwardly rectifying K(+) channels, which reduces the basal firing frequency of dopamine (DA) neurons of the ventral tegmental area (VTA) - ^ Revel FG, Moreau JL, Gainetdinov RR, Bradaia A, Sotnikova TD, Mory R, Durkin S, Zbinden KG, Norcross R, Meyer CA, Metzler V, Chaboz S, Ozmen L, Trube G, Pouzet B, Bettler B, Caron MG, Wettstein JG, Hoener MC (May 2011). "TAAR1 activation modulates monoaminergic neurotransmission, preventing hyperdopaminergic and hypoglutamatergic activity". Proc. Natl. Acad. Sci. U.S.A. 108 (20): 8485–8490. Bibcode:2011PNAS..108.8485R. doi:10.1073/pnas.1103029108. PMC 3101002. PMID 21525407.
- ^ أ ب "Transporters". Methamphetamine. University of Alberta. 8 February 2013.
{{cite encyclopedia}}:|work=ignored (help) - ^ Eiden LE, Weihe E (January 2011). "VMAT2: a dynamic regulator of brain monoaminergic neuronal function interacting with drugs of abuse". Ann. N. Y. Acad. Sci. 1216 (1): 86–98. Bibcode:2011NYASA1216...86E. doi:10.1111/j.1749-6632.2010.05906.x. PMC 4183197. PMID 21272013.
- ^ Inazu M, Takeda H, Matsumiya T (August 2003). "[The role of glial monoamine transporters in the central nervous system]". Nihon Shinkei Seishin Yakurigaku Zasshi (in Japanese). 23 (4): 171–178. PMID 13677912.
{{cite journal}}: CS1 maint: unrecognized language (link) - ^ Melega WP, Cho AK, Schmitz D, Kuczenski R, Segal DS (February 1999). "l-methamphetamine pharmacokinetics and pharmacodynamics for assessment of in vivo deprenyl-derived l-methamphetamine". J. Pharmacol. Exp. Ther. 288 (2): 752–758. PMID 9918585.
- ^ أ ب Kuczenski R, Segal DS, Cho AK, Melega W (February 1995). "Hippocampus norepinephrine, caudate dopamine and serotonin, and behavioral responses to the stereoisomers of amphetamine and methamphetamine". J. Neurosci. 15 (2): 1308–1317. PMID 7869099.
- ^ أ ب Mendelson J, Uemura N, Harris D, Nath RP, Fernandez E, Jacob P, Everhart ET, Jones RT (October 2006). "Human pharmacology of the methamphetamine stereoisomers". Clin. Pharmacol. Ther. 80 (4): 403–420. doi:10.1016/j.clpt.2006.06.013. PMID 17015058.
- ^ Liddle DG, Connor DJ (June 2013). "Nutritional supplements and ergogenic AIDS". Prim. Care. 40 (2): 487–505. doi:10.1016/j.pop.2013.02.009. PMID 23668655.
- ^ Kraemer T, Maurer HH (August 1998). "Determination of amphetamine, methamphetamine and amphetamine-derived designer drugs or medicaments in blood and urine". J. Chromatogr. B. 713 (1): 163–187. doi:10.1016/S0378-4347(97)00515-X. PMID 9700558.
- ^ Kraemer T, Paul LD (August 2007). "Bioanalytical procedures for determination of drugs of abuse in blood". Anal. Bioanal. Chem. 388 (7): 1415–1435. doi:10.1007/s00216-007-1271-6. PMID 17468860.
- ^ Goldberger BA, Cone EJ (July 1994). "Confirmatory tests for drugs in the workplace by gas chromatography-mass spectrometry". J. Chromatogr. A. 674 (1–2): 73–86. doi:10.1016/0021-9673(94)85218-9. PMID 8075776.
- ^ أ ب Paul BD, Jemionek J, Lesser D, Jacobs A, Searles DA (September 2004). "Enantiomeric separation and quantitation of (+/-)-amphetamine, (+/-)-methamphetamine, (+/-)-MDA, (+/-)-MDMA, and (+/-)-MDEA in urine specimens by GC-EI-MS after derivatization with (R)-(−)- or (S)-(+)-alpha-methoxy-alpha-(trifluoromethy)phenylacetyl chloride (MTPA)". J. Anal. Toxicol. 28 (6): 449–455. doi:10.1093/jat/28.6.449. PMID 15516295.
- ^ de la Torre R, Farré M, Navarro M, Pacifici R, Zuccaro P, Pichini S (2004). "Clinical pharmacokinetics of amfetamine and related substances: monitoring in conventional and non-conventional matrices". Clin Pharmacokinet. 43 (3): 157–185. doi:10.2165/00003088-200443030-00002. PMID 14871155.
- ^ Baselt RC (2011). Disposition of toxic drugs and chemicals in man. Seal Beach, Ca.: Biomedical Publications. pp. 1027–1030. ISBN 978-0-9626523-8-7.
- ^ Venkatratnam A, Lents NH (July 2011). "Zinc reduces the detection of cocaine, methamphetamine, and THC by ELISA urine testing". J. Anal. Toxicol. 35 (6): 333–340. doi:10.1093/anatox/35.6.333. PMID 21740689.
- ^ Nakayama, MT. "Chemical Interaction of Bleach and Methamphetamine: A Study of Degradation and Transformation Effects". gradworks. UNIVERSITY OF CALIFORNIA, DAVIS. Retrieved 17 October 2014.
- ^ Pal R, Megharaj M, Kirkbride KP, Heinrich T, Naidu R (October 2011). "Biotic and abiotic degradation of illicit drugs, their precursor, and by-products in soil". Chemosphere. 85 (6): 1002–9. Bibcode:2011Chmsp..85.1002P. doi:10.1016/j.chemosphere.2011.06.102. PMID 21777940.
- ^ Bagnall J, Malia L, Lubben A, Kasprzyk-Hordern B (October 2013). "Stereoselective biodegradation of amphetamine and methamphetamine in river microcosms". Water Res. 47 (15): 5708–18. doi:10.1016/j.watres.2013.06.057. PMID 23886544.
- ^ Crossley FS, Moore ML (November 1944). "Studies on the Leuckart reaction". The Journal of Organic Chemistry. 9 (6): 529–536. doi:10.1021/jo01188a006.
- ^ أ ب ت ث ج Kunalan V, Nic Daéid N, Kerr WJ, Buchanan HA, McPherson AR (September 2009). "Characterization of route specific impurities found in methamphetamine synthesized by the Leuckart and reductive amination methods". Anal. Chem. 81 (17): 7342–7348. doi:10.1021/ac9005588. PMC 3662403. PMID 19637924.
- ^ Overdose Death Rates. By National Institute on Drug Abuse (NIDA).
- ^ "US overdose deaths from fentanyl and synthetic opioids doubled in 2016". The Guardian. 3 September 2017.
- ^ Rassool GH (2009). Alcohol and Drug Misuse: A Handbook for Students and Health Professionals. London: Routledge. p. 113. ISBN 978-0-203-87117-1.
- ^ أ ب "Historical overview of methamphetamine". Vermont Department of Health. Government of Vermont. Retrieved 29 January 2012.
- ^ Grobler SR, Chikte U, Westraat J (2011). "The pH Levels of Different Methamphetamine Drug Samples on the Street Market in Cape Town". ISRN Dentistry. 2011: 1–4. doi:10.5402/2011/974768. PMC 3189445. PMID 21991491.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "Historical overview of methamphetamine". Vermont Department of Health. Retrieved 15 January 2012.
- ^ Ulrich, Andreas (6 May 2005). "The Nazi Death Machine: Hitler's Drugged Soldiers". Spiegel Online. Der Spiegel, 6 May 2005.
- ^ Defalque RJ, Wright AJ (April 2011). "Methamphetamine for Hitler's Germany: 1937 to 1945". Bull. Anesth. Hist. 29 (2): 21–24, 32. doi:10.1016/s1522-8649(11)50016-2. PMID 22849208.
- ^ أ ب Lukasz Kamienski (2016). Shooting Up: A Short History of Drugs and War. Oxford University Press. pp. 111–13. ISBN 9780190263478.
- ^ أ ب Rasmussen, Nicolas (March 2008). On Speed: The Many Lives of Amphetamine (1 ed.). New York University Press. p. 148. ISBN 978-0-8147-7601-8.
- ^ "Controlled Substances Act". United States Food and Drug Administration. 11 June 2009. Retrieved 4 November 2013.
- ^ "Desoxyn". Lundbeck: Desoxyn. Archived from the original on 30 نوفمبر 2012. Retrieved 15 ديسمبر 2012.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "Recordati: Desoxyn". Recordati SP. Archived from the original on 7 يوليو 2013. Retrieved 15 مايو 2013.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ United Nations Office on Drugs and Crime (2007). Preventing Amphetamine-type Stimulant Use Among Young People: A Policy and Programming Guide (PDF). New York: United Nations. ISBN 978-92-1-148223-2. Retrieved 11 November 2013.
- ^ أ ب "List of psychotropic substances under international control" (PDF). International Narcotics Control Board. United Nations. August 2003. Archived from the original (PDF) on 5 December 2005. Retrieved 19 November 2005.
- ^ Cass WA, Smith MP, Peters LE (2006). "Calcitriol protects against the dopamine- and serotonin-depleting effects of neurotoxic doses of methamphetamine". Annals of the New York Academy of Sciences. 1074 (1): 261–71. Bibcode:2006NYASA1074..261C. doi:10.1196/annals.1369.023. PMID 17105922.
وصلات خارجية
- Methamphetamine Toxnet entry
- Methamphetamine Poison Information Monograph
- Drug Trafficking: Aryan Brotherhood Methamphetamine Operation Dismantled, FBI
- Neurologic manifestations of chronic methamphetamine abuse
- An extensive review of the history, pharmacology and effects of methamphetamine abuse, with links to related articles.
- CS1 errors: periodical ignored
- CS1 maint: unflagged free DOI
- CS1 errors: unsupported parameter
- CS1 errors: empty citation
- Template:drugs.com link with non-standard subpage
- Drugs with non-standard legal status
- ECHA InfoCard ID from Wikidata
- Infobox drug articles with non-default infobox title
- Multiple chemicals in Infobox drug
- Chemicals using indexlabels
- Chemical articles with multiple CAS registry numbers
- Articles with hatnote templates targeting a nonexistent page
- مثامفتامين
- مفقدات الشهية
- منشطات جنسية طبيعية
- منشطات القلب
- مسببات الابتهاج
- Excitatory amino acid reuptake inhibitors
- اختراعات يابانية
- علاج البدانة
- Norepinephrine-dopamine releasing agents
- فينيثيلامينات
- ناهضات سيگما
- منبهات
- أمفيتامينات مستبدلة
- محاكيات الودي
- TAAR1 agonists
- علاج اضطراب قصور الإنتباه وفرط الحركة
- VMAT inhibitors