ورم حميد
| الورم الحميد Benign tumor | |
|---|---|
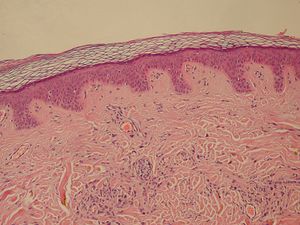 | |
| Normal Epidermis and Dermis with Intradermal Nevus 10x-cropped | |
| التخصص | علم الأمراض |
الورم الحميد، هو كتلة من الخلايا (ورم) التي ليس لديها القدرة على غزو أو انبثاث الأنسجة المجاورة. لا تقمم هذه الخلايا بالانتشار في الأنسجة المجاورة أو غزوها؛ إلا أنها في بعض الأحيان ما تكون كبيرة الحجم. عند إزالتها، عادة ما لا يعاود الورم في الظهور، بخلاف ما تفعله الخلايا الخبيثة أحياناً. على عكس معظم الأورام الحميدة في جميع أجزاء الجسم، فإن أورام المخ الحميدة يمكنها أن تهدد حياة المريض.[1] بصفة عامة، تتمتع الأورام الحميدة بمعدل نمو أبطأ من الأورام الخبيثة وعادة ما تكون الخلايا الورمية أكثر تمايزاً (للخلايا سمات طبيعية).[2][3][4] تكون في الغالب محاطة بسطح خارجي (غمد ليفي من نسيج ضام) أو تبقى مع الظهارة.[5] ومن أمثلة الأورام الحميدة الشائعة الشامات والأورام العضلية الملساء الرحمية.
على الرغم من أن الأورام الحميدة لا تنبث ولا تغزو الأنسجة المجاورة، إلا أن لبعض أنواعها آثار صحية سلبية. قد ينتج عن نمو الأورام الحميدة "تأثير تكتلي" الذي يمكن أن يضغط الأنسجة وقد يسبب تلف الأعصاب، والحد وصول من الدم إلى إحدى أجزاء الجسم (إقفار)، موت الأنسجة (نخر) أو إصابة الأعضاء. قد تكون الآثار الصحية للورم أكثر وضوحاً إذا كان الورم داخل منطقة مغلقة مثل القحف، السبيل التنفسي، الجيب أو داخل العظام. أورام الأنسجة الصماء شديدة التمايز. وتشمل الأمثلة أورام الغدة الدرقية والأورام الجار كظرية.[2]
على الرغم من أن معظم الأورام الحميدة غير مهددة للحياة، فالكثير من أنواعها قد يتحول إلى ورم سرطاني (خبيث) من خلال عملية تُعرف بتطور الورم.[6] لهذا السبب ولأسباب صحية سلبية أخرى، تُزال بعض الأورام الحميدة عن طريق الجراحة.[7]
التصنيف
| الخلية الأصلية | نوع الخلية | الورم |
|---|---|---|
| الأديم الباطن | صفراوية | ورم الأقنية الصفراوية |
| قولونية | سليلة قولونية مستقيمية | |
| غدية | ورم غدي | |
| ورم حليمي | ||
| ورم غدي كيسي | ||
| كبدية | الورم الغدي ذو الخلايا الكبدية | |
| مشيمية | الرحى العدارية | |
| كلوية | ورم غدي أنبوبي كلوي | |
| طلائية | الورم الحليمي ذو الخلايا الحرشفية | |
| معدية | زوائد غدد قاع المعدة | |
| اللحمة المتوسطة | وعائية دموية | ورم وعائي دموي |
| عظمية | ورم عظمي | |
| غضروفية | ورم غضروفي | |
| نسيج دهني | ورم شحمي | |
| نسيج ضام | ورم ليفي | |
| وعاء لمفي | ورم وعائي لمفي | |
| عضلة ملساء | ورم عضلي أملس | |
| عضلة مخططة | ورم عضلي مخطط | |
| الأديم الظاهر | خلية دبقية | ورم نجمي |
| خلايا ميلانينية | وحمة | |
| سحايا | ورم سحائي | |
| عصبونات | ورم عصبي عقدي | |
| المراجع[8] | ||
غالباً وليس دائما تكون الأورام الحميدة مؤلفة من خلايا تحمل شبهاً قوياً للخلايا الطبيعية في جهازها الأصلي. تسمى هذه الأورام تبعاً للخلية أو النسيج الذي نشأت منه متبوعة باللاحقة "-oma" (بإستثناء السرطانة والساركوما، والتي تصنف عموماً ضمن السرطانات). على سبيل المثال الورم الشحمي إنگليزية: Lipoma هو ورم حميد شائع يتكون من خلايا دهنية (Lipocytes).
بعض الأورام تنتج أيضا هرمونات يمكن أن تؤدي إلى حالات تهدد الحياة. الأورام الجزيرية يمكنها إنتاج كميات كبيرة من الأنسولين مما يؤدي إلى نقص السكر في الدم.[9][10] أورام الغدة النخامية يمكن أن تسبب إرتفاعا في مستويات العديد من الهرمونات مثل[11] : هرمون النمو وعامل النمو شبيه الانسولين-1 والذي يؤدي إلى ضخامة الأطراف، الهرمون الموجه لقشر الكظر وكورتيزول يؤدي إلى مرض كوشينغ، هرمون منبه الدرقية والذي يتسبب في فرط الدرقية والهرمون المنشط للحوصلة والهرمون المنشط للجسم الأصفر وبرولاكتين. انغلاف الأمعاء يمكن أن يحدث مع العديد من الأورام القولونية الحميدة.[12] يمكن أن تحدث آثار تجميلية بسبب الأورام وخاصةً تلك الموجودة في الجلد ، مما قد يسبب آثارًا نفسية على الشخص المصاب بالورم.[13] يمكن للأورام الوعائية أن تنزف وفي بعض الحالات يكون النزيف حادا مما يؤدي إلى فقر الدم[14]
الأسباب
متلازمة الورم اللعابي
داء السلائل الورمي الغدي العائلي
داء السلائل الورمي الغدي العائلي هو مرض وراثي نادر يتشكل بنمط جسدي قاهر تتوضع الطفرة على الذراع الطويل للصبغي الجسدي الخامس،يتصف بوجود أكثر من 100 بوليب في القولون والمستقيم، يتحول إلى سرطان قولون في حال عدم العلاج، يتموضع غالباً في القولون السيني والمستقيم، إصابة الذكور أكثر من الإناث ونادرة قبل البلوغ.
التصلب الحدبي
التصلب الحدبي هو مرض وراثي نادر الحدوث، وقد يصيب عدة أجهزة في جسم الإنسان كما يسبب نمو أنواع مختلفة من الأورام الحميدة في الدماغ والقلب والكلية وغيرها.[15][16][17] يحدث المرض بسبب طفرة في إحدى المورثتين: TSC1 أو TSC2 وهما مورثتان كابتتان للورم ترمزان للبروتينين هامارتين وتوبرين على التوالي. قد يتظاهر المرض بنوبات الاختلاج أو التأخر العقلي أو مشاكل سلوكية أو تغيرات جلدية (مثل بقع ورق قيقب مانيتوبا إنگليزية: ash leaf spots ناقصة الصباغ) أو غيرها.
مرض فون هيپل-لينداو
مرض فون هيپل-لينداو هو مرض وراثي نادر يسبب نمو أورام وكيسات في جسم الإنسان. وقد تكون هذه الأورام سرطانية أو حميدة، وقد تنمو في الدماغ والحبل الشوكي والكليتين والبنكرياس وفي الجهاز التناسلي عند الرجال. يتميّز هذا الداء بأورام وعائية في شبكية العين والمخيخ وأحياناً في النخاع .[18]
الآلية
الورم الحميد مقابل الخبيث
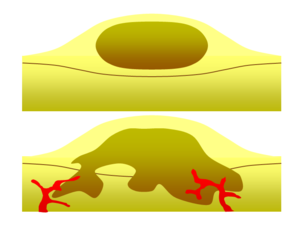
أحد أهم العوامل في تصنيف الورم إلى حميد أو خبيث هو إمكاناته الإجتياحية. إذا كان الورم يفتقر القدرة على غزو الأنسجة المجاورة أو الانتشار إلى مواقع بعيدة عن طريق التفشي، فهو حميد ، وغير ذلك فهو خبيث.
التسرطن متعدد المراحل
التشخيص
العلاج
بعض الأورام الحميدة لا تحتاج لعلاج؛ وقد تزال أنواع أخرى إذا كانت تسبب مشكلة مثل النوبات، عدم الراحة أو لأسباب تجميلية. الجراحة هي المنهجية الأكثر تأثيراً وتستخدم لعلاج معظم الأورام الحميدة. في بعض الأحيان قد تستخدم علاجات أخرى.
المصادر
- ^ "What Is Cancer?". National Cancer Institute (in الإنجليزية). Retrieved 2017-11-26.
 هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
هذا المقال يضم نصاً من هذا المصدر، الذي هو مشاع.
- ^ أ ب Wilson, Kathleen Atkins; Waugh, Anne; Chambers, Graeme; Grant, Allison; Ross, Janet (2006). Ross and Wilson anatomy and physiology in health and illness. Edinburgh: Churchill Livingstone. pp. 53–54. ISBN 0-443-10101-9.
- ^ Nunn, Laura Silverstein; Silverstein, Alvin; Silverstein, Virginia B. (2006). Cancer. Brookfield, Conn: Twenty-First Century Books. pp. 11–12. ISBN 0-7613-2833-5.
- ^ David Lowell Strayer; Raphael Rubin; Rubin, Emanuel (2008). Rubin's pathology: clinicopathologic foundations of medicine. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. pp. 138–139. ISBN 0-7817-9516-8.
- ^ Ober, William B.; Martini, Frederic (2006). Fundamentals of anatomy & physiology. San Francisco: Pearson Benjamin Cummings. ISBN 0-321-31198-1.
- ^ Clark WH (October 1991). "Tumour progression and the nature of cancer". Br. J. Cancer. 64 (4): 631–44. doi:10.1038/bjc.1991.375. PMC 1977704. PMID 1911211.
- ^ Reece, Jane; Campbell, Neil; Urry, Lisa (2005). Biology. San Francisco: Pearson Benjamin Cummings. p. 232. ISBN 0-321-27045-2.
- ^ Cancer nursing: principles and practice. Jones and Bartlett Publishers. 2011.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help) - ^ Marks V, Teale JD (June 1991). "Tumours producing hypoglycaemia". Diabetes Metab Rev. 7 (2): 79–91. doi:10.1002/dmr.5610070202. PMID 1665409.
- ^ Grant CS (October 2005). "Insulinoma". Best Pract Res Clin Gastroenterol. 19 (5): 783–98. doi:10.1016/j.bpg.2005.05.008. PMID 16253900.
- ^ Charis Eng; DeLellis, Ronald A.; Lloyd, Ricardo V.; Phillipp U. Heitz (2004). Pathology and genetics of tumours of endocrine organs. Lyon: IARC Press. ISBN 92-832-2416-7.
- ^ Gill SS, Heuman DM, Mihas AA (October 2001). "Small intestinal neoplasms". J. Clin. Gastroenterol. 33 (4): 267–82. doi:10.1097/00004836-200110000-00004. PMID 11588539.
- ^ Tromberg J, Bauer B, Benvenuto-Andrade C, Marghoob AA (2005). "Congenital melanocytic nevi needing treatment". Dermatol Ther. 18 (2): 136–50. doi:10.1111/j.1529-8019.2005.05012.x. PMID 15953143.
- ^ M. Zuber; F. Harder (2001). Benign tumors of the colon and rectum. Munich: Zuckschwerdt: Surgical Treatment: Evidence-Based and Problem-Oriented.
- ^ van Slegtenhorst M, de Hoogt R, Hermans C, Nellist M, Janssen B, Verhoef S, Lindhout D, van den Ouweland A, Halley D, Young J, Burley M, Jeremiah S, Woodward K, Nahmias J, Fox M, Ekong R, Osborne J, Wolfe J, Povey S, Snell RG, Cheadle JP, Jones AC, Tachataki M, Ravine D, Sampson JR, Reeve MP, Richardson P, Wilmer F, Munro C, Hawkins TL, Sepp T, Ali JB, Ward S, Green AJ, Yates JR, Kwiatkowska J, Henske EP, Short MP, Haines JH, Jozwiak S, Kwiatkowski DJ (1997). "Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34". Science. 277 (5327): 805–8. doi:10.1126/science.277.5327.805. PMID 9242607.
- ^ O'Callaghan FJ, Shiell AW, Osborne JP, Martyn CN (1998). "Prevalence of tuberous sclerosis estimated by capture-recapture analysis". Lancet. 351 (9114): 1490. doi:10.1016/S0140-6736(05)78872-3. PMID 9605811.
- ^ Rott HD, Mayer K, Walther B, Wienecke R (مارس 2005). "Zur Geschichte der Tuberösen Sklerose (The History of Tuberous Sclerosis)" (PDF) (in German). Tuberöse Sklerose Deutschland e.V. Archived from the original (PDF) on 15 مارس 2007. Retrieved 8 يناير 2007.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help)CS1 maint: unrecognized language (link) - ^ Henry, Todd; Campell, James; Hawley, Arthur (1969). Todd-Sanford clinical diagnosis by laboratory methods, edited by Israel Davidsohn [and] John Bernard Henry. Philadelphia: Saunders. p. 555.
{{cite book}}: Cite has empty unknown parameters:|lay-date=,|subscription=,|nopp=,|last-author-amp=,|name-list-format=,|lay-source=,|registration=, and|lay-summary=(help)