باراسيتامول
 | |
 | |
| البيانات السريرية | |
|---|---|
| License data |
|
| فئة السلامة أثناء الحمل |
|
| مسارات الدواء | فموي, شرجي, وريدي |
| رمز ATC | |
| الحالة القانونية | |
| الحالة القانونية |
|
| بيانات الحركية الدوائية | |
| التوافر الحيوي | almost 100% |
| الأيض | 90 to 95% كبدي |
| Elimination half-life | 1–4 ساعة |
| الإخراج | كلوي |
| المعرفات | |
| |
| رقم CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.002.870 |
| Chemical and physical data | |
| التركيب | C8H9NO2 |
| الكتلة المولية | 151.169 g/mol |
| 3D model (JSmol) | |
| Density | 1.263 g/cm3 |
| Melting point | 169 °C (336 °F) |
| Solubility in water | 14 mg/mL @ 25C [1] mg/mL (20 °C) |
| |
الپاراستامول إنگليزية: Paracetamol أو الأستامينوفين إنگليزية: acetaminophen هو مسكن ومخفض للحرارة واسع الاستخدام. مُستخلص من القطران، وهو المُستقلب النشط للفيناسيتين، وعلى عكس الفيناسيتين فإن الباراسيتامول لم يَظهر أنه مسرطن بأي شكل من الأشكال. الباراسيتامول يُتحمل جيداً، وليس له العديد من الأعراض الجانبية للأسبرين، وهو متاح فوق الطاولة. وهو يُستخدم عموماً لعلاج الحمى، والصداع، والألم والأوجاع الخفيفة. يكون الباراسيتامول مفيداً أيضاً في التعامل مع اللآلام الشديدة الأخرى بالاشتراك مع مضادات الالتهاب اللاستيرويدية أو مع المسكنات الأفيونية[2]. ويدخل الباراسيتامول كمكون أساسي في العديد من وصفات البرد والإنفلونزا. وعلى الرغم من أنه آمن للبشر في حدود الجرعات المُوصى بها، إلا أن الجرعات المفرطة يحتمل أن تسبب تسمم كبدي؛ والسبب الأول للفشل الكبدي في الغرب هو التسمم بالباراسيتامول، وهو وراء معظم حالات زيادة الجرعة في الولايات المتحدة، المملكة المتحدة، أستراليا ونيوزيلاند.[3][4][5][6] ويزيد خطره بتناول المشروبات الكحولية.
وابتُدعت كلمتي أسيتامينوفين وباراسيتامول من الأسماء الكيميائية للمركب : بارا-أسيتـيل امينوفين وبارا-أسيتـيل أمـينوفينـول. وفي بعض السياقات، يمكن اختصاره لـ أباف من ن-أستيل-بـارا-أمينوفـينول.
التاريخ

عُرفت المواد المخفضة للحرارة في العصور الوسطى والقديمة بأنها مركبات موجودة في اللحاء الأبيض للصفصاف (عائلة من الكيماويات اسمها ساليسينات، أدت فيما بعد إلى تطور وظهور الأسبرين)، ومركبات محتواه داخل لحاء الكينا.[7] واستخدم لحاء الكينا في إنتاج الكينين لعلاج الملاريا. وللكينين ذات نفسه صفات مخفضة للحرارة. وأخذت جهود تكرير وعزل الساليسين وحمض السالسيليك سنوات عديدة امتدت من منتصف إلى أخر القرن التاسع عشر، وأتمها فليكس هوفمان (بالألمانية: Felix Hoffmann) الكيميائي التابع لمعامل باير في ألمانيا (وقد فعلها من قبله بأربعين عام الكيميائي الفرنسي شارل فردريك گرهارد (بالفرنسية:Charles Frédéric Gerhardt)، ولكنه أهمل هذا العمل لأنه أعتقد حينها أن فصل هذه المواد غير عملي).[8]
وعندما ندرت أشجار الكينا في ثمانينات القرن التاسع عشر، بدأ البحث عن بدائل. وفي عام 1886 كان الأستاذ أدولف كوسمال (بالألمانية: Adolf Kussmaul) يدرس تأثيرات النفثالين المضادة للطفيليات في جامعة ستراسبورغ. وعندما نفذ النفثالين من المعمل، ذهب مساعداه الشابان أرنولد كان (بالألمانية: Arnold Cahn) وبول هيب (بالألمانية: Paul Hepp) إلى صيدلي لشراء النفثالين ولكن الصيدلي أعطى لهم بالخطأ أسيتانيليد بدلاً من النفثالين. وعندما قاموا بدراسة الأسيتانيليد، اندهشوا من المفعول الخافض للحرارة للمنتج الجديد. وبفضل خطأ الصيدلي تم اكتشاف الخواص المخفضة للحرارة للأسيتانيليد[9]. ولكن خواصه المسكنة للألم اكتشفت بعد ذلك بزمن طويل، فالأسيتانيليد هو أبو الباراسيتامول والفيناسيتين[10]. وكان للدكتور هيب أخ يعمل في شركة صغيرة (كاله وشركاه) تنتج الأسيتانيليد[11]. فأقترح عليه استخدام اكتشافه لطرحه في الأسواق لمنافسه مخفضات الحرارة التقليدية التي كانت موجودة حينها مثل حمض الساليسيليك. وأصبح الأسيتانيليد منتجاً تجارياً تحت اسم أنتيفيبرينإنگليزية: antifebrin. وفي نهاية عام 1880، طُرح البارانيتروفينول في الأسواق بأسعار أرخص من الأسيتانيليد. فطلب كارل دويسبيرغ (بالألمانية: Carl Duisberg)، مسئول الأبحاث وبراءات الاختراع في شركة باير (فريدريش باير وشركاه)، من العاملين في القسم العمل على البارانيتروفينول والبحث عن استخدام مفيد له. فكانت لدي اوسكار هينزبرگ (بالألمانية: Oscar Hinsberg) فكرة تحويله إلى أسيتوفينيتيدين[12][9]. وكانت عملية تخليق هذه المادة لها هدف تجاري بحت وجاءت معهم بالحظ، وأظهرت التجارب أن هذه المادة أقوى من الأنتيفيبرين ولها أعراض جانبية أقل. فقرر دويسبيرغ تسويق المادة الجديدة تحت اسم "فيناسيتين"[13]. وقبل ذلك في عام 1878، قام هارمون نورتروب مورسه (بالألمانية:Harmon Northrop Morse) لأول مرة بتخليق الباراسيتامول عن طريق اختزال البارا-نيتروفينول مع القصدير في حمض الخليك الثلجي.[14] وعلى الرغم من ذلك فلم يُستخدم الباراسيتامول في العلاج الطبي حتى عام 1893. وفي هذا العام، أُكتشف الباراسيتامول في بول الأفراد الذين تعاطوا الفيناسيتين، فقام الكيميائيون بتركيزه إلى مركب أبيض ومتبلر ذي طعم مر. وفي عام 1899، وُجد أن الباراسيتامول هو مُستقلب من الأسيتانيليد. وقد تم تجاهل هذا الاكتشاف وقتها.
وفي عام 1946، أُعطي معهد دراسات المسكنات والأدوية المهدئة منحة من السلطات الصحية بمدينة نيويورك لدراسة المشاكل المرتبطة باستخدام المسكنات. وقد عين كلا من برنارد برودي (بالإنجليزية: Bernard Brodie) وجوليوس أكسلرود (بالإنجليزية: Julius Axelrod) للتحري عن سبب ظهور متلازمة عوز المتهموگلوبين، وهي حالة تؤدي إلى نقص قدرة الدم على حمل الأكسجين ويمكن أن تؤدي للوفاة. وفي عام 1948، ربط برودي وأكسلرود بين استخدام الأسيتانيليد ومتلازمة عوز المتهموگلوبين وأكدا أن التأثير المسكن للأسيتانيليد يرجع إلى مُستقلبه النشط الباراسيتامول. وقد دافعوا عن استخدام الباراستامول طالما أنه لايمتلك التأثيرات الضارة للأسيتانيليد.[15]

وقد طرحت شركة معامل ماكنيل (بالإنجليزية:McNeil Laboratories) الدواء لأول مرة في الأسواق عام 1955 كمعالج للحمى والألم للأطفال، تحت الاسم التجاري إكسير تايلنول للأطفال.[16]
وفي عام 1956، طرح فريدريك ستيرنز وشركاه (بالإنجليزية:Frederick Stearns & Co) أقراص الباراسيتامول 500 مغ في أسواق المملكة المتحدة تحت الاسم التجاري بانادول. وكان الپانادول يُصرف فقط بأمر الطبيب لتسكين الألم والحمى. وكانت دعايته "لطيف على المعدة" لأن باقي المسكنات الأخرى كانت تحتوي على الأسبرين وقتها وهو مهيج معوي. وفي يونيو 1958، تم طرح إكسير بندول للأطفال.
وفي عام 1963، تم إضافة الباراسيتامول إلى دستور الأدوية البريطاني، واكتسب شعبية حينها كمسكن قليل الأعراض الجانبية وقليل التفاعل مع الأدوية الأخرى.
وقد انتهت صلاحية براءة اختراع الباراسيتامول في الولايات المتحدة منذ زمن طويل، ويُسمح بإنتاجه في الدول الأخرى بأسماء عامة مختلفة.
كيمياء
التركيب والتفاعلية
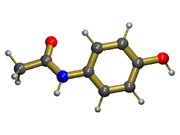
يتكون الباراسيتامول اساساً من حلقة بنزين، استبدلت بمجموعة هيدروكسيل وذرة نيتروجين مجموعة أميد (الأسيتاميد) في الموقعين بارا (1،4). وهو نظام مترافق بشكل كبير إذ أن زوج الإلكترونات الوحيد على أكسجين مجموعة الهيدروكسيل، سحابة الإلكترونات π على حلقة البنزين، زوج إلكترونات النيتروجين الوحيد، والمدار الذري ب على ذرة كربون مجموعة الكربونيل و الزوج الوحيد على أكسجين مجموعة الكربونيل كلهم مترافقون. ويزيد تواجد مجموعتان محفزتان أيضاً من قابلية حلقة البنزين للاستبدال الحلقي المحب للإلكترونات. وبما أن كلا المستبدلين على الحلقة البنزنية يقومان بالتوجيه لمواقع أرثو و بارا وكانا في وضعية بارا بالنسبة لبعضهما البعض فإن جميع المواقع على الحلقة تكون مفعلة كيميائياً بشكل متساو. ويقلل الترافق من قاعدية ذرات الأكسجين والنيتروجين بصورة كبيرة، بينما يزيد من حامضية مجموعة الهيدروكسيل عبر نقل الشحنة التي تظهر على الدالف (الأنيون) السالب فينوكسيد.
خصائص المادة
باراسيتامول مادة بلورية بيضاء تنصهر عند 170°س. تنحل هذه المادة في الكحولات بشكل جيد وكذلك في الماء المغلي، إلا أنها ضعيفة الانحلال بالماء البارد 14 غ/ل عند 20° س.
كثافة المادة في الحالة الصلبة تبلغ 1,293 غ/سم3 وله كتلة مولية مقدارها 151,165 غ/مول.
الباراسيتامول مثل الفينول له خواص حمضية ضعيفة، حيث أن قيمة الأس الهيدروجيني pH للمحلول منه تتراوح بين 5.5 و 6.5.
التخليق
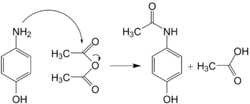
يمكن تخليق الباراسيتامول من الفينول بالطريقة الآتية :
1- نيترة الفينول باستخدام حمض الكبريتيك ونترات الصوديوم (ولأن الفينول نشط جداً، فإن عملية نيترته تتطلب ظروف خفيفة جداً بالمقارنة مع البنزين الذي يتطلب حمض نيتريك ساخن).
2- يتم فصل المتماكب بارا من المتماكب أرثو بالتقطير التجزيئي (سيكون هناك القليل من متماكبات ميتا، لأن الهيدروكسيل يوجه الاستبدال للموقعين أرثو وبارا).
3- يُختزل 4-نيتروفينول إلى 4-أمينوفينول باستخدام عامل مختزل مثل بوروهيدرد الصوديوم في وسط قاعدي.
4- يتفاعل الـ 4-أمينوفينول مع حمض خليك لامائي ليعطي الباراسيتامول.
لاحظ أن تخليق الباراسيتامول لايمر بالمراحل الصعبة والعويصة التي تمر بها تقريباً كل الأدوية الأخرى: فعدم وجود مراكز فراغية يعني عدم الحاجة لتصميم نظام تخليق إختياري لمركز فراغي معين. ولذلك يسهل صناعة الباراسيتامول.
آلية عمل الباراسيتامول
لاتزال الآلية التي يقلل بها الباراسيتامول الحمى والألم مثار الكثير من النقاش.[17] وسبب هذا الجدل يرجع بصورة كبيرة إلى تشابه كلاً من الباراسيتامول والأسبرين في منع إنتاج المركبات الكيماوية البروستاگلاندية المسببة للإلتهاب. ولكن على عكس الأسبرين فأن الباراسيتامول لايمتلك الكثير من الصفات المضادة للإلتهاب. وكذلك فأن الباراسيتامول - على عكس الأسبرين أيضاً - لايقوم بمنع المركبات الثرومبوكسانية التي تسبب تجلط الدم. ومن المعروف أن الأسبرين يقوم بمنع عائلة إنزيمات السيكلوأكسجيناز (كوكس) وبسبب التشابه الجزئي بين تأثير الأسبرين وتأثير الباراسيتامول، فقد ركز الباحثون على تحري إذا كان الباراسيتامول يقوم بمنع عائلة السيكلوأكسجيناز أيضاً. وأقترح العلماء طريقتين يعمل بهما الباراسيتامول ولكن لايوجد تأكيد على صحتهما حتى الآن.[18][19][20][21]
وعائلة إنزيمات الكوكس هي المسئولة عن استقلاب حمض الأراكيدونيك إلى بروستاغلاندين هـ2، وهو جزئ غير ثابت ولذلك يتحول إلى العديد من المركبات الأخرى المسببة للالتهاب. وتقوم مضادات الالتهاب التقليدية - مثل مضادات الالتهاب اللاستيرويدية - بغلق هذه الخطوة. وتعتمد فاعلية إنزيم الكوكس على وجوده في الحالة المتأكسدة ليقوم بنشاطه المتخصص في استقلاب حمض الأراكيدونيك.[22][23] وقد تبين أن الباراسيتامول يختزل إنزيم الكوكس المتأكسد ليمنعه من تكوين الكيماويات المسببة للالتهاب.[19][24]
وقد أظهرت دراسة أن الباراسيتامول يعمل على الجهاز الكانابينويدي الداخلي.[25] فالباراسيتامول يُستقلب إلى ن-أراكيدونويل فينول أمين (AM404)، وهو مركب له العديد من التأثيرات؛ أكثرها أهمية أنه يمنع الخلايا العصبية من امتصاص الأنانداميد الكانابينويدي/الفانيلويدي الداخلي. فامتصاص الأنانداميد يمكن أن ينتج عنه تفعيل مستقبل الألم الرئيسي في الجسم وهو المستقبل الفانيلويدي. وبالإضافة إلى ذلك، فإن الـ ن-أراكيدونويل فينول أمين يغلق قنوات الصوديوم بطريقة مماثلة لطريقة المخدرين ليدوكائين وبروكائين.[26] ولكن لم يُثبت حتى الآن أن هاتين الآليتين السابقتين يمكنهما تسكين الألم، ولايزالا من الآليات المحتملة لعمل الباراسيتامول. على الرغم ذلك فعند غلق مستقبلات الكانابينويد فأن الباراسيتامول يفقد مفعوله المسكن للألم، وهذا يرجح فرضية أن الباراسيتامول يعمل فعلاً على الجهاز الكانابينويدي الداخلي لتسكين الألم.[27]
وتقترح إحدى النظريات أن الباراسيتامول يعمل عن طريق منع الكوكس-3 وهو (أيزوفورم) من عائلة إنزيمات السيكلوأكسجيناز. ولدى هذا الإنزيم - عند إفرازه في الكلاب - تشابه قوي مع إنزيمات الكوكس الأخرى، ويقوم بإنتاج الكيماويات المسببة للالتهاب. ويقوم الباراسيتامول بمنعه إنتقاءياً.[28] ولكن بعض الأبحاث تقول أن إنزيم الكوكس-3 لا يسبب الالتهابات في البشر والفئران[18]. ويُحتمل أيضاً أن الباراسيتامول يغلق مفعول السيكلوأكسجيناز بنفس طريقة الأسبرين ولكن في منطقة الالتهاب توجد البيروكسيدات الذي تمنع التأثير المأكسد للباراسيتامول. وهذا يعني أن هذه الاحتمالية غير صحيحة وأن الباراسيتامول لايعمل في منطقة الالتهاب ولكنه يعمل على الجهاز العصبي المركزي حيث لاتوجد عوامل مؤكسدة.[28] ولاتزال الآلية التي يؤثر بها الباراسيتامول على الكوكس-3 محل جدل بين الباحثين.
حركية الدواء
يُمتص الباراسيتامول بصورة سريعة وكاملة عند تعاطيه بالفم: ويصل إلى أعلى مستوياته في البلازما خلال 15 دقيقة (الأقراص الفوارة) وخلال 30-60 دقيقة (الأقراص أو المسحوق). وينتشر الباراسيتامول سريعاً في جميع أنسجة الجسم.
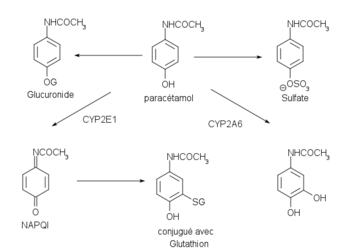
يُستقلب الباراسيتامول بصورة أساسية في الكبد، حيث تتضمن مستقلباته الأساسية مترافقات الكبريتات والغلوكورونيد الخاملة التي تُطرح كلوياً. ولكن تبقى كمية صغيرة نسبياً تستقلب بنظام السيتوكروم ب450 الكبدي وينتج المستقلب الهامشي (ن-أسيتيل-بارا-بنزو-كينون إمين، ويُختصر نبقي NAPQI) المسئول عن التأثيرات السامة للباراسيتامول. ويقوم الحمض الأميني جلوتاثيون باختزال النبقي ثم يخرج في البول بعد ترافقه مع السيستئين وحمض المركابتوبوريك.
ويُطرح الباراسيتامول بصورة أساسية في البول : تُطرح 90% من الجرعة عن طريق الكلية خلال 24 ساعة، في صورة مترافق غلوكورونيد بصورة أساسية (60-80%) و مترافق كبريتات (20-30%) وأقل من 5% في صورة باراسيتامول. وعمر النصف الحيوي ساعتان تقريباً.
المقارنة مع مضادات الالتهاب اللاستيرويدية
على عكس المسكنات الشائعة الأخرى مثل الأسبرين والإيبوبروفين، فأن الباراسيتامول لديه نشاط مضاد للالتهاب ضئيل نسبياً، ولذلك لا يُعتبر مضاد التهاب لا ستيرودي.
الكفاءة
عند مقارنة الباراسيتامول بمضادات الالتهاب اللاستيرويدية الأخرى، تُظهر الدراسات نتائج متناقضة. فقد وجدت دراسة معتمدة على تجربة عشوائية لعلاج ألم خشونة المفاصل المزمن في البالغين أن الباراسيتمول له نفس فائدة وتأثير الإيبوبروفين.[29] وعلى الرغم من ذلك فأن تجربة عشوائية أخرى لعلاج ألم العظام في الأطفال وجدت أن جرعة الإيبوبروفين القياسية الموجودة في المنتجات فوق الطاولة (400 مغ) تعطى تسكين أعلى للألم من جرعة الباراسيتامول القياسية (1000 مغ).[30]
الآثار الجانبية
عند تناول الباراسيتامول بالجرعات الموصي بها فأنه لا يهيج جدار المعدة أو يؤثر على تجلط الدم كما تفعل مضادات الالتهاب اللاستيرويدية الأخرى أو حتى يؤثر على وظائف الكلية. ولكن أظهرت بعض الدراسات أن الجرعة العالية (أكثر من 2,000 مغ في اليوم) يمكنها أن تزيد من احتمالية التعرض لمضاعفات في الجهاز الهضمي العلوي.[31]
والباراسيتامول آمن أثناء الحمل، ولا يؤثر على غلق القناة الشريانية الجنينة كما تفعل مضادات الالتهاب اللاستيرويدية. وبالتناقض مع الأسبرين، فإن الباراسيتامول آمن للأطفال لأنه لا يسبب متلازمة راي في الأطفال المصابين بأمراض فيروسية.
وبالتماثل مع مضادات الالتهاب اللاستيرويدية وبالتناقض مع المسكنات الأفيونية، فأن الباراسيتامول لايسبب غبطة (يوفوريا) أو يغير المزاج بأي شكل من الأشكال. وبينما يمكن للباراسيتامول ومضادات الالتهاب اللاستيرويدية أن تضر الكبد، إلا أن لها احتمالية ضعيفة في أن تسبب إدمان، إعتماد حيوي، تحمل أو أعراض إنسحاب.
يمكن للباراسيتامول، خصوصاُ بالإشتراك مع الأفيونات الضعيفة، أن يسبب صداع مرتد أكثر من مضادات الالتهاب اللاستيرويدية (صداع بسبب كثرة استخدام الدواء) على الرغم من ذلك فإن هذه الإحتمالية أقل بالمقارنة مع الإرگوتامين أو التريبتانات التي تستخدم لعلاج الشقيقة.[32]
وفي عام 2008، قدمت دراسة حالة أولية معتمدة على بحث أولي الدليل على أن تعاطي الباراسيتامول بعد التطعيم الثلاثي (الحصبة، النكاف والحصبة الألمانية) مرتبط بظهور التوحد في الأطفال من 1-5 سنوات. ويبدو أن هذا يظهر فقط في الأطفال الذين يظهرون إرتداد يصاحبه عواقب ما بعد التطعيم مثل حمى. ولم يظهر هذا التأثير مع مسكنات الألم الأخرى مثل الإيبوبروفين. ولم يتم تأكيد هذه الدراسة من مصدر مستقل.[33]
الاستعمال
دواعي الاستعمال
- تسكين الألم سواء كان حاد أو مزمن، خفيف أو متوسط الشدة.[34] ويمكن استخدامه بمفرده أو بالاشتراك مع مسكنات أخرى (كودائين، ديكستروبروبوكسيفين أو ترامادول).
موانع الاستعمال
يمكن أن يوجد الأسبارتام مع الباراسيتامول في بعض المستحضرات، وفي هذه الحالة يمنع استخدامه في حالة الفينايلكيتونوريا.[36]
الحمل والرضاعة
- يمكن استعمال الباراسيتامول أثناء الحمل والرضاعة. ولم يثبت بأن له تأثيرات تؤدي لتشوه الأجنة أو تسممها أثناء الحمل.[36]
- أثناء فترة الرضاعة، يعبر الباراسيتامول في لبن الأم إلى الرضيع وتكون نسبته في اللبن أقل من 2% ولذلك لا يمنع استعماله للمرضعات.[36]
- من المحتمل أن توجد علاقة بين تعاطي الحوامل للباراسيتامول أثناء الحمل خصوصاً في الثلاثة أشهر الأولي وبين احتمال إصابة الأطفال بمشاكل تنفسية أو ربو قبل بلوغهم سن السابعة.[37]
التداخلات الدوائية
بعيداً عن بعض مضادات التجلط الفموية، لا توجد أي تداخلات بين الباراسيتامول وأي دواء أخر. وعند استخدام 3 غرامات باراسيتامول يومياً مقسمة على جرعات ولمدة أربعة أيام متصلة، يمكنه أن يزيد من نشاط مضادات التجلط المضادة لفيتامين ك.[36] وفي هذه الحالة، يجب وضع المريض تحت الملاحظة.[38][39]
الإختبارات المعملية
يمكن للباراسيتامول أن يتداخل مع الاختبارات المعملية الآتية ويغير من نتائجها الحقيقية[36]:
- قياس كمية حمض اليوريك في الدم بطريقة حمض الفوسفوتنغستيك.
- قياس تركيز الغلوكوز في الدم بطريقة الغلوكوز أوكسيداز - بيروكسيداز.
التداخلات الغذائية
لا يوجد أي نوع من التداخلات تم الإبلاغ عنها بين الباراسيتامول وأي نوع من الأطعمة.[36]
معلومات عامة
- يمكن شراءه من الصيدليات بدون أمر الطبيب.
- في حالة نسيان ميعاد أخر جرعة أُخذت، يمكن تعاطي الباراسيتامول في ذلك الوقت ثم يستكمل نظام العلاج كما قرره الطبيب مع مراعاة أخذ الجرعات كل 4 ساعات.
- يجب ابتلاع أقراص الدواء مع سوائل مثل الماء، اللبن أو عصير فواكه
التسمم
تحتوي العديد من الوصفات على الباراسيتامول سواء كانت أدوية فوق الطاولة أو بأمر الطبيب. وبسبب سهولة الحصول عليه من الصيدليات أوالمتاجر توجد احتمالية كبيرة أن يحدث للمستهلك تسمم من جراء تناول جرعة مفرطة.[40] ويمكن أن تؤدي الجرعة المفرطة إلى فشل كبدي يؤدي للموت في غضون أيام مالم يُعالج المصاب في الحال. ولايزال التسمم بالباراسيتامول هو السبب الأكثر شيوعاً للفشل الكبدي الحاد في الولايات المتحدة وبريطانيا.[6][41]
آلية التسمم
تتحول معظم كمية الباراسيتامول إلى مركبات خاملة خلال المرحلة الثانية من الاستقلاب التي يتم فيها ترافق الباراسيتامول مع الكبريتات والغلوكورونيد. وتتأكسد كمية صغيرة من الباراسيتامول عن طريق إنزيمات السيتوكروم 450 ب وتتحول إلى مستقلب وسيط عالى التفاعلية (النبقي أو ن-أسيتيل-بارا-بنزو-كينون إمين).[42][43][44]
ويقوم الحمض الأميني الغلوتاثيون بمنع التسمم بالنبقي عن طريق الترافق معه وتكوين مركب جديد غير سام. ولكن في حالات زيادة كمية الباراسيتامول في الجسم، فإن الباراسيتامول يترافق مع كل كميات الكبريتات والغلوكورونيد المتاحة وتتجه الكمية الباقية منه إلى إنزيمات السيتوكروم 450 ب ليتحول إلى النبقي. وتكون كمية النبقى أكثر من كمية الغلوتاثيون اللازمة للترافق معه وبالتالي يستنفذ الغلوتاثيون من الخلايا الكبدية، ويكون النبقي حراً في التفاعل مع جزيئات الأغشية الخلوية الكبدية مما ينتج عنه دمار خلوي واسع في الكبد يسبب تليف كبدي حاد يؤدي إلى الوفاة. وقد أظهرت التجارب الحيوانية أن التسمم الكبدي يحدث عندما تستنفذ نسبة الغلوتاثيون الكبدي إلى أقل من 70%.[42]
الجرعة السامة
تتنوع جرعة الباراسيتامول السامة تنوعاً كبيراً. ففي البالغين، فجرعة واحدة أعلى من 10 غرام أو 200 مغ/كغ يمكن أن تسبب تسمم.[45][3] ويمكن أن يحدث تسمم أيضاً عند تعاطي عدة جرعات صغيرة على مدار اليوم مجموعها أعلى من هذه الكمية.[3] أما في الأطفال فجرعة واحدة أعلى من 200 مغ/كغ يمكن أن تسبب تسمم.[46] لكن جرعة الباراسيتامول المفرطة نادراً ما تؤدي للمرض أو الوفاة في الأطفال. ونادراً ما بتناول طفل كمية باراسيتامول على مرة واحدة تتطلب علاجه. ولكن معظم حالات التسمم في الأطفال تأتي من الاستعمال المزمن للباراسيتامول.[3]
عند تعاطي واحد غرام باراسيتامول أربع مرات في اليوم، فثلث المرضى يمكن أن تزيد عندهم قيم اختبار وظائف الكبد ثلاثة أضعاف القيم العادية.[47] لكن من غير المؤكد إذا كان ذلك يمكن أن يؤدي إلى فشل كبدي.[48]
ولأن الباراسيتامول يكون مُحضر بالإشتراك مع مواد أخرى في المستحضرات الطبية، فأنه من الضروري حصر جميع مصادر الباراسيتامول التي تناولها الشخص المصاب بالتسمم لمعرفة الكمية التي تناولها. فالباراسيتامول يدخل في العديد من التركيبات المسكنة للألم أو تركيبات الإنفلونزا. وفي بعض الأحيان يحضر بالإشتراك مع أفيونات مثل الهيدروكودون لتقليل استعمال الباراسيتامول بدون داعي وكذلك حتى لا يدمن المريض المادة الأفيونية. وفي الواقع فأن الموتى بسبب الجرعات المميتة أو الفشل الكلوي المزمن من جراء استعمال الباراسيتامول أكثر من عدد الموتى بسبب الأفيونات.[49]
عوامل الخطورة
يحفز الإنكباب المزمن على تناول المشروبات الكحولية إنزيمات السيتوكروم 450 ب، مما يؤدي إلى زيادة احتمالية الإصابة بتسمم الباراسيتامول.[50] وعلى الرغم من ذلك فأن هذه الإحتمالية لا تزال محل جدل بين علماء السموم.[51][52] وذهب بعضهم إلى القول أن تناول الكحول عند تناول جرعة باراسيتامول مفرطة له تأثير واقي من التسمم.[51][53]
والصيام عامل خطورة لأنه عند الصيام تستنفذ مخزونات الغلوتاثيون الكبدية.[3] ومن المعروف أن الأيزرونيازيد - وهو محفز للسيتوكروم 450 ب - يزيد من خطورة تسمم الكبد ولكن آلية حدوث هذا التسمم الكبدي غير معروفة.[54][55] ولكن من المؤكد أن الاستخدام المتزامن لأي دواء محفز للسيتوكروم مع الباراسيتامول سواء كان أيزونيازيد، كاربامازيبين، فينيتوين أو باربيتيورات يزيد من احتمالية التسمم بالباراسيتامول.[56]
العلامات والأعراض
لا يظهر على الأفراد الذين تناولوا جرعة زمفرطة من الباراسيتامول أي أعراض معينة خلال 24 ساعة. ويمكن أن تحدث أعراض غثيان، قئ وتعرق غزير في البداية وتختفي بعد عدة ساعات في معظم الحالات. وإذا أُمتصت الجرعة السامة، يصاب الفرد بفشل كبدي صريح بعد فترة من عدم ظهور أعراض التسمم عليه. وعند تناول جرعات كبيرة جداً يمكن أن تحدث غيبوبة وحماض استقلابي قبل الإصابة بالفشل الكبدي.[57][58]
ويحدث الضرر للخلايا الكبدية لأن الكبد هو مكان الاستقلاب الرئيسي للباراسيتامول. ولكن في بعض الحالات النادرة، يمكن أن يحدث فشل كلوي حاد. وهذا يحدث عادة بسبب أما متلازمة كبدية-كلوية أو متلازمة اختلال وظيفة أكثر من عضو. ويمكن أن يكون الفشل الكلوي الحاد هو العرض الظاهري الأول للتسمم بدلاً من الفشل الكبدي الحاد. ويُرجح أن المستقلب السام قد تم إنتاجه في الكلية أكثر منه في الكبد في هذه الحالة.[59]
وتختلف شدة التسمم بالباراسيتامول على حسب كمية الجرعة وسرعة ودقة العلاج. ويمكن أن يؤدي التليف الكبدي الشامل في بعض الحالات إلى فشل كبدي خاطف يصاحبه مضاعفات مثل نزف، انخفاض غلوكوز الدم، فشل كلوي، اعتلال الدماغ الكبدي، وذمة دماغية، نتان واختلال وظيفة العديد من أعضاء الجسم والموت خلال أيام. وفي معظم الحالات يمكن أن يشفى المريض من التليف الكبدي ويرجع الكبد إلى حالته الطبيعية خلال أسابيع قليلة.[60]
تشخيص التسمم
يمكن التأكد من ظهور تسمم الكبد في غضون فترة من يوم إلى أربعة أيام. وفي الحالات الخطيرة، يمكن التأكد خلال 12 ساعة فقط. ويحتمل وجود مضض في المراق الأيمن. ويمكن أن تُظهر الاختبارات المعملية الدليل على الإصابة بتليف كبدي جسيم عن طريق المستويات المرتفعة للأسبرتات ترانسأميناز، ألانين ترانسأميناز، البيليروبين و زيادة زمن التجلط (خصوصاً زيادة زمن البروثرومبين). ويمكن تشخيص تسمم الكبد بسبب تناول جرعة باراسيتامول مفرطة عندما يتعدا الأسبرتات ترانسأميناز والألانين ترانسأميناز 1000 وحدة دولية/لتر. ويمكن أن تتعدى مستويات الأسبرتات ترانسأميناز والألانين ترانسأميناز 10،000 وحدة دولية/لتر. وعموماً فأن الأسبرتات ترانسأميناز يكون أكثر من الألانين ترانسأميناز في حالة تسمم الكبد بسبب الباراسيتامول.
وظهر جهاز النوموغرام لقياس كميات الدواء في الدم عام 1975، وساعد الجهاز على تأكيد خطورة التسمم بالباراسيتامول عند قياسه في الدم بعد فترة معينة من تناوله.[61] ولتحديد إحتمالية الإصابة بالتسمم الكبدي، يتم تتبع مستوى الباراسيتامول على طول جهاز النوموغرام القياسي. ويمكن أن تعطى عينة الدم التي تُسحب بعد أول أربع ساعات من تناول الباراسيتامول قياس أقل من الكمية الموجودة فعلاً في الدم لأنه يمكن أن يكون الباراسيتامول لا يزال في مرحلة الامتصاص في القناة الهضمية. كما أن تأخير سحب العينة غير محبز لأن تاريخ هذه الحالات غير موثق كفاية ويجب قياس مستوى الباراسيتامول دائماً لإعطاء الدرياق وقت التأكد من وجود مستوى سام في الدم.
العلاج
العلاج الأولي
في البداية، تُعالج جرعة الباراسيتامول المفرطة البسيطة، مثل معظم باقي الجرعات المفرطة، بالتطهير المعوي. كما يلعب الأسيتيل سيستئين دوراً مهماً كدرياق. ويُمتص الباراسيتامول كاملاً في القناة الهضمية خلال ساعتين في الظروف العادية، ولذلك يمكن أن يفيد التطهير المعوي قبل مرور هذا الوقت على تناول الباراسيتامول. ويؤخر وجود الغذاء في المعدة امتصاص الباراسيتامول. وتوجد العديد من الخيارات التي يمكن أن يتبعها الطبيب لتطهير المعدة. وفي الأغلب يتم استخدام الفحم المنشط، كما يمكن غسل المعدة إذا كانت الكمية يمكن أن تهدد حياة المريض ويتم اجراءها خلال ساعة من التعاطي.[62] ولايفيد شراب عرق الذهب في علاج جرعة الباراسيتامول المفرطة لأن القئ يعطل مفعول الفحم المنشط والأسيتيل سيستئين الفموي.[45]
ويقلل الفحم المنشط من امتصاص الباراسيتامول في القناة الهضمية بامتزازه. ويفضل الأطباء استعمال الفحم المنشط على الغسيل المعوي لأن الأخير يمكن أن يسبب ذات الرئة الاستنشاقية. وكان الأطباء في السابق يترددون في استعمال الفحم المنشط لاحتمال امتزازه للأسيتيل سيستئين. وقد أظهرت دراسات أن الاستيل سستين الفموي يُمتص بنسبة 39% فقط عند اعطاءه في نفس الوقت مع الفحم المنشط.[63] وتحبذ دراسات أخرى استخدام الفحم المنشط قبل مرور ساعتين على تناول الجرعة المفرطة من الباراسيتامول.[64] ويمكن استعماله بعد مرور ساعتين في حالة تأخر افراغ المعدة بسبب أدوية معينة أُخذت مع الباراسيتامول أو عند تناول مستحضرات باراسيتامول ممتدة المفعول. ويجب استعمال الفحم المنشط إذا كانت الأدوية المأخوذة مع الباراسيتامول تستدعي تطهير المعدة. أما بالنسبة للأسيتيل سيستئين الفموي، فهناك توصيات متناقضة[63][65] بالنسبة لكمية وميعاد الجرعة التي يجب استعمالها بعد تعاطي الفحم المنشط.
أسيتيل سيستئين
يقلل الأسيتيل سيستئين إنگليزية: N-Acetyl Cystine من سمية الباراسيتامول بتوفيره مجموعات سلفهيدريل (في صورة غلوتاثيون بصورة أساسية) للتفاعل مع النبقي ومنعه من تدمير خلايا الكبد واطراحه خارج الجسم بلا ضرر. ويوصى باستعمال الميثيونين في بعض الحالات[66] على الرغم من أن بعض الدراسات تؤكد أفضلية الأسيتيل سيستئين كدرياق لجرعات الباراسيتامول المفرطة.[67]
إذا تم استعمال الأسيتيل سيستئين قبل مرور ثماني ساعات على تعاطي الباراسيتامول، تقل خطورة التعرض لتسمم الكبد بصورة كبيرة. أما إذا استعمل بعد مرور ثماني ساعات، تقل فاعليته بصورة حادة لأنه حينها يكون قد بدأ مسلسل التفاعلات السامة في الكبد، وتزداد خطورة الاصابة بالتليف الكبدي الحاد الذي يؤدي للموت. وعلى الرغم من أن فاعلية الأسيتيل سيستئين تزيد عند استعماله مبكراً، إلا أنه يفضل تعاطيه بعد مرور 48 ساعة على بلع الباراسيتامول.[68] وفي الممارسة الطبية، إذا حضر المريض للمستشفى بعد مرور ثماني ساعات على جرعة الباراسيتامول المفرطة، تصبح فائدة استعمال الفحم المنشط محل شك، ويبدأ العلاج بالأسيتيل سيستئين في الحال. وكان الطبيب في الماضي يعطي المريض الفحم المنشط بمجرد وصوله المستشفى، ثم يبدأ استعمال الأسيتيل سيستئين، وينتظر نتائج قياس مستوى الباراسيتامول في الدم من المعمل.
يُعتبر كل من الأسيتيل سيستئين الفموي والوردي متساويا الكفاءة في الولايات المتحدة. بينما يُوصى باستعمال الأسيتيل سيستئين الوريدي في أستراليا، جنوب شرق أسيا وبريطانيا. يُعطى 140 مغ/كغ كجرعة تحميل من الأسيتيل سيستئين الفموي يتبعها 17 جرعة 70 مغ/كغ كل أربعة ساعات.[69] ويُتحمل الأسيتيل سيستئين بصعوبة بسبب طعمه المر ورائحته غير الطبية واحتمال تسببه في غثيان وقيء. يمكن تخفيف محلول الأسيتيل سيستئين تركيز 10% أو 20% الذي يباع في الصيدليات إلى تركيز 5% لزيادة تقبله من قِبل المريض. و عادة يمكن استعمال مستحضر الأسيتيل سيستئين المجهز للاستنشاق فموياً إذا تطلب الأمر. كما يمكن لصيدلي المستشفى أن يخفف المستحضر الاستنشاقي ويعقمه بالترشيح واستعماله وريدياً ولكن هذه الطريقة نادرة وغير شائعة. وإذا تطلب الأمر استعمال الفحم المنشط على عدة جرعات لتطهير المعدة من دواء بُلع من الباراسيتامول، يجب الفصل بساعتين بين جرعة الأسيتيل سيستيين والفحم المنشط.
يُستخدم الأسيتيل سيستئين الوريدي بالتسريب الوريدي المستمر على 20 ساعة (الجرعة الكاملة: 300 مغ/كج). والاستعمال الموصي به يتضمن تسريب 150 مغ/كغ كجرعة تحميل تحل في 200 مل دكستروز5%وتعطى على 15 إلى 60 دقيقة، يتبعها تسريب 50 مغ/كغ تحل في 500 مل دكستروز5%وتعطى على 4 ساعات ثم تسرب 100 مغ/كغ الأخيرةتحل في 1000مل دكستروز5% وتعطى على 16 ساعة الباقية.[3] ومن مميزات الاستعمال الوريدي للأسيتيل سيستئين أنه يقلل مدة بقاء المريض بالمستشفى ويريح كلا من الطبيب والمريض كما أنه يسمح باستعمال الفحم المنشط بدون القلق من امتزازه للأسيتيل سيستئين الفموي.[70]
وتتضمن تحاليل المعمل الأساسية التي يجب إجراءها على دم المريض قياس نسب البيليروبين، الأسبرتات ترانسأميناز، الألانين ترانسأميناز وزمن البروثرومبين. وتجرى التحاليل يومياً على الأقل. وبمجرد أن يتم اكتشاف تعاطي جرعة مفرطة محتملة التسمم، يستمر اعطاء الأسيتيل سيستئين حتى ينتهي النظام الموضوع له حتى بعد أن تظهر التحاليل اختفاء الباراسيتامول في الدم. وإذا أصيب المريض بفشل كبدي، يجب استمرار استعمال الأسيتيل سيستئين وعدم الاكتفاء بالجرعات المعيارية الموصوفة حتى تتحسن وظائف الكبد أو يتم زرع كبد للمريض.
ما بعد التسمم
يزيد معدل وفاة المريض بعد يومين من ابتلاع الجرعة المفرطة ويصل هذا الاحتمال إلى ذروته في اليوم الرابع ثم يتناقص تدريجياً. و يُوضع المرضى ذوي الحالة المتدهورة عادة تحت احتمال زرع كبد. ويكون احمضاض الدم هي المؤشر الهام الوحيد على معدل الوفاة والحاجة إلى زرع كبد. وأُبلغ عن معدل وفاة يبلغ 95% للمرضى الذين يقل الرقم الهيدروجيني لديهم عن 7،30. ومن المؤشرات الأخرى على الحالة المتدهورة تتضمن قصور وظيفة الكلي، اعتلال الدماغ الكبدي من الدرجة الثالثة أو أسواً، زيادة ملحوظة في زمن البروثرومبين، أو زيادة في زمن البروثرومبين من اليوم الثالث للرابع. وأظهرت إحدى الدراسات أنه عندما يكون مستوى العامل الخامس لتخثر الدم أقل 10% من المستوي الطبيعي يدل على حالة متدهورة (91% وفاة)، أما إذا كانت النسبة بين العامل الثامن إلى العامل الخامس أقل من 30 تدل على حالة جيدة (100% نجاة).[71]
الوقاية
من إجراءات الوقاية من تسمم الباراسيتامول - بجانب الامتناع عن تناول الجرعات المفرطة - هو استخدام مستحضر بارادوت الذي يحتوي على 100 مغ ميثيونين و500 مغ باراسيتامول. ويضمن الميثيونين وجود مستويات كافية من الغلوتاثيون في الكبد لحمايته إذا أُخذت جرعة باراسيتامول مفرطة.
تأثير الباراسيتامول على الحيوانات
الباراسيتامول شديد السمية على القطط، ولا يجب إعطائهم الباراسيتامول تحت أي ظرف لأن القطط تفتقد إنزيمات الغلوكورونيل ترانسفيراز الضرورية لتكسير الباراسيتامول، فحتى قطعة صغيرة من قرص الباراسيتامول تستطيع قتلها.[72] الأعراض الأولية لتسمم القطط تتضمن قيء، زيادة اللعاب وتغير لون اللثة واللسان. ويُدمر الكبد في غضون يومين مما يؤدي للأصابة باليرقان. وعلى عكس التسمم في الإنسان، فأن أضرار الكبد نادراً ما يكون سبب النفوق؛ ويكون الاختناق الذي يسببه تكون الميتهيموگلوبين وإنتاج أجسام هاينز في خلايا الدم الحمراء مما يمنع نقل الأكسجين عبر الدم. ويمكن علاج التسمم الناتج عن الجرعات الصغيرة بفاعلية ولكن يجب أن يكون سريعاً جداً.
أما في الكلاب، فالباراسيتامول مضاد التهاب مفيد وآمن، واحتمال تسببه في تقرح المعدة أقل من مضادات الالتهاب اللاستيرويدية. ويجب استخدامه بأمر الطبيب البيطري. ويتوفر مستحضر الباراسيتامول-كودائين[73] المرخص للكلاب في صيدليات المملكة المتحدة بأمر الطبيب البيطري.[74]
وإذا اشتبه في تناول القطط لأي باراسيتامول أو إفراط الكلب في تناول جرعة باراسيتامول يجب عرضهم على طبيب بيطري في الحال لإزالة التسمم.[75] وتتضمن تأثيرات التسمم فقر دم انحلالي، أكسدة تدميرية لخلايا الدم الحمراء وميل للنزيف. ولا توجد أدوية منزلية تستطيع علاج تسمم الحيوانات ورجوع الكبد لوظائفه الطبيعية يعتمد على سرعة عرض الحيوان على الطبيب البيطري. ويمكن أن يتضمن علاج جرعة الباراسيتامول المفرطة بواسطة الطبيب البيطري تعويض السوائل، الأسيتيل سيستئين، الميثيونين أو س-أدينوزيل-ل-ميثيونين لابطاء اضرار الكبد وسيميتيدين للحماية من قرحة المعدة. وبمجرد حدوث اضرار الكبد فلا يمكن الرجوع عنه.[76] يمكن أن يساعد فيتامين ج في تحويل الميتهيموگلوبين إلى هيموغلوبين (6 * 30 مغ/كغ كل 6 ساعات).
الباراسيتامول مميت للثعابين، واستخدم في محاولات التحكم في ثعبان الأشجار البني في گوام.[77]
تأثير الباراسيتامول على البيئة
يمكن للباراسيتامول أن يتحول إلى مركب سام طبقاً لأحدى الدراسات[78]، ولأن محطات إعادة تحلية مياه المجاري تقوم بتنقية المياه بأكسدتها بماء جافل. ويتحول الباراسيتامول بواسطة الدالف هيبوكلوريت (-ClO)، إلى ن-أسيتيل-بارا-بنزوكينون إمين و 1,4-بنزوكينون. والمركب الأول (النبقي) سام للكبد بينما يشتبه أن الثاني مسمم جيني ويسبب طفرات. ويجب إجراء المزيد من الدراسات لمعرفة تركيزات هذه المواد في مياه المجاري ومدة بقاء هذه المواد في البيئة. [Image:Bowl hygeia.jpg|thumb|left|Bowl of Hygeia]]
طالع أيضاً
المصادر
- ^ [1]
- ^ Control of Pain in Patients with Cancer Sign Guidelines 40Section 6 [2].
- ^ أ ب ت ث ج ح Daly FF, Fountain JS, Murray L, Graudins A, Buckley NA (2008). "Guidelines for the management of paracetamol poisoning in Australia and New Zealand—explanation and elaboration. A consensus statement from clinical toxicologists consulting to the Australasian poisons information centres". Med. J. Aust. 188 (5): 296–301. PMID 18312195.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Khashab M, Tector AJ, Kwo PY (2007). "Epidemiology of acute liver failure". Curr Gastroenterol Rep. 9 (1): 66–73. PMID 17335680.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Hawkins LC, Edwards JN, Dargan PI (2007). "Impact of restricting paracetamol pack sizes on paracetamol poisoning in the United Kingdom: a review of the literature". Drug Saf. 30 (6): 465–79. PMID 17536874.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Larson AM, Polson J, Fontana RJ; et al. (2005). "Acetaminophen-induced acute liver failure: results of a United States multicenter, prospective study". Hepatology. 42 (6): 1364–72. doi:10.1002/hep.20948. PMID 16317692.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Gormley, James J. "White willow bark is a gentle, effective pain-reliever." Better Nutrition. March, 1996. Retrieved on August 17, 2007.
- ^ "The Aspirin story". Did You Know?.
{{cite web}}: Unknown parameter|accessday=ignored (help); Unknown parameter|accessmonth=ignored (|access-date=suggested) (help); Unknown parameter|accessyear=ignored (|access-date=suggested) (help) - ^ أ ب Pain relief: from coal tar to paracetamol. RSC, article de juillet 2005. En ligne, page consultée le 15 janvier 2008.
- ^ Patrice Queneau, La Saga du paracétamol. Médecine, volume 2, numéro 4, pp 158-9, avril 2006, Thérapeutiques. En ligne, page consultée le 15 janvier 2008.
- ^ Petite histoire du médicament
- ^ Note : transformation en trois étapes, par réduction du NO2 en NH2 ; éthylation du groupe OH ; et finalement acylation du groupe NH2.
- ^ (إنگليزية)Exp't 461 Acetaminophen, Tylenolقالب:Pdf sur courses.chem.psu.edu
- ^ H. N. Morse (1878). "Ueber eine neue Darstellungsmethode der Acetylamidophenole". Berichte der deutschen chemischen Gesellschaft. 11 (1): 232–233. doi:10.1002/cber.18780110151.
- ^ Brodie BB, Axelrod J (1948). "The fate of acetanilide in man" (PDF). J Pharmacol Exp Ther. 94 (1): 29–38.
- ^ "A Festival of Analgesics." Chemical Heritage Foundation. 2001. Retrieved on August 17, 2007.
- ^ Rossi, S. (ed.) (2008). Australian Medicines Handbook 2008. Adelaide: Australian Medicines Handbook. p. 30. ISBN 0-9757919-6-7.
{{cite book}}:|author=has generic name (help); Check|isbn=value: checksum (help) - ^ أ ب Kis B, Snipes JA, Busija DW (2005). "Acetaminophen and the cyclooxygenase-3 puzzle: sorting out facts, fictions, and uncertainties". J. Pharmacol. Exp. Ther. 315 (1): 1–7. doi:10.1124/jpet.105.085431. PMID 15879007.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Aronoff DM, Oates JA, Boutaud O (2006). "New insights into the mechanism of action of acetaminophen: Its clinical pharmacologic characteristics reflect its inhibition of the two prostaglandin H2 synthases". Clin. Pharmacol. Ther. 79 (1): 9–19. doi:10.1016/j.clpt.2005.09.009. PMID 16413237.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Bertolini A, Ferrari A, Ottani A, Guerzoni S, Tacchi R, Leone S (2006). "Paracetamol: new vistas of an old drug". CNS drug reviews. 12 (3–4): 250–75. doi:10.1111/j.1527-3458.2006.00250.x. PMID 17227290.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Graham GG, Scott KF (2005). "Mechanism of action of paracetamol". American journal of therapeutics. 12 (1): 46–55. doi:10.1097/00045391-200501000-00008. PMID 15662292.
- ^ Ohki S, Ogino N, Yamamoto S, Hayaishi O (1979). "Prostaglandin hydroperoxidase, an integral part of prostaglandin endoperoxide synthetase from bovine vesicular gland microsomes". J. Biol. Chem. 254 (3): 829–36. PMID 104998.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Harvison PJ, Egan RW, Gale PH, Nelson SD (1986). "Acetaminophen as a cosubstrate and inhibitor of prostaglandin H synthase". Adv. Exp. Med. Biol. 197: 739–47. PMID 3094341.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Roberts, L.J II. & Marrow, J.D. "Analgesic-antipyretic and Antiinflammatory Agents and Drugs Employed in the Treatment of Gout" in, "Goodman & Gilman's The Pharmacological Basis of Therapeutics 10th Edition" by Hardman, J.G. & Limbird, L.E. Published by McGraw Hill, 2001, p.687–731.
- ^ Högestätt ED, Jönsson BA, Ermund A; et al. (2005). "Conversion of acetaminophen to the bioactive N-acylphenolamine AM404 via fatty acid amide hydrolase-dependent arachidonic acid conjugation in the nervous system". J. Biol. Chem. 280 (36): 31405–12. doi:10.1074/jbc.M501489200. PMID 15987694.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Köfalvi A (2008). "Chapter 9: Alternative interacting sites and novel receptors for cannabinoid ligands. In: 'Cannabinoids and the Brain' Springer-Verlag": 131–160. doi:10.1007/978-0-387-74349-3_9.
{{cite journal}}: Cite journal requires|journal=(help) - ^ Ottani A, Leone S, Sandrini M, Ferrari A, Bertolini A (2006). "The analgesic activity of paracetamol is prevented by the blockade of cannabinoid CB1 receptors". Eur. J. Pharmacol. 531 (1–3): 280–1. doi:10.1016/j.ejphar.2005.12.015. PMID 16438952.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Chandrasekharan NV, Dai H, Roos KL; et al. (2002). "COX-3, a cyclooxygenase-1 variant inhibited by acetaminophen and other analgesic/antipyretic drugs: cloning, structure, and expression". Proc. Natl. Acad. Sci. U.S.A. 99 (21): 13926–31. doi:10.1073/pnas.162468699. PMID 12242329.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Bradley JD, Brandt KD, Katz BP, Kalasinski LA, Ryan SI (1991). "Comparison of an antiinflammatory dose of ibuprofen, an analgesic dose of ibuprofen, and acetaminophen in the treatment of patients with osteoarthritis of the knee". N. Engl. J. Med. 325 (2): 87–91. PMID 2052056.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Clark E, Plint AC, Correll R, Gaboury I, Passi B (2007). "A randomized, controlled trial of acetaminophen, ibuprofen, and codeine for acute pain relief in children with musculoskeletal trauma". Pediatrics. 119 (3): 460–7. doi:10.1542/peds.2006-1347. PMID 17332198.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ García Rodríguez LA, Hernández-Díaz S (December 15, 2000). "The risk of upper gastrointestinal complications associated with nonsteroidal anti-inflammatory drugs, glucocorticoids, acetaminophen, and combinations of these agents". Arthritis Research and Therapy. 3: 98. doi:10.1186/ar146. PMID 11178116.
{{cite journal}}:|access-date=requires|url=(help); Check date values in:|date=(help)CS1 maint: unflagged free DOI (link) - ^ Colás Chacartegui R, Temprano González R, Gómez Arruza C, Muñoz Cacho P, Pascual Gómez J (2005). "[Abuse pattern of analgesics in chronic daily headache: a study in the general population]". Rev Clin Esp. 205 (12): 583–87. PMID 16527179.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Schultz ST, Klonoff-Cohen HS, Wingard DL, Akshoomoff NA, Macera CA, Ji M (2008). "Acetaminophen (paracetamol) use, measles-mumps-rubella vaccination, and autistic disorder: the results of a parent survey". Autism. 12 (3): 293–307. doi:10.1177/1362361307089518. PMID 18445737.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب [3] Paracetamol, Past, Present anf Future.
- ^ Fièvre de l'enfant et du nourrisson, Dr H. Raybaud sur www.esculape.com.
- ^ أ ب ت ث ج ح BIAM, en substance : le Paracetamol, novembre 2004, sur http://www.biam.fr, page consultée le 15 janvier 2008.
- ^ (إنگليزية) [Pre-natal exposure to paracetamol and risk of wheezing and asthma in children - A birth cohort study Error: {{Lang}}: text has italic markup (help)]. Rebordosa et al. Int J Epidemiol. 2008 Apr 9
- ^ (إنگليزية)[Paracetamol in the treatment of osteoarthritis pain Error: {{Lang}}: text has italic markup (help)], Brandt K. Drugs. 2003; 63 Spec No 2:23-41.
- ^ Hansten P.D. et Horn J.R. in : [Drug interactions. Analysis and management. A clinical perspective and analysis of current developments] Error: {{Lang}}: text has italic markup (help). Fact and comparisons. 2000.
- ^ Sheen C, Dillon J, Bateman D, Simpson K, Macdonald T (2002). "Paracetamol toxicity: epidemiology, prevention and costs to the health-care system". QJM. 95 (9): 609–19. doi:10.1093/qjmed/95.9.609. PMID 12205339.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Ryder SD, Beckingham IJ (2001). "ABC of diseases of liver, pancreas, and biliary system. Other causes of parenchymal liver disease". BMJ. 322 (7281): 290–92. doi:10.1136/bmj.322.7281.290. PMID 11157536. [11157536 Free full text]
- ^ أ ب Richardson, JA (2000). "Management of acetaminophen and ibuprofen toxicoses in dogs and cats" (PDF). J Vet Emerg Crit Care. 10: 285–291.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Rumbeiha WK, Lin YS, Oehme FW (1995). "Comparison of N-acetylcysteine and methylene blue, alone or in combination, for treatment of acetaminophen toxicosis in cats". Am. J. Vet. Res. 56 (11): 1529–33. PMID 8585668.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Sellon, R.K. Acetaminophen. In: Peterson ME, Talcott PA, eds. Small Animal Toxicology. Toronto: WB Saunders, 2001: 388–395.
- ^ أ ب Dart RC, Erdman AR, Olson KR, Christianson G, Manoguerra AS, Chyka PA, Caravati EM, Wax PM, Keyes DC, Woolf AD, Scharman EJ, Booze LL, Troutman WG; American Association of Poison Control Centers (2006). "Acetaminophen poisoning: an evidence-based consensus guideline for out-of- hospital management". Clin Toxicol (Phila). 44 (1): 1–18. PMID 16496488.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Tenenbein M (2004). "Acetaminophen: the 150 mg/kg myth". J Toxicol Clin Toxicol. 42 (2): 145–48. PMID 15214618.
- ^ Watkins PB, Kaplowitz N, Slattery JT; et al. (2006). "Aminotransferase elevations in healthy adults receiving 4 grams of acetaminophen daily: a randomized controlled trial". JAMA. 296 (1): 87–93. doi:10.1001/jama.296.1.87. PMID 16820551.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Dart RC, Bailey E (2007). "Does therapeutic use of acetaminophen cause acute liver failure?". Pharmacotherapy. 27 (9): 1219–30. doi:10.1592/phco.27.9.1219. PMID 17723075.
- ^ Brecher, Edward M (1972). Consumers Union Report on Licit and Illicit Drugs. Boston: Little, Brown. ISBN 0316153400.
- ^ Zimmerman HJ, Maddrey WC (1995). "Acetaminophen (paracetamol) hepatotoxicity with regular intake of alcohol: analysis of instances of therapeutic misadventure". Hepatology. 22 (3): 767–73. PMID 7657281.
- ^ أ ب Dargan PI, Jones AL (2002). "Should a lower treatment line be used when treating paracetamol poisoning in patients with chronic alcoholism?: a case against". Drug Saf. 25 (9): 625–32. PMID 12137557.
- ^ Buckley NA, Srinivasan J (2002). "Should a lower treatment line be used when treating paracetamol poisoning in patients with chronic alcoholism?: a case for". Drug Saf. 25 (9): 619–24. PMID 12137556.
- ^ Schmidt LE, Dalhoff K, Poulsen HE (2002). "Acute versus chronic alcohol consumption in acetaminophen-induced hepatotoxicity". Hepatology. 35 (4): 876–82. doi:10.1053/jhep.2002.32148. PMID 11915034.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Crippin JS (1993). "Acetaminophen hepatotoxicity: potentiation by isoniazid". Am J Gastroenterol. 88 (4): 590–92. PMID 8470644.
- ^ Nolan CM, Sandblom RE, Thummel KE, Slattery JT, Nelson SD (1994). "Hepatotoxicity associated with acetaminophen usage in patients receiving multiple drug therapy for tuberculosis". Chest. 105 (2): 408–11. doi:10.1378/chest.105.2.408. PMID 7508362.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Bray GP, Harrison PM, O'Grady JG, Tredger JM, Williams R (1992). "Long-term anticonvulsant therapy worsens outcome in paracetamol-induced fulminant hepatic failure". Hum Exp Toxicol. 11 (4): 265–70. PMID 1354974.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Zezulka A, Wright N (1982). "Severe metabolic acidosis early in paracetamol poisoning". Br Med J (Clin Res Ed). 285 (6345): 851–2. PMC 1499688. PMID 6811039.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Roth B, Woo O, Blanc P (1999). "Early metabolic acidosis and coma after acetaminophen ingestion". Ann Emerg Med. 33 (4): 452–6. PMID 10092726.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Boutis K, Shannon M (2001). "Nephrotoxicity after acute severe acetaminophen poisoning in adolescents". J Toxicol Clin Toxicol. 39 (5): 441–5. doi:10.1081/CLT-100105413. PMID 11545233.
- ^ Linden CH, Rumack BH (1984). "Acetaminophen overdose". Emerg. Med. Clin. North Am. 2 (1): 103–19. PMID 6394298.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Rumack B, Matthew H (1975). "Acetaminophen poisoning and toxicity". Pediatrics. 55 (6): 871–76. PMID 1134886.
- ^ Vale JA, Kulig K; American Academy of Clinical Toxicology; European Association of Poisons Centres and Clinical Toxicologists (2004). "Position paper: gastric lavage". J Toxicol Clin Toxicol. 42 (7): 933–43. doi:10.1081/CLT-200045006. PMID 15641639.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب Ekins B, Ford D, Thompson M, Bridges R, Rollins D, Jenkins R (1987). "The effect of activated charcoal on N-acetylcysteine absorption in normal subjects". Am J Emerg Med. 5 (6): 483–87. doi:10.1016/0735-6757(87)90166-5. PMID 3663288.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Buckley NA, Whyte IM, O'Connell DL, Dawson AH. (1999). "Activated charcoal reduces the need for N-acetylcysteine treatment after acetaminophen (paracetamol) overdose". J Toxicol Clin Toxicol. 37 (6): 753–57. doi:10.1081/CLT-100102452. PMID 10584587.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Spiller H, Krenzelok E, Grande G, Safir E, Diamond J (1994). "A prospective evaluation of the effect of activated charcoal before oral N-acetylcysteine in acetaminophen overdose". Ann Emerg Med. 23 (3): 519–23. doi:10.1016/S0196-0644(94)70071-0. PMID 8135427.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Mant TG, Tempowski JH, Volans GN, Talbot JC (1984). "Adverse reactions to acetylcysteine and effects of overdose". Br Med J (Clin Res Ed). 289 (6439): 217–9. PMC 1442311. PMID 6234965.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Alsalim W, Fadel M (2003). "Towards evidence based emergency medicine: best BETs from the Manchester Royal Infirmary. Oral methionine compared with intravenous n-acetyl cysteine for paracetamol overdose". Emerg Med J. 20 (4): 366–7. PMC 1726135. PMID 12835357.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Keays R, Harrison P, Wendon J, Forbes A, Gove C, Alexander G, Williams R (1991). "Intravenous acetylcysteine in paracetamol induced fulminant hepatic failure: a prospective controlled trial". BMJ. 303 (6809): 1026–9. PMID 1954453.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Woo OF, Mueller PD, Olson KR, Anderson IB, Kim SY (2000). "Shorter duration of oral N-acetylcysteine therapy for acute acetaminophen overdose". Ann Emerg Med. 35 (4): 363–8. PMID 10736123.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ^ Buckley N, Whyte I, O'Connell D, Dawson A (1999). "Oral or intravenous N-acetylcysteine: which is the treatment of choice for acetaminophen (paracetamol) poisoning?". J Toxicol Clin Toxicol. 37 (6): 759–67. doi:10.1081/CLT-100102453. PMID 10584588.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Pereira LM, Langley PG, Hayllar KM, Tredger JM, Williams R (1992). "Coagulation factor V and VIII/V ratio as predictors of outcome in paracetamol induced fulminant hepatic failure: relation to other prognostic indicators". Gut. 33 (1): 98–102. doi:10.1136/gut.33.1.98. PMID 1740285.
{{cite journal}}: CS1 maint: multiple names: authors list (link) قالب:PMC - ^ Allen AL (2003). "The diagnosis of acetaminophen toxicosis in a cat". Can Vet J. 44 (6): 509–10. PMID 12839249.
- ^ "Pardale-V Tablets: Presentation". UK National Office of Animal Health Compendium of Animal Medicines. September 28, 2006.
{{cite web}}: Check date values in:|date=(help); Unknown parameter|accessday=ignored (help); Unknown parameter|accessyear=ignored (|access-date=suggested) (help) - ^ "Pardale-V Tablets: Legal Category". UK National Office of Animal Health Compendium of Animal Medicines. November 15, 2005.
{{cite web}}: Check date values in:|date=(help); Unknown parameter|accessday=ignored (help); Unknown parameter|accessmonth=ignored (|access-date=suggested) (help); Unknown parameter|accessyear=ignored (|access-date=suggested) (help) - ^ Villar D, Buck WB, Gonzalez JM (1998). "Ibuprofen, aspirin and acetaminophen toxicosis and treatment in dogs and cats". Vet Hum Toxicol. 40 (3): 156–62. PMID 9610496.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Manning AM. "Acetaminophen Toxicity in Dogs". PetPlace.com.
{{cite web}}: Unknown parameter|accessday=ignored (help); Unknown parameter|accessmonth=ignored (|access-date=suggested) (help); Unknown parameter|accessyear=ignored (|access-date=suggested) (help) - ^ Johnston J, Savarie P, Primus T, Eisemann J, Hurley J, Kohler D (2002). "Risk assessment of an acetaminophen baiting program for chemical control of brown tree snakes on Guam: evaluation of baits, snake residues, and potential primary and secondary hazards". Environ Sci Technol. 36 (17): 3827–33. doi:10.1021/es015873n. PMID 12322757.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Environmental science & technology. ISSN 0013-936X. Environmental science and technology 2006, vol. 40, n°2, p. 516-522.
وصلات خارجية
- CS1 errors: unsupported parameter
- CS1 errors: generic name
- CS1 errors: ISBN
- CS1 errors: access-date without URL
- CS1 maint: unflagged free DOI
- Lang and lang-xx template errors
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Articles without EBI source
- Articles without KEGG source
- Articles without InChI source
- Articles without UNII source
- Articles containing unverified chemical infoboxes
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- أميدات
- فينولات
- مسكنات ألم
- خافضات حرارة
- الأدوية الأساسية حسب منظمة الصحة العالمية