هيموگلوبين
Hemoglobin, human, adult (heterotetramer, (αβ)2)
| ||
| ||
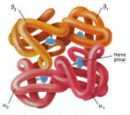
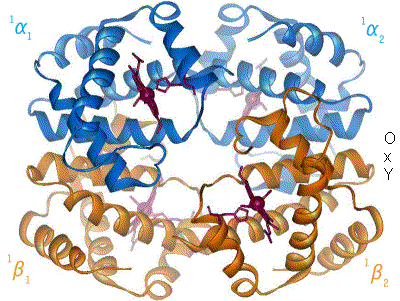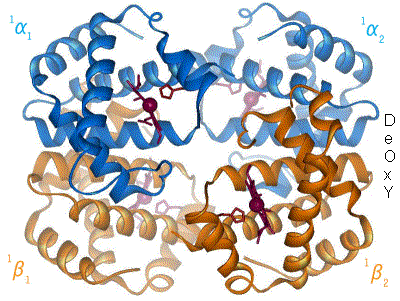
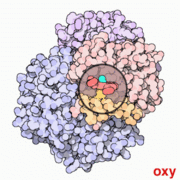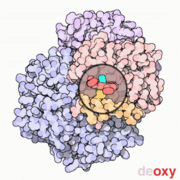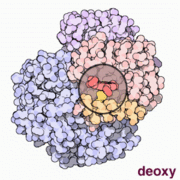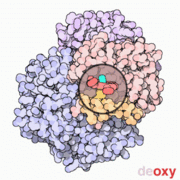
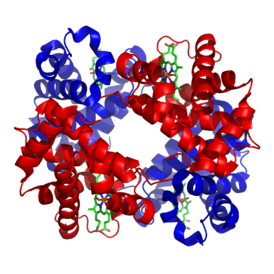
| Structure of human hemoglobin. The protein's α and β subunits are in red and blue, and the iron-containing heme groups in green. From PDB 1GZX قالب:Proteopedia | ||
| - | ||
| Protein type | metalloprotein, گلوبين | |
| Function | ناقل-أكسجين | |
| Cofactor(s) | هيم (4) | |
| - | ||
| Subunit Name |
Gene | Chromosomal Locus |
| Hb-α1 | HBA1 | Chr. 16 p13.3 |
| Hb-α2 | HBA2 | Chr. 16 p13.3 |
| Hb-β | HBB | Chr. 11 p15.5 |
الهيموگلوبين Hemoglobin هو بروتين محمول داخل خلايا الدم الحمراء. يلتقط الأوكسجين في الرئتين ويسلّمه إلى الأنسجة للحفاظ على حياة الجسم. الهيموگلوبين يتكون من بروتينين متماثلين ملتصقان ببعضهما البعض. يجب تواجد كِلا البروتينين ليستطيع الهيموگلوبين تحميل و إعطاء الأوكسجين لخلايا الجسم. أحد البروتينين يدعى ألفا، و الآخر بيتا. قبل الولادة، لا يتم إنتاج بروتين بيتا. لكن يوجد بروتين أخر يحل مكانه يسمى غاما، و هو لا يوجد إلا في طور الجنين، و يعمل كبديل للبيتا إلى وقت الولادة.
مثل جميع البروتينات، مخطّطات تصنيع الهيموگلوبين مخزنة داخل الـ دي إن أي (المادة التي تكون الجينات). الإنسان لديه، في العادة، أربعة جينات للتحكم بتصنيع بروتين ألفا،( سلسلة ألفا). بينما يتحكم جينان آخران بتصنيع سلسلة البيتا. (يوجد إيضا جينين إضافيين للتحكم بإنتاج سلسلة غاما لدى الجنين). يتم إنتاج سلسلة ألفا و بيتا بنفس الكمية، على الرغم من العدد المختلف للجينات. ترتبط سلاسل البروتين تلك بخلايا الدم الحمراء النامية، وتبقى معا طيلة حياة خلية الدم الحمراء.
خلايا الدم الحمراء
خلايا الدم الحمراء تتكوّن من جزئين. الهيموگلوبين في داخل الخلية على شكل سائل. و غشاء يحيط به مشكلا شكل الخلية الخارجي و يحوي الهيموگلوبين في الداخل. يمكن تمثيل الخلية ببالون ماء مطاطي. المطاط سيكون غشاء الخلية، والماء هو الهيموغلوبين. فصائل الدم المعروفة و هي، أي، بي، أو، و أي بي، هي خصائص الغشاء. بينما يكون الهيموگلوبين داخل الخلايا الحمراء متماثل بين جميع أنواع الفصائل و عند جميع البشر. و يمكن تشبيه ذلك ببالونات الماء الملونة، فهنالك البالونات ذات المطاط الأحمر و هنالك البالونات ذات المطاط الأصفر و هكذا، و جميعها تحوي الماء.
إنتاج الهيموگلوبين
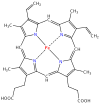
يتطلّب إنتاج الهيموگلوبين تنسيق إنتاج الهيمي و الجلوبين. الهيمي Heme هي مجموعة تعويضية prosthetic group بقوم بالمساعدة بالربط القابل للعكس للأوكسجين مع الهيموغلوبين. بينما الغلوبين Globin هو البروتين الذي يحيط ويحمي جزيئة الهيمي. أربعة سلاسل من الغلوبين (سلسلتا ألفا وسلسلتا بيتا) تتشكل بصورة تشبه الديدان الملتفة. كل سلسلة من الجلوبين تحتوي مجموعة هيمي صغيرة. في مركز كل مجموعة هيمي توجد نواة من ذرة حديد (Fe). في الشكل الأول في الأعلى يظهر الجلوبين المكون من كل من سلسلتي البيتا باللون البرتقالي و سلسلتي الألفا الحمراء، بينما تظهر جزيئات الهيمي باللون الأزرق.
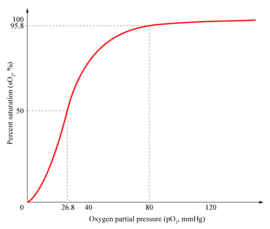
تأثير بور
قدرة الهيموگلوبين على إطلاق الأوكسجين، تتأثّر بقيمة مؤشر الحموضة pH، ثاني أكسيد الكربون CO2، وبالإختلافات في بيئة الرئتين الغنية بالأوكسجين وبيئة الأنسجة قليلة الأوكسجين. قيمة مؤشر الحموضة pH في الأنسجة أقل إلى حد كبير (أكثر حامضية) من الرئتين. يتم توليد البروتونات خلال التفاعل بين ثاني أكسيد الكاربون والماء لتشكيل ثنائي الكربونات bicarbonate:
CO2 + H20 -----------------> HCO3- + H+
هذه الحموضة المتزايدة تخدم غرضين. أولا، تضعف البروتونات الرابط بين الهيموگلوبين و الأوكسجينِ، مما يسمح بإطلاق الأكسجين بصورة سهلة إلى الأنسجة. عند إطلاق ذرات الأكسجين الأربعة المرتبطة بالهيموغلوبين، يرتبط الهيموگلوبين مع بروتونين. هذا يؤدي لدفع توازن التفاعل نحو الجانب الأيمن من المعادلة. هذا هو ما يعرف بتأثير بور The Bohr Effect ، و هو حيوي في إزالة ثاني أكسيد الكربون لأن ثاني أكسيد الكربون لا الذوبان في مجرى الدم. إنّ آيونات ثنائي الكربونات لها قابلية للذوبان أعلى بكثير، وعليه، يمكن إعادتها إلى الرئتين بعد إرتباطها بالهيموغلوبين. إذا لم يستطع الهيموگلوبين إمتصاص البروتونات الزائدة، سينتقل توازن التفاعل إلى يسار المعادلة، ولن يصبح في الإمكان التخلص من ثاني أكسيد الكربون.
في الرئتين، يعمل هذا التأثير بإتجاه عكسي. عند وجود تركيز أوكسجين عالي في الرئتين، فإن إرتباط البروتون يضعف. و يتم إطلاق البروتونات، مما يؤدي إلى نقل توازن التفاعل إلى اليسار، مما يشكل ثاني أكسيد الكربون عديم الذوبان و الّذي يطرد من خلال الرئتين. الهيموگلوبين قليل البروتونات له ميل أكبر للإتحاد مع الأوكسجين، و هكذا تستمر دورة نقل الأكسجين و التخلص من ثاني أكسيد الكربون.
Binding of ligands
- CO2 + H2O → H2CO3 → HCO3- + H+
In similar fashion, hemoglobin also has competitive binding affinity for cyanide (CN-), sulfur monoxide (SO), nitrogen dioxide (NO2), and sulfide (S2-), including hydrogen sulfide (H2S). All of these bind to iron in heme without changing its oxidation state, but they nevertheless inhibit oxygen-binding, causing grave toxicity.
أنماط الهيموگلوبين عند البشر
| hemoglobin, alpha 1 | |
|---|---|
| المميزات | |
| الرمز | HBA1 |
| Entrez | 3039 |
| HUGO | 4823 |
| OMIM | 141800 |
| RefSeq | NM_000558 |
| UniProt | P69905 |
| بيانات أخرى | |
| الموقع | كر. 16 p13.3 |
| hemoglobin, alpha 2 | |
|---|---|
| المميزات | |
| الرمز | HBA2 |
| Entrez | 3040 |
| HUGO | 4824 |
| OMIM | 141850 |
| RefSeq | NM_000517 |
| UniProt | P69905 |
| بيانات أخرى | |
| الموقع | كر. 16 p13.3 |
| hemoglobin, beta | |
|---|---|
| المميزات | |
| الرمز | HBB |
| Entrez | 3043 |
| HUGO | 4827 |
| OMIM | 141900 |
| RefSeq | NM_000518 |
| UniProt | P68871 |
| بيانات أخرى | |
| الموقع | كر. 11 p15.5 |
عند المضغة embryo :
عند الجنين foetus :
- Hemoglobin F (α2γ2) (PDB 1FDH)
عند البالغين :
- Hemoglobin A (α2β2) (PDB 1BZ0) - The most common type.
- Hemoglobin A2 (α2δ2) - δ chain synthesis begins late in the third trimester and in adults, it has a normal level of 2.5%
- Hemoglobin F (α2γ2) - In adults Hemoglobin F is restricted to a limited population of red cells called F-cells.
Variant forms which cause disease:
- Hemoglobin S (α2βS2) - A variant form of hemoglobin found in people with sickle cell disease. There is a variation in the β-chain gene, causing a change in the properties of hemoblobin which results in sickling of red blood cells.
- Hemoglobin C (α2βC2) - Another variant due to a variation in the β-chain gene. This variant causes a mild chronic hemolytic anemia.
تدرُّك الهيموگلوبين عند الحيوانات الفقارية
الاستخدام التشخيصي
Hemoglobin levels are amongst the most commonly performed blood tests, usually as part of a full blood count or complete blood count. Results are reported in g/L, g/dL or mol/L. For conversion, 1 g/dL is 0.621 mmol/L. If the total hemoglobin concentration in the blood falls below a set point, this is called anemia. Normal values for hemoglobin levels are:
- Women: 12.1 to 15.1 g/dl
- Men: 13.8 to 17.2 g/dl
- Children: 11 to 16 g/dl
- Pregnant women: 11 to 12 g/dl [1]
المشاكل الوراثية
كون تركيب الهيموگلوبين هو نفسه لدى جميع البشر، هو أمر ناتج عن كون الجينات التي تشفّر الهيموگلوبين متماثلة ايضا لدى جميع البشر. من حين لآخر، يتغير أحد الجينات لسبب أو لأخر من الأسباب التي يمكن أن تحدث في الطبيعة. هذه التعديلات في الجينات نادرة جداً. و بما ان الجينات يتم توريثها، فهذا يعني أن الجين الذي ينتج هيموغلوبينا شاذا لدى فرد معين، سينتقل إلى أطفاله. و الأطفال سينتجون الهيموگلوبين المعدل و المماثل لذلك عند الوالد. أكثر التغيرات التي تصيب جينات إنتاج الهيموگلوبين لا تسبب أي مشكلة. لكن طبعا أي تغير في البروتين سيغر سماته و سلوكه. أنواع الاضطرابات التي يمكن أن تنتج تتضمّن مرض الخلية المنجلية والتلاسيميا.
على الرغم من أن التغييراتِ التي تنتج الهيموگلوبين الشاذ نادرة، إلا أنه يوجد المئات من الهيموگلوبين الشاذ (المغاير، قد تكون تسمية أفضل). هذا التغاير نتج خلال ملايين السنوات من التطور البشري. معظم الهيموگلوبين المغاير يعمل و يقوم بمهامه بصورة جيدة، و لا يمكن معرفة الإصابة به إلا من خلال فحص الـ دي إن أي حيث أنه لا أعراض جانبية له. بعض أنواع الهيموگلوبين الشاذ، لا يؤدي وظيفته بصورة إعتيادية ويمكن أن ينتج اضطرابات سريرية، مثل مرض الخلية المنجلية.
كيف يؤثر الخلل الوراثي
الجينات يمكن أن تصاب بضرر يؤدي إلى عدم قدرتها على إنتاج كميات طبيعية من الهيموغلوبين. في العادة، أحد مجموعات جينات الهيموگلوبين تتأثّرة، إما مجموعة جين ألفا أو مجموعة جين بيتا. على سبيل المثال، أحد جيني بيتا قد يخفق في إنتاج كمية طبيعية من بروتين سلسلة بيتا. و ستكون جينات ألفا الأربعة تعمل على إنتاج كمية طبيعية من بروتين سلسلة ألفا. سيظهر عدم توازن في كمية بروتين سلسلة ألفا وبروتين سلسلة البيتا داخل الخلية. حيث سيكون هناك كمية من سلسلة ألفا أكثر من اللازم. عدم التوازن هذا يدعى التلاسيميا. في هذا المثال السابق، هو ستكون الحالة هي تلاسيميا بيتا، و ذلك لكون جين سلسلة البيتا هو الذي أخفق.
الهيموگلوبين في التاريخ والفن
انظر أيضا
- كلوروفيل Chlorophyll
- Globin fold
- هيموسيانين Hemocyanin
- هيموپروتين
- مرض الخلية المنجلية Sickle-cell disease
تنويعات الهيموگلوبين:
الوحدات البروتينية للهيموگلوبين (جينات):
المراجع
المصادر
|
|
وصلات خارجية
- Interactive models of hemoglobin (Requires MDL Chime)
- Interactive hemoglobin saturation curves
- National Anemia Action Council - anemia.org
- Pulse Oximetry Glossary