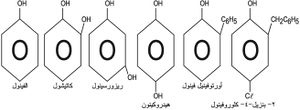
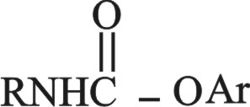فينول
|
| |||
|
| |||

| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك المفضل
Phenol[1] | |||
| اسم أيوپاك النظامي
Benzenol | |||
| أسماء أخرى
Carbolic acid
Phenylic acid Hydroxybenzene Phenic acid | |||
| المُعرِّفات | |||
| رقم CAS | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.003.303 | ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| الخصائص | |||
| الصيغة الجزيئية | C6H6O | ||
| كتلة مولية | 94.11 g mol-1 | ||
| المظهر | Transparent crystalline solid | ||
| الرائحة | Sweet and tarry | ||
| الكثافة | 1.07 g/cm3 | ||
| نقطة الانصهار | |||
| نقطة الغليان | |||
| قابلية الذوبان في الماء | 8.3 g/100 mL (20 °C) | ||
| log P | 1.48[3] | ||
| ضغط البخار | 0.4 mmHg (20 °C)[4] | ||
| الحموضة (pKa) |
| ||
| λmax | 270.75 nm[2] | ||
| Dipole moment | 1.224 D | ||
| علم الأدوية | |||
| C05BB05 (WHO) D08AE03, N01BX03, R02AA19 | |||
| المخاطر | |||
| صفحة بيانات السلامة | [1] | ||
| ن.م.ع. مخطط تصويري |    [6] [6]
| ||
| H301, H311, H314, H331, H341, H373[6] | |||
| P261, P280, P301+P310, P305+P351+P338, P310[6] | |||
| NFPA 704 (معيـَّن النار) | |||
| نقطة الوميض | 79 °C (174 °F; 352 K) | ||
| حدود الانفجار | 1.8–8.6%[4] | ||
| الجرعة أو التركيز القاتل (LD, LC): | |||
LD50 (الجرعة الوسطى)
|
| ||
LDLo (المنشورة الأقل)
|
| ||
LC50 (التركيز الأوسط)
|
| ||
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |||
PEL (المسموح)
|
TWA 5 ppm (19 mg/m3) [skin][4] | ||
REL (الموصى به)
|
| ||
IDLH (خطر عاجل)
|
250 ppm[4] | ||
| مركبات ذا علاقة | |||
مركـّبات ذات علاقة
|
Thiophenol Sodium phenoxide | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
الفينول إنگليزية: Phenol: هو مركب صلب بلوري عديم اللون ذو رائحة قاريّة لطيفة، وغالبًا ما يشار إليها برائحة المشافي. صيغته الكيميائية هو C6H5OH. وبنيته عبارة عن زمرة الهيدروكسيل مرتبطة بحلقة فينيل، وبالتالي فهو مركب عطري.
الفينولات
 مقالة مفصلة: فينولات
مقالة مفصلة: فينولات
تستخدم كلمة الفينول أيضا للإشارة إلى أي مركب يحتوي على حلقة عطرية ذات ست عناصر، مرتبطة مباشرة إلى زمرة الهيدروكسيل (-OH). في الواقع، تعتبر الفينولات فئة من المركبات العضوية التي تحتوي الفينول كعضو أساسي.
الخواص
الفينول محدود الذوبان في الماء (8.3 گ/100مل). وهو حامضي بعض الشيء. ولجزيء الفينول ميل ضعيف لفقد شاردة H+ من زمرة الهيدروكسيل، معطيًا شادرة الفينوكسيد العالية الذوبان في الماء C6H5O−. بالمقارنة مع الكحول الأليفاتي، يظهر الفينول حموضة أعلى من الكحول بكثير، بل و يتفاعل مع محلول NaOH ليفقد H+، في حين أن الكحول الأليفاتي لا يتفاعل. إحدى التفسيرات لزيادة الحموضة هي استقرار الرنين (resonance stabilization) لأنيون الفينوكسيد في الحلقة العطرية. وبهذه الطريقة ، الشحنة السلبية على الأكسجين تتقاسمها ذرات الكربون الأرثو و النظيرة (para)[8]. بتفسير آخر، زيادة الحموضة هي نتيجة لتداخل المدارات بين زوج الأكسجين الوحيد و النظام العطري[9].
تستخدم بعض مشتقات الفينول مثل أورتوفينيل فينول و2 ـ بنزيل ـ4ـ كلوروفينول مطهرات ومبيدات للجراثيم.
وهذا يفسر استخدام الفينول في عيادات أطباء الأسنان تحت اسم حمض الكربوليك carbolic acid، كما يستخدم طلاب علم الأحياء الدقيقة العامل الفينوليphenol coefficient لمقارنة الفعالية الميكروبيولوجية لمركب ما مع تلك التي للفينول.[10]
الكريوزوت creosote
هو أحد القطفات الناتجة من تقطير قطران الفحم، وهو غني بالفينول وأورتو وميتا وبارا الكريزولات cresols المستخدمة مواد حافظة للخشب، ومثلها بنتا كلورو الفينول (بنتا كلور).
التواجد
توجد المركبات الفينولية في بعض النباتات مثل شجيرة Larrea mexicana من نباتات المناطق الجافة الأمريكية من الفصيلة القدّيسية zygophyllaceous وإن المواد المهيِّجة السامة في نبات اللبلاب ivy وشجر السنديان oak هي مركبات فينولية.
استحصالها
تحضر معظم الفينولات صناعياً بالطرائق نفسها المستخدمة مخبرياً، كما توجد طرائق خاصة للحصول على بعضها على نطاق تجاري، بما فيها المركب الأكثر أهمية وهو الفينول.
صناعياً
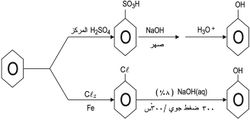
يحضر الفينول صناعياً بإزاحة مجموعة الكلورو أو مجموعة السلفون المرتبطتين بالحلقة البنزنية بايون الهدروكسيد. يستخدم في الاصطناعين البنزن مادة أولية:
استخدمت طريقة إزاحة مجموعة السلفون بأيون الهدروكسيد في أوائل القرن العشرين، أما إزاحة الكلور فقد استخدمت عام1928 من قبل شركة Dow Chemical Company.
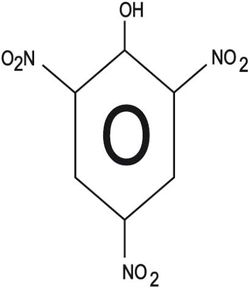
يعزى الاهتمام باصطناع الفينول على مقياس واسع إلى القوة التفجيرية لحمض البيكريك (2، 4، 6 ـ ثلاثي نيترو الفينول) وملحه الأمونيومي، والتي تعادل القوة التدميرية لمادة TNT (تري نترو تولوين).
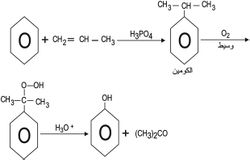
أما الطريقة الأحدث في اصطناع الفينول صناعياً فتقوم على أكسدة الكومين cumene إلى الفينول والأسيتون، وهما مادتان مهمتان صناعياً.
تفصل بعض الفينولات وإيتراتها الموافقة من الزيوت العطرية من نباتات مختلفة (تدعى بالزيوت العطرية لأنها تحتوي على عطر أو نكهة تميز هذه النباتات).
مخبرياً
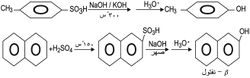
1ـ يؤدي الصهر القلوي لسلفونات الأريل مع مزيج من هدروكسيدي الصوديوم والبوتاسيوم عند الدرجة 300ْس، ومن ثم تحميض المزيج التفاعلي إلى تشكل المركب الفينولي بمردود معقول. إنّ طريقة التحضير هذه هي الطريقة المفضلة في تحضير الفينول. ويعد الصهر القلوي لحمض -بيتا -نفتالين - حمض السلفونيك مع هدروكسيد الصوديوم طريقة مناسبة لتحضير بيتا ـ نفتول.
أمثلة:
2ـ بحلمهة أملاح الديازونيوم الناتجة من تفاعل الأمينات الأولية مع حمض الآزوتي (NaNO2+HCl) عند الدرجةصفر سيلسيوس حيث ينطلق الآزوت وتتكون الفينولات.
أهم تفاعلات الفينولات
تفاعلات المجموعة الهدروكسيلية
1- الحموضة الضعيفة للزمرة الهدروكسيلية: تذوب الفينولات بسرعة في محلول هدروكسيد الصوديوم معطية أنيون الفينوكسيد. تبلغ قيمة pKa للفينول 9.8 وهي أضعف ألف مرة من حموضة حمض الكربون (pKa = 6.56).
وهكذا فإن أغلب الفينولات لا تتفاعل مع محلول كربونات الصوديوم الحامضة، ولكنها تترسب من محاليل الفينوكسيد عند معالجة الأخيرة بثنائي أكسيد الكربون:
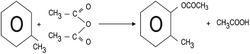
2ـ هناك تفاعلات قليلة تحصل مع المجموعة الهدروكسيلية في الفينولات. تتفاعل الفينولات بسرعة مع بلاماء الحموض أو كلوريداتها مكونة الأسترات.
3ـ لا يمكن الحصول من الفينولات مباشرة على الإتيرات بفعل حمض الكبريت، غير أنه يمكن الحصول على الإتيرات الالكيلية ـ الأريلية انطلاقاً من أنيون الفينوكسيد.
4ـ تتفاعل الفينولات مع إيزوسيانات RNCO معطية ضروب اليوريتان
وهي ذات درجات انصهار مرتفعة مما يجعلها مشتقات فينولية مفيدة.
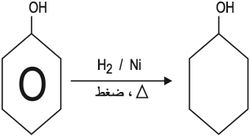
5 ـ الاختزال: إرجاع الفينول بالهدروجين بوجود وسيط من النيكل إلى حلقي الهكسانول.
6ـ الأكسدة: تتأكسد الفينولات بأكسيد الكروم إلى كينونات. فالفينول نفسه يتأكسد إلى بارا ـ بنزوكينون، حيث يتأكسد هدروكسيل الفينول، كما تتأكسد في الوقت نفسه ذرة الهدروجين الموجودة في الموضع بارا بالنسبة للهدروكسيل.
وأكسدة الفينولات عملية معقدة، وفي شروط أكسدة أكثر عنفاً يحدث تحطم للحلقة الفينولية.
7 ـ لا يمكن الحصول على هاليدات الأريل مباشرة من الفينولات، فهاليدات الهدروجين لا تؤثر في الفينولات، أما هاليدات الفسفور فتعطي غالباً الإسترات الأريلية لحمض الفوسفور.
8 ـ تحتوي الفينولات على مجموعة الإينول C = C − OH- التي تتفاعل بسرعة مع كلوريد الحديد (III) في محاليل معتدلة مكونة معقدات Ar O Fe Cl2 تعطي ايونات ArOFe++ الملونة بألوان زرقاء أو أرجوانية أو خضراء تستخدم في الكشف الكيفي عن الفينولات.
التفاعلات على الحلقة العطرية
إنّ مجموعة الهدروكسيل مانحة للإلكترونات وهي تزيد الكثافة الإلكترونية في الحلقة في موضعي الأورتو والبارا، ونتيجة لذلك فإن الفينولات تخضع بسهولة لتفاعلات الاستبدال الإلكتروفيلي، وفيما يأتي أهم هذه التفاعلات:
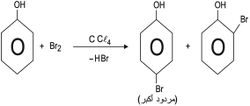
1ـ الهلجنة halogenation: الفينولات والإتيرات الفينيلية فعالة بحيث لا تتطلب هلجنتها أي وسيط (مثل Al Cl3)، ويمكن باختيار شروط مناسبة إدخال هالوجين واحد أو اثنين أو ثلاثة إلى الحلقة العطرية:
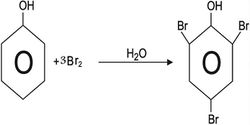
وإذا أجريت البرومة باستخدام ماء البروم، فإن التفاعل يؤدي إلى تشكل 6,4,2 -ثلاثي برومو الفينول.
2ـ النترجة nitration: تعطي معالجة الفينول بحمض الآزوت الممدد عند درجة حرارة الغرفة مزيجاً من أورتو ـ نترو الفينول وبارا ـ نترو الفينول:
أورتو ـ نترو الفينول أكثر تطايراً من بارا-نترو الفينول لأنه يشكل روابط هدروجينية ضمن الجزيء في حين يشكل المماكب-بارا روابط هدروجينية بين جزيئيه مما يجعله في حالة متجمعة، وهذا يجعله أقل تطايراً من أورتوـ نترو الفينول.
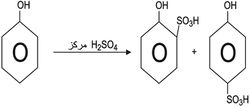
3ـ السلفنة sulphanation: يمكن سلفنة الفينول بحمض الكبريت المركز، وعند درجة حرارة الغرفة تتشكل كميات متساوية من المماكبين أورتو وبارا. أما في درجات الحرارة الأعلى فيسود المماكب بارا (09%).
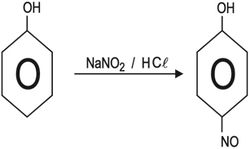
4ـ النترزة nitrosation: يتفاعل الفينول حتى مع الإلكتروفيلات الضعيفة، فايون النتروزونيوم NO+ المتكون في حمض الآزوتي المحمض يهاجم الفينول معطياً بارا-نتروزو الفينول.
5 ـ تزاوج ديازو diazo coupling: تتفاعل الفينولات وخاصة الفينوكسيدات مع أملاح الديازونيوم لتعطي أريل أزوفينولات:
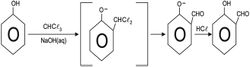
6ـ تفاعل رايمرـ تيمان Reimer-Tiemann: تؤدي معالجة الفينول مع الكلورفورم في محلول هدروكسيد الصوديوم إلى تشكل زمرة الدهيدية على الحلقة العطرية في الموقع أورتو بالنسبة إلى زمرة الهدروكسيد.
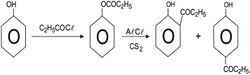
7 ـ تشكل الإسترات: تتحول الفينولات إلى إستراتها بفعل انهيدريدات (بلاماءات) الحموض أو كلوريداتها، وعند تسخين إسترات الفينول مع كلوريد الألمنيوم تهاجر زمرة الاستيل من الأكسجين الفينولي إلى الموضع أورتو أو بارا بالنسبة للهدروكسيل ويتكون الكيتون، ويدعى هذا التفاعل بإعادة ترتيب فريس Freis.
8 ـ التكاثف مع الفورم ألدهيد: يتفاعل الفينول مع الفورم ألدهيد بوجود أساس فتتكون مادة راتنجية تسمى البكاليت bakelite الذي يستخدم بفضل مقاومته الحرارية والكهربائية العالية في صنع كؤوس الشرب وأجسام أجهزة الهاتف والمفاتيح الكهربائية، وهو من أوائل البوليمرات الاصطناعية التي أنتجت.
المراجع
- ^ "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 690. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Only one name is retained, phenol, for C6H5-OH, both as a preferred name and for general nomenclature.
- ^ "Phenol".
- ^ "Phenol_msds".
- ^ أ ب ت ث ج NIOSH Pocket Guide to Chemical Hazards 0493
- ^ Kütt, Agnes; Movchun, Valeria; Rodima, Toomas; Dansauer, Timo; Rusanov, Eduard B.; Leito, Ivo; Kaljurand, Ivari; Koppel, Juta; Pihl, Viljar; Koppel, Ivar; Ovsjannikov, Gea; Toom, Lauri; Mishima, Masaaki; Medebielle, Maurice; Lork, Enno; Röschenthaler, Gerd-Volker; Koppel, Ilmar A.; Kolomeitsev, Alexander A. (2008). "Pentakis(trifluoromethyl)phenyl, a Sterically Crowded and Electron-withdrawing Group: Synthesis and Acidity of Pentakis(trifluoromethyl)benzene, -toluene, -phenol, and -aniline". The Journal of Organic Chemistry. 73 (7): 2607–20. doi:10.1021/jo702513w. PMID 18324831.
- ^ أ ب ت Sigma-Aldrich Co., Phenol. Retrieved on 2022-02-15.
- ^ أ ب ت "Phenol". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Organic Chemistry 2nd Ed. John McMurry ISBN 0-534-07968-7
- ^ "The Acidity of Phenol". ChemGuide. Jim Clark. Retrieved 2007-08-05.
- ^ فاروق قنديل. "الفينولات". الموسوعة العربية. Retrieved 2012-09-01.
مراجع للإستزادة
- موريسون وبويد، الكيمياء العضوية, ترجمة فاروق قنديل وصلاح القادري و آخرين (منشورات المركز العربي للتعريب والترجمة والتأليف والنشر، دمشق 2000).
- ANDREW L. TERNAY Jr. ,Contemporary Organic Chemistry (W.B. Saunders Company 1979).
- GRAHAM SOLOMON & CRAIG FRYHLE, Organic Chemistry (John Wiley and Sons, Inc. 2000).
انظر أيضاً
- Bamberger rearrangement
- Claisen rearrangement
- Cresols
- Fries rearrangement
- Phenolic compounds in wine
- Polyphenol antioxidant
- Resveratrol