پرمنگنات الپوتاسيوم
|
| |||
| الأسماء | |||
|---|---|---|---|
| اسم أيوپاك
Potassium manganate(VII)
| |||
| أسماء أخرى
پرمنگنات الپوتاسيوم
منگنات الپوتاسيوم السباعية معدن الحرباء بلورات كوندي پرمنگنات البوتاش | |||
| المُعرِّفات | |||
| رقم CAS | |||
| ECHA InfoCard | 100.028.874 | ||
| رقم EC |
| ||
| KEGG | |||
PubChem CID
|
|||
| رقم RTECS |
| ||
| UN number | 1490 | ||
CompTox Dashboard (EPA)
|
|||
| الخصائص | |||
| الصيغة الجزيئية | KMnO4 | ||
| كتلة مولية | 158.034 g/mol | ||
| المظهر | إبر قرمزية-برونزية-رمادية ماجنتا–وردية في المحلول | ||
| الرائحة | عديم الرائحة | ||
| الكثافة | 2.703 g/cm3 | ||
| نقطة الانصهار | |||
| قابلية الذوبان في الماء | 6.38 g/100 ml (20 °C) 25 g/100 mL (65 °C) | ||
| قابلية الذوبان | ينحل في الكحول و المذيبات العضوية | ||
| البنية | |||
| البنية البلورية | Orthorhombic | ||
| الكيمياء الحرارية | |||
| الإنتالپية المعيارية للتشكل ΔfH |
−813.4 kJ/mol | ||
| Standard molar entropy S |
171.7 J K−1 mol−1 | ||
| المخاطر | |||
تبويب الاتحاد الاوروپي (DSD)
|
مؤكسد (O) ضار (Xn) خطر على البيئة (N) | ||
| توصيف المخاطر | R8, R22, R50/53 | ||
| تحذيرات وقائية | (S2), S60, S61 | ||
| NFPA 704 (معيـَّن النار) | |||
| مركبات ذا علاقة | |||
أنيونات أخرى
|
منگنيت الپوتاسيوم منگنات الپوتاسيوم | ||
كاتيونات أخرى
|
پرمنگنات الصوديوم پرمنگنات الأمونيوم | ||
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |||
| مراجع الجدول | |||
پرمنگنات الپوتاسيوم أو برمنجنات البوتاسيوم هو مركب كيميائي صيغته الكيميائية KMnO4 وفى هذا الملح يكون المنجنيز في حاله الأكسدة +7 وهو يسمى أيضا برمنجنات ملح القلي.
يعتبر أيون البرمنجنات عامل مؤكسد قوي وهو له القدرة على الذوبان في الماء ليعطى محلول ذو لون قرمزي غامق. وتبخيره يعطى بلورات سوداء ناعمة
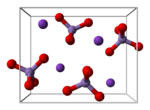
بلورات پرمنگنات البوتاسيوم لها بنية بلورية من النمط orthorhombic (معينة من النمط أورثو).
الخواص
الخواص العامة
- بلورات پرمنگنات الپوتاسيوم لها بنية بلورية من النمط المعيني المستقيم، وتكون ثوابت الشبكة البلورية كالتالي: a = 910.5 pm و b = 572.0 pm و c = 742.5 pm ، في حين أن طول الرابطة Mn-O تبلغ 162.9 بيكومتر.
- ينحل فوق منغنات البوتاسيوم بشكل جيد في الماء، وتكون محاليله ذات لون لون قرمزي غامق. يستخدم حمض الأكساليك من أجل تقييس تلك المحاليل وذلك في الكيمياء التحليلية. [1]
- عند تسخين بلورات فوق منغنات البوتاسيوم إلى درجات حرارة تصل إلى 240°س يتفكك المركب إلى كل من منغنات البوتاسيوم وأكسيد المنغنيز الرباعي (ثنائي أكسيد المنغنيز) وأكسيد البوتاسيوم، ويطلق غاز الأكسجين [2] حسب المعادلة التالية:
10KMnO4 –Δ→ 3K2MnO4 + 7MnO2 + 2K2O + 6O2
ويؤدي التسخين إلى درجات حرارة أعلى إلى تفكك المنغنات أيضاً:
2K2MnO4 –Δ→ 2MnO2 + K2O + O2
الخواص المؤكسدة
 محلول مائي من KMnO4 في دورق حجمي |
يتميز پرمنگنات الپوتاسيوم بخواصه المؤكسدة القوية، وذلك لأن المنغنيز يكون بأعلى حالة أكسدة له. لذلك فإن أغلب تفاعلاته الكيميائية مع المركبات المختلفة تتأثر بتلك الخاصية، وذلك عند التفاعل مع كل من:
الأحماض
يتأكسد حمض هيدروكلوريك ليعطي غاز الكلور، وبشكل مشابه يتفاعل پرمنگنات الپوتاسيوم مع حمض الكبريتيك المركز بتفاعل أكسدة ليعطي أكسيد المنغنيز السباعي (سباعي أكسيد المنغنيز) Mn2O7، ويمكن أن يكون هذا التفاعل انفجارياً. [3] يمكن لتفاعل فوق المنغنات مع حمض الكبريتيك أن يعطي غاز الأوزون حسب المعادلة:
- 6 KMnO4 (aq) + 9 H2SO4 (aq) → 6 MnSO4 (aq) + 3 K2SO4 (aq) + 9 H2O (l) + 5 O3 (g)
إلا أنه يجب أخذ الحيطة والحذر عند إجرائه. [4][5]
المركبات اللاعضوية
يؤكسد پرمنگنات الپوتاسيوم أيونات الحديد الثنائي إلى الثلاثي، كما يؤكسد أيونات الكبريتيت إلى أيونات الكبريتات، ويكون مخطط الأكسدة-اختزال للمثال الأخير كالتالي:
المركبات العضوية
بالنسبة للمركبات العضوية فإن فوق منغنات البوتاسيوم يؤكسد الرابطة المضاعفة في الألكينات ليعطي الحمض الكربوكسيلي الموافق. [6]
- CH3(CH2)17CH=CH2 + [O] → CH3(CH2)17COOH
كما يؤكسد الألدهيدات أيضاً إلى الأحماض الكربوكسيلية الموافقة، فعلى سبيل المثال فهو يؤكسد الهيبتانال إلى حمض الهيبتانويك. [7]
- C6H13CHO + [O] → C6H13COOH
كما أنه يؤكسد التولوين إلى حمض البنزويك [8]
التحضير
يحضر مركب پرمنگنات الپوتاسيوم من أكسيد المنغنيز الرباعي (ثنائي أكسيد المنغنيز) MnO2 والذي يتفاعل مع هيدروكسيد البوتاسيوم بوجود أكسجين الهواء ليعطي مركب منغنات البوتاسيوم K2MnO4، والذي يؤكسد إلى فوق منغنات كهربائياً (أكسدة مصعدية).
أما مخبرياً فيمكن تحضير المركب بأكسدة ثنائي أكسيد المنغنيز باستعمال مركب كلورات البوتاسيوم في وسط قلوي ومن ثم بتمرير غاز ثنائي أكسيد الكربون في المحلول.
الاستخدامات
التعقيم ومعالجة المياه
استخدم مركب پرمنگنات الپوتاسيوم في السابق من أجل معالجة مياه الشرب مياه المسابح والخزانات. [9] كما يمكن أن تستخدم محاليله المائية من أجل معالجة حالات متوسطة من مرض الفاقوع pompholyx، والتهاب الجلد Dermatitis (طفح). [10][11] وفي حالات إصابة الأطراف بالفطريات. [12]
Potassium permanganate is used extensively in the water treatment industry. It is used as a regeneration chemical to remove iron and hydrogen sulfide (rotten egg smell) from well water via a "manganese greensand" filter. "Pot-Perm" is also obtainable at pool supply stores and is used additionally to treat wastewater. Historically it was used to disinfect drinking water[13][14] and can turn the water pink.[15] Modern hiking and survivalist guides advise against using potassium permanganate in the field because it is difficult to dose correctly.[16] It currently finds application in the control of nuisance organisms such as zebra mussels in fresh water collection and treatment systems.[17]
وتستخدم في علاج ماء المسابح والخزانات.
استخدامات طبية حيوية
- استعملت محاليل البرمنغنات فيما مضى من أجل علاج مرض السيلان، ويستعمل للآن من أجل علاج مرض داء المبيضات. [18]
- يؤدي حضن أنسجة مثبتة بپرمنگنات الپوتاسيوم إلى منع أميلويد amyloid AA من تلطيخ صباغ أحمر الكونغو، في حين أن الأنواع الأخرى من الأميلويد لا تتأثر بذلك. [19][20]
A major application of KMnO4 is as a reagent for the synthesis of organic compounds.[21] Significant amounts are required for the synthesis of ascorbic acid, chloramphenicol, saccharin, isonicotinic acid, and pyrazinoic acid.[22]
KMnO4 is used in qualitative organic analysis to test for the presence of unsaturation. It is sometimes referred to as Baeyer's reagent after the German organic chemist Adolf von Baeyer. The reagent is an alkaline solution of potassium permanganate. Reaction with double or triple bonds (R
2C=CR
2 or R−C≡C−R) causes the color to fade from purplish-pink to brown. Aldehydes and formic acid (and formates) also give a positive test.[23] The test is antiquated.
KMnO4 solution is a common thin layer chromatography (TLC) stain for the detection of oxidizable functional groups, such as alcohols, aldehydes, alkenes, and ketones. Such compounds result in a white to orange spot on TLC plates.[24][25][26]
تخليق المركبات العضوية
يستعمل پرمنگنات الپوتاسيوم من أجل الاصطناع العضوي للعديد من المركبات العضوية. فعلى سبيل المثال تستهلك كميات كبيرة منه لتحضير حمض الأسكوربيك وكلورامفينيكول والسكارين وحمض إيزو النيكوتينيك وحمض البيرازينويك. [22]

A major application of KMnO4 is as a reagent for the synthesis of organic compounds.[27] Significant amounts are required for the synthesis of ascorbic acid, chloramphenicol, saccharin, isonicotinic acid, and pyrazinoic acid.[22]
KMnO4 is used in qualitative organic analysis to test for the presence of unsaturation. It is sometimes referred to as Baeyer's reagent after the German organic chemist Adolf von Baeyer. The reagent is an alkaline solution of potassium permanganate. Reaction with double or triple bonds (R
2C=CR
2 or R−C≡C−R) causes the color to fade from purplish-pink to brown. Aldehydes and formic acid (and formates) also give a positive test.[28] The test is antiquated.
KMnO4 solution is a common thin layer chromatography (TLC) stain for the detection of oxidizable functional groups, such as alcohols, aldehydes, alkenes, and ketones. Such compounds result in a white to orange spot on TLC plates.[29][30][31]
الاستخدام التحليلي
Potassium permanganate can be used to quantitatively determine the total oxidizable organic material in an aqueous sample. The value determined is known as the permanganate value. In analytical chemistry, a standardized aqueous solution of KMnO4 is sometimes used as an oxidizing titrant for redox titrations (permanganometry). As potassium permanganate is titrated, the solution becomes a light shade of purple, which darkens as excess of the titrant is added to the solution. In a related way, it is used as a reagent to determine the Kappa number of wood pulp. For the standardization of KMnO4 solutions, reduction by oxalic acid is often used.[32] In agricultural chemistry, it is used for estimation of active carbon in soil.[33]
Aqueous, acidic solutions of KMnO4 are used to collect gaseous mercury in flue gas during stationary source emissions testing.[34]
In histology, potassium permanganate was used as a bleaching agent.[35][36]
الحفاظ على الفواكه
Ethylene absorbents extend storage time of bananas even at high temperatures. This effect can be exploited by packing bananas in polyethylene together with potassium permanganate. By removing ethylene by oxidation, the permanganate delays the ripening, increasing the fruit's shelf life up to 4 weeks without the need for refrigeration.[37][38][39]
The chemical reaction, in which ethylene (C2H4) is oxidised by potassium permanganate (KMnO4) to carbon dioxide (CO2), manganese oxide (MnO2) and potassium hydroxide (KOH), in the presence of water, is presented as follows:[40]
3 C2H4 + 12 KMnO4 + 2 H2O → 6 CO2 + 2 H2O + 12 MnO2 + 12 KOH
Survival kits
Potassium permanganate is sometimes included in survival kits: as a hypergolic fire starter (when mixed with glycerol antifreeze from a car radiator);[41][42][43] as a water sterilizer; and for creating distress signals on snow.[44]
مكافحة النيران
Potassium permanganate is added to "plastic sphere dispensers" to create backfires, burnouts, and controlled burns. Polymer spheres resembling ping-pong balls containing small amounts of permanganate are injected with ethylene glycol and projected towards the area where ignition is desired, where they spontaneously ignite seconds later.[45][46] Both handheld[46] helicopter-[45] unmanned aircraft systems (UAS) or boat-mounted[46] plastic sphere dispensers are used.
استخدامات أخرى
Potassium permanganate is one of the principal chemicals used in the film and television industries to "age" props and set dressings. Its ready conversion to brown MnO2 creates "hundred-year-old" or "ancient" looks on hessian cloth (burlap), ropes, timber and glass.[47]
Potassium permanganate can be used to oxidize cocaine paste to purify it and increase its stability. This led to the Drug Enforcement Administration launching Operation Purple in 2000, with the goal of monitoring the world supply of potassium permanganate; however, potassium permanganate derivatives and substitutes were soon used thereafter to avoid the operation.[48]
Potassium permanganate is used as an oxidizing agent in the synthesis of cocaine and methcathinone.[49]
Potassium permanganate is one of a number of possible treatments for Ichthyophthirius multifiliis (commonly known as "ich"), a parasite that infects and usually kills freshwater aquarium fish.
التاريخ
In 1659, Johann Rudolf Glauber fused a mixture of the mineral pyrolusite (manganese dioxide, MnO2) and potassium carbonate to obtain a material that, when dissolved in water, gave a green solution (potassium manganate) which slowly shifted to violet and then finally red.[50] The reaction that produced the color changes that Glauber observed in his solution of potassium permanganate and potassium manganate (K2MnO4) is now known as the "chemical chameleon".[51] This report represents the first description of the production of potassium permanganate.[52] Just under 200 years later, London chemist Henry Bollmann Condy had an interest in disinfectants; he found that fusing pyrolusite with sodium hydroxide (NaOH) and dissolving it in water produced a solution with disinfectant properties. He patented this solution, and marketed it as 'Condy's Fluid'. Although effective, the solution was not very stable. This was overcome by using potassium hydroxide (KOH) rather than NaOH. This was more stable, and had the advantage of easy conversion to the equally effective potassium permanganate crystals. This crystalline material was known as 'Condy's crystals' or 'Condy's powder'. Potassium permanganate was comparatively easy to manufacture, so Condy was subsequently forced to spend considerable time in litigation to stop competitors from marketing similar products.[53] According to Varlam Shalamov, potassium permanganate solution was used as a catch-all treatment for dysentery, frostbite and ulcers in the Gulag camps of Kolyma.
Early photographers used it as a component of flash powder. It is now replaced with other oxidizers, due to the instability of permanganate mixtures.[citation needed]
التحضير
Potassium permanganate is produced industrially from manganese dioxide, which also occurs as the mineral pyrolusite. In 2000, worldwide production was estimated at 30,000 tonnes.[22] The MnO2 is fused with potassium hydroxide and heated in air or with another source of oxygen, like potassium nitrate or potassium chlorate.[22] This process gives potassium manganate:
- 2 MnO
2 + 4 KOH + O
2 → 2 K
2MnO
4 + 2 H
2O
With sodium hydroxide, the end product is not sodium manganate but an Mn(V) compound, which is one reason why the potassium permanganate is more commonly used than sodium permanganate. Furthermore, the potassium salt crystallizes better.[22]
The potassium manganate is then converted into permanganate by electrolytic oxidation in alkaline media:
- 2 K
2MnO
4 + 2 H
2O → 2 KMnO
4 + 2 KOH + H
2
Other methods
Although of no commercial importance, potassium manganate can be oxidized by chlorine or by disproportionation under acidic conditions.[54] The chlorine oxidation reaction is
- 2 K
2MnO
4 + Cl
2 → 2 KMnO
4 + 2 KCl
and the acid-induced disproportionation reaction may be written as
- 3 K
2MnO
4 + 4 HCl → 2 KMnO
4 + MnO
2 + 2 H
2O + 4 KCl
A weak acid such as carbonic acid is sufficient for this reaction:
- 3 K
2MnO
4 + 2 CO
2 → 2 KMnO
4 + 2 K
2CO
3 + MnO
2
Permanganate salts may also be generated by treating a solution of Mn2+ ions with strong oxidants such as lead dioxide (PbO2), sodium bismuthate (NaBiO3), or peroxydisulfate. Tests for the presence of manganese exploit the vivid violet color of permanganate produced by these reagents.
Reactions
Organic chemistry
Dilute solutions of KMnO4 convert alkenes into diols. This behaviour is also used as a qualitative test for the presence of double or triple bonds in a molecule, since the reaction decolorizes the initially purple permanganate solution and generates a brown precipitate (MnO2). In this context, it is sometimes called Baeyer's reagent. However, bromine serves better in measuring unsaturation (double or triple bonds) quantitatively, since KMnO4, being a very strong oxidizing agent, can react with a variety of groups.
Under acidic conditions, the alkene double bond is cleaved to give the appropriate carboxylic acid:[55]
- CH
3(CH
2)
17CH=CH
2 + 2 KMnO
4 + 3 H
2SO
4 → CH
3(CH
2)
17COOH + CO
2 + 4 H
2O + K
2SO
4 + 2 MnSO
4
Potassium permanganate oxidizes aldehydes to carboxylic acids, illustrated by the conversion of n-heptanal to heptanoic acid:[56]
- 5 C
6H
13CHO + 2 KMnO
4 + 3 H
2SO
4 → 5 C
6H
13COOH + 3 H
2O + K
2SO
4 + 2 MnSO
4
Even an alkyl group (with a benzylic hydrogen) on an aromatic ring is oxidized, e.g. toluene to benzoic acid.[57]
- 5 C
6H
5CH
3 + 6 KMnO
4 + 9 H
2SO
4 → 5 C
6H
5COOH + 14 H
2O + 3 K
2SO
4 + 6 MnSO
4
Glycols and polyols are highly reactive toward KMnO4. For example, addition of potassium permanganate to an aqueous solution of sugar and sodium hydroxide produces the chemical chameleon reaction, which involves dramatic color changes associated with the various oxidation states of manganese. A related vigorous reaction is exploited as a fire starter in survival kits. For example, a mixture of potassium permanganate and glycerol or pulverized glucose ignites readily.[41] Its sterilizing properties are another reason for inclusion of KMnO4 in a survival kit.[citation needed]
Ion exchange
Treating a mixture of aqueous potassium permanganate with a quaternary ammonium salt results in ion exchange, precipitating the quat salt of permanganate. Solutions of these salts are sometimes soluble in organic solvents:[58]
- KMnO
4 + R
4NCl → R
4NMnO
4 + KCl
Similarly, addition of a crown ether also gives a lipophilic salt.[59]
Reaction with acids and bases
Permanganate reacts with concentrated hydrochloric acid to give chlorine and manganese(II):
- 2 KMnO
4 + 16 HCl → 2 MnCl
2 + 5 Cl
2 + 2 KCl + 8 H
2O
In neutral solution, permanganate slowly reduces to manganese dioxide (MnO2). This is the material that stains one's skin when handling KMnO4.
KMnO4 reduces in alkaline solution to give green K2MnO4:[60]
- 4 KMnO
4 + 4 KOH → 4 K
2MnO
4 + O
2 + 2 H
2O
This reaction illustrates the relatively rare role of hydroxide as a reducing agent.
Addition of concentrated sulfuric acid to potassium permanganate gives Mn2O7.[61] Although no reaction may be apparent, the vapor over the mixture will ignite paper impregnated with alcohol. Potassium permanganate and sulfuric acid react to produce some ozone, which has a high oxidizing power and rapidly oxidizes the alcohol, causing it to combust. As the reaction also produces explosive Mn2O7, this should only be attempted with great caution.[62][63]
Thermal decomposition
Solid potassium permanganate decomposes when heated:
- 2 KMnO
4 → K
2MnO
4 + MnO
2 + O
2
It is a redox reaction.
Safety and handling
Potassium permanganate poses risks as an oxidizer.[64] Contact with skin can cause skin irritation and in some cases severe allergic reaction. It can also result in discoloration and clothing stains.[65]
الهامش
- ^ Kovacs KA, Grof P, Burai L, Riedel M (2004). "Revising the Mechanism of the Permanganate/Oxalate Reaction". J. Phys. Chem. A. 108: 11026. doi:10.1021/jp047061u.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Römpp CD 2006, Georg Thieme Verlag 2006
- ^ F. A. Cotton, G. Wilkinson, C. A. Murillo, and M. Bochmann (April 1999). Advanced Inorganic Chemistry, 6th Edition. Wiley-VCH. ISBN 0-471-19957-5
- ^ Barthel, H. and Duvinage, B. (2000). "Clemens Winkler. His Experiments with Ozone in 1892". Praxis der Naturwissenschaften, Chemie. 49: 18ff.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Dzhabiev, T. S.; Denisov, N. N.; Moiseev, D. N. and Shilov, A. E. (2005). "Formation of Ozone During the Reduction of Potassium Permanganate in Sulfuric Acid Solutions". Russian Journal of Physical Chemistry. 79: 1755–1760.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Donald G. Lee, Shannon E. Lamb, and Victor S. Chang (1990). "Carboxylic Acids from the Oxidation of Terminal Alkenes by Permanganate: Nonadecanoic Acid". Organic Syntheses
{{cite journal}}: CS1 maint: multiple names: authors list (link); Collected Volumes, 7, pp. 397. - ^ John R. Ruhoff. "n-Heptanoic acid". Organic Syntheses; Collected Volumes, 2, pp. 315.
- ^ Gardner KA, Mayer JM (1995). "Understanding C-H Bond Oxidations: H· and H- Transfer in the Oxidation of Toluene by
Permanganate". Science. 269 (5232): 1849. doi:10.1126/science.7569922. PMID 7569922.
{{cite journal}}: line feed character in|title=at position 85 (help) - ^ Assembly of Life Sciences (U.S.). Safe Drinking Water Committee. Drinking water and health, Volume 2. p. 98. ISBN 9780309029315.
- ^ BIRT AR (1964). "Drugs for eczema of children". Can Med Assoc J. 90 (11): 693–4. PMC 1922428. PMID 14127384.
{{cite journal}}: Unknown parameter|month=ignored (help) - ^ Stalder JF, Fleury M, Sourisse M; et al. (1992). "Comparative effects of two topical antiseptics (chlorhexidine vs KMn04) on bacterial skin flora in atopic dermatitis". Acta Derm Venereol Suppl (Stockh). 176: 132–4. PMID 1476027.
{{cite journal}}: Explicit use of et al. in:|author=(help)CS1 maint: multiple names: authors list (link) - ^ Program for Appropriate Technology in Health PATH (1988). "Skin diseases". Health Technol Dir. 8 (3): 1–10. PMID 12282068.
- ^ Assembly of Life Sciences (U.S.). Safe Drinking Water Committee (1977). Drinking water and health, Volume 2. National Academies Press. p. 98. ISBN 978-0-309-02931-5. Retrieved 2016-09-13.
- ^ Downey R, Barrington M (28 February 2005). "Red faces over pink water". The Northern Advocate. Archived from the original on 2011-07-19.
- ^ "Onoway apologizes for 'alarming' pink tap water". CBC News. 7 March 2017. Archived from the original on 7 March 2017. Retrieved 8 March 2017.
- ^ Johannes Vogel (2014). Trinkwasserversorgung in Extremsituationen (in German). Paul Pietsch Verlage GmbH. ISBN 978-3613507845.
{{cite book}}: CS1 maint: unrecognized language (link) - ^ "EPA Guidance Manual Alternative Disinfectants and Oxidants". U.S. Environmental Protection Agency. 13 October 2015. Archived from the original on 2016-10-01.
- ^ Haseltine, Florence (1976). "Private Medicine". Woman Doctor: the Internship of a Modern Woman (Book Club ed.). Houghton Mifflin. p. 32.
{{cite book}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Wright, J. R.; Calkins E.; Humphrey R. L. (1977). "Potassium permanganate reaction in amyloidosis. A histologic method to assist in differentiating forms of this disease". Lab Invest. 36 (3): 274–81. PMID 839739.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ van Rijswijk, M. H.; van Heusden, C. W. (1979). "The potassium permanganate method. A reliable method for differentiating amyloid AA from other forms of amyloid in routine laboratory practice". Am J Pathol. 97 (1): 43–58. PMC 2042379. PMID 495695.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Fatiadi A (1987). "The Classical Permanganate Ion: Still a Novel Oxidant in Organic Chemistry". Synthesis. 1987 (2): 85–127. doi:10.1055/s-1987-27859. S2CID 94121246.
- ^ أ ب ت ث ج ح Arno H. Reidies "Manganese Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a16_123 خطأ استشهاد: وسم
<ref>غير صالح؛ الاسم "Ullmann" معرف أكثر من مرة بمحتويات مختلفة. - ^ Glagovich N (2013). "Baeyer Test". Department of Chemistry and Biochemistry. Central Connecticut State University. Archived from the original on 24 January 2013. Retrieved 9 May 2018.
- ^ Thin Layer Chromatography stains http://www.reachdevices.com/TLC_stains.html
- ^ Jork, H., Funk, W., Fischer, W., Wimmer, H. (1990): Thin-Layer Chromatography: Reagents and Detection Methods, Volume 1a, VCH, Weinheim, ISBN 3-527-278834
- ^ Jork, H., Funk, W., Fischer, W., Wimmer, H. (1994): Thin-Layer Chromatography: Reagents and Detection Methods, Volume 1b, VCH, Weinheim
- ^ Fatiadi A (1987). "The Classical Permanganate Ion: Still a Novel Oxidant in Organic Chemistry". Synthesis. 1987 (2): 85–127. doi:10.1055/s-1987-27859. S2CID 94121246.
- ^ Glagovich N (2013). "Baeyer Test". Department of Chemistry and Biochemistry. Central Connecticut State University. Archived from the original on 24 January 2013. Retrieved 9 May 2018.
- ^ Thin Layer Chromatography stains http://www.reachdevices.com/TLC_stains.html
- ^ Jork, H., Funk, W., Fischer, W., Wimmer, H. (1990): Thin-Layer Chromatography: Reagents and Detection Methods, Volume 1a, VCH, Weinheim, ISBN 3-527-278834
- ^ Jork, H., Funk, W., Fischer, W., Wimmer, H. (1994): Thin-Layer Chromatography: Reagents and Detection Methods, Volume 1b, VCH, Weinheim
- ^ Kovacs KA, Grof P, Burai L, Riedel M (2004). "Revising the Mechanism of the Permanganate/Oxalate Reaction". J. Phys. Chem. A. 108 (50): 11026. Bibcode:2004JPCA..10811026K. doi:10.1021/jp047061u.
- ^ "Quick Reference Guide: Potassium Permanganate Test for Active Carbon". Agriculture Victoria—Victorian Resources Online. Victoria, Australia.
- ^ Code of Federal Regulations(7-1-07) Edition, Title 40, Part 60, Appendix A-8, Method 29, Section 7.3.1
- ^ Picken MM (April 2010). "Amyloidosis-where are we now and where are we heading?". Archives of Pathology & Laboratory Medicine. 134 (4): 545–551. doi:10.5858/134.4.545. PMID 20367306.
- ^ Murphy CL, Eulitz M, Hrncic R, Sletten K, Westermark P, Williams T, Macy SD, Wooliver C, Wall J, Weiss DT, Solomon A (July 2001). "Chemical typing of amyloid protein contained in formalin-fixed paraffin-embedded biopsy specimens". American Journal of Clinical Pathology. 116 (1): 135–142. doi:10.1309/TWBM-8L4E-VK22-FRH5. PMID 11447744.
- ^ Scott KJ, McGlasson WB, Roberts EA (1970). "Potassium Permanganate as an Ethylene Absorbent in Polyethylene Bags to Delay the Ripening of Bananas During Storage". Australian Journal of Experimental Agriculture and Animal Husbandry. 10 (43): 237. doi:10.1071/EA9700237.
- ^ Scott KJ, Blake, JR, Stracha, G, Tugwell, BL and McGlasson WB (1971). "Transport of Bananas at Ambient Temperatures using Polyethylene Bags". Tropical Agriculture (Trinidad). 48: 163–165.
- ^ Scott KJ, Gandanegara S (1974). "Effect of Temperature on the Storage Life of bananas Held in Polyethylene Bags with an Ethylene Absorbent". Tropical Agriculture (Trinidad). 51: 23–26.
- ^ Álvarez-Hernández MH, Artés-Hernández F, Ávalos-Belmontes F, Castillo- Campohermoso MA, Contreras-Esquivel JC, Ventura-Sobrevilla JM, Martínez-Hernández GB (2018). "Current scenario of adsorbent materials used in ethylene scavenging systems to extend fruit and vegetable postharvest life". Food Bioproc Technol. 11 (3): 511–525. doi:10.1007/s11947-018-2076-7.
- ^ أ ب Gillis B, Labiste D. "Fire by Chemical Reaction". PrimitiveWays. Archived from the original on 2015-09-24.
- ^ "Potassium Permanganate" (PDF). Pole Shift Survival Information. Archived from the original (PDF) on 4 August 2016. Retrieved 9 May 2018.
- ^ "Making Fire with Potassium Permanganate and Glycerin". thesurvivalcache. 3 November 2012. Archived from the original on 13 May 2016. Retrieved 13 September 2016.
- ^ "Distress Signals". Evening Post. CXXI (107): 5. 7 May 1936. Archived from the original on 5 November 2011.
- ^ أ ب "Aerial Ignition, Plastic Sphere Dispenser Description". Missoula Technology and Development Center. USDA Forest Service. Archived from the original on 26 April 2016. Retrieved 9 May 2018.
- ^ أ ب ت "Wetland Warrior". Dirty Jobs. No. 2, season 6.
- ^ Brody E (February 2000). "Victor DeLor contractor profile". PaintPRO. 2 (1). Archived from the original on 2008-07-23. Retrieved 2009-11-12.
One of the techniques DeLor is known for among designers and clients is the special effects he creates with various chemical solutions. When applied to wood surfaces, these chemicals give a weathered appearance to new wood. ... To achieve the aesthetic on interior surfaces, DeLor often uses a mixture of water and potassium permanganate, a dry powder chemical.
- ^ Gosmer K, Vammen M (March 10, 2014). "The Terrifying Substances People Put in Cocaine". Vice Media.
- ^ Binder R, Machata G, Stead H (May 2003). "[Analysis of potassium permanganate as addictive drug "precursor"]". Archiv für Kriminologie. 211 (5–6): 160–165. PMID 12872685.
- ^ Glauber, Johann Rudolph, Prosperitas Germaniae (The prosperity of Germany), part 3 (Amsterdam, (Netherlands): Johann Jansson, 1659), pp. 93–94. From pp. 93–94: " … donec tandem Magnesiam istam nitro fixo permixtam, in crucibulo forti coctione a nitro reseratam vidi, unde elegans color purpureus provenit, massam hanc effusam in pulvere redegi, aqua calida extraxi, per filtrum liquorem transmisi. Tandem vero elegantissimum purpureum, igneumque liquorem accepi, qui fere singulis horis in frigore tantummodo consistens colorem permutavit, sic ut jam viridis, jam caerulei, jam sanguinei coloris sponte sua factus sit, mox iterum alios elegantissimos colores receperit." ( … until finally I saw [that] by mixing that magnesia [i.e., magnesia nigra, pyrolusite, the ore containing manganese dioxide ] with fixed niter [i.e., inert niter, potassium carbonate], by cooking [it] in a strong crucible, [the colored compound was] released by the niter, whence a fine purple color arises; this mass [was] poured out, reduced to powder, extracted with hot water, [and] the solution passed through a filter. Then I got a truly most elegant, purple, and fiery solution, which nearly every hour ([while] standing just in the cold) changed color, so that it was spontaneously made now green, now blue, now red in color; soon again it received other most elegant colors.) Glauber JR. "Prosperitatis Germaniae pars .... 3: In qua Salpetrae ex variis ubiq, obviis subiectis facillime atque copiose extrahendi modus traditur. Eiusve utilitates summae declarantur" [Part of the Prosperity of Germany .... 3: In which the method of extracting saltpeter from various everywhere, in the most convenient and abundant manner, is given. His interests are clearly stated] (in Latin). Archived from the original on 2016-12-20 – via Bavarian State Library.
{{cite web}}: CS1 maint: unrecognized language (link) Translated in: Glauber JR (1689). The Works of the Highly Experienced and Famous Chymist, John Rudolph Glauber. Translated by Packe C. London, England: Thomas Millbourn. p. 353. Archived from the original on 2012-01-07. - ^ "How to use Chameleon Pigment for Chameleon Paint?" (in الإنجليزية الأمريكية). 2024-01-19. Retrieved 2024-06-07.
- ^ Weeks ME (1956). Leicester HM (ed.). Discovery of the Elements (6th ed.). Easton, Pennsylvania: Journal of Chemical Education. pp. 172–173.
- ^ "Important Trade Mark Case". Otago Witness. 2 (2420): 53. 2 August 1900. Archived from the original on 4 March 2016.
- ^ Walton HF (1948). Inorganic Preparations. New York: Prentice-Hall. pp. 150–151.
- ^ Lee DG, Lamb SE, Chang VS (1990). "Carboxylic Acids from the Oxidation of Terminal Alkenes by Permanganate: Nonadecanoic Acid". Organic Syntheses; Collected Volumes, 7, pp. 397.
- ^ Ruhoff JR. "n-Heptanoic acid". Organic Syntheses; Collected Volumes, 2, pp. 315.
- ^ Gardner KA, Mayer JM (September 1995). "Understanding C-H bond oxidations: H. and H- transfer in the oxidation of toluene by permanganate". Science. 269 (5232): 1849–1851. Bibcode:1995Sci...269.1849G. doi:10.1126/science.7569922. PMID 7569922.
- ^ Herriott AW (1977). "Purple benzene: Solubilization of anions in organic solvents". J. Chem. Educ. 54 (4): 229. Bibcode:1977JChEd..54Q.229H. doi:10.1021/ed054p229.1.
- ^ Doheny Jr AJ, Ganem B (1980). "Purple benzene revisited". J. Chem. Educ. 57 (4): 308. Bibcode:1980JChEd..57..308D. doi:10.1021/ed057p308.1.
- ^ Nyholm RS, Woolliams PR (1968). "Manganates (VI)". Inorganic Syntheses. Vol. 11. pp. 56–61. doi:10.1002/9780470132425.ch11. ISBN 978-0-470-13242-5.
- ^ Cotton FA, Wilkinson G, Murillo CA, Bochmann M (1999). Advanced Inorganic Chemistry (6th ed.). Wiley-VCH. ISBN 0-471-19957-5.
- ^ Barthel H, Duvinage B (2000). "Clemens Winkler. His Experiments with Ozone in 1892". Praxis der Naturwissenschaften, Chemie. 49: 18ff.
- ^ Dzhabiev TS, Denisov NN, Moiseev DN, Shilov AE (2005). "Formation of Ozone During the Reduction of Potassium Permanganate in Sulfuric Acid Solutions". Russian Journal of Physical Chemistry. 79: 1755–1760.
- ^ Bretherick L, Urben PG, Pitt MJ (2007). Bretherick's Handbook of Reactive Chemical Hazards. Vol. 1 (7th ed.). Elsevier Academic Press. pp. 1811–7. ISBN 978-0-12-373945-2.
- ^ Griffin S. "How to Remove Potassium Permanganate". livestrong.com. Archived from the original on 13 April 2018. Retrieved 9 May 2018.
وصلات خارجية
- CS1 errors: invisible characters
- CS1 errors: unsupported parameter
- CS1 الإنجليزية الأمريكية-language sources (en-us)
- CS1: Julian–Gregorian uncertainty
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Chembox image size set
- Short description is different from Wikidata
- Articles with unsourced statements from June 2023
- بذرة كيمياء
- پرمنگنات
- مركبات الپوتاسيوم
- عوامل مؤكسدة
- مطهرات
- إشعال النار
- مؤكسدات نارية
- كيماويات التصوير الضوئي