توتر سطحي Surface tension

| جزء من سلسلة عن |
| ميكانيكا الاستمرارية |
|---|
التوتر السطحي هو ذلك التأثير الذي يجعل الطبقة السطحيّة لأي سائل تتصرف كورقة مرنة. ذلك التأثير الذي يسمح للحشرات بالسير على الماء ، والأشياء المعدنية الصغيرة كالإبر، أو أجزاء ورق القصدير من الطفو على الماء ، وهوالمسبب أيضا للخاصيّة الشعريّة. وهناك التوتر الواجهي هو اسم لنفس التأثير عندما يحدث بين سائلين.
من منا لم يسأل نفسه لماذا قطرة الماء تبقى معلقة في صنبور الماء لبعض الوقت ? و لماذا تميل السوائل لجعل سطوحها شبه كروية ? , أيضاً لم تكون بعض الحشرات قادرة أن تمشي على سطح الماء? , و كيف بإمكاننا جعل إبرة فولاذية جافة قادرة أن تطفو على سطح الماء إذا وضعت بعناية؟
إن سبب هذه الظواهر هو الظاهرة السطحية للسوائل التي تعرف باسم التوتر السطحي
التعريف
تربط بين جزيئات المادة المتجانسة قوى تسمى قوى الجذب الجزيئية ( قوى التماسك ) تعمل على تماسك جزيئات هذه المادة بعضها ببعض , إن قيمة هذه القوى في السوائل تكون أقل مما عليه في الأجسام الصلبة و هذا ما يفسر تغير شكل السائل بتغير الإناء الموجود فيه , بالإضافة على تلك القوى يوجد قوى تؤثر بين جزيئات السائل و جزيئات الأوساط الأخرى التي تلامسها سواء أكانت حالة تلك الأوساط صلبة أو سائلة أو غازية تدعى هذه القوى ب ( قوى التلاصق ) .
الآن و اعتمادا على ما سبق سوف نوضح الفرق بين محصلة قوى الجذب الجزيئية لجزيئات السائل في أوضاعها المختلفة سواء عند السطح أو داخل السائل . الشكل (1)
بالنسبة للجزيئات الواقعة في داخل السائل أي على بعد عدة أقطار جزيئية إلى الأسفل من سطحه , فإن كل جزيء مثل ( A ) سوف يتأثر بقوى تماسك مع جزيئات السائل الأخرى من جميع الجهات و بنفس القدر تقريباً مما يعني أن جزيء مثل ( A ) سيكون متأثر بمجموعة متزنة من القوى محصلتها معدومة . أما بالنسبة لجزيئات السائل عند السطح فإن كل جزيء مثل ( B ) سوف يكون متأثر بقوى تماسك مع جزيئات السائل من الجهة السفلى و متأثر بقوى التلاصق مع جزيئات الهواء من الجهة العليا و حيث أن كثافة السوائل أكبر بكثير من كثافة الغازات لذلك فإن محصلة هذه القوى تكون في اتجاه قوى التماسك .
أي أن كل جزيء عند السطح يكون متأثراً بقوى جذب إلى الداخل ( مما يقلل من فرصة شغله موقع سطحي ) تؤدي إلى تقلص سطح السائل ليشغل أصغر مساحة ممكنة له. و هذا يفسر الشكل الشبه الكروي لفطرات السائل و يكون عندئذ سطحها أصغرياً بالنسبة لحجم معين .
و بالتالي عدد الجزيئات الموجودة على السطح أقل من جزيئات السائل , و لذلك فإن البعد المتوسط بين الجزيئات على السطح أكبر قليلاً من البعد المتوسط داخل السائل و هذا يؤدي وسطياً إلى وجود قوى تجاذبية بين جزيئات السطح و هذا يفسر وجود التوتر السطحي.
من ناحية أخرى : يلاحظ أن للجزيئات الموجودة على سطح السائل طاقة كامنة أكبر من الطاقة الكامنة للجزيئات الموجودة وسط السائل وهذا يعود إلى أنه عندما نريد جلب جزيء من السائل إلى السطح يجب كسر عدد من روابطه أي يجب بذل عمل للقيام بذلك وهذا العمل يتحول إلى طاقة كامنة داخل الجزيء. و لكن هذا يخالف الميل الطبيعي للأجسام لتقليل طاقتها , و يتحقق ذلك في السوائل من خلال ميلها الطبيعي لتقليل مساحة سطحها إلى أقل قدر ممكن حيث يبرهن رياضياً أن ذلك يتحقق عندما يكون شكل السطح كروياً .
والآن لنعرف التوتر السطحي ( γ ) لسائل : القوة المؤثرة في وحدة الطول في سطح بزاوية قائمة على أحد جانبي خط مرسوم في السطح . في الشكل المرسوم جانباً (2) يمثل [ AB ] خطاً مرسوماً طوله ( 1 m ) على سطح سائل يقاس التوتر السطحي (γ ) بوحدة ( N/m ).
سبب التوتر السطحي
يحدث التوتر السطحي بسبب التجاذب بين جزيئات السائل بواسطة التغير في قوى الجزيئات الداخليّة. في معظم السائل كل جزيء يسحب بالتساوي في جميع الإتجاهات بواسطة جزيئات السائل المجاورة ، ومحصّلة هذه القوى صفر. عند سطح السائل تسحب الجزيئات بواسطة الجزيئات الأخرى الأعمق في السائل ولكن ليست الجاذبية كجاذبية الجزيئات المجاورة لها في الوسط من حيث الشدّة (تكون كضغط هواء أو سائل آخر). لذلك كل الجزيئات عند السطح تكون عرضة لقوى داخليّة من التجاذب الجزيئي الذي من الممكن أن يكون متَّزن فقط مع مقاومة السائل للضغط. ولذلك يغير السائل شكله حتى يشغل أقل مساحة سطح ممكنة.
وبعبارة أخرى يمكن تفسير هذه الظاهرة وهي أنّ طاقة الجزيء المتّصل مع جاره أقل من طاقة الجزيء الغير متّصل مع جاره. وكل الجزيئات الدّاخليّة تمتلك ما يجب امتلاكه من الجيران. ولكن جيران جزيئات السطح أقل عدداً من جيران الجزيئات الداخليّة ، ولذا هي في حالة طاقة عالية. ولكي يقلل السائل من حالة طاقته لا بد أن يقلل عدد جزيئات سطحه ، ولذا يقلل من مساحة سطحه.
التوتر السطحي في الحياة اليومية
بعض الأمثلة للتوتر السطحي المشاهد في المياه العاديّة:
تقدم ظاهرة الشد السطحي تفسيراً لكثير من الظواهر الشائعة في حياتنا. فعلى سبيل المثال تأخذ قطرات السوائل أشكال شبه كروية بسبب ظاهرة الشد السطحي، وذلك لأن الكرة هي الشكل الهندسي ذو مساحة السطح الأقل. كما أن تباين مدى قوة قوى تماسك جزيئات السائل وقوى الالتصاق بالمادة المحيطة بالسائل يفسر لنا لماذاقد يبلل سائل معين بعض المواد في حين أنه لا يبلل مواد أخرى. فعلى سبيل المثال فإن الماء لا ينتشر على الأسطح النايلونية أو الأسطح المغطاة بالشمع وذلك لأن قوى تماسك جزيئات الماء مع بعضها البعض أكبر من قوى التصاق الماء بالسطح المشمع، وبالتالي تتجمع قطرات الماء فوق ذلك السطح على شكل قطرات يمكن أن تسقط بسهولة دون أن تبلل السطح. وقد تم استغلال هذه الملاحظات في صناعة معاطف المطر والمظلات.
وتقدم ظاهرة التوتر السطحي تفسيراً لإمكانية عمل فقاعات الصابون بينما لا يمكن القيام بعمل فقاعات باستخدام الماء النقي وحده، وذلك لأن الماء النقي لديه قوى توتر سطحي كبيرة، ولكن بإضافة منشطات السطوح (كالصابون) إليه تقل تلك القوى بأكثر من عشر أضعاف، وبذلك يصبح من الممكن عمل فقاعات ذات سطوح كبيرة بكتلة قليلة من السائل.
كما أن إضافة الصابون إلى الماء تجعله منظفاً ممتازاً عبر تقليل توتره السطحي وبالتالي تجعله قادراً على تبليل والإحاطة بالأوساخ لتسهل إزالتها. ويمكنك التحقق من ذلك باستخدام بعض الصابون حتى تتمكن من مزج الماء بالزيت مثلاً. حيث يعمل الصابون في هذه الحالة على تقليل التوتر السطحي متيحاً إمكانية عمل قطرات ضئيلة الحجم من الزيت داخل مقدار من الماء أو العكس. بينما لو لم يكن الصابون موجوداً لما امتزج السائلان وذلك لأن قوى التوتر السطحي لدى كل من السائلين أكبر من قوى تماسك أحدهما مع الآخر. كل هذه الأمور تظهر الأهمية البالغة لظاهرة الشد أو التوتر السطحي.
ومن الملاحظات الأخرى التي تفسرها ظاهرة التوتر السطحي هو تكوين بعض السوائل لسطح محدب أو سطح مقعر عند وضعها في وعاء أنبوبي. وذلك يعود لتباين قوة التوتر السطحي وقوة التصاق جزيئات السائل بالوعاء المحيط. التوتر السطحي Surface Tension
من منا لم يسأل نفسه لماذا قطرة الماء تبقى معلقة في صنبور الماء لبعض الوقت ? و لماذا تميل السوائل لجعل سطوحها شبه كروية ? , أيضاً لم تكون بعض الحشرات قادرة أن تمشي على سطح الماء? , و كيف بإمكاننا جعل إبرة فولاذية جافة قادرة أن تطفو على سطح الماء إذا وضعت بعناية ?.
إن سبب هذه الظواهر هو الظاهرة السطحية للسوائل التي تعرف باسم التوتر السطحي
تربط بين جزيئات المادة المتجانسة قوى تسمى قوى الجذب الجزيئية ( قوى التماسك ) تعمل على تماسك جزيئات هذه المادة بعضها ببعض , إن قيمة هذه القوى في السوائل تكون أقل مما عليه في الأجسام الصلبة و هذا ما يفسر تغير شكل السائل بتغير الإناء الموجود فيه , بالإضافة على تلك القوى يوجد قوى تؤثر بين جزيئات السائل و جزيئات الأوساط الأخرى التي تلامسها سواء أكانت حالة تلك الأوساط صلبة أو سائلة أو غازية تدعى هذه القوى ب ( قوى التلاصق ) .
الآن و اعتمادا على ما سبق سوف نوضح الفرق بين محصلة قوى الجذب الجزيئية لجزيئات السائل في أوضاعها المختلفة سواء عند السطح أو داخل السائل . الشكل (1)
(الشكل 1)
بالنسبة للجزيئات الواقعة في داخل السائل أي على بعد عدة أقطار جزيئية إلى الأسفل من سطحه , فإن كل جزيء مثل ( A ) سوف يتأثر بقوى تماسك مع جزيئات السائل الأخرى من جميع الجهات و بنفس القدر تقريباً مما يعني أن جزيء مثل ( A ) سيكون متأثر بمجموعة متزنة من القوى محصلتها معدومة . أما بالنسبة لجزيئات السائل عند السطح فإن كل جزيء مثل ( B ) سوف يكون متأثر بقوى تماسك مع جزيئات السائل من الجهة السفلى و متأثر بقوى التلاصق مع جزيئات الهواء من الجهة العليا و حيث أن كثافة السوائل أكبر بكثير من كثافة الغازات لذلك فإن محصلة هذه القوى تكون في اتجاه قوى التماسك .
أي أن كل جزيء عند السطح يكون متأثراً بقوى جذب إلى الداخل ( مما يقلل من فرصة شغله موقع سطحي ) تؤدي إلى تقلص سطح السائل ليشغل أصغر مساحة ممكنة له. و هذا يفسر الشكل الشبه الكروي لفطرات السائل و يكون عندئذ سطحها أصغرياً بالنسبة لحجم معين .
و بالتالي عدد الجزيئات الموجودة على السطح أقل من جزيئات السائل , و لذلك فإن البعد المتوسط بين الجزيئات على السطح أكبر قليلاً من البعد المتوسط داخل السائل و هذا يؤدي وسطياً إلى وجود قوى تجاذبية بين جزيئات السطح و هذا يفسر وجود التوتر السطحي.
من ناحية أخرى : يلاحظ أن للجزيئات الموجودة على سطح السائل طاقة كامنة أكبر من الطاقة الكامنة للجزيئات الموجودة وسط السائل وهذا يعود إلى أنه عندما نريد جلب جزيء من السائل إلى السطح يجب كسر عدد من روابطه أي يجب بذل عمل للقيام بذلك وهذا العمل يتحول إلى طاقة كامنة داخل الجزيء. و لكن هذا يخالف الميل الطبيعي للأجسام لتقليل طاقتها , و يتحقق ذلك في السوائل من خلال ميلها الطبيعي لتقليل مساحة سطحها إلى أقل قدر ممكن حيث يبرهن رياضياً أن ذلك يتحقق عندما يكون شكل السطح كروياً .
التعريف الفيزيائي للتوتر السطحي
يرمز للتوتر السطحي بالرمز σ, γ أو T، ويعرّف بأنه القوة المؤثرة عموديّا على طول خط عمل وحدة القوى عندما تكون هذه القوة موازية للسطح. ويقاس التوتر السطحي بوحدات نيوتن لكل متر(N·m-1) ، أو داين لكل سنتيميتر. وبالنسبة للديناميكا الحرارية يعرف التوتر السطحي على انه الشغل المبذول لوحدة المساحات.
الشد السطحي أو التوتر السطحي كما ذكرنا هو خاصية لسطح السائل إذ يعمل كغشاء مشدود تقف عليه الحشرات و تطفو عليه الإبرة أو الشفرة الفلزية أو حتى قطعة نقدية مع أن كثافتها أكبر من كثافة السائل.
يعتمد التوتر السطحي على عاملين:
- نوع السائل: أي أنه الحشرة لا تقف على أي سائل. حيث أن هناك ذات توتر سطحي أعلى من سوائل أخرى.
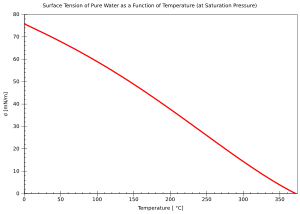
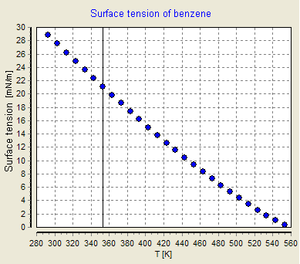
- درجة الحرارة: إذا كان السائل في درجة غليانه فذلك سيؤدي إلى انعدام قوةالتوتر السطحي. وبشكل عام كلما ارتفعت درجة حرارة السائل قل الشد السطحي للسائل.
تنشأ خاصية التوتر السطحي لسائل ما بسبب وجود قوة تماسك بين جزيئاته، و يعمل سطح السائل و كأنه غشاء مشدود. أي أن عندما نضع شفرة برفق على ماء في إناء، فإن جزيئات الماء سوف تتماسك و كأنها غشاء مشدود يحمل الشفرة. حتى ولو كانت كثافة الشفرة أكبر من كثافة الماء.
ويمكن فهم سبب حدوث ظاهرة الشد السطحي إذا لاحظنا أن أي جزيء داخل السائل يتعرض لقوى متساوية من قبل الجزيئات الحيطة به وفي جميع الاتجاهات. ولكن على النقيض من ذلك فإن جزيئات السائل التي تقع على السطح تتعرض لقوى جذب (تعرف بقوة التماسك) فقط في اتجاه السائل، (انظر الشكل الأول).
طرق قياس التوتر السطحي
يقاس التوتر السطحي باستخدام الانابيب الشعرية capillary tubes وبقياس ارتفاع السائل(h) داخل الانبوية الشعرية ونصف قطر الانبوية (r)وباستخدام العلاقة الرياضية: حيث t التوتر السطحي للسائل المستخدم وd كثافة السائل وg التعجيل الارضي وh ارتفاع السائل داخل الانبوبة الشعرية وr نصف قطر الانبوبة الشعرية.
التوتر السطحي والديناميكا الحرارية
قيم التوتر السطحي
| قيم التوتر السطحي لبعض السوائل | ||
|---|---|---|
| واجهة التلامس | درجة الحرارة | γ in (mN·m–1) |
| ماء-هواء | 20º C | 72.86±0.05 |
| ماء-هواء | 21.5º C | 72.75 |
| ماء-هواء | 25º C | 71.99±0.05 |
| ميثيلين أيوديد - هواء | 20º C | 67.00 |
| ميثيلين أيوديد - هواء | 21.5º C | 63.11 |
| إثيلين جليكول - هواء | 25º C | 47.3 |
| إثيلين جليكول - هواء | 40º C | 46.3 |
| ديميثيل سولفكسيد - هواء | 20º C | 43.54 |
| بروبلين كربونات - هواء | 20º C | 41.1 |
| بنزين - هواء | 20º C | 28.88 |
| بنزين - هواء | 30º C | 27.56 |
| طلوين - هواء | 20º C | 28.52 |
| كلوروفورم - هواء | 25º C | 26.67 |
| حمض بربيوني - هواء | 20º C | 26.69 |
| حمض الزبدة - هواء | 20º C | 26.51 |
| كربون ثلاثي الكلورايد - هواء | 25º C | 26.43 |
| حمض الأستيك - هواء | 20º C | 25.09 |
| ديثيلين جليكول - هواء | 20º C | 30.09 |
| نونان - هواء | 20º C | 22.85 |
| ميثانول - هواء | 20º C | 22.50 |
| إيثانول - هواء | 20º C | 22.39 |
| إيثانول - هواء | 30º C | 21.55 |
| أوكتان - هواء | 20º C | 21.62 |
| هبتان - هواء | 20º C | 20.14 |
| إيثر - هواء | 25º C | 20.14 |
| الزئبق - هواء | 20º C | 486.5 |
| زئبق - هواء | 25º C | 485.5 |
| الزئبق - هواء | 30º C | 484.5 |
| NaCl - هواء | 1073º C | 115 |
| KClO3 - هواء | 20º C | 81 |
| ماء- 1-Butanol | 20º C | 1.8 |
| ماء- أسيتات الإيثيل | 20º C | 6.8 |
| ماء - حمض الهبتانويك | 20º C | 7.0 |
| ماء - بنزالدهايد | 20º C | 15.5 |
| ماء- الزئبق | 20º C | 415 |
| إيثانول- الزئبق | 20º C | 389 |
الجدول يبين قيم التوتر السطحي لسوائل معينة عند تلامسها مع سطوح أخرى. القيم في الجدول مقاسة بوحدة ملي نيوتن لكل متر، وهذه الوحدة تساوي وحدة داين لكل سنتيميتر
التأثيرات
سائل في أنبوب رأسي
لو أن أنبوباً كان ضيقاً بما فيه الكفايةوالتصاق السائل بجدرانه قوي بما فيه الكفاية، فإن الشد السطحي يمكن أن يجذب السائل لأعلى في الأنبوب في ظاهرة تعرف بإسم الظاهرة الشعرية. والارتفاع الذي يصعده العمود يـُحسَب من المعادلة التالية:[1]
حيث
- هو ارتفاع السائل،
- هو الشد السطحي بين السائل والهواء،
- هو كثافة السائل،
- هو نصف قطر الأنبوب الشعري،
- هي عجلة الجاذبية،
- هي زاوية الاتصال المشروحة آنفاً. فإذا كانت أكبر من 90°، كما هو الحال مع الزئبق في حاوي زجاجي، فإن السائل سينخفض بدلاً من أن يرتفع.
وإذا وضعت قطرة من مائع على مستوٍ أفقي فإن القطرة تأخذ على الأغلب هيئة سطح دوراني. فإذا فرض أن القطرة كبيرة كبراً كافياً ليكون لها سطح علوي أفقي، وإذا كان هـ ارتفاع القطرة عن المستوي الأفقي، فإن:
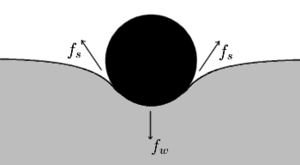
الإبرة الطافية
تخضع الإبرة الطافية على سطح الماء إلى ثقلها وإلى ضغط المائع وإلى التوتر السطحي عند منحني التقاء السطح الحر للمائع مع الإبرة. ولكن ثقل الإبرة قوة تتجه نحو الأسفل، وضغط الماء قوة متجهة نحو الأعلى وهي أقل من وزن الإبرة. ولولا قوة التوتر السطحي لاتجهت الإبرة نحو أسفل الوعاء. غير أن محصلة قوى التوتر السطحي تضاف إلى ضغط الماء وهذا ما يجعل الإبرة تطفو على سطح الماء.
Puddles on a surface
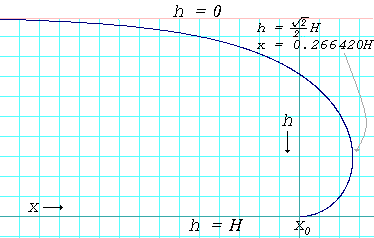
حيث
is the depth of the puddle in centimeters or meters. is the surface tension of the liquid in dynes per centimeter or newtons per meter. is the acceleration due to gravity and is equal to 980 cm/s2 or 9.8 m/s2 is the density of the liquid in grams per cubic centimeter or kilograms per cubic meter
In reality, the thicknesses of the puddles will be slightly less than what is predicted by the above formula because very few surfaces have a contact angle of 180° with any liquid. When the contact angle is less than 180°, the thickness is given by:[2]
For mercury on glass, , , and , which gives . For water on paraffin at 25 °C, , , and which gives .
The formula also predicts that when the contact angle is 0°, the liquid will spread out into a micro-thin layer over the surface. Such a surface is said to be fully wettable by the liquid.
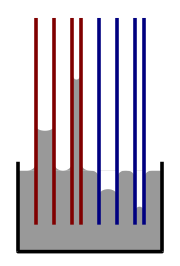
The break up of streams into drops
Thermodynamics
As stated above, the mechanical work needed to increase a surface is . Hence at constant temperature and pressure, surface tension equals Gibbs free energy per surface area:[2]
where is Gibbs free energy and is the area.
Thermodynamics requires that all spontaneous changes of state are accompanied by a decrease in Gibbs free energy.
Kelvin's Equation for surfaces arises by rearranging the previous equations. It states that surface enthalpy or surface energy (different from surface free energy) depends both on surface tension and its derivative with temperature at constant pressure by the relationship.[3]
ثرموديناميكا فقاعة الصابون
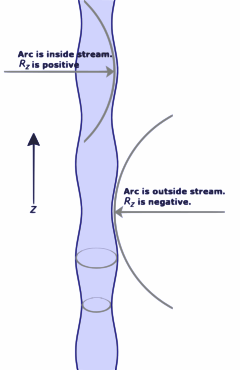
وإذا ما استخدم دستور لابلاس في حالة الأغشية المائعية، كما هو الحال في غشاء محلول الصابون بالماء الذي نحصل عليه بوضع سلك مغلق في هذا المحلول ثم سحبه ببطء من المحلول فإنه ينتج أن
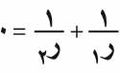 تسمى السطوح التي تحقق هذه المعادلة سطوحاً أصغرية. وينتج من هذا أن شكل فقاعة الصابون هو شكل سطح كروي.
تسمى السطوح التي تحقق هذه المعادلة سطوحاً أصغرية. وينتج من هذا أن شكل فقاعة الصابون هو شكل سطح كروي.
حيث هي الفرق في الضغط بين داخل وخارج الفقاعة، و هو الشد السطحي. وفي حالة الاتزان، , وبذلك،
- .
فلفقاعة كروية، فإن الحجم والمساحة السطحية يـُحسبا ببساطة بالمعادلة
- ,
and
- .
Substituting these relations into the previous expression, we find
- ,
which is equivalent to the Young-Laplace equation when Rx = Ry. For real soap bubbles, the pressure is doubled due to the presence of two interfaces, one inside and one outside.
تأثير درجة الحرارة
There are only empirical equations to relate surface tension and temperature:
Here V is the molar volume of that substance, TC is the critical temperature and k is a constant valid for almost all substances.[4] A typical value is k = 2.1 x 10−7 [J K−1 mol-2/3].[4][5] For water one can further use V = 18 ml/mol and TC = 374°C.
A variant on Eötvös is described by Ramay and Shields:[6]
where the temperature offset of 6 kelvins provides the formula with a better fit to reality at lower temperatures.
- Guggenheim-Katayama:[3]
is a constant for each liquid and n is an empirical factor, whose value is 11/9 for organic liquids. This equation was also proposed by van der Waals, who further proposed that could be given by the expression, , where is a universal constant for all liquids, and is the critical pressure of the liquid (although later experiments found to vary to some degree from one liquid to another).[3]
Both Guggenheim-Katayama and Eötvös take into account the fact that surface tension reaches 0 at the critical temperature, whereas Ramay and Shields fails to match reality at this endpoint.
تأثير تركيز المحلول
Solutes can have different effects on surface tension depending on their structure:
- Little or no effect, for example sugar
- Increase surface tension, inorganic salts
- Decrease surface tension progressively, alcohols
- Decrease surface tension and, once a minimum is reached, no more effect: surfactants
تأثير حجم القطرة على ضغط البخار
- is the standard vapor pressure for that liquid at that temperature and pressure.
- is the molar volume.
- is the gas constant
is the Kelvin radius, the radius of the droplets.
The effect explains supersaturation of vapors. In the absence of nucleation sites, tiny droplets must form before they can evolve into larger droplets. This requires a vapor pressure many times the vapor pressure at the phase transition point.[6]
| P/P0 for water drops of different radii at STP[3] | ||||
|---|---|---|---|---|
| Droplet radius (nm) | 1000 | 100 | 10 | 1 |
| P/P0 | 1.001 | 1.011 | 1.114 | 2.95 |
The effect becomes clear for very small drop sizes, as a drop of 1 nm radius has about 100 molecules inside, which is a quantity small enough to require a quantum mechanics analysis.
جدول البيانات
| Liquid | Temperature °C | Surface tension, γ |
|---|---|---|
| Acetic acid | 20 | 27.6 |
| Acetic acid (40.1%) + Water | 30 | 40.68 |
| Acetic acid (10.0%) + Water | 30 | 54.56 |
| Acetone | 20 | 23.7 |
| Diethyl ether | 20 | 17.0 |
| Ethanol | 20 | 22.27 |
| Ethanol (40%) + Water | 25 | 29.63 |
| Ethanol (11.1%) + Water | 25 | 46.03 |
| Glycerol | 20 | 63 |
| n-Hexane | 20 | 18.4 |
| Hydrochloric acid 17.7M aqueous solution | 20 | 65.95 |
| Isopropanol | 20 | 21.7 |
| Mercury | 15 | 487 |
| Methanol | 20 | 22.6 |
| n-Octane | 20 | 21.8 |
| Sodium chloride 6.0M aqueous solution | 20 | 82.55 |
| Sucrose (55%) + water | 20 | 76.45 |
| Water | 0 | 75.64 |
| Water | 25 | 71.97 |
| Water | 50 | 67.91 |
| Water | 100 | 58.85 |
انظر أيضاً
- Anti-fog
- Capillary wave—short waves on a water surface, governed by surface tension and inertia
- Cheerio effect—the tendency for small wettable floating objects to attract one another.
- Cohesion
- Dimensionless numbers
- Dortmund Data Bank—contains experimental temperature-dependent surface tensions.
- Electrodipping force
- Electrowetting
- Eötvös rule—a rule for predicting surface tension dependent on temperature.
- Fluid pipe
- Hydrostatic Equilibrium—the effect of gravity pulling matter into a round shape.
- Meniscus—surface curvature formed by a liquid in a container.
- Mercury beating heart—a consequence of inhomogeneous surface tension.
- Microfluidics
- Sessile drop technique
- Specific surface energy—same as surface tension in isotropic materials.
- Spinning Drop Method
- Stalagmometric method
- Surface tension values
- Surfactants—substances which reduce surface tension.
- Tears of wine—the surface tension induced phenomenon seen on the sides of glasses containing alcoholic beverages.
- Tolman length—leading term in correcting the surface tension for curved surfaces.
- Wetting and dewetting
معرض لآثار التوتر السطحي
Surface tension prevents a coin from sinking: the coin is indisputably denser than water, so it cannot be floating due to buoyancy alone.
الهوامش
المصادر
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةs_z - ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةcwp - ^ أ ب ت ث ج Adam, Neil Kensington (1941). The Physics and Chemistry of Surfaces, 3rd ed. Oxford University Press.
- ^ أ ب ت "Surface Tension by the Ring Method (Du Nouy Method)" (pdf). PHYWE. Retrieved 2007-09-08.
- ^ أ ب "Physical Properties Sources Index: Eötvös Constant". Retrieved 2008-11-16.
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةmoore - ^ Lange's Handbook of Chemistry, 10th ed. pp 1661–1665
وصلات خارجية
- On surface tension and interesting real-world cases
- MIT Lecture Notes on Surface Tension
- Surface Tensions of Various Liquids
- Calculation of temperature-dependent surface tensions for some common components
- Surface Tension Calculator For Aqueous Solutions Containing the Ions H+, NH4+, Na+, K+, Mg2+, Ca2+, SO42-, NO3-, Cl-, CO32-, Br- and OH-.
- The Bubble Wall (Audio slideshow from the National High Magnetic Field Laboratory explaining cohesion, surface tension and hydrogen bonds)