فلز انتقالي
| جزء من سلسلة عن |
| الجدول الدوري |
|---|
يحمل المصطلح فلز انتقالي (يسمى أيضا عنصرا انتقاليا) في علم الكيمياء تفسيران ممكنان:
- بصفة عامة هو أي عنصر من عناصر المستوى الفرعى d في الجدول الدوري، بما في ذلك الزنك والسكانديوم. وهذا يطابق تماما مجموعات الجدول الدوري من 3 إلى 13.
- لتحديد أكثر يمكن أن ترجع للعناصر التي تكون على الأقل بها أيون شبه ممتلئ بالإلكترونات في التوزيع الإلكتروني لعناصر المستوى الفرعي d. وهذا يطابق تماما عناصر المستوى الفرعى d بدون الزنك والسكانديوم .
راجع أيضا العناصر الإنتقالية الداخلية ، وهذا إسم يطلق على أى من عناصر المستوى f .
لكل تفسير استخداماته وما يثبته. الأول بسيط وسهل التدوال. بينما تنبع خواص العناصر الانتقالية كمجموعة من قدرتها على المساهمة بإلكترونات تكافؤ المستوى الفرعى s قبل المستوى الفرعى d، وهذه الخاصية تتبعها كل عناصر المستوى الفرعى d فيما عدا الزنك والسكانديوم, ولذا فإنه يفضل استخدام التفسير الأكثر دقة لما له من فائدة في كثير من المواقف. ويتم المساهمة بإلكترونات الأوربيتال d بعد s لأنه بمجرد البدء في ملء الأوربيتال d بالإلكترونات فإنه يقترب من النواة، مما يجعل إلكترونات المستوى الفرعى s أبعد وبالتالي تكون الإلكترونات الخارجية.
| Group | الدورة الرابعة | الدورة الخامسة | الدورة السادسة | الدورة السابعة | ||
|---|---|---|---|---|---|---|
| 3 (III B) | Sc 21 | Y 39 | Lu 71 | Lr 103 | ||
| 4 (IV B) | Ti 22 | Zr 40 | Hf 72 | Rf 104 | ||
| 5 (V B) | V 23 | Nb 41 | Ta 73 | Db 105 | ||
| 6 (VI B) | Cr 24 | Mo 42 | W 74 | Sg 106 | ||
| 7 (VII B) | Mn 25 | Tc 43 | Re 75 | Bh 107 | ||
| 8 (VIII B) | Fe 26 | Ru 44 | Os 76 | Hs 108 | ||
| 9 (VIII B) | Co 27 | Rh 45 | Ir 77 | Mt 109 | ||
| 10 (VIII B) | Ni 28 | Pd 46 | Pt 78 | Ds 110 | ||
| 11 (I B) | Cu 29 | Ag 47 | Au 79 | Rg 111 | ||
| 12 (II B) | Zn 30 | Cd 48 | Hg 80 | Uub 112 |
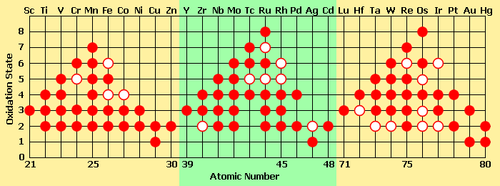
الفلزات الإنتقالية هى العناصر الكيميائية الأربعين من 21 إلى 30 ، من 39 إلى 48 ، ومن 71 إلى 80 ، ومن 103 إلى 112 .وقد تم إستخدام إنتقالية من مكانها في الجدول الدوري . ففى كل دورة من الدورات الأربعة التى توجد فيها ، تمثل هذه العناصر إضافة ناجحة للإلكترونات في المدار d في الذرة . وعلى هذا فإن الفلزات الإنتقالية تمثل الحالة الإنتقالية بين عناصر المجموعة الثانية وعناصر المجموعة الثالثة عشر .
الشكل الإلكتروني
عناصر المجموعة الرئيسية السابقة للمجموعة الإنتقالية في الشكل الدوري ( العناصر من 1 إلى 20 ) لا يوجد لها إلكترونات في المدار d ولكن في المدارات s ، d فقط . في الدورة الرابعة من السكانديوم إلى الزنك يمتلئ المستوى الفرعى d . فيما عدا مجموعة النحاس ومجموعة الكروم توجد عناصر المستوى الفرعي d في الحالة الأرضية حيث يوجد فيها إلكترونان في المستوى الفرعى s . الشكل الإلكتروني لعناصر المستوى الفرعي d كالتالى : ns2(n-1)d1-10 حيث n هى رقم الكم الرئيسي .
المدار s الخارجي لعناصر المستوى الفرعى d يكون في حالة طاقة أقل من طاقة المستوى الفرعى d للمستوى n-1 . ونظرا لأن الذرات تميل لأن تكون في أقل حالات الطاقة ، فإنه يتم ملئ المدرا s أولا ، ولكن النحاس (4s13d10) والكروم (4s13d5) هما إستثناء ويحتويان على إلكترون واحد في المدار الخارجي نظرا لحالة النصف إمتلاء والتى تكون أكثر ثباتا في الطاقة ( يحدث ذلك عند وجود 5 أو 10 إلكترونات في المدار d ) .
يحتوى السكانديوم على إلكترون وحيد في المدار d ، و إلكترونان في المدار s الخارجي . ونظلا لأن أيون السكانديوم Sc3+) لا يوجد به إلكترونات في المدار d أى أنه لا يمكن أن يكون ممتلئ جزيئا بالإلكترونات لهذا المدار ، ولذا فغنه لا يكون من الفلزات الإنتقالية لو طبقنا هذه القاعدة بالتحديد . وبالمثل ، الزنك فإنه لا يكون من الفلزات الإنتقالية نظرا لأنه يوجد كأيون Zn2+ ويحتوى على مدار d ممتلئ .
الخواص الكيميائية
تميل العناصر الإنتقالية لأن يكون لها عزم شد ، كثافة ، درجة حرارة غليان ودرجة حرارة ذوبان عالية . وكما يوجد في كثير من الفلزات الإنتقالية ، فإن هذا يرجع إلى قدرة إلكترونات المدار d على إعادة التمركز . فالمواد الفلزية ، كلما زادت فيها الإلكترونات المشاركة بين النويات ، كلما كان الفلز أقوى .
ويوجد عدة خواص عامة للفلزات الإنتقالية :
- يكونوا مركبات ملونة .
- يمكن أن يكون لها أكثر من حالة تأكسد .
- عوامل حفازة جيدة .
- لونها فضى يميل إلى الأزرق في درجة حرارة الغرفة ، فيما عدا النحاس والذهب .
- كلها صلبة في درجة حرارة الغرفة فيما عدا الزئبق .
- يمكن أن تكون مركبات معقدة ، والتى يتم وصفها في نظرية الحقل البللوري .
حالات التأكسد المختلفة
عند المقارنة مع عناصر المجموعة الثانية مثل الكالسيوم ، فإن العناصر الإنتقالية تكون أيونات بمدى واسع من حالات التأكسد . وتظهر حالات التأكسد العديدة للعناصر الإنتقالية نظرا لأن حالة الإمتلاء الجزئي في المستوى الفرعى d تمكن هذه العناصر من تقبل أو إعطاء الإلكترونات في التفاعلات الكيميائية . بينما يفقد أيون عنصر الكالسيوم أكثر من 2 إلكترون ، بينما يمكن للعناصر الإنتقالية أن تفقد حتى 9 إلكترونات . ويمكن الوصول لسبب هذا عن طريق دراسة المحتوى الحراري للتأين للمجموعتان . الطاقة اللازمة لتحريك إلكترون من الكالسيوم تكون قليلة حتى محاولة تحريك إلكترون من المستوى الفرعى التالى للمستوى s الخارجي والذى يحتوى 2 إلكترون . وفى الواقع فإن Ca3+ له محتوى حرارى مرتفع لدرجة أنه يحدث بندرة شديدة طبيعيا . بينما أى عنصر إنتقالي مثل الفانديوم له تقريبا زيادة خطيةفى المحتوى الحراري للتأين خلال إلكترونات المدارات s ، d ، نظرا لقرب الطاقة بين المدارات 3d و 4s . وعلى هذا فغن العناصر الإنتقالية غالبا ما توجد في فى حالات عالية .
يمكن ملاحظة ظهور إتجاه معين يظهر هلال الدورة للعناصر الانتقالية:
- يزيد رقم التأكسد لكل أيون حتى الوصول للمنجنيز ، والذى يرجع بعده هذا الرقم للنقصان. وهذا النقصان راجع للجذب الزائد من البروتونات الموجودة في النواة للإلكترونات, مما يجعلها صعبة الإنفصال.
- عند وجود العناصر في حالات التأكس المنخفضة ، يمكن أن يتواجدوا على هيئة أيونات بسيطة. ولكن عند التواجد في حالات التأكسد الأعلى فإنها غالبا ما تكون مرتبطة تساهميا لمركبات لها سالبية كهربية مثل O ، F ، ويوجد هذا في الأيونات متعددة الذرات مثل الكرومات والفانيدات والبيرمنجنات.
الخواص بعد النظر إلى ثبات حالة التأكسد:
- كلما زادت حالة التأكسد كلما قل ثبات العناصر خلال الدورة .
- تميل العناصر ذات حالات التأكسد العالية لتكون عومال مؤكسدة جيدة ، بينما تميل العناصر ذات حالات التأكسد النمنخفضة لأن تكون عتصبح عوامل مؤكسدة أكثر عند الإنتقال من عنصر إلى أخر خلال الدورة .مختلفة */
وامل مختزلة.
- الأيونات +2 خلال الدورة تبدأ بكونها عامل مخنزل قوي ، وتصبح أكثر ثباتا عند الإنتقال من عنصر إلى أخر خلال الدورة.
- الأيونات +3 تبدأ ثابتة.
النشاط الحفزي
تكون الفلزات الإنتقالية عوامل حفازة جيدة سواء كانت متجانسة أو غير متجانسة ، فمثلا الحديد هو العامل الحفاز في عملية هابر . كما يستخدم النيكل أو البلاتين في عملية هدرجة الألكينات .
المركبات الملونة
يمكن للعين البشرية تمييز اللون خلال التردد المرئى للأشعة الإلكترومغناطيسية للطيف الإلكترومغناطيسي . ويكون هناك عديد من الألوان ناتجة من التغير في تركيب الضوء بعد إنعكاسه أو أمتصاصه عند إصطدامه بأى مادة . ونظرا لأن لتركيب الفلزات الإنتقالية ، فغنها تكون مركبات وأيونات ملونه . كما أن اللون يتغير للعنصر الواحد خلال أيوناته المختلفة MnO</nowiki>4- ( المنجنيز في حالة التأكسد +7 ) مركب أرجواني اللون ، بينما Mn2+ لونه قرنفلى شاحب .
يمكن بإستخدام تكون المركبات المعقدة تحديد اللون في العناصر الإنتقالية . وهذا نظرا لتأثير الليجندات على المدار 3d . تقوم الليجندات بجذب بعض إلكترونات المدار 3d وتقسمهم إلى مجموعات أعلى وأقل في الطاقة . يمكن للإشعاع الإلكترومغناطيسي أن يلاحظ لو أن تردده يتناسب مع فرق الطاقة بين حالتى الطاقة الموجودتان في الذرة ( طبقا للمعادلة e=hf ) عندما يصطدم الضوء بذرة والتى يكون الدارد 3d فيها منقسم ، يتم ترقية بعض الإلكترونات إلى مستوى طاقة أعلى . وبالتالى نظرا لأنه يمكن إمتصاص عديد من ترددات الضوء فإنه ينتج من ذلك عديدي من الألوان في المنركبات المعقدة .
يعتمد اللون في المركب المعقد على التالى :
- نوع أيون الفلز ، وبالتحديد عدد الإلكترونات في المدار d .
- ترتيب الليجندات حول أيون الفلز ( فمثلا يمكن للنظائر الفراغية ).
- طبيعة الليجند الحيط بإيون الفلز . فكلما زذدات قوة الليجند كلما زادت فروق الطاقة بين مجموعتى 3d المنفصلتين .
المركب المعقد المتكون من المدار d في عنصر الزنك ( والذى لا يعتبر عنصر إنتقالي ) لا لون له ، نظرا لأن المارد 3d ممتلئ ، لا توجد إلكترنات قابلة للحركة لمستوى طاقة أعلى .
المصادر
- ويكيبيديا الإنجليزية.