جزيء
الجزيء molecule هو أصغر جسيم من المادة الكيميائية النقية يحتفظ بتركيبها الكيميائي، وخواصها. علم دراسة الجزيئات يسمى كيمياء جزيئية'' أو فيزياء جزيئية ، اعتمادا على مجال الرؤية المعين. تهتم الكيمياء الجزيئية بالقوانين التى تحكم التفعلات بين الجزيئات التى ينتج عنها تكون أو تكسير للروابط الكيميائية، بينما تهتم الفيزياء الجزيئية بالقوانين التى تحكم بناء الجزيئات. وبصفة عامة، فإن الفرق بينها قد يكون غامض وصعب التحديد إلى حد ما.

وتحمل الجزيئات الخواص الرئيسة للمواد المركبة بصورة مشابهة لما تحمله الذرات لمواد بسيطة مكونة من عنصر كيمياوي وحيد. يبلغ عدد الذرات فيما يقصد بالجزيئة عادة عشرة و ما دون ذلك، إلا أن هذا العدد يمكن أن يصل إلى عشرات أو مئات أو آلاف الذرات، فيقال عن الجزيء حينئذ جزيء كبير macromolecule. تتكون جزيء الماء مثلاً من ثلاث ذرات H2O أما جزيء الهموجلوبين في البروتينات والمركبات العضوية.
قد تترتب الذرات على شكل سلسلة مكونة ما يسمى أحادي الحد monomer، ثم ترتبط هذه السلاسل فيما بينها عرضيا بشكل متصالب لتكون بوليمر في عملية التبلمر.
بدأ التنبيه إلى ضرورة التمييز بين الذرات والجزيئات المتعددة الذرات عند دراسة خواص الغازات منذ عام 1811 على يد أڤوگادرو، وتأكدت صلاحيته عندما استطاع ستانيسلاو كانيزارو Cannizzaro عام 1858 حل تناقضات النتائج التجريبية المتراكمة حتى ذلك الوقت وتبين له إضافة إلى ذلك، ضرورة النظر في البنية الثلاثية الأبعاد للجزيئات.
و لتعريف الجزيئات بدقة، فإن الجزيئات يمكن أن تتكون من ذرة واحدة (كما في الغازات النبيلة) أو أكثر من ذرة مرتبطة معا. و يتم إستخدام تصور الجزيء وحيد الذرة حصريا في نظرية الحركة للغازت. في علم الجزيئات يتكون الجزيء من نظام ثابت (حالة ترابط) تستوعب ذرتين أو أكثر. والمصطلح جزيء غير ثابت يستخدم للأنواع النشطة، أى الجسيمات التى لها عمر قصير (لها رنين) في الإلكترونات والذرات، مثل الجذور "Radicals", الجزيئات الأيونية, جزيء رايدبرگ (شاهد ذرة رايدبرگ)، الحالات الإنتقالية، متراكبات فان در ڤال، أو الأنظمة التى يحدث فيها تجمع للذرات في تكاثف بوز-أينشتاين. كما يستخدم المصطلح جزيء بصفة خاصة كمرادف "للرابطة التساهمية"، وهذا نتيجة للحقيقة التى تنص على أن المركبات غير التساهمية, المركبات الأيونية لا تنتج ما يمكن تعريفه بدقة على أنه "الجسيمات الدقيقة" التى يمن أن تتلائم مع التعريفات السابقة.
ورغم أن مصطلح الجزيء تم استخدامه لأول مرة في عام 1811 عن طريق أڤوگادرو، كان المصطلح مادة مفتوحة للنقاش في مجتمع الكيمياء حتى ظهور نتائج أبحاث بيرن في عام 1911. كما أن النظرية الحديثة للجزيئات قد استفادت كثيرا من التقنيات المستخدمة في الكيمياء الحسابية.
علم الجزيئيات
التاريخ والتسمية
 مقالة مفصلة: تاريخ نظرية الجزيئيات
مقالة مفصلة: تاريخ نظرية الجزيئيات
تكون الجزيئات
أمكن تفسير تكون الجزيئات بدءاً من ذراتها والكثير من خواصها اعتماداً على ميكانيك الكم[ر] الذي يحدد التوابع الموجية لذرات العناصر المختلفة وخاصة تناظراتها وطبقاتها الإلكترونية الخارجية، إذ تميل الذرات لإكمال الطبقة الإلكترونية الخارجية حتى تشبع وفق قوانين محددة في ميكانيك الكم. أما إذا كانت مشبعة أصلاً، كما هي الحال في الغازات الخاملة مثل الهليوم، فإن تشكل الجزيئات منها بعيد الاحتمال في درجات الحرارة العادية ولا تتشكل الجزيئات إلا في درجات حرارة منخفضة تحت الصفر المئوي بكثير. يعزى ذلك إلى أن الطاقة المكتسبة من الإرتباط التي تسمى طاقة التشكل، أقل بكثير من الطاقة الحرارية الوسطية للذرات في الدرجة العادية من الحرارة.
وإذا كانت الطبقة الخارجية لذرة ما تحتوي إلكتروناً واحداً، كما في المعادن القلوية مثل الصوديوم، تميل هذه الذرة إلى التخلي عن هذا الإلكترون لتصبح طبقتها مشبعة؛ بالمقابل يمكن أن تكتمل طبقة ذرة عنصر آخر، كما في الهالوجينات مثل الكلور، بهذا الإلكترون فتتكون جزيئة هي كلور الصوديوم (ملح الطعام) في مثالنا، عند اقتراب الذرتين ويكون انتقال الإلكترون شبه كامل من الذرة الأولى إلى الثانية وتظهر الرابطة بينهما وكأنها رابطة كهربائية بين أيون موجب الشحنة وأيون سالب الشحنة (الذرة التي اكتسبت إلكتروناً). وتسمى الرابطة رابطة أيونية أو شاردية. قد لا يكون انتقال الإلكترونات كاملا في حالة جزيئات أخرى، بل يتم الإشباع بتشارك الإلكترونات فيما بينها فيقضي الإلكترون وقته بين الذرتين فتسمى الرابطة عندئذ تشاركية أو تساهمية. يظهر هذا الأمر واضحاً عندما تكون الجزيئة مكونة من ذرتين متماثلتين مثل جزيئة الهدروجين أو الأكسجين، ويظهر كلاهما بالشكل الجزيئي عند درجة الحرارة العادية مما يشير إلى أن الرابطة بين الذرتين قوية، أقوى من حالة الغازات الخاملة. أما إذا لم تكن ذرتا الجزيئة متماثلتين فتختلف المدد الزمنية التي يصرفها الإلكترون بين الذرتين وتظهر الجزيئة وكأنها ثنائي قطب كهربائي كما في ذرة أول أكسيد الكربون CO. وتصبح المسألة أكثر تعقيداً عندما تتكون الجزيئة من ثلاث ذرات أو أكثر سواء من حيث الحسابات أو من حيث الإمكانات المختلفة لمواقع الذرات وترابطاتها وتآثراتها فيما بينها. فلا بد أن تتأثر الذرات بجاراتها ويصبح لابد من إلى النظر في الإمكانات الثلاثية الأبعاد لتوضحها.
بنية الجزيئات
ليس للجزيئات الثنائية الذرة من وسطاء نحددها سوى البعد بين الذرتين و شدة الترابط بينهما. أما بالنسبة للجزيئات الثلاثية الذرة فإنه من الضروري تحديد الزوايا بين الخطوط الواصلة بينها، إضافة إلى أطوالها و قوة الروابط، ولابد من الكلام أيضاً عن ترتيب الذرات لإتمام الوصف. ففي جزيئة الماء مثلاً، المكونة من ذرتي هدروجين وذرة أكسجين تكون الزاوية مساوية 105 ْ والترتيب H-O-H، وليس O-H-H، أما في حالة ثنائي أكسيد الكربون فالترتيب O-C-O والزاوية قرابة 180 ْ. وتبدأ الصورة الثلاثية الأبعاد بالظهور عندما يزيد عدد الذرات على الثلاث، إذ ليس من الضروري عندئذ أن تبقى الذرات موزعة في مستو واحد أي مسطحة. فجزيئة الميثان CH4 مثلاً، يرتبط فيها أربع ذرات هدروجين بذرة كربون وفق أحرف رباعي وجوه تشغل ذرة الكربون مركزه وذرات الهدروجين رؤوسه. ويمكن أن تستبدل بذرة الهدروجين مجموعة CH3 وتستمر هذه العملية لنحصل على سلسلة تكوّن نوع مما يعرف بالفحوم الهدروجينية (الكربوهدروجينية) المختلفة باختلاف هندستها. فقد تتشكل فحوم هدروجينية حلقية مغلقة أو شبه مغلقة. وقد ساعدت مثل هذه الدراسات البنيوية في تصنيع كثير من المواد المشابهة للمواد الطبيعية، إضافة إلى اقتراح مواد جديدة ذات خواص مميزة. يطلق على جزيئاتها اسم البنية مثل المكعبية والنجمية والموشورية أو ذات الكرسي أو القاربية وغير ذلك .
وكما حصل لدى دراسة بنية المواد العضوية التي أساسها الكربون والهدروجين، تبين أن السليكون والأكسجين هما أساس الفلزات الطبيعية حيث تقوم الرابطة والبنية بدور حاسم في تحديد خواصها. تمثل الوحدة O-Si الوحدة الرئيسة في هيكل البنية فإذا تكررت بضع وحدات فقط تشكلت صخور طرية كالصخور الحوارية، أما إذا تكونت سلاسل طويلة صارت البنية ليفية مثل الأسبيستوس أو قد تشكل بنية ثنائية البعد صفيحية مثل الميكا، بينما يمثل الكوارتز البنية الثلاثية الأبعاد المرتبطة بقوى متقاربة الشدة في الأبعاد الثلاثة.
الرابطة الكيميائية
 مقالة مفصلة: رابطة كيميائية
مقالة مفصلة: رابطة كيميائية

فى الجزيئات تكون الذرات بأزواج الإلكترونات المشتركة في "الرابطة الكيميائية". وقد تتكون من ذرات لنفس العنصر الكيميائي، مثل الأكسجين (O2)، أو من ذرات عناصر مختلفة مثل الماء (H2O).
حجم الجزيء
معظم الجزيئات صغيرة للغاية حتى يمكن رؤيتها بالعين المجردة، و لكن يوجد بعض الإستثناءات، فمثلا الجزيئات الكبيرة مثل جزيء DNA يمكن أن يصل للحجم المجهري.
أصغر الجزيئات حجما هو جزيء الهيدروجين. المسافة بين الذرية له تكون 1.5 Å. و لكن يصعب تحديد السحابة الإلكترونية بدقة. و تحت الظروف العادية يكون للجزيء بعد يتراوح من عدة إلى عدة عشرات من Å. وقد يوجد روابط اخرى مثل الرابطة المشتركة حيث الرابطة المشتركة تتكون من ثلاثة اقسام احداية ثنايئية ثلاثية والرابطة التساهمية
المعادلة الملكية
 مقالة مفصلة: معادلة ملكية
مقالة مفصلة: معادلة ملكية
"المعادلة الملكية" للجزيء هى نسبة الرقم الصحيح للعناصر التى تكون المركب. فمثلا في الشكل النقي للماء، دائما يتكون من 1:2 هيدروجين : أكسجين، كما أن الكحول الإثيلي أو الإيثانول جاما يتكون من الكربون، والهيدروجين, والأكسجين بنسبة 1:6:2. وعموما, هذا لا يحدد نوع الجزيء فمثلا داي ميثيل إثير له نفس النسبة الموجودة في الميثانول. وتسمى الجزيئات التى لها نفس عدد الذرات المكونة لها أيزومرات.
المعادلة الكيميائية
 مقالة مفصلة: معادلة كيميائية
مقالة مفصلة: معادلة كيميائية
"المعادلة الكيميائية" تعكس الرقم الدقيق لعدد الذرات التى تكون الجزيء. ويتم حساب الكتلة الجزيئية من المعادلة الكيميائية في وحدات تساوى 12/1 من كتلة نظير ذرة C 12.
هندسة الجزيء
 مقالة مفصلة: هندسة جزيئية
مقالة مفصلة: هندسة جزيئية
الجزيئات لها حالة تعادل ثابتة بطول رابطة وزاوية بين الروابط معينين. وتتكون المادة النقية من جزيئات لها نفس البناء الفراغي. ويكون المعادلة الكيميائية وبناء الجزيء دور هام في تحديد خواص الجزيء, وخاصة نشاطيته. الأيزومرات تتشارك في نفس شكل المعادلة الكيميائية, ولكن يكون لكل منها خواص مختلفة تماما نظزرا لإختلاف بنائها. الأيزومرات الفراغية، نوع خاص من الأيزومرات, ويمكن أن يكون لها خواص فيزوكيميائية متشابهه ولكن في نفس الوقت تختلف تماما في نشاطها الحيوي.
التحليل الطيفي الجزيئي
 مقالة مفصلة: التحليل الطيفي
مقالة مفصلة: التحليل الطيفي
الطيف الجزيئي هو دراسة استجابة جزيء للطيف الذى له تردد معين (أو طبقا لمعادلة بلانك لطاقة ذلك الطيف). وهذا الطيف عبارة عن موجة كهرمغناطيسية أو شعاع من الإلكترونات . وهناك تطوير في الأنواع الجديدة من المطياف الجزيئي ليصبح مطياف بوزيترون. ويمكن أن يكون الرنين الجزيئي ناتج من إمتصاص الطيف (مطياف الإمتصاص), أو إنبعاث طيف أخر (مطياف الإنبعاث)، أو كنتيجة لتفتت الجزيء, أو تغير في حالته الكيميائية.
ويعتبر المطياف أقو الأدوات في التحقق من الخواص المجهرية للجزيئات، وبالتحديد، مستويات الطاقة. ومن أجل الحصول على أقصى المعلومات المجهرية من نتائج التجارب، فإنه يتم إقران الدراسات الطيفية مع دراسات الكيماء الحسابية. كما أنه من المفيد معرفة أن الأصل النظرى للمطياف يرجع إلى نظرية التشتت.
الجوانب النظرية
التطبيقات
مكّن تحديد الجزيئات وبنيتها في المواد الطبيعية، من تقليدها والحصول صناعياً على مواد مشابهة، كما مكن تحديد الاختلاف بين مواد تقوم بوظائف متماثلة من اقتراح بنى مبتكرة ودراسة خصائصها، كأن ندخل ذرات معدنية بين حلقتين مسطحتين من فحوم هدروجينية حلقية مثل الفروسين d2Fe (C5H5)لنحصل على المركبات المعدنية العضوية organometallic compounds وهي جزيئات يمكن أن يكون ترابطها جيداً بالمعادن من جهة وكارهة للماء من الجهة الثانية فتستعمل في طلي أدوات الطبخ. كما أمكن إدخال عناصر جديدة بنسب ضئيلة مثل الحديد أو النحاس في جزيئات عضوية فاتضحت تأثيرات سريرية وسمية لها. ويمكن أيضاً تحريض حدوث ترابطات عرضية فتزداد القساوة أو المرونة كما في تصنيع البوليمرات المختلفة خلال عملية التبلمر. وما أمكن فعله في المواد العضوية جرب على الفلزات فقد أمكن تصنيع مواد خاصة أساسها السليكون أو مواد عضوية أضيف لها وحدة SiO مثل المواد السليكونية الهلامية التي تجمع بين الخواص العضوية والسيليكاتية. وقد أفادت هذه العمليات من دراسة الاهتزازات الممكنة للجزيئات في تراكيبها المختلفة فعينت تواترات هذه الاهتزازات وشداتها واستخلص منها قوة الروابط وإمكان فصلها ثم إعادة ربطها ضمن ظروف جديدة للحصول على بنية مبتكرة ذات مميزات جديدة.
ويعد تحديد بنية جزيء الدنا DNA بداية مرحلة جديدة في علوم الحياة.[6]
مواضيع متعلقة
- هندسة جزيئية
- شكل المدار الجزيئي
- الرابطة التساهمية
- الجزيئات القطبية
- الجزيئات الغير قطبية
- قائمة الجزيئات في الفضاء المحيط
- ثنائي الذرة
- جزيئات متعددة الذرات
انظر أيضاً
- Atom
- Van der Waals molecule
- Diatomic molecule
- Small molecule
- Chemical polarity
- Molecular geometry
- Covalent bond
- Noncovalent bonding
- list of compounds for a list of chemical compounds
- List of molecules in interstellar space
- Software for molecular mechanics modeling
- Molecular Hamiltonian
- Molecular ion
- Molecular orbital
- Molecular modelling
- Molecular design software
- WorldWide Molecular Matrix
- Periodic Systems of Small Molecules
المصادر
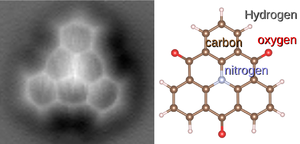
- ^ Iwata, Kota; Yamazaki, Shiro; Mutombo, Pingo; Hapala, Prokop; Ondráček, Martin; Jelínek, Pavel; Sugimoto, Yoshiaki (2015). "Chemical structure imaging of a single molecule by atomic force microscopy at room temperature". Nature Communications. 6: 7766. Bibcode:2015NatCo...6E7766I. doi:10.1038/ncomms8766. PMC 4518281. PMID 26178193.
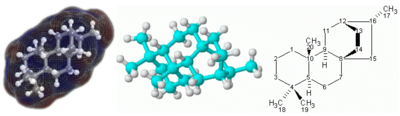
- ^ Dinca, L. E.; De Marchi, F.; MacLeod, J. M.; Lipton-Duffin, J.; Gatti, R.; Ma, D.; Perepichka, D. F.; Rosei, F. (2015). "Pentacene on Ni(111): Room-temperature molecular packing and temperature-activated conversion to graphene". Nanoscale. 7 (7): 3263–9. Bibcode:2015Nanos...7.3263D. doi:10.1039/C4NR07057G. PMID 25619890.
- ^ Hapala, Prokop; Švec, Martin; Stetsovych, Oleksandr; Van Der Heijden, Nadine J.; Ondráček, Martin; Van Der Lit, Joost; Mutombo, Pingo; Swart, Ingmar; Jelínek, Pavel (2016). "Mapping the electrostatic force field of single molecules from high-resolution scanning probe images". Nature Communications. 7: 11560. Bibcode:2016NatCo...711560H. doi:10.1038/ncomms11560. PMC 4894979. PMID 27230940.
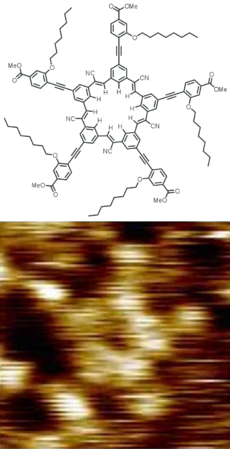
- ^ Hirsch, Brandon E.; Lee, Semin; Qiao, Bo; Chen, Chun-Hsing; McDonald, Kevin P.; Tait, Steven L.; Flood, Amar H. (2014). "Anion-induced dimerization of 5-fold symmetric cyanostars in 3D crystalline solids and 2D self-assembled crystals". Chemical Communications. 50 (69): 9827–30. doi:10.1039/C4CC03725A. PMID 25080328.
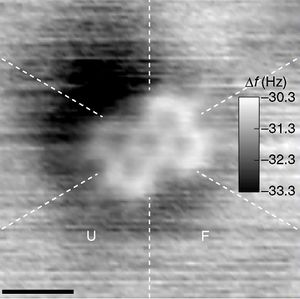
- ^ Zoldan, V. C.; Faccio, R; Pasa, A. A. (2015). "N and p type character of single molecule diodes". Scientific Reports. 5: 8350. Bibcode:2015NatSR...5E8350Z. doi:10.1038/srep08350. PMC 4322354. PMID 25666850.
- ^ فوزي عوض. "الجزيئات (والجزيئات الكبيرة)". الموسوعة العربية.
وصلات خارجية
- Molecule of the Month – School of Chemistry, University of Bristol