كربونات المغنسيوم
| |
| |
| الأسماء | |
|---|---|
| أسماء أخرى | |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.008.106 |
| E number | E504(i) (acidity regulators, ...) |
PubChem CID
|
|
| رقم RTECS |
|
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
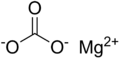
| الصيغة الجزيئية | MgCO3 |
| كتلة مولية | 84.3139 گ/مول (anhydrous) |
| المظهر | مادة صلبة بيضاء اللون hygroscopic |
| الرائحة | عديمة الرائحة |
| الكثافة | 2.958 گ/سم3 (anhydrous) 2.825 گ/سم3 (dihydrate) 1.837 گ/سم3 (trihydrate) 1.73 گ/سم3 (pentahydrate) |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | anhydrous: 0.0139 گ/100مل (25 °C) 0.00603 گ/100مل (100 °C)[2] |
| نتاج قابلية الذوبان، Ksp | 10−7.8[1] |
| قابلية الذوبان | soluble in acid, aqueous CO2 insoluble in acetone, ammonia |
| القابلية المغناطيسية | −32.4·10−6 cm3/mol |
| معامل الانكسار (nD) | 1.717 (anhydrous) 1.458 (dihydrate) 1.412 (trihydrate) |
| البنية | |
| البنية البلورية | Trigonal |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-1113 kJ/mol[3] |
| Standard molar entropy S |
65.7 J/mol·K[2][3] |
| سعة الحرارة النوعية، C | 75.6 J/mol·K[2] |
| المخاطر | |
| صفحة بيانات السلامة | ICSC 0969 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | غير قابل للاشتعال |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 15 مگ/م3 (الإجمالي) TWA 5 مگ/م3 (resp)[4] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
بيكربونات الماغنسيوم |
كاتيونات أخرى
|
كربونات البريليوم كربونات الكالسيوم كربونات السترونتيوم كربونات الباريوم |
مركـّبات ذات علاقة
|
Artinite Hydromagnesite Dypingite |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كربونات المغنسيوم هو مركب كيميائي له الصيغة MgCO3، ويكون على شكل ملح أبيض اللون لا يذوب في الماء، وله استخدامات عديدة علاجياً وصناعياً وصيدلانياً.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص
مسحوق أبيض ضخم عديم الرائحة، أو كتل خفيفة بيضاء هشة، عديم الانحلال عملياً في الماء، ولا ينحل في الكحول، لكن ينحل في الحموض الممدة مع فوران.
التحضير
التفاعلات
مع الأحماض
- MgCO3 + 2 HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
الانحلال
- MgCO3 → MgO + CO2 (ΔH = +118 ك.ج/مول)
- Mg(HCO3)(OH)•2(H2O) → Mg(HCO3)(OH)•(H2O) + H2O عند 157 °س
- Mg(HCO3)(OH)•(H2O) → Mg(HCO3)(OH) + H2O عند 179 °س
الاستخدامات
- علاجياً: تستعمل كربونات المغنسيوم كمادة مضادة للحموضة، كما أن لها تأثيراً مسهلاً تناضحياً.
- صناعيا: يدخل في صناعة معاجين الأسنان وأدوات التجميل كالكريمات ويستخدم أيضا كمادة مالئة لتقوية البلاستيك وزيادة صلابته عند التصنيع[5].
الاستخدام الصيدلاني
يُستعمل كممدد في المضغوطات والمحافظ حيث يُستعمل بشكل رئيسي في مضغوطات الضغط المباشر بتراكيز أعلى من 45% وزن/وزن، كما يُستخدم أيضاً لادمصاص السوائل الداخلة في تركيب المضغوطة كالمطعمات و تُعد كربونات المغنسيوم غذاءً إضافياً ، أما علاجياً فيُستخدم كمضاد للحموضة.
الأمان
- تم تصنيف كربونات المغنسيوم في فئة المواد غير السامة غير المخرشة لكن كما هو معروف فإن استخدام أملاح المغنسيوم ومنها كربونات المغنسيوم هو مُضاد استطباب لدى المصابين بقصور كلوي.
- يتفاعل كربونات المغنسيوم في المعدة مع الحموضة المعديّة مشكلاً ملح كلوريد المغنيزيوم الذوّاب وثنائي أكسيد الكربون، لذلك لا يُنصح باستخدام كربونات المغنسيوم كمُضاد للحموضة للأشخاص الذين لا يحتملون حركة غاز ثاني أكسيد الكربون داخل المعدة.
- يُمتص جزء من المغنسيوم ويُطرح عن طريق البول، كما يملك كربونات المغنسيوم خصائص مليّنة كأملاح المغنسيوم الأخرى وقد يُحدث إسهالات.
حفظ المادة
يجب أن يحفظ في عبوات محكمة الإغلاق في أماكن جافة و باردة.
انظر أيضاً
- أسيتات الكالسيوم/كربونات الماغنسيوم
- Upsalite، شكل غير متبلور من كربونات المغانيسيوم
المصادر والهوامش
- ^ Bénézeth, Pascale; Saldi, Giuseppe D.; Dandurand, Jean-Louis; Schott, Jacques (2011). "Experimental determination of the solubility product of magnesite at 50 to 200 °C". Chemical Geology. 286 (1–2): 21–31. doi:10.1016/j.chemgeo.2011.04.016.
- ^ أ ب ت http://chemister.ru/Database/properties-en.php?dbid=1&id=634
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 0-618-94690-X.
- ^ NIOSH Pocket Guide to Chemical Hazards 0373
- ^ استفسارات - بيوتات الكيمياء التعليمية.
وصلات خارجية
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||

