امتزاز
الامتزاز أو الادمصاص (إنگليزية: adsorption) هو تراكم ذرات أو جزيئات على سطح المادة. وتخلق هذه العملية طبقة من الجزيئات أو الذرات التي تراكمت بكثافة على سطح الممتصات. وهو يختلف عن الامتصاص حيث تنتشر المادة في السائل أو الصلب لتشكل محلولا. يجمع مصطلح اشتراب (sorption) كلا العمليتين، في حين أن الانتزاز هو عكس الامتزاز.
وبعبارات بسيطة، الامتزاز هو "تجميع مادة ما على سطح المادة الماصة". فهي عملية إزالة يحدث فيها الربط مع سطوح جزئيات المادة الماصة بواسطة تجاذب كيميائي أو فيزيائي. وكثيرا ما يخلط مفوم الامتزاز مع الانتزاز، حيث تقوم المادة المتجمعة أو المزالة بالتغلغل قي مادة أخرى (رينولدز وريتشاردز، 1996).
ويوجد الامتزاز في كثير من النظم الفيزيائية والبيولوجية والكيميائية الطبعية، ويستخدم استخداما واسعا في التطبيقات الصناعية مثل: تنقية الماء باستخدام الكربون النشط أو الراتنجات الاصطناعية. وتعتبر كل من عمليات الامتزاز، والتبادل الأيوني، والاستشراب من عمليات الاشتراب (sorption) حيث تنتقل المواد الممتصة انتقائيا من الطور السائل إلى سطح الجسيمات الصلبة المستعلقة غير الذوابة في وعاء أو معبأة في عمود.
على غرار التوتر السطحي، فإن الامتزاز هو نتيجة لطاقة السطح. في المواد الصلبة، تترابط جميع الذرات مع بعضها (سواء كانت رابطة أيونية أو تساهمية أو معدنية))وتكون الذرات في قلب المادة محاطة بذرات أخرى. ولكن الذرات على سطح الادة الماصة لا تكون محاطة كليا بذرات من المادة الماصة، وبذلك يمكن أن تجذب مواد ممتزة. وتعتمد طبيعة الروابك المتشكلة على نوعية الجزئيات المرتبطة، ولكن عملية الامتزاز عموما تصنف كامتزاز فيزيائي (physisorption) (تتصف بقوى فان دير فالس الضعيفة) أو امتزاز كيميائي (chemisorption) (تتصف بروابط تساهمية).
التمزز الفيزيائي
لا يتم التمزز الفيزيائي إلا في درجات حرارة منخفضة، وهو يستعمل قوى قليلة الشدة تدعى قوى ڤان در ڤالز؛ ولا تزيد الحرارة المنطلقة عن هذا التمزز على رتبة 5حرة/ مول. ويزداد هذا التمزز بازدياد ضغط الغاز، وينقص بارتفاع درجة الحرارة؛ ففي درجة حرارة وضغط معينين يكون الغاز أكثر قابلية للتمزز كلما كان أسهل تسييلاً.
ويمكن للغاز حسب الحالات ـ أن يكوّن على سطح الجسم الصلب طبقةً أحادية الجزيء أو متعددة الجزيئات.
ويعد التمزز الفيزيائي وسيلة تجزئة في التحليل المباشر، وهو يستعمل أيضاً في جعل الخلاء كاملاً في حيز مغلق.
التمزز الكيمياوي
هو تكوّن روابط بين الجزيئات السطحية لمعدن (أو لأي مادة أخرى ذات طاقة سطحية عالية) ومادة أخرى (غاز أو سائل) على تماس معه.
وهذه الروابط المتشكلة قابلة للمقارنة من حيث الشدة بالروابط الكيمياوية العادية، وهي أقوى بكثير من قوى فاندرفالس المميزة للتمزز الفيزيائي إذ تكون الحرارة المنطلقة عن هذا التمزز من رتبة 100حرة/مول.
وفي الغالب تتبدل الجزيئات المتمزَّزَة كيمياوياً، فهكذا مثلاً يُتمزز الهدروجين الجزيئي كيمياوياً على سطح معدني على هيئة ذرات هدروجين، ويمكن للفحوم الهدروجينية أن تُتَمزز كيمياوياً على هيئة ذرات هدروجين وأجزاء صغيرة فحمية هدروجينية.
تتبدل خاصيات الجزيئات ـ حتى في الحالة التي لا يحدث فيها التفكك تبدلاً يختلف باختلاف السطح الماز. وهذه الآلية هي القوة المنشطة للوساطة.
والمثال العملي للتمزز الكيمياوي هو التزليق lubrication للأجزاء المعدنية المتحركة في الآلات؛ إذ تكوّن رقاقةٌ من الزيت المزلِّق طبقة متمززة كيمياوياً على السطح البيني interface فتجنبه قوى الاحتكاك العالية التي تحدث في حال غياب هذه الطبقة الزيتية.
ويتطلب التمزز الكيمياوي أجسامأ صلبة ذات طاقات سطحية عالية كالنيكل والفضة والبلاتين والحديد. ويقوم التمزز الكيمياوي بدور مهم جداً في تفسير آلية الوساطة المتغايرة (الحفز غير المتجانس).
ففي نمط تمزز الغاز، وعندما تكون الطبقة المتمززة أحادية الجزيء فإن الجزء من سطح الجسم الماز والمغطى بالمُزازة يتغير في درجة حرارة ثابتة بتغير ضغط الغاز
متساوي حرارة الامتزاز
يوصف الامتزاز عادة بخط متساوي الحرارة (Isotherm)، وهو كمية المواد الممتزة على المادة المازة كتابع للضغط (إذا كان غازا) أو كتابع للتركيز (إذا كان سائلا) عند درجة حرارة ثابتة. وتكون الكمية الممتزة معدلة بكتلة المادة المازة لتسمح بمقارنة المواد المختلفة.
وقد نشر فروندليتش وكوستر (1894) أول مقاربة رياضية لمتساوي حرارة الامتزاز، وتعد صيغة تجريبية بحتة للامتزاز الغازي:
حيث كمية المادة الممتزة، و كتلة المادة المازة، و هو ضغط الامتزاز، و و هي الثوابت التجريبية لكل زوج من المواد المازة والممتزة عند درجة حرارة معينة. ولهذا التابع حد أقصى عند ازدياد الضغط. وعند ازدياد درجة الحرارة، يتغير كل من و لتعكس الملاحظة التجريبية التي تظهر أن كمية المادة الممتزة تتباطئ وتكون الحاجة إلى ضغط أكبر لإشباع السطح.
نموذج لانغموير
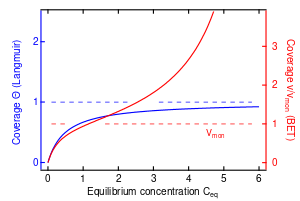
في عام 1916، نشر إرڤنگ لانگموير نموذج جديد لمتساوي حرارة للغازات الممتزة على المواد الصلبة، وحمل هذا النموذج اسمه. وهو متساوي حرارة شبه تجريبي مستمد من آلية حركية مقترحة. وهو يقوم على أربع فرضيات:
- إن سطح المواد المازة متجانس، أي أن جميع مواقع الامتزاز متكافئة.
- لا تتفاعل الجزيئات الممتزة.
- يحدث كل الامتزاز بالآلية نفسها.
- في حالة الامتزاز الأقصى، تتشكل طبقة رقيقة: لا تتوضع الجزيئات الممتزة على جزيئات أخرى سبق امتزازها، وإنما على السطوح الحرة فقط للمادة المازة.
ونادرا ما تكون هذه الفرضيات الأربعة كلها صحيحة: فهناك دائما عيوب على السطح، وليس بالضرورة أن تكون الجزيئات الممتزة خاملة، وليس بالضرورة أيضاً أن تكون آلية امتزاز الجزيئات الأولى هي نفسها بالنسبة للجزيئات اللاحقة. الشرط الرابع هو الأكثر إشكالا، فأغلب الجزيئات ستمتز على طبقات رقيقة؛ وهذه المشكلة يعالجها نموذج بيت للسطوح المستوية (غير المسمامية). ويعتبر متساوي حرارة لانغموير الخيار الأول لمعظم نماذج الامتزاز، وله العديد من التطبيقات قي حركية السطوح (وعادة ما تسمى بـ حركية لانگموير-هنشلوود) والديناميكا الحرارية.
وقد اقترح لانجموير أن الامتزاز يحدث وفق هذه الآلية: ، حيث A هو جزيء الغاز و S هو موقع الامتزاز. ويرمز لمعدل الامتزاز المباشر والعكسي بالرمز k و k-1. فإذا عرفنا التغطية السطحية، ، باعتبارها نسبة من مواقع الامتزاز المشغولة، فيكون عند التوازن:
- أو
حيث هو الضغط الجزئي للغاز أو التركيز المولي للمحلول. ومن أجل الضغوط المنخفضة جدا وعند الضغوط العالية .
ومن الصعب قياس تجريبيا. وعادة تكون المادة الممتزة غازا، وتعطى الكمية الممتزة بالمول، أوالجرام، أو بحجم الغاز في الشروط النظامية بالغرام من المادة المازة. فإذا دعونا بحجم المادة الممتزة عند الشرطين النظاميين المتطلب لتشكيل طبقة رقيقة على المادة المازة (في غرام من المادة المازة)، . ونحصل على التعبير من أجل خط مستقيم كما يلى:
ومن منحني هذا التابع وتقاطعه مع محور y نحصل على vmon وK وهي ثوابت لكل زوج من المواد المازة/الممتزة عند درجة حرارة محددة. vmon يتعلق بعدد مواقع الامتزاز باستخدام قانون الغازات المثالية. لو افترضنا أن عدد المواقع هو كل المساحة في المواد الصلبة مقسمة على المقطع العرضي للجزيئات الممتزة، فيمكن عندها حساب مساحة سطح المادة المازة بسهولة. تعتمد مساحة سطح المادة المازة على بنيتها، فكلما كانت أكثر مسامية (تحتوي على ثقوب أكثر)، زادت مساحة السطح، وزاد التأثير على التفاعل عند السطح. وإذا امتز أكثر من غاز واحد على السطح، نعرف باعتبارها جزء من المواقع الفارغة ويكون لدينا:
و
حيث i كل واحد من الغازات الممتزة.
BET
 مقالة مفصلة: نظرية BET
مقالة مفصلة: نظرية BET
في كثير من الأحيان تكون الجزيئات متعددة الطبقات، ومثلاً، يكون بعضها ممتز على جزيئات ممتصة بالفعل والأيسوثرم انجميور يكون غير صالح. وفي عام 1938 ستيفان بروناور، پول إمت، وإدوارد تلر قاموا بتطوير نموذج الأيزوثرم الذي يأخذ بعين الاعتبار هذا الاحتمال. وتسمى نظريتهم بنظرية بيت BET، بعد الحروف الأولى في أسمائهم الاخيرة. وقد قاموا بتعديل آلية لانجموير على النحو التالي :
- A(g) + S ⇌ AS,
- A(g) + AS ⇌ A2S,
- A(g) + A2S ⇌ A3S and so on.
وعليه فان اشتقاق الصيغة يكون أكثر تعقيداً مما في لانجموير (انظر الروابط للاشتقاق الكامل). ونحصل على:
x هو الضغط المنقسم بواسطة ضغط البخار للكثف في درجة الحرارة تلك(عادة تُرمز {P/P^0} ،و{/v} هو حجمُ ال STP مِنْ الامتزاز الممتز، و{v}{mon} هو حجم الSTP من مقدار الامتصاص المطلوب لتشكيل المونوبلاير وc هو الموازنةُ الثابتةُ {K} التي تم استخدامها في أيزوثرم لانگموير مضروبا في ضغط بخار الامتصاص. الفرضية الرئيسية التي إستعملتْ في إِشْتِقاق معادلةِ بيتَ التي تتعقب حرارة التكثيف لجميع الطبقات ما عدا الأولى، والتي تكون مساوية لحرارة تكثيف الامتزاز.
وأيزوثرم لانگموير عادة ما يكون أفضل بالنسبة للامتزاز الكيميائي وأيزوثرم بت يعمل على نحو أفضل للامتزاز الفيزيائى للأسطح عديمة الفجوات متناهية الصغر.
كيسليوك
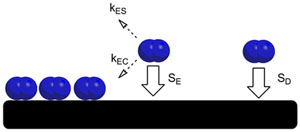
في حالاتِ أخرى، تكون التفاعلات الجزيئية بين جزيئاتِ الغازِ قد كثّفتْ سابقاً على تفاعلات شكلِ صلبِ بجزيئاتِ كبيرة من الغازِ في المرحلةِ الغازيةِوبالتالي، يكون امتزاز جزيئات الغاز إلى السطح مفضل اكثر للحدوث في جميع أنحاء جزيئات الغاز التي هي بالفعل موجودة على سطح صلب، وجعل أيسوثرم الانجميور الممتص فعال لأغراض التمثيل. وكان قد دُرس هذا الأثر قي نظام معين حيث كان النيتروجين هو المكثف والتنغستن كان الممتزات بواسطة بول كيسليوك (مواليدعام 1922 - وفيات عام. 2008) في عام 1957. وللتعويض عن احتمال زيادة حدوث امتزاز حول الجزيئات الموجودة على سطح الركازة ،طور كيسليوك نظرية بادرةِ الرسميةِ، حيث قد تدخل جزيئات الحالة البادرةعلى التفاعل بين الممتزات الصلبة والامتزاز في المرحلة الغازية. ومن هنا، جزيئات الامتزاز أمّا تُكثّفُ إلى الممتز أَوالذى يمتز إلى المرحلةِ الغازيةِ.وعليه فان احتمال حدوث امتزاز من الحالة البادرة يعتمد على قربها من كثف الجزيئات إلى الجزيئات الأخرى التي سبق أن تم امتزازها. وإذا كان هذا الجزيءالممتص في الحالة البادرةعلى مقربة من الجزيء الممتص الذى سبق تشكيله على السطح، فإنه ينطوي على احتمال الخلاف الذى ينعكس على حجم Se المستمر وسوف يكون إما ممتز من الحالة البادرة بمعدل kEC أو سوف يمتز قي المرحلة الغازية قي نسبة من . وإذا كان هناك جزيئةِ ممتزة تَدْخلُ قي حالةَ البادرةَ في المواقع التي تكون بعيدُة عن أيّ جزيئات ممتصة أخرى مُكَثَّفة سابقاً، فإنّ إحتمالَ الإلتِصاق المنعكسُ يكون بحجمِ إس دي ثابت.
كل هذه العوامل قد أدرجت في اطار واحد ثابت وهو ما يسمى "معامل الشائكة ،، وهو ما موضح أدناه :
حيث أن {SD0}هو ما فرض بواسطة العوامل التي تؤخذ في الاعتبار من جانب نموذج لانجميور ،كما أن {0/SD} يمكن أن يكون معدل الامتزاز الثابت. ومع ذلك، يختلف معدل نموذج كيسليوك الثابت (R’) عما هو من نموذج لانجميور ،كما يستخدم R’ لتمثيل تأثير نشره على تشكيل المونولاير ويتناسب مع الجذر التربيعي لمعامل انتشار النظام. ويكتب أيسوثرم امتزاز الكيسليوك على النحو التالي، حيث Θ(t) هو تغطية جزئية من الممتزات مع الامتزاز، وt هو الغمر الوقت :
الحل لنتائج (Θ(t:
هندرسون - كيسليوك
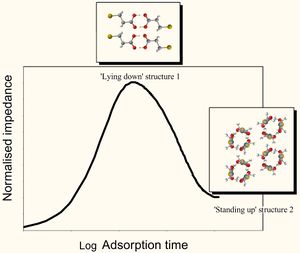
كان قد تم تطوير أيسوثرم الامتزاز هذا للاستخدام مع حقل جديد للحكم الذاتي لتجميع امتزاز مونولاير(sam). ويتم امتزاز جزيئات SAM إلى سطح الممتزات حتى يصبح السطح مشبع مع جزيئات sam "السلاسل الهيدروكربونية"و تكون مسطحة ضد الامتزاز. وهذا هو ما وصف هيكل"الاستلقاء" (بالهيكل الأول). ومن ثم يحدث الامتزاز، مسبباً في أن تكون السلاسل الهيدروكربونية مشردة من قبل جماعات ثيول الموجودة على جزيئات SAMالممتزة حديثا. وعندما تحدث خطوة الامتزاز الكيميائى هذه ،فان القوات الكهروستاتيكية بين جزيئاتSAM الحديثة وبين التي تم امتزازها مسبقاً تُحدث بنياناً جديداً لتتشكل، حيث تُشغل جزيئات SAM توجهات "النهوض" (الهيكل الثانى). وعندما يحدث الامتزاز الاضافى، تصبح جميع الممتزات متشبعة بSAM في اتجاه النهوض، ولا يحدث المزيد من الامتزاز.
وعادة يكون الامتزازSAM موجود في مرحلة السائل وتكون الممتزات عادة صلبة. وبالتالي، التفاعلات بين الجزيئات تكون مهمة ويمكن تظبيق امتزاز الأيسوثرم كيسليوك. والتطور المتسلسل من حامض ميركابتوبروبيوبيك"الاستلقاء" و"النهوض" SAM(الآلام والكروب الذهنية) يُنشيء الذهب الممتز من مرحلة الايثانول MPA ،و كان يدرسها اندرو هندرسون (مواليد 1982) وآخرون في عام 2009. واستخدم هندرسون وآخرون علم اطياف مقاومة الكيمياء الكهربائية لتحليل الامتزاز الكيميائي وشهد أن الهيكل كان ميزة مقاومة مختلفة للهيكل الثانى وتم تطوير كلا الهيكلين بالتتابع. هذا يسمح لاستخلاص أربعة قواعد كالاتى :
- ان هذا القدر من الامتزاز على سطح الممتزات كان مساويا لمجموع الامتزاز شاغلاً الهيكل الأول والهيكل الثانى.
- معدل تشكيل الهيكل الأول يعتمد على توافر المواقع المحتملة الامتزاز وكذلك التفاعلات بين الجزيئات.
- مقدار الهيكل الأول استنزف مثلما تشكل الهيكل الثانى.
- معدل تكوين الهيكل الثاني يمليه مقدار الامتزاز شاغلاً الهيكل الأول والتفاعلات بين الجزيئات في وقت الغمر، t.
ومن هذه التصريحات ،استخدم هندرسون وآخرون فترات منفصلة لوصف معدل الامتزاز الجزئى للهيكل الأول {Θ1(t)}والهيكل الثانى {Θ2(t)] } كدالة احتجاب للوقت (t). وكل هذه المصطلحات أملتهاعملية امتزاز كيسليوك متساوية الحرارة، حيث تتغير مع وقع رقم واحد المرتبط بتشكيل الهيكل الأول والوقع رقم اثنين المرتبط بتشكيل الهيكل الثانى.
واشتركت هذه الشروط قي معادلة هندرسون للامتزاز الحرارى، الذي يحدد قوة إشارة اكتشاف المعاوقة الكهربائية المُطَبَّعة الكلية المسببة من احادى الطبقة الممتزة (z)t)كوظيفة من Θ1(t), Θ2(t), φ1 وφ2. وتعد قيم φ غير متغيرة الوزن، التي قامت بتسوية قيم الإشارة التي من شأنها أن تنجم عن الممتزات هي التي غطت تماما مع الهيكل الأول أو الهيكل الثانى. وتظهر معادلة الأيسوثرم كما هو مبين أدناه :
وعلى الرغم من أن ايسوثيرم الامتزاز لهندرسون - كيسليوك كان طبق الاصل للامتزازsam، كان هندرسون وآخرون يفترضون أن امتزاز الأيسوثرم هذا من المحتمل أن ينطبق على العديد من الحالات الأخرى من الامتزاز وأن Θ 1 (t) وΘ 2 (t) يمكن حسابها باستخدام عمليات امتزاز الأيسوثرم الأخرى، بدلاً من نوذج كيسليوك(مثل معادلة لانجيمور للامتزاز متساوى الحرارة).
آسر الامتزاز
الامتزاز الثابت يعد من ثوابت التوازن، وبالتالي يتم امتثال معادلة ڤانت هوف كالتالي:
كما يُلاحظ في هذه الصيغة، يجب أن يكون العنصر kمختلفاً قي المظهر الخارجى له فقط عند القيام بالتغطية المستمرة. وإذا بدأنا من خط التحاور بيت مع افتراض أن تغير الكون هو نفسه بالنسبة لتسييل الغاز الطبيعي والامتزاز فسوف نجد أن: ، وهذا يعني أن الامتزاز هو أكثر تسييلاً من التذويب.
الممتزات
الخصائص والمتطلبات العامة
الممتزات تستخدم عادة في شكل حبيبات كروية، قضبان ،أو قوالب ،وتوجد مع كتل هيدروديناميكية بأقطار تتراوح بين 0.5 و 10 ملم. ويجب أن تكون لهم مقاومة عالية للاحتكاك ,واستقرار حراري عالي وبأقطار سم صغيرة، والتي تنتج في المنطقة المعرضة أكثر أعلى السطح، وبالتالي ارتفاع قدرة السطح على الإمتزاز. والممتزات يجب أيضا أن يكون لها هيكل متميز والذى يتيح النقل السريع للابخرة الغازية.
ومعظم الممتزات الصناعية تندرج في واحدة من ثلاث فئات هي :
- المركبات المحتوية على الأوكسجين—عادة ما تكون المائية، والقطبية، بما في ذلك مواد مثل هلام السيليكا وزيولايت.
- المركبات المستندة إلى الكربون—وعادة ما تكون مسعورة وغير مناقضة، بما في ذلك مواد مثل الكربون المنشط والجرافيت.
- مركبات البوليمر المستندة—وهى مجموعات وظيفية قطبية أو غير قطبية في مصفوفة بوليمر المثقّبة..
هلام السليكا
 مقالة مفصلة: هلام سيليكا
مقالة مفصلة: هلام سيليكا
هلام السليكا خامل كيميائيا ،غير سامّ، قطبي ومستقرّ بشكل بعدي (<400 درجة مئوية) في شكل غير متبلور شافي 2. وتم اعداده بواسطة التفاعل بين سيليكات الصوديوم وحمض الكبريتيك، واذى تبعته سلسلة من العمليات بعد انتهاء العلاج مثل الشيخوخة، والتخليل، وما إلى هذا بعد نتائج أساليب العلاج في توزيعاتِ حجمِ المسامِ المُخْتَلِفةِ.
وتستخدم السيليكا لتجفيف عملية الهواء (مثل الأكسجين، والغاز الطبيعي) وامتزاز المواد الهيدروكربونية (القطبية) الثقيلة من الغاز الطبيعي.
زيولايت
 مقالة مفصلة: زيولايت
مقالة مفصلة: زيولايت
زيولايت قد يكون العنصر الطبيعي أو العنصر الأولومينوسيليكاتى الصناعي الذي يعيد شبكةَ المسامِ وكذلك يطلقِ الماءِ في درجةِ الحرارة العاليةِ. ويعد الزيولايت قطبي في طبيعته.
وكان قد صنع بواسطة التوليفات الهيدروحرارية من الومينوسيليكات الصوديوم أو بواسطة مصدر سيليكا آخر في اوتوكلاف يليها التبادل الأيوني مع بعض الكاتيونات (Na+, Li+, Ca2+, K+, NH4+). وعادة ما يتراوح قطر قناة أقفاص الزيوليت من 2 إلى 9 Å (200 حتي 900 م). ويتم تتبع عملية التبادل الأيوني بواسطة تجفيف البلورات، والتي يمكن استدارتها مع مادة تساعد على التماسك في شكل حبات ماكروبوروس.
وكذلك يتم تطبيق الزيولايت في عملية التجفيف في الهواء ،ويتم إزالة ثاني أكسيد الكربون من الغاز الطبيعي، وإزالة أول أكسيد الكربون من غاز الإصلاح، وفصل الهواء، والتكسير بالحفز، والتوليف الحفاز والإصلاح.
كما يتم توليف زيولايت (صواني) الغير قطبية من مصادر ألومنيوم السيليكا الحرة أو عن طريق ديلومينات من الألمنيوم والتي تحتوي على الزيولايت. وتتم عملية الديلومينات عن طريق معالجة الزيوليت مع البخار في درجات حرارة مرتفعة، وعادة أكبر من 500 درجة مئوية (1000 درجة فهرنهايت). وتعتبر هذه الحرارة العالية لمعالجة فواصل الألمنيوم الحرارية وكذلك لطرد سندات الأكسجين وذرة الألومنيوم من إطار الزيوليت.
الكربون المنشط
 مقالة مفصلة: كربون منشط
مقالة مفصلة: كربون منشط
يعتبر الكربون المنشط على درجة عالية من المسامية ،صلب وغير متبلور يتكون من كريستالات جوهرية مع شعرية الغرافيت، وعادة ما أعد في حبيبات صغيرة أو مسحوق. فهى تعتبر رخيصة وغير نادرة. ولكن من العوائق الرئيسية أنها قابلة للاشتعال.
والكربون المنشط يمكن أن يكون مصنوع من مواد كربونية، بما في ذلك الفحم (البيتومين، السابيتومينوس، والليغنيت)، الجفت، والخشب، أو القشور (على سبيل المثال جوز الهند). وتتكون العملية من مرحلتين، الكربنة والتنشيط. وتشمل عملية الكربنة التجفيف ثم التدفئة لفصل المنتجات الثانوية، بما في ذلك القطران وغيره من المواد الخام الهيدروكربونية، وكذلك لابعاد أي غازات متولدة. يتم الانتهاء من عملية الكربنة عندما يتم تسخين المادة من 400الي600 درجة مئوية في جو نقص الأوكسجين الذي لا يستطيع دعم الاحتراق.
وتم "تنشيط" الجسيمات المتفحمة عن طريق تعريضها لعامل مؤكسد، وعادة مايكون بخار أو غاز ثاني أكسيد الكربون عند درجة حرارة عالية. ويحترق هذا العامل قبالة هياكل تسد المسام التي أنشئت خلال مرحلة الكربنة ،وهكذا فإنهاتصنع هيكل مسامي، ثلاثي الأبعاد من الجرافيت الشعرية. ويمثل حجم السموم التي انتجت أثناء عملية التشغيل وظيفة من الوقت الذي يقضونه في هذه المرحلة. وتُؤدّي أوقاتُ التعرّضِ الأطول إلى حجومِ المسامِ الأكبرِ. وترتكز مرحلة الكربونات المائية الأكثر شعبية بسبب صلابة ومقاومة التآكل في توزيع المسام، والتكلفة المنخفضة، ولكن فعاليتها تحتاج إلى اختبار في كل طلب لتحديد المنتج الأمثل.
ويستخدم الكربون المنشط لامتزاز المواد العضوية وغير الممتزة القطبية وكذلك يستخدم عادة لعلاج غاز النفايات (النفايات والمياه). فهو يعد من الممتزات الأكثر استعمالا. وتَشتقُّ فائدتُها بشكل رئيسي مِنْ المَسَمّ المِكْرَوِيّ الخاص بها وكذلك من حجوم نتائج المنطقة السطحيّة العالية.
مبرِّدات الامتزاز
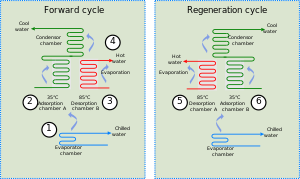
Combining an adsorbent with a refrigerant, adsorption chillers use heat to provide a cooling effect. This heat, in the form of hot water, may come from any number of industrial sources including waste heat from industrial processes, prime heat from solar thermal installations or from the exhaust or water jacket heat of a piston engine or turbine.
Although there are similarities between adsorption chillers and absorption refrigeration, the former is based on the interaction between gases and solids. The adsorption chamber of the chiller is filled with a solid material (for example zeolite, silica gel, alumina, active carbon or certain types of metal salts), which in its neutral state has adsorbed the refrigerant. When heated, the solid desorbs (releases) refrigerant vapour, which subsequently is cooled and liquefied. This liquid refrigerant then provides a cooling effect at the evaporator from its enthalpy of vaporization. In the final stage the refrigerant vapour is (re)adsorbed into the solid.[1] As an adsorption chiller requires no compressor, it is relatively quiet.
تكثيف موقع بوابة التوسط
تكثيف موقع بوابة التوسط هو نموذج لتكثيفِ غازِ الموقعِ الإنتقائيِ المُنَشَّطِ في الأنظمةِ العاملة المساعدةِ المعدنيةِ التي تَحتوي على تَشْكِيلة مواقعِ التكثيفِ المختلفةِ.وفي مثل هذه الأنظمة ،يعبر التنسيق المنخفض "الحافة والزاوية" عن مواقع شبه معيبة يُمْكِنُ أَنْ تَعْرضَ تكثيفَ أوطأَ بكثير مِنْ مواقع التنسيقِ العاليِ (الطائرة الأساسية). ونتيجة لذلك، يمكن لهذه المواقع أن تكون بمثابة "البوابات" للامتزاز السريع جدا لبقية السطح. وتعتمد هذه الظاهرة علي الاثر المشترك "الغير مباشر"، حيث تمتز بعض الأنواع المعرضة للتنقل المرتفع على بعض الأسطح. ويوضح هذا النموذج الملاحظات التي تبدو غير متناسقة للديناميكا الحرارية وامتزاز الغاز والحركية في نظم الحفاز للسطح حيث يمكن وأن توجد في مجموعة من هياكل التنسيق، وأنه قد تم تطبيقه بنجاح على أنظمة الحفاز المتعلق بنظام المعدنين حيث تم ملاحظة نشاط تعاوني.
وقد تم تطوير النموذج الأصلي من قبل الملك وزملاء العمل Uner et alو آخرون. قي عام1997، نارايان وآخرون 1998، وفاندروييل وآخرون 1999) واشتركوا لوصف امتزاز الهيدروجين على السيليكا التي يدعمها القلوي روجت روثينيوم والفضة والنحاس، والروثينيوم المتعلق بنظام المعدنين. وطبقت المجموعة ذاتها نموذج لثاني أكسيد الكربون والهدرجة (فيشر تروبش التوليف، Üner 1998). وقد أَكّدَ نفس النموذجِ Zupanc وآخرون (2002) في وقت لاحق بعد ذلك على محفّزاتِ سيزيومِ المدعومِ لأكسيدَ المغنيسيوم الثنائي المعدن.
الامتزاز في الفيروسات
الامتزاز هو الخطوة الأولى في دورة العدوى الفيروسية. والخطوات التالية هي الاختراق الغيرملموس، والتوليف (النسخ إذا لزم الأمر، والترجمة)، وكذلك الافراج عنهم. وتعد اجابة دورة الفيروس، في هذا الصدد ،هي المماثل الاهم لجميع أنواع الفيروسات. وهناك عوامل مثل النسخةِ قَدْ أو قَدْ لا تَكُونُ مطلوبة إذا كان الفيروسِ قادر على مُكَامَلَة معلوماتِه الجينيّةِ في نواةِ الخليةَ، َوكذلك إذا تمْكِنُ الفيروسِ من أَنْ يُضاعفَ نفسه مباشرة ضمن سايتوبسلام الخلية.
المراجع
- جريدة Cussler(1997).نشر : كبير للنقل الجماعي في الأنظمة السائلة، الطبعه الثانيه، pp. 308 – 330.
- هندرسون، أب، قانون الجنسية Seetohul، عميد حزب العدالة والتنمية، P. راسل، S. Z. Pruneanu وعلي (2009). 'ألف أيسوثرم الرواية، واضعاً النموذج الذي ساعد قي تجميع امتزاز مونولاير والتغييرات الهيكلية'، انجميور، المجلد. 25، لا. 2، ص. 931-938.
- كيسليوك، P. (1957). 'غازات الاحتمالات الشائكة chemisorbed على السطوح الصلبة'، مجلة الفيزياء والكيمياء من المواد الصلبة، المجلد. 3، ص. 95-101.
- نارايان، والملخص الفني ليبرتي الملك (1998). 'الهيدروجين الدولي للامتزاز على السيليكا التي تدعمها RU_AGالفضة والنحاس والحفازة المتعلقة بنظام المعدنين للتحقيق عبر المسعرية الجوهرية، المجلد. 312، nos.1 - 2، pp. 105 – 114.
- Üner، لا، N. Savargoankar، M. Pruski الملخص الفني والملك، (1997). 'آثار المروجين القلوي على ديناميات التعاطي بالكيماويات الهيدروجين وحركية التفاعل الغازى على المواد الحفازة Ru/SiO2 ، دراسات في علوم المساحة والحفز ، vol.109، ص. 315-324.
- Uner,D.O. (1998).آلية معقولة لتعزيز القلويات في توليف فيشر تروبش : لكثف التنقلات '، هندسة الكيمياء الصناعية، والبحوث، المجلد. 37، ص. 2239-2245.
- VanderWiel، وموانئ دبي، M. Pruski الملخص الفني والملك (1999). 'دراسة الحركية للالامتزاز وردود الفعل من الهيدروجين على السيليكا التي يساندها الروثينيوم والفضية والروثينيوم المتعلق بنظام معدنين المحفزات خلال الهدرجة من اول اكسيد الكربون'، مجلة الحفز، المجلد. 188، لا. 1، pp. 186 – 202.
- Zupanc، C.، A. Hornung، O. Hinrichsen وMuhler M. (2002). ' تفاعل الهيدروجينِ مَع محفّزاتRu / MgO '، مجلّة العامل المساعدِ، الجزء. 209, pp. 501–514.
المصادر
صلاح يحياوي. "التمزز". الموسوعة العربية.
اقرأ أيضا
- امتصاص (المادة)
- نظرية بت
- معادلة فرويندليش
- معادلة لانگموير
- الغربال الجزيئي
- تفاعلات على الأسطح
- تبلل
- Adatom
- Cryo-adsorption
- Dual-polarization interferometry
- Fluidized bed concentrator
- Kelvin probe force microscope
- Micromeritics
- Molecular sieve
- Polanyi adsorption
- Pressure swing adsorption
- Random sequential adsorption
- Hydrogen-bonded organic framework
المراجع
- ^ Pilatowsky, I.; Romero, R.J.; Isaza, C.A.; Gamboa, S.A.; Sebastian, P.J.; Rivera, W. (2011). "Chapter 5: Sorption Refrigeration Systems". Cogeneration Fuel Cell-Sorption Air Conditioning Systems. Green Energy and Technology. Springer. pp. 99, 100. doi:10.1007/978-1-84996-028-1_5. ISBN 978-1-84996-027-4.
<ref> ذو الاسم "Langmuir" المُعرّف في <references> غير مستخدم في النص السابق.للاستزادة
- Cussler, E. L. (1997). Diffusion: Mass Transfer in Fluid Systems (2nd ed.). New York: Cambridge University Press. pp. 308–330. ISBN 978-0-521-45078-2.























![{\displaystyle z_{\mathrm {t} }=\theta _{\mathrm {1(t)} }.[\varphi _{\mathrm {1} }.(1-\theta _{\mathrm {2(t)} })+\varphi _{\mathrm {2} }.\theta _{\mathrm {2(t)} }].}](https://www.marefa.org/api/rest_v1/media/math/render/svg/7eb89500ccc7fd32bae0828e28e29b242bb9a6e7)



