كربونات الفضة
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Silver(I) carbonate, Silver carbonate
| |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.007.811 |
| رقم EC |
|
| عناوين مواضيع طبية MeSH | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | Ag2CO3 |
| كتلة مولية | 275.75 g/mol |
| المظهر | Pale yellow crystals |
| الرائحة | Odorless |
| الكثافة | 6.077 g/cm3[1] |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | 0.031 g/L (15 °C) 0.032 g/L (25 °C) 0.5 g/L (100 °C)[2] |
| نتاج قابلية الذوبان، Ksp | 8.46·10−12[1] |
| قابلية الذوبان | Insoluble in alcohol, liquid ammonia, acetates, acetone[3] |
| القابلية المغناطيسية | −80.9·10−6 cm3/mol[1] |
| البنية | |
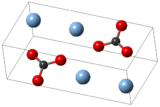
| البنية البلورية | Monoclinic, mP12 (295 K) Trigonal, hP36 (β-form, 453 K) Hexagonal, hP18 (α-form, 476 K)[4] |
| الزمرة الفراغية | P21/m, No. 11 (295 K) P31c, No. 159 (β-form, 453 K) P62m, No. 189 (α-form, 476 K)[4] |
| ثابت العقد | a = 4.8521(2) Å, b = 9.5489(4) Å, c = 3.2536(1) Å (295 K)[4] |
| ثابت العقد | α = 90°, β = 91.9713(3)°, γ = 90° |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−505.8 kJ/mol[1] |
| Standard molar entropy S |
167.4 J/mol·K[1] |
| سعة الحرارة النوعية، C | 112.3 J/mol·K[1] |
| المخاطر | |
| ن.م.ع. مخطط تصويري |  [5] [5]
|
| ن.م.ع. كلمة الاشارة | Warning |
| H315, H319, H335[5] | |
| P261, P305+P351+P338[5] | |
| خطر الاستنشاق | Irritant |
| NFPA 704 (معيـَّن النار) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
3.73 g/kg (mice, oral)[6] |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كربونات الفضة مركب كيميائي له الصيغة Ag2CO3، ويكون على شكل صلب ذي لون أصفر مخضر.
الخواص
- العينات المتوفرة من هذا المركب غالباً ما يصحبها لون رمادي نتيجة وجود شوائب من فلز الفضة فيها.
- لا ينحل مركب كربونات الفضة عملياً في الماء، لكنه ينحل في الأحماض مثل حمض النتريك وحمض الكبريتيك، كذلك في محاليل كربونات البوتاسيوم وسيانيد البوتاسيوم.
التحضير
يحضر مركب كربونات الفضة بشكل سهل نسبياً من تفاعل كربونات الصوديوم مع نترات الفضة، فيترسب مركب كربونات الفضة من المحلول حسب المعادلة:
- 2AgNO3 + Na2CO3 → Ag2CO3 + 2NaNO3
الاستخدامات
- يستخدم مركب كربونات الفضة ككاشف كيميائي في الاصطناع العضوي مثل تفاعل كونيگز-كنور.
- في أكسدة فيتيزون، يُستعمل كعامل مؤكسد في تحضير المركبات العضوية وذلك عندما يُشرَّب في مسحوق مكروئي من السيليت Celite الأرضي. [7] [8]
المصادر
- موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag
المراجع
- ^ أ ب ت ث ج ح خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةcrc - ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (2nd ed.). New York City: D. Van Nostrand Company. p. 605.
- ^ Comey, Arthur Messinger; Hahn, Dorothy A. (February 1921). A Dictionary of Chemical Solubilities: Inorganic (2nd ed.). New York: The MacMillan Company. p. 203.
- ^ أ ب ت Norby, P.; Dinnebier, R.; Fitch, A.N. (2002). "Decomposition of Silver Carbonate; the Crystal Structure of Two High-Temperature Modifications of Ag2CO3". Inorganic Chemistry. 41 (14). doi:10.1021/ic0111177.
- ^ أ ب ت Sigma-Aldrich Co., Silver carbonate. Retrieved on 2014-05-06.
- ^ أ ب "Silver Carbonate MSDS". http://www.saltlakemetals.com. Salt Lake City, Utah: Salt Lake Metals. Retrieved 2014-06-08.
{{cite web}}: External link in|website= - ^ Mijs, W. J.; de Jonge, C. R. H. I., Hrsg., Organic Synthesis by Oxidation with Metal Compounds, Plenum: New York, NY, (1986); S. 503–567.
- ^ Momeni, A. R.; Sameh, T.; Golmohammadi, H.; Naghash, H. J.; Aliyan, H.; Massah, A. R.; Solati, A., Bull. Korean Chem. Soc., (2006) 27, 355–356.
| H2CO3 | He | |||||||||||||||||
| Li2CO3 | BeCO3 | B | C | N | O | F | Ne | |||||||||||
| Na2CO3 | MgCO3 | Al | Si | P | S | Cl | Ar | |||||||||||
| K2CO3 | CaCO3 | Sc | Ti | V | Cr | MnCO3 | FeCO3 | CoCO3 | NiCO3 | CuCO3 | ZnCO3 | Ga | Ge | As | Se | Br | Kr | |
| Rb2CO3 | SrCO3 | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag2CO3 | CdCO3 | In | Sn | Sb | Te | I | Xe | |
| Cs2CO3 | BaCO3 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl2CO3 | PbCO3 | Bi | Po | At | Rn | ||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||
| ↓ | ||||||||||||||||||
| La2(CO3)3 | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||||
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||||
الكلمات الدالة:
This article may include material from Wikimedia licensed under CC BY-SA 4.0. Please comply with the license terms.
