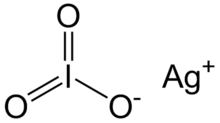
يودات الفضة
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
يودات الفضة
| |
| المُعرِّفات | |
| رقم CAS | |
| ECHA InfoCard | 100.029.126 |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | AgIO3 |
| كتلة مولية | 282.77 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 5.53 غ/سم3 |
| نقطة الانصهار | |
| قابلية الذوبان في الماء | ضعيف الانحلال |
| المخاطر | |
تبويب الاتحاد الاوروپي (DSD)
|
 O O
|
| توصيف المخاطر | R36/37/38-R8 |
| تحذيرات وقائية | S17-S26-S37/39 [1] |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
يودات الفضة مركب كيميائي له الصيغة AgIO3 ، ويكون على شكل بلورات بيضاء.
الخواص
- مركب يودات الفضة ضعيف الانحلالية في الماء.
- يتفكك مركب يودات الفضة بالتسخين حيث يعطي غاز الأكسجين.
التحضير
يحضر يودات الفضة من تفاعل نترات الفضة مع يودات الصوديوم، [2] حيث ينتج نترات الصوديوم كناتج ثانوي حسب المعادلة:
AgNO3 + NaIO3 → AgIO3 + NaNO3
شكل آخر من يودات الفضة
يمكن تحضير شكل آخر من يودات الفضة له الصيغة Ag5IO6 وذلك بمفاعلة كميات متناسبة من أكسيد الفضة الأحادية مع يودات البوتاسيوم، وذلك تحت درجات مرتفعة نسبياً وتحت ضغط مرتفع من غاز الأكسجين. (673 كلفن و 270 ميغا باسكال ضغط أكسجين). [3]
الاستخدامات
يستخدم في الكيمياء التحليلية لتحديد الهاليدات في المعايرة اليودومترية. سابقاً على سبيل المثال فإن يودات الفضة كانت تستخدم لتحديد نسبة الكلوريد في الدم والسوائل الحيوية الأخرى، وذلك اعتماداً على المعادلة:
NaCl + AgIO3 → AgCl + NaIO3
حيث يترسب كلوريد الفضة، ويفاعل يودات الصوديوم الناتج مع يوديد البوتاسيوم المضاف تدريجياً، فيتحرر ثلاثة جزيئات من اليود مقابل كل أيون كلوريد. يكشف عن اليود باستخدام مركبات ثيوكبريتات، مثل ثيوكبريتات الصوديوم، وباستخدام النشاء كمؤشر (مشعر). [4]
المراجع
- ^ http://search.be.acros.com/msds?for=acro2&sup=ACROS&lang=EN&server=www.acros.be&search=39026
- ^ Qiu, Chao (2005). "Distribution of Thioethers in Hydrotreated Transformer Base Oil by Oxidation and ICP-AES Analysis". Industrial & Engineering Chemistry Research. 44 (11): 4151–4155. doi:10.1021/ie048833b. Retrieved 2007-05-03.
Silver nitrate reacts with iodate to form the precipitate of silver iodate, and the precipitate is transferred to silver nitrate.
{{cite journal}}: Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Anton Kovalevskiy, Martin Jansen (2006). "Synthesis, Crystal Structure Determination, and Physical Properties of Ag5IO6". Zeitschrift für anorganische und allgemeine Chemie. 632 (4): 577–581. doi:10.1002/zaac.200500476.
- ^ http://www.biochemj.org/bj/048/0051/0480051.pdf
