ورم القشرة الكظرية الغدي
| ورم القشرة الكظرية الغدي | |
|---|---|
| الأسماء الأخرى | ورم القشرة الكظرية الغدي, ورم غدي كظري |
 | |
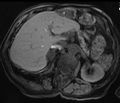
| ورم غدي كظري في مريض مصاب بمتلازمة كون | |
| التخصص | علم الغدد الصماء, علم الأورام |
عادة ما يوصف ورم القشرة الكظرية الغدي بأنه ورم حميد ينشأ من الخلايا التي تتكون منها قشرة الغدة الكظرية . مثل معظم الأورام الغدية ، يعتبر ورم القشرة الكظرية الغدي ورمًا حميدًا لأن معظمها لا يعمل ولا تظهر عليه أعراض . تصنف أورام القشرة الكظرية الغدية على أنها اضطرابات مستقلة عن الهرمون الموجه لقشر الكظر ، وترتبط عادةً بالحالات المرتبطة بفرط الكظر مثل متلازمة كوشينغ ( فرط الكورتيزول ) أو متلازمة كون ( فرط الألدوستيرونية) ، والتي تُعرف أيضًا باسم الألدوستيرونية الأولية ..[1] بالإضافة إلى ذلك ، تدعم تقارير الحالات الحديثة ارتباط أورام قشر الكظر الغدية بفرط الأندروجين أو فرط الأندروجين الوردي الذي يمكن أن يسبب كثرة الشعر عند الإناث..[2] تختلف "متلازمة كوشينگ " عن " مرض كوشينگ " على الرغم من أن كلا الحالتين ناتجة عن فرط الكورتيزول. يشير مصطلح " مرض كوشينگ " تحديدًا إلى "فرط الكورتيزول الثانوي" المصنف على أنه " متلازمة كوشينغ المعتمدة على الهرمون الموجه لقشرة الكظر " الناتجة عن أورام الغدة النخامية الغدية . في المقابل ، تشير "متلازمة كوشينگ" تحديدًا إلى "فرط الكورتيزول الأولي" المصنف على أنه " متلازمة كوشينغ المستقلة عن الهرمون الموجه لقشرة الكظر " الناتجة عن أورام الغدة الكظرية الغدية.
استعراض
| فرط كورتيزون الدم | |
|---|---|
 | |
| التخصص | علم الغدد الصماء, علم الأورام |
| الأعراض | آفات غدية كظرية |
غالبًا ما يتم تصنيف الأورام الغدية الكظرية على أنها أورام غير نشطة للغدد الصماء نظرًا لأن معظمها لا تعمل ولا تظهر عليها أعراض . تظهر اورام القشرة الكظرية الغدية الوظيفية أعراضًا تتفق مع متلازمات الغدد الصماء المختلطة. في معظم حالات الورم القشرة الكظرية الغدي المبلغ عنها ، أظهر المرضى متلازمات غدد صماء واحدة أو عدة متلازمات مثل فرط الألدوستيرونية / متلازمة كون,[3] فرط الكورتيزول / متلازمة كوشينغ ،,[4] فرط الأندروجين / الاستئناث،,[5] الترجيل,[6] أو الشعرانية (كثرة الشعر).[7] تتضمن بعض الأعراض الشائعة المرتبطة بأورام القشرة الكظرية الغدية ما يلي::
الجهاز العضلي الهيكلي
القلب والأوعية الدموية
الغدد الصماء والاستقلاب
→ أكثر انتشارًا عند الذكور
→ أكثر انتشارًا عند الإناث
- فرط الأندروجين
- دورات الحيض غير المنتظمة
العصبية النفسية
الجلد
- كدمات بسيطة
- علامات التمدد
- الشعرانية
- حب الشباب
السبب
| مناطق الغدد الكظرية | |
|---|---|
 | |
| التخصص | علم الغدد الصماء, علم الأورام |
| مناطق الغدد الكظرية | |
|---|---|
 | |
| التخصص | علم الغدد الصماء, علم الأورام |
تشير دراسة الحالات المبلغ عنها إلى أن معظم أورام الغدة الكظرية الغدية تحدث بسبب الانتشار الورمي للخلايا القشرية الكظرية داخل الطبقات الثلاث المتميزة لقشرة الغدة الكظرية. في البشر، تتكون قشرة الغدة الكظرية ثلاث مناطق مركزية بما في ذلك منطقة الكبيبية ، المنطقة الحزمية و منطقة الشبكية أنه في ظل الظروف العادية تستجيب لمطالب الجسم الفسيولوجية لهرمونات الستيرويد. تعتبر قشرة الغدة الكظرية عضوًا ديناميكيًا يتم فيه استبدال الخلايا الشائخة بخلايا متمايزة حديثًا. هذا التجديد المستمر يسهل إعادة تشكيل الأعضاء مما يساهم في الخصائص الديناميكية لقشرة الغدة الكظرية.. [8] بالمقابل ، يُعتقد أن الفسيولوجيا التطورية لقشرة الغدة الكظرية تلعب دورًا محوريًا في تكوين أورام الغدة الكظرية الغدية. ومن ثم ، فإن الآليات الجزيئية المشاركة في التطور الطبيعي للغدد الكظرية تشبه السيوف ذات الحدين التي يمكن أن تؤدي إلى تكوين أورام داخل قشرة الغدة الكظرية. علاوة على ذلك ، تشير الدراسات الحديثة إلى أن الطفرات التي تؤثر على المسارات الجزيئية لمنطقة قشر الكظر يمكن أن تحفز الانتشار غير الطبيعي وتكوين الورم. من خلال هذه الدراسات ، تم التعرف على أحادي فوسفات الأدينوسين الحلقي المعتمد على بروتين كيناز أ كوسيط رئيسي لإفراز الكورتيزول ، وقد تورطت الطفرات المرتبطة بخلل تنظيم مسارات أحادي فوسفات الأدينوسين - بروتين كيناز أ في الفيزيولوجيا المرضية لقشرة الكظر.[9]
الفيزيولوجيا المرضية
إذا كانت أورام الغدة الكظرية الغدية وظيفية ، فيمكن أن تؤثر على الأنشطة الطبيعية لقشرة الغدة الكظرية. توجد داخل الغدد الكظرية ثلاث مناطق مسؤولة عن إفراز الفئات الثلاث الرئيسية من المنشطات الكظرية. وبالتالي ، يمكن أن تؤدي أورام الغدة الكظرية الغدية الوظيفية لقشرة الكظر إلى الإفراط في إفراز الستيرويدات الكظرية المرتبطة بمتلازمات الغدد الصماء النقية أو المختلطة ، وهي حالة تُعرف باسم فرط الكظرية.[بحاجة لمصدر]
التشخيص
نظرًا لطبيعتها غير المصحوبة بأعراض ، تم التعرف على معظم الحالات المبلغ عنها من أورام الغدة الكظرية الغدية مصادفة من خلال تشريح الجثة أو أثناء التصوير الطبي ، وخاصة التصوير المقطعي المحوسب والتصوير بالرنين المغناطيسي . ومن ثم ، فقد حصلوا على عنوان الورم العرضي الذي يشير إلى ورم غدي صغير تم اكتشافه بالمصادفة..[10] على الرغم من أن أورام الغدة الكظرية الغدية تعتبر تحديًا للتمييز عن قشرة الغدة الكظرية الطبيعية ، إلا أنها تظهر على أنها آفات مقيدة جيدًا بمجرد عزلها..[بحاجة لمصدر]
الاشعة التشخيصية
الاختبارات المعملية
- اختبار تحفيز هرمون المطلق لموجه القشرة
- اختبار تثبيط جرعة عالية من ديكساميثازون
وصف إجمالي
- آفة متحددة جيدًا
- حجم ≤5 سم
- الوزن ≤ 50 جرام
- غالبًا ما تظهر ككتلة ذات لون أصفر ذهبي
(قد يكون لها مناطق داكنة بؤرية تتوافق مع النزف ، ونضوب الدهون ، وليبوفوسين))[10]
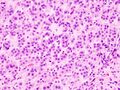
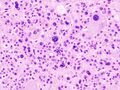
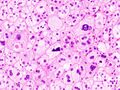
علم الانسجة
يشير تحليل النسيجي المرضي المجهري لعينات الأنسجة التي تم الحصول عليها من قشرة الغدة الكظرية للأفراد الذين يعانون من أعراض مرتبطة بالورم الغدي مثل الالدوسترونية الأولية (PA) إلى أن خلايا الورم الغدي أكبر نسبيًا مع اختلاف السيتوبلازم ، وزيادة التباين في الحجم النووي. يعتمد هذا المؤشر على المقارنة بين عينات أنسجة قشرة الغدة الكظرية السليمة (الطبيعية) والمتأثرة (المرتبطة بالورم الغدي).[بحاجة لمصدر]
يتم تمييز أورام الغدة الكظرية الغدية الأكثر شيوعًا عن سرطان القشرة الكظرية (نظائرها الخبيثة) بواسطة نظام فايس,[11] علي النحو التالي::[12]
| الخصائص[12] | النتيجة |
|---|---|
| درجة نووية عالية (مكبرة ، بيضاوية إلى مفصصة ، ذات حبيبات خشنة إلى كروماتين مفرط اللون ويمكن تمييزها بسهولة ، نوى بارزة))[13] | 1 |
| انقسامات فتيلية أكثر من 5/50 حقول طاقة عالية | 1 |
| انقسامات فتيلية شاذة | 1 |
| السيتوبلازم اليوزيني في> 75٪ من الخلايا السرطانية | 1 |
| بنية منتشرة تزيد عن 33٪ من الورم | 1 |
| نخر | 1 |
| الغزو الوريدي | 1 |
| الغزو الجيبي (لا توجد عضلات ملساء في الجدار) | 1 |
| غزو المحفظة | 1 |
تشير النتيجة الإجمالية إلى:[12]
- 0-2: ورم الغدة الكظرية الغدية
- 3: غير محدد
- 4-9: سرطان القشرة الكظرية
العلاج
- يمكن معالجة حالات ورم الغدة الكظرية الغدي الغير فعال من خلال المتابعة والمراقبة على المدى الطويل.
- يعتمد نهج العلاج لحالات ورم الغدة الكظرية الغدي لقشر الكظر على نوع الاضطرابات التي تسببها وتطورها. قد يكون الاستئصال الجراحي مطلوبًا إذا كان وجوده يؤدي إلى ضمور في الغدد الكظرية والأنسجة المحيطة.
من أجل الحصول على استراتيجيات علاج أفضل ، من المهم إجراء مزيد من الفحص والدراسة وتمييز الآليات الجزيئية المتميزة المشاركة في تكوين أورام الغدة الكظرية ذات التنشؤ الداخلي ، وتضخم الغدة الكظرية ، ومتلازمة كوشينغ المستقلة عن الهرمون الموجه لقشرة الكظر لتحسين العلامات التشخيصية والمآلية المتاحة التي يمكن أن تساعد الأطباء في المعالجة والعلاج المسبق لمثل هذه الحالات[14]
المآل
- عادة ما تكون الدلائل طويلة المدى للأفراد الذين تم تشخيص إصابتهم بورم الغدة الكظرية الغدي غير الوظيفي لقشر الكظر ممتازة.
- إن الدلائل طويلة المدى للأفراد الذين تم تشخيص إصابتهم بورم الغدة الكظرية الغدي الوظيفي لقشر الكظر جيدة مع التشخيص والعلاج المبكر.
علم الاوبئة
- معدل الانتشار: أنثى> ذكر
- أكثر شيوعًا عند البالغين
- ظهور مبكر نسبيًا عند الإناث (عمر 20) مقارنة بالذكور (عمر ≤ 30)
- السبب الأكثر شيوعًا لمتلازمة كوشينغ الغير معتمدة علي الهرمون الموجه لقشرة الكظرية
انظر ايضا
- فرط التنسج
- ورم كظري
- متلازمة كوشينگ
- متلازمة كون
- فرط الكورتيزول
- فرط الألدوستيرونية
- فرط الأندروجين
- الغدة الكظرية
- ورم المستقتمات الكظري
- ورم القواتم الكظري
- ورم عصبي عقدي كظري
المراجع
- ^ "Definition: adrenocortical adenoma from Online Medical Dictionary".
- ^ LaVoie, Melanie; Constantinides, Vasilis; Robin, Noel; Kyriacou, Angelos (30 July 2018). "Florid hyperandrogenism due to a benign adrenocortical adenoma". BMJ Case Reports. 2018: bcr-2018-224804. doi:10.1136/bcr-2018-224804. PMC 6067132. PMID 30061126.
- ^ Wang, Wei; Wei, Feng; Li, RanHao; Tian, JiaHui (October 2019). "A case report of idiopathic hyperaldosteronism characterized by bilateral adrenal adenoma". Medicine. 98 (43): e17418. doi:10.1097/MD.0000000000017418. PMC 6824822. PMID 31651844.
- ^ Ren, Kaiyun; Wei, Jia; Liu, Qilin; Zhu, Yuchun; Wu, Nianwei; Tang, Ying; Li, Qianrui; Zhang, Qianying; Yu, Yerong; An, Zhenmei; Chen, Jing; Li, Jianwei (17 June 2019). "Hypercortisolism and primary aldosteronism caused by bilateral adrenocortical adenomas: a case report". BMC Endocrine Disorders. 19: 63. doi:10.1186/s12902-019-0395-y. PMC 6580498. PMID 31208392.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ LaVoie, Melanie; Constantinides, Vasilis; Robin, Noel; Kyriacou, Angelos (30 July 2018). "Florid hyperandrogenism due to a benign adrenocortical adenoma". BMJ Case Reports. 2018: bcr-2018-224804. doi:10.1136/bcr-2018-224804. PMC 6067132. PMID 30061126.
- ^ Kobayashi, Toshihiro; Imachi, Hitomi; Sato, Seisuke; Ibata, Tomohiro; Fukunaga, Kensaku; Yoshimoto, Takuo; Kikuchi, Fumi; Yonezaki, Kazuko; Yamaji, Nao; Lyu, Jingya; Dong, Tao; Nagata, Hiromi; Kadota, Kyuichi; Kushida, Yoshio; Haba, Reiji; Murao, Koji (1 February 2019). "Bilateral Adrenocortical Adenomas along with Virilization and Cushing's Syndrome". Internal Medicine. 58 (3): 405–409. doi:10.2169/internalmedicine.0790-18. PMC 6395137. PMID 30210105.
- ^ Rodríguez-Gutiérrez, René; Bautista-Medina, Mario Arturo; Teniente-Sanchez, Ana Eugenia; Zapata-Rivera, Maria Azucena; Montes-Villarreal, Juan (2013). "Pure Androgen-Secreting Adrenal Adenoma Associated with Resistant Hypertension". Case Reports in Endocrinology. 2013: 356086. doi:10.1155/2013/356086. PMC 3681270. PMID 23819074.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Pihlajoki, Marjut; Dörner, Julia; Cochran, Rebecca S.; Heikinheimo, Markku; Wilson, David B. (5 March 2015). "Adrenocortical Zonation, Renewal, and Remodeling". Frontiers in Endocrinology. 6: 27. doi:10.3389/fendo.2015.00027. PMC 4350438. PMID 25798129.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lodish, Maya (June 2017). "Genetics of Adrenocortical Development and Tumors". Endocrinology and Metabolism Clinics of North America. 46 (2): 419–433. doi:10.1016/j.ecl.2017.01.007. PMC 5424622. PMID 28476230.
- ^ أ ب Lloyd, Ricardo V. (April 2011). "Adrenal cortical tumors, pheochromocytomas and paragangliomas". Modern Pathology. 24: S58–65. doi:10.1038/modpathol.2010.126. PMID 21455202.
- ^ Wang, Cuiping; Sun, Yang; Wu, Huanwen; Zhao, Dachun; Chen, Jie (2014). "Distinguishing adrenal cortical carcinomas and adenomas: a study of clinicopathological features and biomarkers". Histopathology. 64 (4): 567–576. doi:10.1111/his.12283. ISSN 0309-0167. PMC 4282325. PMID 24102952.
- ^ أ ب ت Aye, Than Than; Myint, Phone; Myint, Kyar Nyo Soe (2015). "Adrenocortical Oncocytoma Presenting with Gynaecomastia". Journal of the ASEAN Federation of Endocrine Societies. 30 (1): 27–30. doi:10.15605/jafes.030.01.08. ISSN 0857-1074.
- ^ Tito Fojo. "Adrenocortical Cancer". Retrieved 2020-07-02.
- ^ Bourdeau, Isabelle; Lampron, Antoine; Costa, Marcia Helena Soares; Tadjine, Mimi; Lacroix, André (June 2007). "Adrenocorticotropic hormone-independent Cushing's syndrome". Current Opinion in Endocrinology, Diabetes and Obesity. 14 (3): 219–225. doi:10.1097/MED.0b013e32814db842. PMID 17940443. S2CID 40454423.
- ^ Data and references for pie chart are located at file description page in Wikimedia Commons.
وصلات خارجية
| Classification | |
|---|---|
| External resources |