ثاني أكسيد السليكون
عينة من ثاني أكسيد السليكون.
| |
| الأسماء | |
|---|---|
| اسم أيوپاك
Silicon dioxide
| |
أسماء أخرى
| |
| المُعرِّفات | |
| رقم CAS | |
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.028.678 |
| رقم EC |
|
| E number | E551 (acidity regulators, ...) |
| مرجع Gmelin | 200274 |
| KEGG | |
| عناوين مواضيع طبية MeSH | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| الخصائص | |
| الصيغة الجزيئية | SiO2 |
| كتلة مولية | 60.08 گ/مول |
| المظهر | مادة صلبة شفافة بيضاء أو بيضاء مائلة للصفرة (مسحوق/رمال) |
| الكثافة | 2.648 (α-quartz), 2.196 (amorphous) g·cm−3[1] |
| نقطة الانصهار | |
| نقطة الغليان | |
| القابلية المغناطيسية | −29.6·10−6 cm3/mol |
| التوصيل الحراري | 12 (|| c-axis), 6.8 (⊥ c-axis), 1.4 (am.) W/(m⋅K)[1] |
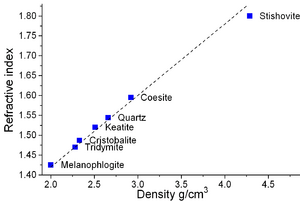
| معامل الانكسار (nD) | 1.544 (o), 1.553 (e)[1] |
| المخاطر | |
| NFPA 704 (معيـَّن النار) | |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 20 mppcf (80 mg/m3/%SiO2) (amorphous)[2] |
REL (الموصى به)
|
TWA 6 mg/m3 (amorphous)[2] Ca TWA 0.05 mg/m3[3] |
IDLH (خطر عاجل)
|
3000 mg/m3 (amorphous)[2] Ca [25 mg/m3 (cristobalite, tridymite); 50 mg/m3 (quartz)][3] |
| مركبات ذا علاقة | |
diones ذات العلاقة
|
ثاني أكسيد الكربون |
مركـّبات ذات علاقة
|
أول أكسيد السليكون |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
−911 kJ·mol−1[4] |
| Standard molar entropy S |
42 J·mol−1·K−1[4] |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
ثاني أكسيد السليكون (إنگليزية: Silicon dioxide)، أو السليكا (إنگليزية: silica)، أو الرمل الأبيض (إنگليزية: White Sand)، هو أحد أكاسيد السليكا صيغته الكيميائية SiO
2، يشيع تواجده في الطبيعة على شكل الكوارتز وفي العديد من العضيات الحية الأخرى.[5][6] في الكثير من مناطق العالم، تشكل السليكا المكون الرئيسي للرمال. السليكا هي واحدة من أكثر مجموعات المواد تعقيدًا ووفرة، حيث توجد كمركب للعديد من المعادن وكمنتج اصطناعي. ومن أشهر الأمثلة الكوارتز المنصهر، السليكا المدخنة، هلام السليكا، الأوپال، والهلام الهوائي. يستخدم ثاني أكسيد السليكون في المواد الإنشائية، الإلكترونيات الدقيقية (كعازل كهربائي)، وكمكونات في الصناعات الغذائية والدوائية.
التركيب
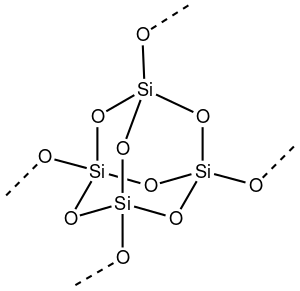
في غالبية السيليكات، تُظهر ذرة السليكون تنسيق رباعي السطوح، مع أربع ذرات أكسجين تحيط بذرة السليكون المركزية (انظر خلية الوحدة 3-D). بالتالي، يشكل ثاني أكسيد السليكون مواد صلبة شبكية ثلاثية الأبعاد حيث ترتبط كل ذرة سليكون ارتباطاً تساهمياً بطريقة رباعية السطوح مع 4 ذرات أكسجين. في المقابل، يكون ثاني أكسيد الكربون جزيء خطي. هياكل ثاني أكسيد الكربون والسليكون شديدة الاختلاف هي مظهر من مظاهر قاعدة الرابطة المزدوجة.
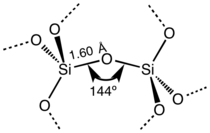
لثاني أكسيد السليكون العديد من العديد من الأشكال البلورية، لكنها دائمًا ما يكون لها نفس البنية المحلية حول السليكون والأكسجين. في ألفا-كوارتز يكون طول رابطة السليكون-الأكسجين 161 pm، حيث يتراوح طوله في ألفا-تريديميت 154-171 pm. كما تتراوح رابطة الأكسجين-السليكون بين أدنى قيمة 140° في ألفا-تريديميت، حتى 180° في بيتا-تريميديت. في ألفا-كوارتز، تبلغ زاوية السليكون-أكسجين-سليكون 144°.[7]
- تعدد الأشكال
ألفا كوارتز هو أكثر الأشكال استقراراً من ثاني أكسيد السليكون الصلب عند درجة حرارة الغرفة. المعادن ذات درجات الحرارة المرتفعة، الكريستوباليت والتريديميت، تتمتع بكثافة منخفضة مؤشرات إنكسار أقل من الكوارتز. يحدث التحول من ألفا-كوارتز إلى بيتا-كوارتز بشكل مفاجئ عند درجة حرارة 573° س. نظرًا لأن التحول مصحوب بتغير كبير في الحجم، فيمكنه بسهولة تحفيز تكسير المواد الخزفية أو الصخور التي تمر عبر حد درجة الحرارة هذا.[8] المعادن ذات الضغط المرتفع، السيفرتيت، الستيشوڤيت، والكويسيت، تتمتع بكثافة ومؤشر إنعكاس أكبر من الكوارتز.[9] للستيشوڤيت هيكل شبيه بالروتيل حيث يكون السليكون بستة تنسيقات. تبلغ كثافة الستيشوڤيت 4.287 گ/سم3، الذي بالمقارنة بألفا-كوارتز، الأكثر كثافة من المعادن ذات الضغط المنخفض، والتي تبلغ كثافتها 2.64 گ/سم3.[10] يمكن أن يُعزى الاختلاف في الكثافة إلى الزيادة في التنسيق حيث أن أقصر ستة أطوال روابط السليكون-أكسجين في الستيشوڤيت (أربعة أطوال روابط السليكون-أكسجين تبلغ 176 pm والاثنان الآخران من 181 pm) أكبر من طول رابطة السليكون أكسجين (161 pm) في ألفا-كوارتز.[11] يؤدي التغيير في التنسيق إلى زيادة أيونية رابطة السليكون-أكسجين.[12] الأهم من ذلك، أن أي انحرافات عن هذه المعلمات القياسية تشكل اختلافات أو اختلافات في البنية الدقيقة، والتي تمثل نهجًا للمواد الصلبة الغير متبلورة أو الصلبة الزجاجية أو المواد الزجاجية.
الفوجاسيت-سليكا، تعدد شكلي آخر، يُحصل عليه بإزالة ألمنة الصوديوم المنخفض، الزيوليت-Y فائق الثبات مع المعالجة الحمضية والحرارية المشتركة. تحتوي المادة الناتجة على أكثر من 99% سيليكا، وتبلور ومساحة سطح معينة مرتفعة (أكثر من 800 م2/گ). يتمتع الفوجاسيت-سليكا باستقرار حراري وحمضي عالي جدًا. على سبيل المثال، يحافظ على درجة عالية من الترتيب الجزيئي بعيد المدى أو التبلور حتى بعد الغليان في حمض الهيدروكلوريك المركز.[13]
- ثاني أكسيد السليكون المنصهر
تُظهر السليكا المنصهرة العديد من الخصائص الفيزيائية الغريبة التي تشبه تلك التي لوحظت في السائل الماء: تمدد درجة الحرارة السالب، والكثافة القصوى عند درجات حرارة ~ 5000°س، والحد الأدنى من السعة الحرارية.[14] تنخفض كثافتها من 2.08 گ/سم3 عند درجة حرارة 1950°س إلى 2.03گ/سم3 عند درجة حرارة 2200 °س.[15]
- ثاني أكسيد السليكون الجزيئي
يتمتع ثاني أكسيد السليكون الجزيئي ببنية خطية شبيهة بثاني أكسيد الكربون. يُحضر عن طريق دمج أول أكسيد السليكون (SiO) مع الأكسجين في مصفوفة أرگون.
ثاني أكسيد السليكون الثنائي، (SiO2)2 يُحصل عليه بتفاعل O2 مع مصفوفة معزولة لأول أكسيد السليكون الثنائي، (Si2O2). في ثاني أكسيد السليكون الثنائي توجد ذرتين من الأكسجين تجسران بين ذرات السيليكون بزاوية Si-O-Si تبلغ 94 درجة وطول الرابطة 164.6 pm وطول رابطة Si-O النهائية هو 150.2 pm. يبلغ طول رابطة Si-O 148.3 pm، مقارنة بطول 161 في ألفا كوارتز. تقدر طاقة الرابطة بـ 621.7 ك.ج./مول.[16]
التواجد في الطبيعة
الجيولوجيا
الشكل الشائع لثاني أكسيد السليكون في الطبيعة هو الكوارتز، الذي يؤلف أكثر من من حيث الكتلة، 10% من قشرة الأرض.[17] الكوارتز هو التعدد الشكلي الوحيد المستقر للسليكون على سطح الأرض. عُثر على التكرارات غير المستقرة لمعدني الكويسيت والستيشوڤيت ذوي الضغط المرتفع، حول بنى التصادم ومرتبطة بالإكلوجيت الذي يتشكل أثناء التحول الصخري عالي-فائق الضغط. تُعرف أشكال درجات الحرارة المرتفعة للتريديميت والكريستوباليت من الصخور البركانية الغنية بالسيليكا. في أجزاء كثيرة من العالم، تعتبر السيليكا هي المكون الرئيسي للرمال.[18]
علم الأحياء
على الرغم من أن السليكا ضعيفة الذوبان، إلا أنها توجد في العديد من النباتات مثل الأرز. يبدو أن المواد النباتية التي تحتوي على نسبة عالية من السليكا النباتية ذات أهمية بالنسبة لحيوانات الرعي، من الحشرات القارضة إلى ذوات الحوافر. تسرع السليكا من تآكل الأسنان، وقد تكون المستويات العالية من السليكا في النباتات التي تأكلها الحيوانات العاشبة آلية دفاعية ضد الافتراس.[19][20]
السيليكا هي أيضًا المكون الأساسي لرماد قش الأرز، والذي يستخدم، على سبيل المثال، في الترشيح وكمواد اسمنتية تكميلية (SCM) في تصنيع الأسمنت والخرسانة.[citation needed]
لأكثر من مليار سنة، كان تكون السليكا داخل الخلايا وعن طريقها أمرًا شائعًا في العالم البيولوجي. في العالم الحديث، يحدث في البكتيريا والكائنات وحيدة الخلية والنباتات والحيوانات (اللافقاريات والفقاريات).
من أبرز الأمثلة على ذلك:
- الاختبارات أو المحار الدياتومي (أي الأصداف) من الدياتومات، الشعوعيات، وtestate amoebae.[6]
- السليكا النباتية في خلايا الكثير من الحيوانات، منها الكنباثيات، وخاصة جميع الحشائش، ونطاق واسع من ثنائيات الفلقة.
- تشكل الشوكيات الهيكل العظمي للعديد من الإسنفنجيات.
غالبًا ما تُظهر المعادن البلورية المتكونة في البيئة الفسيولوجية خواصًا فيزيائية استثنائية (على سبيل المثال، القوة والصلادة وصلابة الكسر) وتميل إلى تكوين هياكل هرمية تظهر ترتيبًا هيكليًا مجهريًا عبر مجموعة من المقاييس. تتبلور المعادن من بيئة غير مشبعة بالسليكون، وتحت ظروف درجة حموضة متعادلة ودرجة حرارة منخفضة (0-40 درجة مئوية).
من غير الواضح ما هي الطرق التي تعتبر بها السليكا مهمة في تغذية الحيوانات. يمثل مجال البحث هذا تحديًا لأن السليكا موجودة في كل مكان وفي معظم الظروف تذوب بكميات ضئيلة فقط. ومع ذلك، فإنه يحدث بالتأكيد في الجسم الحي، مما يخلق التحدي المتمثل في تخليق عناصر تحكم خالية من السليكا لأغراض البحث. هذا يجعل من الصعب التأكد عندما يكون لوجود السيليكا آثار مفيدة عملية، وعندما يكون وجودها مصادفة، أو حتى ضارة. الإجماع الحالي هو أنه يبدو بالتأكيد أن السليكا مادة هامة في نمو وقوة وإدارة العديد من الأنسجة الضامة. هذا صحيح ليس فقط للأنسجة الضامة الصلبة مثل العظام والأسنان[مطلوب توضيح] لكن ربما في الكيمياء الحيوية تكون هامة للهياكل المحتوية على الإنزيم تحت الخلوي أيضًا.[21][مصدر قديم]
الاستخدامات
في الإنشاءات
حوالي 95% من الاستخدام التجاري لثاني أكسيد السليكون (الرمل) في صناعة البناء، على سبيل المثال لانتاج الخرسانة (اسمنت بورتلاند).[17]
كانت بعض رواسب رمال السليكا، ذات الحجم والشكل المرغوب فيه للجسيمات والمحتوى المرغوب فيه من الطين والمحتويات المعدنية الأخر، مهمة لصب الرمل للمنتجات المعدنية.[22] تتيح نقطة الانصهار العالية للسليكا إمكانية استخدامها في تطبيقات مثل صب الحديد؛ يستخدم صب الرمل الحديث أحيانًا معادن أخرى لأسباب أخرى.
تُستخدم السليكا المتبلورة في التصديع الهيدروليكي للتكوينات التي تحتوي على زيت صخري وغاز صخري.[23]
كمادة لصناعة الزجاج والسليكون
السليكا هي المكون الأساسي في إنتاج معظم أنواع الزجاج. كما تذوب المعادن الأخرى بالسليكا، فإن مبدأ انخفاض درجة التجمد يقلل من درجة انصهار الخليط ويزيد سيولته. تبلغ درجة حرارة التزجج لثاني أكسيد السليكون النقي حوالي 1475 كلڤن.[24] عند تبريد ثاني أكسيد السليكون المصهور بسرعة، فإنه لا يتبلور، لكنه يتجمد كزجاج. لهذا، فإن معظم عمليات تزجيج الخزف احتوي على السليكا كمكون رئيسي.
تتشابه الهندسة الهيكلية للسليكون والأكسجين في الزجاج مع تلك الموجودة في الكوارتز ومعظم الأشكال البلورية الأخرى من السليكون والأكسجين مع السليكون المحاط برباعي السطوح المنتظم لمراكز الأكسجين. ينشأ الاختلاف بين الأشكال الزجاجية والبلورية من اتصال الوحدات الرباعية السطوح: على الرغم من عدم وجود دورية طويلة المدى في ترتيب الشبكة الزجاجية، إلا أن المقاييس الطويلة تتجاوز طول رابطة السليكون-أكسجين. أحد الأمثلة على هذا الترتيب هو تفضيل تشكيل حلقات من 6-رباعي السطوح.[25]
غالبية الألياف الضوئية المستخدمة في الاتصالات مصنوعة أيضًا من السليكا. وهي مادة خام أولية للعديد من الخزفيات مثل الفخاريات والخزف الحجري والپورسلين.
يستخدم ثاني أكسيد السليكون لإنتاج عنصر السليكون. تتضمن العملية الاختزال الحراري-الكربوني في فرن القوس الكهربائي:[26]
السليكا المدخنة
تُحضر السليكا المدخنة، المعروفة أيضًا باسم السيليكا اپبيروجينية، عن طريق حرق SiCl4 في لهب الهيدروجين الغني بالأكسجين لإنتاج "دخان" SiO2.[10]
يمكن إنتاجها أيضاً عن طريق تبخير رمل الكوارتز في قوس كهربائي عند درجة حرارة 3000 مئوية. ينتج عن كلتا العمليتين قطرات مجهرية من السليكا غير المتبلورة مدمجة في جسيمات ثانوية متفرعة، تشبه السلسلة ، ثلاثية الأبعاد والتي تتكتل بعد ذلك في جزيئات من الدرجة الثالثة، مسحوق أبيض بكثافة كتلة منخفضة للغاية (0.03-.15 گ/سم3) وبالتالي مساحة سطح عالية.[27]
تعمل الجسيمات كعامل تثخين thixotropic، أو كعامل مضاد للتكتل، ويمكن معالجتها لجعلها محبة للماء أو كارهة للماء لتطبيقات الماء أو السوائل العضوية.
السليكا المدخنة عبارة عن مسحوق متناهي الصغر يُجمع كمنتج ثانوي لإنتاج السليكون وسبائك الفروسيليكون. ويتكون من جسيمات كروية غير بلورية بمتوسط قطر جسيمي يبلغ 150 نانومتر، بدون تفرع المنتج الپيروجيني. يستخدم بصفة رئيسة كمادة پوزولانية للخرسانة عالية الأداء. يمكن استخدام جسيمات السيليكا النانوية المدخنة بنجاح كعامل مضاد للشيخوخة في مواد رابطة الأسفلت.[28]
الأغذية، مستحضرات التجميل، والتطبيقات الدوائية
السيليكا، سواء كانت غروانية أو مترسبة أو مدخنة، هي مادة مضافة شائعة في إنتاج الغذاء. تستخدم بشكل أساسي كعامل تدفق أو مضاد- للتكتل في الأطعمة المسحوقة مثل البهارات ومبيض القهوة النباتي، أو المساحيق التي يتم تشكيلها في أقراص صيدلانية.[27] يمكنها امتصاص الماء من المواد الرطبة. تستخدم السليكا الغروانية كعامل ترويق لصناعة النبيذ والجعة والعصائر، حيث يكونرقم E E551.[17]
في مستحضرات التجميل، تعتبر السليكا مفيدة لخصائصها الناشرة للضوء[29] وطبيعتها الماصة للرطوبة.[30]
تراب المشطورات، وهو منتج مُعدن، يُستخدم في الأغذية ومستحضرات التجميل منذ عدة قرون. يتكون من هياكل السيليكا المجهرية الدياتومات؛ في شكل أقل معالجة يباع "كمسحوق للأسنان".[citation needed] تُصنع أو تُعدن السليكا المائية كمادة كاشطة صلبة في معجون الأسنان.
أشباه الموصلات
يستخدم ثاني أكسيد السليكون على نطاق واسع في تكنولوجيا أشباه الموصلات.
- للتخميل الأولي (مباشرة على سطح أشباه الموصلات).
- كعازل بوابة أصلي في تكنولوجيا موس. اليوم، عندما تقدم القياس (أبعاد طول بوابة ترانزستور موس) إلى أقل من 10 نانومتر؛ استبدل ثاني أكسيد السليكون بموادة عازلة كهربائية أخرى مثل أكسيد الهافنيوم أو ما شابه ذلك بثابت عازل أعلى مقارنة بثاني أكسيد السليكون.
- كطبقة عازلة بين الطبقات المعدنية (الأسلاك) (في بعض الأحيان تصل إلى 8-10) وربط العناصر.
- كطبقة تخميل ثانية (لحماية عناصر أشباه الموصلات وطبقات المعدن) عادةً ما توضع في طبقات مع بعض المواد العازلة الأخرى مثل نيتريد السليكون.
نظرًا لأن ثاني أكسيد السليكون هو أكسيد أصلي للسليكون، فهويستخدم على نطاق واسع مقارنة بأشباه الموصلات الأخرى مثل زرنيخيد الگاليوم أو فوسفيد الإنديوم.
يمكن لثاني أكسيد السليكون أن ينمو على سطح أشباه موصلات السليكون.[31]
يمكن لطبقات أكسيد السليكون أن تحمي أسطح السليكون أثناء عمليات الانتشار، ويمكن استخدامها لإخفاء الانتشار.[32][33]
التخميل السطحي هو العملية التي يتم من خلالها جعل سطح أشباه الموصلات خاملًا، ولا يغير خصائص أشباه الموصلات نتيجة للتفاعل مع الهواء أو المواد الأخرى التي تلامس سطح البلورة أو حافتها.[34][35]
يقلل تكوين طبقة من ثاني أكسيد السليكون النامي حراريًا بشكل كبير من تركيز الأطوار الإلكترونية على سطح السليكون.[35] SiO2 تحافظ الأغشية على الخصائص الكهربائية لوصلات الموجب والسالب وتمنع هذه الخصائص الكهربائية من التدهور بسبب البيئة المحيطة الغازية.[33] يمكن استخدام طبقات أكسيد السليكون لتثبيت أسطح السليكون كهربائيًا.[32] تعتبر عملية التخميل السطحي طريقة هامة لتصنيع أشباه الموصلات التي تتضمن طلاء رقاقة السليكون بطبقة عازلة من أكسيد السليكون بحيث يمكن للكهرباء أن تخترق بشكل موثوق إلى السليكون الموصل أدناه. إن زراعة طبقة من ثاني أكسيد السليكون فوق رقاقة السليكون تمكنها من التغلب على الأطوار السطحية التي تمنع الكهرباء من الوصول إلى طبقة أشباه الموصلات.[34][36] عملية التخميل السطحي للسليكون بواسطة الأكسدة الحرارية (ثاني أكسيد السليكون) أمر بالغ الأهمية في صناعة أشباه الموصلات. يستخدم بشكل شائع لتصنيع رقائق ترانزستورات الأثر الحقلي للأكاسيد المعدنية لأشباه الموصلات (الموسفت) ودوائر السليكون المتكاملة (مع العملية السطحية).[34][36]
أخرى
تستخدم السليكا الكارهة للماء كمون مزيل للرغوة.
نظرًا لكونها مقاومة للحرارة، فهي مفيدة على شكل ألياف كنسيج للحماية الحرارية عند درجات الحرارة المرتفعة.[citation needed]
تُستخدم السليكا في استخراج الحمض النووي والرنا نظرًا لقدرتها على الارتباط بالأحماض النووية في ظل وجود chaotropes.[37]
استخدم هلام السيكا في مركبة الفضاء ستاردست لجمع الجسيمات خارج كوكب الأرض.[38]
يمكن استخدام السليكا النقية (ثاني أكسيد السليكون)، عند تبريدها على شكل كوارتز مدمج في زجاج بدون نقطة انصهار حقيقية، كألياف زجاجية في صناعة الألياف الزجاجية.
الإنتاج
يتم الحصول على ثاني أكسيد السليكون غالبًا عن طريق التعدين، بما في ذلك تعدين الرمل وتنقية الكوارتز. الكوارتز مناسب للعديد من الأغراض، بينما المعالجة الكيميائية مطلوبة لجعل المنتج أنقى أو أكثر ملاءمة (على سبيل المثال، أكثر تفاعلية أو الحصول على حبيبات دقيقة).[citation needed]
السليكا المرسبة
تُنتج السليكا المترسبة أو السليكا غير المتبلورة عن طريق تحميض محاليل سيليكات الصوديوم. يُغسل الراسب الجيلاتيني أو هلام السيليكا أولاً ثم يُجفف لإنتاج سيليكا مسامية-دقيقة عديمة اللون.[10] المعادلة المثالية التي تشتمل على حمض الكبريتيك وثلاثي السيليكات هي:
تم إنتاج ما يقرب من مليار كيلوگرام/سنوياً (1999) من السيليكا بهذه الطريقة، لاستخدامها بشكل أساسي في مركبات الپوليمر - الإطارات ونعال الأحذية.[17]
في الرقائق الدقيقة
تنمو الأغشية الرقيقة من السيليكا تلقائيًا على رقاقة السليكون عبر الأكسدة الحرارية، مما ينتج طبقة ضحلة جدًا تبلغ حوالي 1 نانومتر أو 10 أنگستروم الذي يسمى الأكسيد الأصلي.[39] تُستخدم درجات حرارة أعلى وبيئات بديلة لتنمية طبقات شديدة الإحكام من ثاني أكسيد السليكون على السليكون، على سبيل المثال عند درجات حرارة تتراوح بين 600 و1200 °س، باستخدام ما يسمى بالأكسدة الجافة مع O2
أو الأكسدة الرطبة مع H2O.[40][41]
طبقة الأكسيد الأصلية مفيدة في الإلكترونيات الدقيقة، حيث تعمل بمثابة عازل كهربائي مع ثبات كيميائي عالي. يمكن أن يحمي السليكون الشحنة ويخزنها، ويمنع التيار، بل ويعمل كمسار متحكم به للحد من تدفق التيار.[42]
الطرق المعملية أو الخاصة
من مركبات السليكون العضوي
تبدأ العديد من الطرق المؤدية إلى تحضير ثاني أكسيد السليكون بمركب السليكون العضوي، على سبيل المثال HMDSO،[43]. يُوضح تركيب السليكا أدناه باستخدام الأورثوسيليكات رباعية الإيثيل (TEOS).[44] ببساطة، تُسخن الأورثوسيليكات رباعية الإيثيل على درجة حرارة 680–730 °س مما ينتج الأكسيد:
وبالمثل، تحترق الأورثوسيليكات رباعية الإيثيل عند 400 درجة مئوية تقريباً:
تخضع الأورثوسيليكات رباعية الإيثيل للتحلل المائي عبر ما يسمى عملية الهلام-سول. يتأثر مسار التفاعل وطبيعة المنتج بالمحفزات، لكن المعادلة المثالية هي:[45]
طرق أخرى
نظرًا لكونه مستقرًا للغاية، فإن ثاني أكسيد السيليكون يُحضر من عدة طرق. يعتبر احتراق السيلان بسيط من الناحية المفاهيمية، لكنه ذو قيمة عملية قليلة، يعطي ثاني أكسيد اليليكون. يشبه هذا التفاعل احتراق الميثان:
ومع ذلك، فقد استخدم ترسيب البخار الكيميائي لثاني أكسيد اليليكون على سطح بلوري من السيلان باستخدام النيتروجين باعتباره "غاز حامل" عند درجة حرارة 200-500°س.[46]
التفاعلات الكيميائية
تتحول السليكا إلى سيليكون بالاختزال بالكربون.
يتفاعل الفلور مع ثاني أكسيد السليكون ليشكل SiF4 وO2 بينما غازات الهالوجين الأخرى (Cl2, Br2, I2) تكون غير متفاعلة بشكل أساسي.[10]
معظم أشكال ثاني أكسيد السليكون (باستثناء السيتشوڤيت، والتي لا تتفاعل بدرجة ذات أهمية[47]) يهاجمها حمض الهيدروفلوريك (HF) to produce حمض سداسي فلوروسلسليك:[7]
يستخدم HF لإزالة أو سبك ثاني أكسيد السليكون في صناعة أشباه الموصلات.
تحت الظروف العادية، لا يتفاعل السليكون مع معظم الأحماض ولكنه يذوب بواسطة حمض الهيدروفلوريك.
يتم مهاجمة السيليكون بقواعد مثل هيدروكسيد الصوديوم المائي لإعطاء السيليكات.
يعمل ثاني أكسيد السليكون تعريف لوكس-فلود|كحمض لوكس-فلود، حيث يكون قادراً على التفاعل مع القواعد في ظل ظروف معينة. نظرًا لأنها لا تحتوي على أي هيدروجين، فإن السليكا غير المائية لا يمكن أن تعمل بشكل مباشر كحمض برونستد-لاوري. بينما ثاني أكسيد السليكون يتمتع بقابيلة ذوبان ضعيفة فقط في الماء عند درجات الحموضة المنخفضة أو الطبيعية (عادة، 2 × 10−4 M بالنسبة للكوارتز حتى 10−3 M بالنسبة لكريپتوكريستالين للعقيق الأبيض) تتفاعل القواعد القوية مع الزجاج وتذيبه بسهولة. لذلك، يجب تخزين القواعد القوية في زجاجات بلاستيكية لتجنب اعوجاج غطاء الزجاجة، للحفاظ على سلامة المحتوى، وتجنب التلوث غير المرغوب فيه بواسطة أنيون السليكات.[48]
يذوب ثاني أكسيد السليكون في القلويات الساخنة المركزة أو الهيدروكسيد المنصهر، كما هو موضح في هذه المعادلة المثالية:[10]
سيعادل ثاني أكسيد السليكون أكاسيد الفلزات الأساسية (على سبيل المثال أكسيد الصوديوم، أكسيد البوتاسيوم، ثاني أكسيد الرصاص، أكسيد الزنك، أو مخاليط من الأكاسيد، مكونة السليكات والزجاج حيث يتم كسر روابط السليكون-الأكسجين-السليكون في السيليكا على التوالي).[7] كمثال على ذلك تفاعل أكسيد الصوديوم وثاني أكسيد السليكون يمكن أن ينتج أورثوسليكات الصوديوم، سليكات الصوديوم، والزجاج، بناءاً على نسب المواد المتفاعلة:[10]
- .
أمثلة على هذه الأنواع من الزجاج ذات الأهمية التجارية، على سبيل المثال زجاج الصودا والجير، زجاج البورسليكات، زجاج الرصاص. في هذه النوعية من الزجاج، يُطلق على السيليكا اسم الشبكة السابقة أو السابقة الشبكية.[7]
يستخدم التفاعل أيضًا في أفران الصهر لإزالة الشوائب الرملية في الخام عن طريق معادلة أكسيد الكالسيوم، وتشكيل خبث سيليكات الكالسيوم.

يتفاعل ثاني أكسيد السيليكون في عملية تقطير مرتد ساخنة، في وجود ثنائي النيتروجين، مع گلايكول الإثيلين وقاعدة فلزية قلوية لإنتاج التكافؤ القوي، سليكات خماسية التنسيق التي توفر الوصول إلى مجموعة متنوعة من مركبات السيليكون الجديدة.[49] السيليكات غير قابلة للذوبان بشكل أساسي في جميع المذيبات القطبية باستثناء الميثانول.
يتفاعل ثاني أكسيد السليكون مع عنصر السليكون في درجات حرارة عالية لإنتاج أكسيد السليكون:[7]
قابيلة الذوبان في الماء
تعتمد قابلية ذوبان ثاني أكسيد السليكون في الماء بشدة على شكله البلوري وهي أعلى بثلاث إلى أربع مرات بالنسبة للسليكا[مطلوب توضيح] عن الكوارتز؛ كدالة لدرجة الحرارة، فإنها تبلغ ذروتها عند 340°س تقريباً.[50] تُستخدم هذه الخاصية لتنمية بلورات منفردة من الكوارتز في عملية مائية حرارية حيث يذوب الكوارتز الطبيعي في ماء شديد السخونة في وعاء ضغط يكون أكثر برودة في الأعلى. بالنسبة للبلورات 0.5-1 كگ؛ يمكن إنماء كگ لمدة 1-2 شهر.[7] هذه البلورات هي مصدر للكوارتز شديد النقاء لاستخدامه في التطبيقات الإلكترونية.[10] أعلى من درجة الحرارة الحرجة للمياه 647.096 K (373.946 °C; 705.103 °F) وضغط يصل إلى 22.064 ميجاباسكال (3،200.1 psi) أو أكثر، يكون الماء مائع فوق حرج ويصبح الذوبان أعلى مرة أخرى منه في درجات الحرارة المنخفضة.[51]
التأثيرات الصحية
تناول السليكا عن طريق الفم هي غير سامة بشكل أساسي حيث ج.م.50 5000 ملگ/كگ (5 g/kg).[17] وجدت دراسة أجريت عام 2008 بعد أبحاث لمدة 15 عامًا أن المستويات الأعلى من السليكا في الماء يبدو أنها تقلل من خطر الخرف. ارتبطت زيادة 10 ملگ/يومياً من السليكا في مياه الشرب بانخفاض خطر الإصابة بالخرف بنسبة 11%.[52]
يمكن أن يؤدي استنشاق غبار السليكا المتبلور الناعم إلى السحار السليكي، التهاب الشعب الهوائية، أو سرطان الرئة، حيث يستقر الغبار في الرئتين ويهيج الأنسجة بشكل مستمر، مما يقلل من سعة الرئة.[53] عند استنشاق جزيئات السيليكا الدقيقة بكميات كبيرة بما يكفي (على سبيل المثال من خلال التعرض المهني)، فإنه يزيد من خطر أمراض المناعة الذاتية الجهازية مثل الذئبة[54] التهاب المفاصل الروماتويدي مقارنة بالمعدلات المتوقعة بين عامة الأشخاص.[55]
المخاطر المهنية
تعتبر السليكا من المخاطر المهنية للأشخاص الذين يقومون السفع الرملي أو الذين يعملون مع المنتجات التي تحتوي على مسحوق السليكا البلورية. قد تسبب السليكا غير المتبلورة، مثل السليكا المدخنة، تلفًا لا يمكن إصلاحه في الرئة في بعض الحالات، ولكنها لا ترتبط بتطور السحار السلكي. يمكن أن يتأثر الأطفال، ومرضى الربو في أي عمر، والذين يعانون من الحساسية، وكبار السن (جميعهم يعانون من نقص سعة الرئة) في وقت أقل.[56]
تشكل السليكا البلورية هي خطراً مهنياً لأولئك الذين يعملون في تركيب أرفف المطابخ الحجرية، لأن عملية لبقطع والتركيب تخلق كميات كبيرة من السليكا المحمولة جواً.[57] تشكل السليكا البلورية المستخدمة في التصديع الهيدروليكي خطراً صحياً على العمال.[23]
الفسيولوجيا المرضية
في الجسم، لا تذوب جزيئات السليكا البلورية خلال الفترات ذات الصلة سريريًا. يمكن لبلورات السليكا الموجودة داخل الرئتين تنشيط الجسيم الالتهابي NLRP3 داخل خلايا الدم البيضاء والخلايا التغصنية، وبالتالي ينتج عنها إنتاج الإنترلوكين، وهو سيتوكين محرض على الالتهاب في الجهاز المناعي.[58][59][60]
التنظيم
تحدد اللوائح التي تقيد التعرض للسليكا "فيما يتعلق بمخاطر السحار السليكي" أنها معنية فقط بالسليكا، وهي مادة بلورية وتشكل الغبار.[61][62][63][64][65][66]
عام 2013، خفضت إدارة السلامة والصحة المهنية الأمريكية حد التعرض إلى 50 م.گ/م3 من الهواء. قبل 2013، كان مسموحاً بالتعرض لـ 100 م.گ/م3 ولعمال البناء حتى 250 م.گ/م3.[23]
عام 2013، طالبت إدارة السلامة والصحة المهنية أيضاً "بالإنجاز الأخضر" للآبار التصديع لتقليل التعرض للسليكا البلورية بالإضافة إلى تقييد حد التعرض.[23]
الأشكال البلورية
يتواجد ثاني أكسيد السليكون، أكثر من أي مادة تقريبًا، بأشكال بلورية متعددة. تسمى هذه الأشكال تعدد الأشكال.
| الشكل | السمات البنيوية رمز پيرسون، رقم المجموعة. |
ρ g/cm3 |
ملاحظات | البُنية |
|---|---|---|---|---|
| ألفا-كوارتز | rhombohedral (trigonal) hP9, P3121 No.152[67] |
2.648 | Helical chains making individual single crystals optically active; α-quartz converts to β-quartz at 846 K | 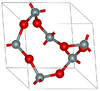
|
| بيتا-كوارتز | hexagonal hP18, P6222, No. 180[68] |
2.533 | Closely related to α-quartz (with an Si-O-Si angle of 155°) and optically active; β-quartz converts to β-tridymite at 1140 K | 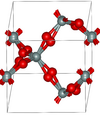
|
| ألفا-تريديميت | orthorhombic oS24, C2221, No.20[69] |
2.265 | شكل مستقر تحت الضغط العادي | 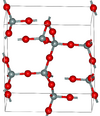
|
| بيتا-تريديميت | hexagonal hP12, P63/mmc, No. 194[69] |
Closely related to α-tridymite; β-tridymite converts to β-cristobalite at 2010 K | 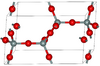
| |
| ألفا-كريستوباليت | tetragonal tP12, P41212, No. 92[70] |
2.334 | شكل مستقر تحت الضغط العادي | 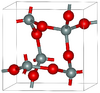
|
| بيتا-كريستوباليت | cubic cF104, Fd3m, No.227[71] |
Closely related to α-cristobalite; melts at 1978 K | 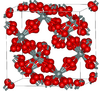
| |
| كياتيت | tetragonal tP36, P41212, No. 92[72] |
3.011 | Si5O10, Si4O8, Si8O16 rings; synthesised from glassy silica and alkali at 600–900 K and 40–400 MPa | 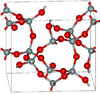
|
| موگانيت | monoclinic mS46, C2/c, No.15[73] |
Si4O8 and Si6O12 rings | 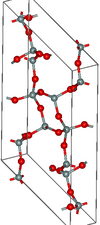
| |
| كويسيت | monoclinic mS48, C2/c, No.15[74] |
2.911 | Si4O8 and Si8O16 rings; 900 K and 3–3.5 GPa | 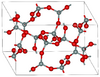
|
| ستيشوڤيت | tetragonal tP6, P42/mnm, No.136[75] |
4.287 | One of the densest (together with seifertite) polymorphs of silica; rutile-like with 6-fold coordinated Si; 7.5–8.5 GPa | 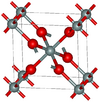
|
| سيفرتيت | orthorhombic oP, Pbcn[76] |
4.294 | One of the densest (together with stishovite) polymorphs of silica; is produced at pressures above 40 GPa.[77] | 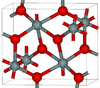
|
| ملانوفلوگيت | cubic (cP*, P4232, No.208)[78] or tetragonal (P42/nbc)[79] | 2.04 | Si5O10, Si6O12 rings; mineral always found with hydrocarbons in interstitial spaces - a clathrasil (silica clathrate)[80] | 
|
| fibrous W-silica[10] |
orthorhombic oI12, Ibam, No.72[81] |
1.97 | Like SiS2 consisting of edge sharing chains, melts at ~1700 K | 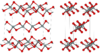
|
| 2D silica[82] | hexagonal | Sheet-like bilayer structure | 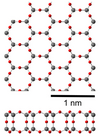
|
السلامة
يمكن أن يؤدي استنشاق السيليكا المتبلورة الدقيقة إلى التهاب شديد في أنسجة الرئة والسحار السليكي والتهاب الشعب الهوائية وسرطان الرئة وأمراض المناعة الذاتية الجهازية، مثل الذئبة الحمراء والتهاب المفاصل الروماتويدي. استنشاق ثاني أكسيد السليكون الغير متبلور، بجرعات عالية، يؤدي إلى التهاب غير دائم قصير الأمد، حيث تشفى جميع التأثيرات.[83]
أسماء أخرى
تعدد هذه القائمة الموسعة المرادفات لثاني أكسيد السليكون.[84]
- CAS 112945-52-5
- Acitcel
- Aerosil
- Amorphous silica dust
- Aquafil
- CAB-O-GRIP II
- CAB-O-SIL
- CAB-O-SPERSE
- Catalogue
- Colloidal silica
- Colloidal silicon dioxide
- Dicalite
- DRI-DIE Insecticide 67
- FLO-GARD
- Fossil flour
- Fumed silica
- Fumed silicon dioxide
- HI-SEL
- LO-VEL
- Ludox
- Nalcoag
- Nyacol
- Santocel
- Silica
- Silica aerogel
- Silica, amorphous
- Silicic anhydride
- Silikill
- Synthetic amorphous silica
- Vulkasil
انظر أيضاً
المصادر
- ^ أ ب ت Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). Boca Raton, FL: CRC Press. ISBN 1439855110.
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0552
- ^ أ ب NIOSH Pocket Guide to Chemical Hazards 0682
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ^ Iler RK (1979). The Chemistry of Silica. New York: Wiley. ISBN 9780471024040.
- ^ أ ب Fernández LD, Lara E, Mitchell EA (2015). "Checklist, diversity and distribution of testate amoebae in Chile" (PDF). European Journal of Protistology. 51 (5): 409–24. doi:10.1016/j.ejop.2015.07.001. PMID 26340665.
- ^ أ ب ت ث ج ح خ قالب:Holleman&Wiberg
- ^ Cuff YH (1996). Ceramic Technology for Potters and Sculptors. Philadelphia: University of Pennsylvania. pp. 93–95. ISBN 9780812213775.
- ^ De La Rocha C, Conley DJ (2017). "Mystical Crystals of Silica". Silica Stories. Cham: Springer. pp. 50–55. doi:10.1007/978-3-319-54054-2_4. ISBN 9783319540542.
- ^ أ ب ت ث ج ح خ د Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. pp. 393–99. ISBN 978-0-08-022057-4.
- ^ Wells AF (1984). Structural Inorganic Chemistry. Oxford Science Publications. ISBN 9780198553700.
- ^ Kirfel A, Krane HG, Blaha P, et al. (2001). "Electron-density distribution in stishovite, SiO2: a new high-energy synchrotron-radiation study". Acta Crystallogr. A. 57 (6): 663–77. doi:10.1107/S0108767301010698. PMID 11679696.
- ^ Scherzer J (1978). "Dealuminated faujasite-type structures with SiO2/Al2O3 ratios over 100". J. Catal. 54 (2): 285. doi:10.1016/0021-9517(78)90051-9.
- ^ Shell SM, Debenedetti PG, Panagiotopoulos AZ (2002). "Molecular structural order and anomalies in liquid silica" (PDF). Phys. Rev. E. 66 (1): 011202. arXiv:cond-mat/0203383. Bibcode:2002PhRvE..66a1202S. doi:10.1103/PhysRevE.66.011202. PMID 12241346. S2CID 6109212. Archived from the original (PDF) on 2016-06-04. Retrieved 2009-07-07.
- ^ Aksay IA, Pask JA, Davis RF (1979). "Densities of SiO2-Al2O3 Melts" (PDF). J. Am. Ceram. Soc. 62 (7–8): 332–336. doi:10.1111/j.1151-2916.1979.tb19071.x.
- ^ Jutzi P, Schubert U (2003). Silicon chemistry: from the atom to extended systems. Wiley-VCH. ISBN 9783527306473.
- ^ أ ب ت ث ج Flörke OW, Graetsch HA, Brunk F, et al. (2018). "Silica". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a23_583.pub3.
{{cite encyclopedia}}: Cite has empty unknown parameter:|authors=(help) - ^ Berslien E (2012). An Introduction to Forensic Geoscience. Wiley & Sons. p. 138. ISBN 9781405160544.
- ^ Massey FP, Ennos AR, Hartley SE (2006). "Silica in grasses as a defence against insect herbivores: Contrasting effects on folivores and a phloem feeder". J. Anim. Ecol. 75 (2): 595–603. doi:10.1111/j.1365-2656.2006.01082.x. PMID 16638012.
- ^ Keeping MG, Kvedaras OL (2008). "Silicon as a plant defence against insect herbivory: Response to Massey, Ennos and Hartley". J. Anim. Ecol. 77 (3): 631–3. doi:10.1111/j.1365-2656.2008.01380.x. PMID 18341561.
- ^ Carlisle EM (1986). "Silicon as an essential trace element in animal nutrition". In Evered D, O'Connor M (eds.). Silicon Biochemistry: Ciba Foundation Symposium. Novartis Foundation Symposia. Vol. 121. Wiley & Sons. pp. 123–39. doi:10.1002/9780470513323.ch8. ISBN 9780470513323. PMID 3743227.
- ^ Nevin, Charles Merrick (1925). Albany moulding sands of the Hudson Valley. University of the State of New York at Albany.
- ^ أ ب ت ث Greenhouse S (23 Aug 2013). "New Rules Would Cut Silica Dust Exposure". NYTimes. Retrieved 24 Aug 2013.
- ^ Ojovan MI (2004). "Glass formation in amorphous SiO2 as a percolation phase transition in a system of network defects". JETP Lett. 79 (12): 632–634. Bibcode:2004JETPL..79..632O. doi:10.1134/1.1790021. S2CID 124299526.
- ^ Elliott SR (1991). "Medium-range structural order in covalent amorphous solids". Nature. 354 (6353): 445–452. Bibcode:1991Natur.354..445E. doi:10.1038/354445a0. S2CID 4344891.
- ^ Atkins PW, Overton T, Rourke J, et al., eds. (2010). Shriver & Atkins' inorganic chemistry (5th ed.). Oxford: Oxford University Press. p. 354. ISBN 9780199236176. OCLC 430678988.
- ^ أ ب "Cab-O-Sil Fumed Metal Oxides".
- ^ Cheraghian, Goshtasp; Wistuba, Michael P.; Kiani, Sajad; Barron, Andrew R.; Behnood, Ali (December 2021). "Rheological, physicochemical, and microstructural properties of asphalt binder modified by fumed silica nanoparticles". Scientific Reports. 11 (1): 11455. Bibcode:2021NatSR..1111455C. doi:10.1038/s41598-021-90620-w. PMC 8169902. PMID 34075083.
- ^ Barel AO, Paye M, Maibach HI (2014). Handbook of Cosmetic Science and Technology (4th ed.). CRC Press. p. 444. ISBN 9781842145654.
These soft-focus pigments, mainly composed of polymers, micas and talcs covered with rough or spherical particles of small diameters, such as silica or titanium dioxide, are used to optically reduce the appearance of wrinkles. These effects are obtained by optimizing outlines of wrinkles and reducing the difference of brightness due to diffuse reflection.
- ^ Barel AO, Paye M, Maibach HI (2014). Handbook of Cosmetic Science and Technology (4th ed.). CRC Press. p. 442. ISBN 9781842145654.
The silica is a multiporous ingredient, which absorbs the oil and sebum.
- ^ Bassett, Ross Knox (2007). To the Digital Age: Research Labs, Start-up Companies, and the Rise of MOS Technology. Johns Hopkins University Press. pp. 22–23. ISBN 9780801886393.
- ^ أ ب Lécuyer, Christophe; Brock, David C. (2010). Makers of the Microchip: A Documentary History of Fairchild Semiconductor. MIT Press. p. 111. ISBN 9780262294324.
- ^ أ ب Saxena, A (2009). Invention of integrated circuits: untold important facts. International series on advances in solid state electronics and technology. World Scientific. pp. 96–97. ISBN 9789812814456.
- ^ أ ب ت "Martin Atalla in Inventors Hall of Fame, 2009". Retrieved 21 June 2013.
- ^ أ ب Black, Lachlan E. (2016). New Perspectives on Surface Passivation: Understanding the Si-Al2O3 Interface. Springer. p. 17. ISBN 9783319325217.
- ^ أ ب "Dawon Kahng". National Inventors Hall of Fame. Retrieved 27 June 2019.
- ^ Goodwin W, Linacre A, Hadi S (2007). An Introduction to Forensic Genetics. Wiley & Sons. p. 29. ISBN 9780470010259.
- ^ Calderone J (20 Aug 2015). "This cloud-like, futuristic material has been sneaking its way into your life since 1931". Business Insider. Retrieved 11 Feb 2019.
- ^ Doering R, Nishi Y, eds. (2007). Handbook of Semiconductor Manufacturing Technology. CRC Press. ISBN 9781574446753.
- ^ Lee S (2006). Encyclopedia of chemical processing. CRC Press. ISBN 9780824755638.
- ^ Morgan DV, Board K (1991). An Introduction To Semiconductor Microtechnology (2nd ed.). Chichester, West Sussex, England: John Wiley & Sons. p. 72. ISBN 9780471924784.
- ^ Riordan M (2007). "The Silicon Dioxide Solution: How physicist Jean Hoerni built the bridge from the transistor to the integrated circuit". IEEE Spectrum. Retrieved 11 Feb 2019.
- ^ Chrystie, Robin S. M.; Ebertz, Felix L.; Dreier, Thomas; Schulz, Christof (2019-01-28). "Absolute SiO concentration imaging in low-pressure nanoparticle-synthesis flames via laser-induced fluorescence". Applied Physics B (in الإنجليزية). 125 (2): 29. Bibcode:2019ApPhB.125...29C. doi:10.1007/s00340-019-7137-8. ISSN 1432-0649. S2CID 127735545.
- ^ Romero-Jaime, A. K.; Acosta-Enríquez, M. C.; Vargas-Hernández, D.; Tánori-Córdova, J. C.; Pineda León, H. A.; Castillo, S. J. (August 2021). "Synthesis and characterization of silica–lead sulfide core–shell nanospheres for applications in optoelectronic devices". Journal of Materials Science: Materials in Electronics (in الإنجليزية). 32 (16): 21425–21431. doi:10.1007/s10854-021-06648-1. ISSN 0957-4522. S2CID 236182027.
- ^ Nandiyanto AB, Kim SG, Iskandar F, et al. (2009). "Synthesis of spherical mesoporous silica nanoparticles with nanometer-size controllable pores and outer diameters". Microporous and Mesoporous Materials. 120 (3): 447–453. doi:10.1016/j.micromeso.2008.12.019.
- ^ Morgan DV, Board K (1991). An Introduction To Semiconductor Microtechnology (2nd ed.). Chichester, West Sussex, England: John Wiley & Sons. p. 27. ISBN 9780471924784.
- ^ Fleischer, Michael (1962). "New mineral names" (PDF). American Mineralogist. Mineralogical Society of America. 47 (2): 172–174.
- ^ Rodgers GE (2011). Descriptive Inorganic, Coordination, and Solid State Chemistry. Cengage Learning. pp. 421–2. ISBN 9781133172482.
- ^ Laine, Richard M.; Blohowiak, Kay Youngdahl; Robinson, Timothy R.; Hoppe, Martin L.; Nardi, Paola; Kampf, Jeffrey; Uhm, Jackie (17 October 1991). "Synthesis of pentacoordinate silicon complexes from SiO2" (PDF). Nature. 353 (6345): 642–644. Bibcode:1991Natur.353..642L. doi:10.1038/353642a0. hdl:2027.42/62810. S2CID 4310228.
- ^ Fournier RO, Rowe JJ (1977). "The solubility of amorphous silica in water at high temperatures and high pressures" (PDF). Am. Mineral. 62: 1052–1056.
- ^ Okamoto, Atsushi (2019). "Formation of silica particles from supercritical fluids and its impacts on the hydrological properties in the crust". Egu General Assembly Conference Abstracts: 4614. Bibcode:2019EGUGA..21.4614O.
- ^ Rondeau V, Jacqmin-Gadda H, Commenges D, et al. (2008). "Aluminum and Silica in Drinking Water and the Risk of Alzheimer's Disease or Cognitive Decline: Findings from 15-Year Follow-up of the PAQUID Cohort". Am. J. Epidemiol. 169 (4): 489–96. doi:10.1093/aje/kwn348. PMC 2809081. PMID 19064650.
- ^ "Work Safely with Silica". CPWR - The Center for Construction Research and Training. Retrieved 11 Feb 2019.
- ^ "Action Plan for Lupus Research". NIAMS. NIH. 2017. Retrieved 11 Feb 2019.
- ^ Meyer A, Sandler DP, Beane Freeman LE, et al. (2017). "Pesticide Exposure and Risk of Rheumatoid Arthritis among Licensed Male Pesticide Applicators in the Agricultural Health Study". Environ. Health Perspect. 125 (7): 077010-1–077010-7. doi:10.1289/EHP1013. PMC 5744649. PMID 28718769.
- ^ Reuzel PG, Bruijntjes JP, Feron VJ, et al. (1991). "Subchronic inhalation toxicity of amorphous silica and quartz dust in rats". Food Chem. Toxicol. 29 (5): 341–54. doi:10.1016/0278-6915(91)90205-L. PMID 1648030.
- ^ "Worker Exposure to Silica during Countertop Manufacturing, Finishing and Installation" (PDF). NIOSH and OSHA. 2015. Retrieved 26 Feb 2015.
- ^ Hornung V, Bauernfeind F, Halle A, et al. (2008). "Silica crystals and aluminum salts activate the NALP3 inflammasome through phagosomal destabilization". Nat. Immunol. 9 (8): 847–856. doi:10.1038/ni.1631. PMC 2834784. PMID 18604214.
- ^ Merchant JA, ed. (1986). Occupational Respiratory Diseases (PDF). Cincinnati, OH: US Department of Health and Human Services, NIOSH. doi:10.26616/NIOSHPUB86102. hdl:2027/uc1.31210023588922. DHHS (NIOSH) Publication Number 86-102.
- ^ NIOSH (2002) Hazard Review, Health Effects of Occupational Exposure to Respirable Crystalline Silica. Cincinnati, OH: U.S. Department of Health and Human Services, U.S. Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 2002-129.
- ^ "Crystalline Factsheet" (PDF). Archived from the original (PDF) on 22 December 2017. Retrieved 3 August 2017.
- ^ "Silica, Crystalline". Retrieved 3 August 2017.
- ^ "Frequently Asked Questions". Retrieved 3 August 2017.
- ^ "If It's Silica, It's Not Just Dust!" (PDF). Retrieved 3 August 2017.
- ^ "What you should know about crystalline silica, silicosis, and Oregon OSHA silica rules" (PDF). Retrieved 3 August 2017.
- ^ Szymendera, Scott D. (January 16, 2018). Respirable Crystalline Silica in the Workplace: New Occupational Safety and Health Administration (OSHA) Standards (PDF). Washington, DC: Congressional Research Service. Retrieved 27 January 2018.
- ^ Lager G. A.; Jorgensen J. D.; Rotella F.J. (1982). "Crystal structure and thermal expansion of a-quartz SiO2 at low temperature". Journal of Applied Physics. 53 (10): 6751–6756. Bibcode:1982JAP....53.6751L. doi:10.1063/1.330062.
- ^ Wright, A. F.; Lehmann, M. S. (1981). "The structure of quartz at 25 and 590 °C determined by neutron diffraction". Journal of Solid State Chemistry. 36 (3): 371–80. Bibcode:1981JSSCh..36..371W. doi:10.1016/0022-4596(81)90449-7.
- ^ أ ب Kihara, Kuniaki; Matsumoto, Takeo; Imamura, Moritaka (1986). "Structural change of orthorhombic-Itridymite with temperature: A study based on second-order thermal-vibrational parameters". Zeitschrift für Kristallographie. 177 (1–2): 27–38. Bibcode:1986ZK....177...27K. doi:10.1524/zkri.1986.177.1-2.27.
- ^ Downs R. T.; Palmer D. C. (1994). "The pressure behavior of a cristobalite" (PDF). American Mineralogist. 79: 9–14.
- ^ Wright, A. F.; Leadbetter, A. J. (1975). "The structures of the β-cristobalite phases of SiO2 and AlPO4". Philosophical Magazine. 31 (6): 1391–401. Bibcode:1975PMag...31.1391W. doi:10.1080/00318087508228690.
- ^ Shropshire, Joseph; Keat, Paul P.; Vaughan, Philip A. (1959). "The crystal structure of keatite, a new form of silica". Zeitschrift für Kristallographie. 112 (1–6): 409–13. Bibcode:1959ZK....112..409S. doi:10.1524/zkri.1959.112.1-6.409.
- ^ Miehe, Gerhard; Graetsch, Heribert (1992). "Crystal structure of moganite: a new structure type for silica". European Journal of Mineralogy. 4 (4): 693–706. Bibcode:1992EJMin...4..693M. doi:10.1127/ejm/4/4/0693.
- ^ Levien L.; Prewitt C. T. (1981). "High-pressure crystal structure and compressibility of coesite" (PDF). American Mineralogist. 66: 324–333.
- ^ Smyth J. R.; Swope R. J.; Pawley A. R. (1995). "H in rutile-type compounds: II. Crystal chemistry of Al substitution in H-bearing stishovite" (PDF). American Mineralogist. 80 (5–6): 454–456. Bibcode:1995AmMin..80..454S. doi:10.2138/am-1995-5-605. S2CID 196903109.
- ^ Dera P.; Prewitt C. T.; Boctor N. Z.; Hemley R. J. (2002). "Characterization of a high-pressure phase of silica from the Martian meteorite Shergotty". American Mineralogist. 87 (7): 1018. Bibcode:2002AmMin..87.1018D. doi:10.2138/am-2002-0728. S2CID 129400258.
- ^ Seifertite. Mindat.org.
- ^ Skinner BJ, Appleman DE (1963). "Melanophlogite, a cubic polymorph of silica" (PDF). Am. Mineral. 48: 854–867.
- ^ Nakagawa T.; Kihara K.; Harada K. (2001). "The crystal structure of low melanophlogite". American Mineralogist. 86 (11–12): 1506. Bibcode:2001AmMin..86.1506N. doi:10.2138/am-2001-11-1219. S2CID 53525827.
- ^ Rosemarie Szostak (1998). Molecular sieves: Principles of Synthesis and Identification. Springer. ISBN 978-0-7514-0480-7.
- ^ Weiss, Alarich; Weiss, Armin (1954). "Über Siliciumchalkogenide. VI. Zur Kenntnis der faserigen Siliciumdioxyd-Modifikation". Zeitschrift für Anorganische und Allgemeine Chemie. 276 (1–2): 95–112. doi:10.1002/zaac.19542760110.
- ^ Björkman, T; Kurasch, S; Lehtinen, O; Kotakoski, J; Yazyev, O. V.; Srivastava, A; Skakalova, V; Smet, J. H.; Kaiser, U; Krasheninnikov, A. V. (2013). "Defects in bilayer silica and graphene: common trends in diverse hexagonal two-dimensional systems". Scientific Reports. 3: 3482. Bibcode:2013NatSR...3E3482B. doi:10.1038/srep03482. PMC 3863822. PMID 24336488.
- ^ Johnston CJ, Driscoll KE, Finkelstein JN, et al. (2000). "Pulmonary Chemokine and Mutagenic Responses in Rats after Subchronic Inhalation of Amorphous and Crystalline Silica". Toxicol. Sci. 56 (2): 405–413. doi:10.1093/toxsci/56.2.405. PMID 10911000.
- ^ Lewis, Grace Ross (1999). 1001 chemicals in everyday products (2nd ed.). John Wiley & Sons (Wiley-Interscience). pp. 250–1. ISBN 0-471-29212-5 – via Internet Archive.
وصلات خارجية
 Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية (eleventh ed.). Cambridge University Press.
Chisholm, Hugh, ed. (1911). . دائرة المعارف البريطانية (eleventh ed.). Cambridge University Press. {{cite encyclopedia}}: Cite has empty unknown parameter:|coauthors=(help)- Tridymite, بطاقة السلامة الكيميائية العالمية 0807
- Quartz, بطاقة السلامة الكيميائية العالمية 0808
- Cristobalite, بطاقة السلامة الكيميائية العالمية 0809
- amorphous, NIOSH Pocket Guide to Chemical Hazards
- crystalline, as respirable dust, NIOSH Pocket Guide to Chemical Hazards
- Formation of silicon oxide layers in the semiconductor industry. LPCVD and PECVD method in comparison. Stress prevention.
- Quartz SiO2 piezoelectric properties
- Silica (SiO2) and Water
- Epidemiological evidence on the carcinogenicity of silica: factors in scientific judgement by C. Soutar and others. Institute of Occupational Medicine Research Report TM/97/09
- Scientific opinion on the health effects of airborne silica by A Pilkington and others. Institute of Occupational Medicine Research Report TM/95/08
- The toxic effects of silica Archived 2016-04-15 at the Wayback Machine by A Seaton and others. Institute of Occupational Medicine Research Report TM/87/13
- Structure of precipitated silica
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- Articles containing إنگليزية-language text
- Pages using Lang-xx templates
- Articles with unsourced statements from October 2021
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from February 2022
- All articles lacking reliable references
- Articles lacking reliable references from February 2022
- Articles with unsourced statements from August 2020
- Articles with unsourced statements from July 2017
- مقالات بالمعرفة تحتاج توضيح from August 2019
- مقالات المعرفة المحتوية على معلومات من دائرة المعارف البريطانية طبعة 1911
- ثاني أكسيد السليكون
- مركبات السيليكون
- أكاسيد
- مواد سيراميكية
- مواد حرارية
- مسرطنات المجموعة 1 حسب تصنيف الوكالة الدولية لأبحاث السرطان
- مكونات زجاج الأكسيد الشائع
- سواغات












![{\displaystyle {\ce {Si(s) + 6HF(aq) -> [SiF6]^{2-}(aq) + 2H+(aq) + 2H2(g)}}}](https://www.marefa.org/api/rest_v1/media/math/render/svg/66ef925f22cf837dfded5fd4ddfe23d0f70442d1)
![{\displaystyle {\ce {Si(s) + 4NaOH(aq) -> [SiO4]^{4-}(aq) + 4Na+(aq) + 2H2(g)}}}](https://www.marefa.org/api/rest_v1/media/math/render/svg/4f4fc74863b69a7899f3f2c729fdef24f27d5f92)






