جسم مضاد
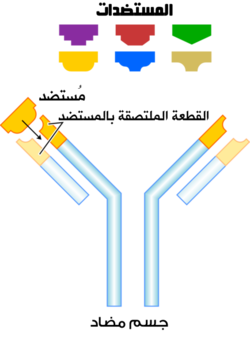
الجسم المضاد (antibody، اختصاراً Ab)، يُعرف أيضاً بالگلوبولين المناعي (immunoglobulin، اختصاراً Ig)،[1] هو بروتين كبير على شكل حرف Y يتم إنتاجه بشكل أساسي بواسطة خلايا البلازما التي يستخدمها الجهاز المناعي لتحييد الممراض مثل الجرثومة الممرضة والفيروسات . يتعرف الجسم المضاد على جزيء فريد للممرض ، يسمى مستضد ، عبر المنطقة المتغيرة المرتبطة بالمستضد (Fab).[2][3] كل طرف "Y" من الأجسام المضادة يحتوي على مستوقع (مشابه لقفل) التي هي محددة لواحدة بعينها حاتمة (مشابه إلى مفتاح) على مستضد، مما يسمح هذين الهيكلين للربط معا بدقة. باستخدام آلية الربط هذه ، يمكن للجسم المضاد وضع علامة على ميكروب أو خلية مصابة للهجوم من قبل أجزاء أخرى من الجهاز المناعي ، أو يمكن تحييد هدفه مباشرة (على سبيل المثال ، عن طريق تثبيط جزء من الميكروب ضروري لغزوها وبقائها ). اعتمادًا على المستضد ، قد يعيق الارتباط العملية البيولوجية المسببة للمرض أو قد ينشط الخلايا البلعمية لتدمير المادة الغريبة. يتم التحكم في قدرة الجسم المضاد على التواصل مع المكونات الأخرى للجهاز المناعي عبر منطقة Fc الخاصة به (الموجودة في قاعدة "Y") ، والتي تحتوي على موقع گلكزة محفوظ متضمن في هذه التفاعلات.[4] إن إنتاج الأجسام المضادة هو الوظيفة الرئيسية لجهاز المناعة الخلطية .[5]
يتم إفراز الأجسام المضادة بواسطة الخلايا البائية في جهاز المناعة التكيفي ، ومعظمها خلايا بائية متباينة تسمى خلايا البلازما . يمكن أن تحدث الأجسام المضادة في شكلين ماديين ، شكل قابل للذوبان يتم إفرازه من الخلية ليصبح حراً في پلازما الدم ، وشكلًا مرتبطًا بالغشاء مرتبط بسطح خلية بائية ويشار إليه باسم مستقبل الخلية البائية (BCR). تم العثور على BCR فقط على سطح الخلايا البائية ويسهل تنشيط هذه الخلايا وتمايزها اللاحق إما في مصانع الأجسام المضادة تسمى خلايا البلازما أو خلايا الذاكرة البائية التي ستبقى في الجسم وتذكر نفس المستضد حتى تتمكن الخلايا البائية من الاستجابة أسرع عند التعرض في المستقبل..[6] في معظم الحالات ، يكون تفاعل الخلية البائية مع الخلية التائية المساعدة ضروريًا للتنشيط الكامل للخلية البائية ، وبالتالي ، توليد الأجسام المضادة بعد ارتباط المستضد [7] يتم إطلاق الأجسام المضادة القابلة للذوبان في الدم وسوائل الأنسجة ، بالإضافة إلى العديد من الإفرازات لمواصلة الاستطلاع بحثًا عن غزو الكائنات الدقيقة
لأجسام المضادة هي بروتينات سكرية تنتمي إلى عائلة الگلوبولين المناعي الفائقة .[4] وهي تشكل معظم جزء جاما گلوبولين من بروتينات الدم . وتكون عادة مصنوعة من وحدات هيكلية أساسية مع اثنين سلاسل ثقيلة كبيرة واثنين سلاسل خفيفة صغيرة . هناك عدة أنواع مختلفة من السلاسل الثقيلة للأجسام المضادة التي تحدد الأنواع الخمسة المختلفة للأجزاء المتبلورة (Fc) التي يمكن إرفاقها بأجزاء ربط المستضد. تسمح الأنواع الخمسة المختلفة من مناطق Fc بتجميع الأجسام المضادة في خمسة انماط إسوية . كل منطقة Fc من نوع معين من أجسام مضادة معينة قادرة على الارتباط بمستقبل Fc المحدد (FcR) ، باستثناء IgD (الگلوبولين المناعي دي) ، وهو في الأساس BCR ، مما يسمح لمركب الجسم المضاد-المستضد بالتحكم في أدوار مختلفة اعتمادًا على FcR الذي يربطه. يتم تعديل قدرة الجسم المضاد على الارتباط بـ FcR المقابل له من خلال هيكل الغليكان الموجود في المواقع المحفوظة داخل منطقة Fc.[4] تساعد قدرة الأجسام المضادة على الارتباط بـ FcRs في توجيه الاستجابة المناعية المناسبة لكل نوع مختلف من الأجسام الغريبة التي تصادفها .[8] على سبيل المثال ، گلوبيولين مناعي هـ مسؤول عن الاستجابة الأرجية يتكون من تحلل الخلايا الصارية وإفراز الهيستامين . يرتبط مستوقع جزء ارتباط بالمستضد للگلوبيولين مناعي هـ بمستضد الأرجية ، على سبيل المثال جزيئات عث غبار المنزل ، بينما ترتبط منطقة Fc بمستقبل Fc ε. يتفاعل المستأرج- گلوبيولين مناعي ه -FcRε مع تنبيغ إشارة الحساسية (الأرجية) لتحفيز حالات مثل الربو.[9]
على الرغم من أن البنية العامة لجميع الأجسام المضادة متشابهة جدًا ، إلا أن منطقة صغيرة في طرف البروتين متغيرة للغاية ، مما يسمح بملايين الأجسام المضادة ذات هياكل طرف مختلفة قليلاً ، أو مواقع ربط المسضد. تُعرف هذه المنطقة بالمنطقة شديدة التغير . يمكن لكل من هذه المتغيرات الارتباط بمستضد مختلف.[2] هذا التنوع الهائل من مستوقعات الأجسام المضادة على اجزاء ربط المستضد يسمح للجهاز المناعي بالتعرف على مجموعة واسعة ومتساوية من المستضدات..[1] يتم إنشاء عدد كبير ومتنوع من مستوقعات الأجسام المضادة من خلال أحداث إعادة التركيب العشوائية لمجموعة من شرائح الجينات التي ترمز إلى مواقع ربط مستضدات مختلفة (أو مستوقعات ) ، تليها طفرات عشوائية في هذه المنطقة من جين الأجسام المضادة ، والتي تخلق المزيد من التنوع.[8][10] تسمى هذه العملية التأشبية التي تنتج تنوع مستوقع الأجسام المضادة المستنسخة بإعادة التركيب V (D) J أو VJ. يكون مستوقع الأجسام المضادة متعدد الجينات ، ويتكون من ثلاثة جينات ، V و D و J. كل موضع مستوقع هو أيضًا متعدد الأشكال ، بحيث يتم اختيار أليل V ، واحد من D ، وواحد من J أثناء إنتاج الأجسام المضادة. ثم يتم ضم هذه الأجزاء الجينية معًا باستخدام إعادة التأشب الجيني العشوائي لإنتاج المستوقع. المناطق التي يتم فيها إعادة تجميع الجينات بشكل عشوائي معًا هي المنطقة شديدة التغير المستخدمة في التعرف على المستضدات المختلفة على أساس استنساخ. .
كما يتم إعادة تنظيم جينات الأجسام المضادة في عملية تسمى التبديل الطبقي الذي يغير نوع واحد من أجزاء Fc ذات السلسلة الثقيلة إلى نوع آخر ، مما يخلق نمطًا إسوياً مختلفًا للجسم المضاد الذي يحتفظ بالمنطقة المتغيرة الخاصة بالمستضد. وهذا يسمح باستخدام الأجسام المضادة الفردية من قبل أنواع مختلفة من مستقبلات Fc ، والتي يتم التعبير عنها في أجزاء مختلفة من الجهاز المناعي
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
أول استخدام لمصطلح "الأجسام المضادة" حدث في نص پول إرليخ . يظهر مصطلح Antikörper (الكلمة الألمانية للجسم المضاد ) في ختام مقاله "دراسات تجريبية على المناعة" ، الذي نشر في أكتوبر 1891 ، والذي ينص على أنه "إذا أدت مادتان إلى نشوء جسمين مضادين مختلفين ، فيجب أن تكون هي نفسها مختلفة ".[11] ومع ذلك ، لم يتم قبول المصطلح على الفور وتم اقتراح العديد من المصطلحات الأخرى للأجسام المضادة ؛ وشملت هذه الجسم المناعي، المستقبلي، الجسم الوسيط، حساسيّة المادة، الرابط، ديزمون، فيلوسيتاز، المصلح، وImmunisin .[11] تحتوي كلمة الجسم المضاد على تشابه رسمي مع كلمة مضاد الذيفان ومفهوم مشابه لـ Immunkörper ( الجسم المناعي باللغة الإنجليزية) .[11] على هذا النحو ، يحتوي البناء الأصلي للكلمة على خلل منطقي ؛ مضاد السموم(مضاد الذيفان) هو شيء موجه ضد السم ، بينما الجسم المضاد هو جسم موجه ضد شيء ما .[11]

بدأت دراسة الأجسام المضادة في عام 1890 عندما وصف كيتاساتو شيباسابورو نشاط الأجسام المضادة ضد الخناق وذيفان الكزاز. طرح كيتاساتو نظرية المناعة الخلطية ، مقترحًا أن الوسيط في المصل يمكن أن يتفاعل مع مستضد غريب.[15][16] دفعت فكرته بول إرليتش إلى اقتراح نظرية السلسلة الجانبية لتفاعل الأجسام المضادة والمستضدات في عام 1897 ، عندما افترض أن المستقبلات (الموصوفة بـ "السلاسل الجانبية") على سطح الخلايا يمكن أن ترتبط بشكل خاص بالذيفان - في "قفل" والمفتاح "التفاعل - وأن رد الفعل هذا هو الدافع لإنتاج الأجسام المضادة.[17] يعتقد باحثون آخرون أن الأجسام المضادة موجودة بحرية في الدم ، وفي عام 1904 ، اقترح ألمروث رايت أن الأجسام المضادة القابلة للذوبان مغلفة بالبكتيريا لتمييزها عن البلعمة والقتل. عملية أطلق عليها اسم الطهاية.[18]
في عشرينيات القرن العشرين ، لاحظ مايكل هايدلبرغر و اوزوالد أڤري أن المستضدات يمكن أن تتسبب فيها الأجسام المضادة واستمر في إظهار أن الأجسام المضادة مصنوعة من البروتين .[19] تم فحص الخصائص البيوكيميائية لتفاعلات للجسم المضاد- المستضد بمزيد من التفصيل في أواخر الثلاثينيات من قبل جون ماراك .[20] كان التقدم الرئيسي التالي في أربعينيات القرن العشرين ، عندما أكد لاينس پولنگ نظرية القفل والمفتاح التي اقترحها إيرليك من خلال إظهار أن التفاعلات بين الأجسام المضادة والمستضدات تعتمد على شكلها أكثر من تكوينها الكيميائي .[21] في عام 1948 ، اكتشف أستريد فاجريوس أن الخلايا البائية ، في شكل خلايا البلازما ، كانت مسؤولة عن توليد الأجسام المضادة. .[22]
ويركز العمل الإضافي على توصيف هياكل بروتينات الأجسام المضادة. كان التقدم الرئيسي في هذه الدراسات الهيكلية هو اكتشاف في أوائل الستينيات من قبل جرالد إدلمان وجوزيف جالي السلسلة الخفيفة للجسم المضاد ,[23] وإدراكهم أن هذا البروتين هو نفس بروتين بنس جونز الذي وصفه هنري بنس جونز عام 1845.[24] ذهب إدلمان لاكتشاف ان الأجسام المضادة تتكون من الرابطة ثنائي السلفيد -موصلة بالسلاسل الثقيلة و الخفيفة. في نفس الوقت تقريبًا ، اتسمت مناطق ربط الأجسام المضادة (Fab) وذيل الأجسام المضادة (Fc) لـ IgG بـ رودني بورتر .[25] استخلص هؤلاء العلماء معًا هيكل وتسلسل الأحماض الأمينية الكامل لـ الگلوبولين المناعي ج ، وهو إنجاز حصلوا عليه بشكل مشترك جائزة نوبل في الفيسيولوجيا أو الطب عام 1972 .[25] تم تحضير جزء Fv وتميز به ديفيد جيفول .[26] بينما ركزت معظم هذه الدراسات المبكرة على الگلوبولين المناعي إم و الگلوبولين المناعي ج ، تم تحديد أنماط إسوية اخري من الغلوبولين المناعي في الستينيات: اكتشف توماس توماسي الأجسام المضادة الإفرازية ( الگلوبولين المناعي أ ) ;[27] اكتشف ديفيد س. رو وجون ل. فاهي الگلوبولين المناعي دي ;[28] اكتشف كيميشيجي اشيزاكا و تيركو ايشيزاكا الگلوبولين المناعي هـ وأظهروا أنه فئة من الأجسام المضادة المشاركة في تفاعلات الحساسية .[29] في سلسلة تاريخية من التجارب التي بدأت في عام 1976 ، أظهر سوسومو تونگاوا أن المادة الوراثية يمكنها إعادة ترتيب نفسها لتشكيل مجموعة واسعة من الأجسام المضادة المتاحة .[30]
الأشكال
قد يسمى الشكل المرتبط بغشاء الجسم المضاد بالگلوبيولين المناعي السطحي (sIg) أو الگلوبولين المناعي الغشائي (mIg). وهو جزء من مستقبل الخلية البائية (BCR) ، والذي يسمح للخلية البائية بالكشف عن وجود مستضد معين في الجسم ويحفز تنشيط الخلية البائية.[7] تتألف ال BCR من الأجسام المضادة (گلوبولين المناعي دي) أو(گلوبولين المناعي إم) المرتبطة بالسطح و المتغايرة گلوبولين المناعي-الفا و گلوبولين المناعي-بيتا المرتبطين ، والذين يكونوا قادرين على تحويل الإشارة .[31] سيكون للخلية البائية البشرية النموذجية ما بين 50000 إلى 100000 جسم مضاد مرتبط بسطحها.[31] عند ارتباط المستضد ، فإنها تتجمع في بقع كبيرة ، يمكن أن يتجاوز قطرها ميكرومتر واحد ، على أطواف دهنية تعزل مستقبلات الخلية البائية من معظم مستقبلات إشارات الخلية الأخرى.[31] قد تحسن هذه البقع كفاءة الاستجابة المناعية الخلوية .[32] في البشر ، يكون سطح الخلية مكشوفًا حول مستقبلات الخلايا البائية لعدة مئات من النانومتر,[31] مما يعزل مستقبلات الخلية البائية عن التأثيرات المتنافسة .
تداخلات الجسم المضاد-المستضد
يتفاعل مستوقع الجسم المضاد مع حاتمة المستضد. عادة ما يحتوي المستضد على حواتم مختلفة على طول سطحه مرتبة بشكل متقطع ، وتسمى الحواتم السائدة على مستضد معين المحددات.
يتفاعل الجسم المضاد والمستضد من خلال التكامل المكاني (القفل والمفتاح). القوى الجزيئية المشاركة في تفاعل منطقة ربط الاجسام المضادة-الحاتمة ضعيفة وغير محددة - على سبيل المثال القوى الكهروستاتيكية والروابط الهيدروجينية والتفاعلات الكارهة للماء قوى فان دير فالس . وهذا يعني أن الارتباط بين الجسم المضاد والمستضد قابل للعكس ، وأن تقارب الجسم المضاد تجاه مستضد نسبي وليس مطلقًا. يعني الارتباط الضعيف نسبيًا أيضًا أنه من الممكن أن يتفاعل الجسم المضاد مع مستضدات مختلفة من تقارب نسبي مختلف.
في كثير من الأحيان ، بمجرد ارتباط الجسم المضاد والمستضد ، يصبحان معقدًا مناعيًا ، يعمل ككائن وحدوي ويمكن أن يعمل كمستضد في حد ذاته ، يتم التصدي له بواسطة الأجسام المضادة الأخرى. وبالمثل ، فإن الناشبات هي جزيئات صغيرة لا تثير أي استجابة مناعية من تلقاء نفسها ، ولكن بمجرد ارتباطها بالبروتينات ، فإن المعقد الناتج أو ناقل الناشبة الناتج يكون مستضدًا.
الأنماط الإسوية
يمكن أن تأتي الأجسام المضادة بأصناف مختلفة تُعرف بالانماط الإسوية أو الفئات. في الثدييات الحقيقية ، هناك خمسة أنماط إسوية من الأجسام المضادة تعرف باسم گلوبولين المناعي أ و گلوبولين المناعي دي و گلوبولين المناعي هـ و گلوبولين المناعي جي و گلوبولين المناعي إم. يتم تسمية كل منها ببادئة "Ig" والتي ترمز إلى الگلوبولين المناعي (اسم يستخدم أحيانًا بالتبادل مع الأجسام المضادة) وتختلف في خصائصها البيولوجية ومواقعها الوظيفية وقدرتها على التعامل مع مستضدات مختلفة ، كما هو موضح في الجدول[33] تشير اللواحق المختلفة للنماذج الإسوية للجسم المضاد إلى الأنواع المختلفة من السلاسل الثقيلة التي يحتويها الجسم المضاد ، مع كل فئة سلسلة ثقيلة تسمى أبجديًا: α (ألفا) و γ (جاما) و δ (دلتا) و ε (إبسيلون) و μ (ميو ). وهذا يؤدي إلى IgA(گلوبولين المناعي أ ) و IgG(گلوبولين المناعي جي) و IgD (گلوبولين المناعي دي)و IgE (گلوبولين المناعي هـ)و IgM(گلوبولين المناعي إم) على التوالي .
| الإسم | الأنواع | الوصف | مجمعات الأجسام المضادة |
| IgA | 2 | يوجد في مناطق الأغشية المخاطية مثلاً في الأمعاء، في المجاري التنفسية والمجارية البولية، وتحمي هذه المناطق من الإستعمار من قِبل المكروبات.[34] | 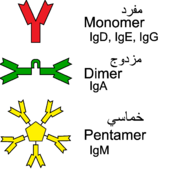
|
| IgD | 1 | يعمل بصورة أساسية كمستقبل مستضدات على سطح الخلايا البائية.[35] وظيفته معروفة بصورة أقل من الأنواع الأخرى. | |
| IgE | 1 | يرتبط بمثيري الحساسية allergens ويحفز إطلاق الهستامين histamine من خلايا الصارية mast cells، وله دور في الحساسية. أيضاً يحمي ضد الديدان الطفيلية.[36] | |
| IgG | 4 | بأشكاله الأربع، يوفر أغلبية المناعة المبنية على الأجسام المضادة ضد الميكروبات الغازية.[36] | |
| IgM | 1 | متواجد على سطح الخلايا البائية ويتم إفرازه بطمع avidity عالي جداً. يقضي على الميكروبات في بداياتهم في المناعة المتوسطة للخلايا البائية قبل أن يكون هناك IgG بما فيه الكفاية.[36][35] |
يتغير الشكل الإسوي للجسم المضاد للخلايا البائية أثناء تطوير الخلية وتنشيطها. تعبر الخلايا البائية غير الناضجة ، التي لم تتعرض أبدًا لمستضد ، عن النمط الإسوي IgM في شكل مرتبط بسطح الخلية. تُعرف الخلايا الليمفاوية البائية ، في هذا الشكل الجاهز للاستجابة ، باسم "الخلايا الليمفاوية البائية الساذجة". تعبر اللمفاويات البائية الساذجة عن كل من IgM السطحي و IgD. إن التعبير المشترك لكلا النوعين من الاشكال الإسوية للگلوبولين المناعي يجعل الخلية البائية جاهزة للاستجابة للمستضد.[37] نشيط الخلايا البائية يتبع مشاركة الأجسام المضادة جزيء خلايا المربوطة مع مستضد، مما يسبب الخلية إلى الانقسام والتمايز لإنتاج الأجسام المضادة تسمى خلية البلازما . في هذا الشكل المنشط، تبدأ الخلية البائية لإنتاج الأجسام المضادة في شكل افرازات بدلا من شكل مرتبط بالغشاء. تخضع بعض الخلايا الفرعية للخلايا البائية المنشَّطة للتبديل النظائري ، وهي آلية تتسبب في تغير إنتاج الأجسام المضادة من IgM أو IgD إلى الأنماط الإسوية للجسم المضاد الأخرى ، IgE أو IgA أو IgG ، والتي لها أدوار محددة في جهاز المناعة
| الفئة | النوع | الوصف |
|---|---|---|
| IgY | وجد في الطيور والزواحف مرتبط ب IgG الخاص بالثدييات.[38] | |
| IgW | وجد في أسماك القرش والزلاجات مرتبط ب IgD الخاص بالثدييات.[39] |
البُنية
الأجسام المضادة ثقيلة (~ 150 كيلو دالتون ) بروتينات البلازما الكروية . يبلغ حجم جزيء الجسم المضاد حوالي 10 نانومتر .[40] لديهم سلاسل السكر (الغليكان) المضافة إلى بقايا الأحماض الأمينية المحفوظة. .[4][41] بعبارة أخرى ، الأجسام المضادة هي بروتينات سكرية .[4] يعتبر الغليكان المرفق ذو أهمية حاسمة في بنية ووظيفة الجسم المضاد .[4] من بين أمور أخرى ، يمكن للغليكانات المعدلة تعديل تقارب الجسم المضاد لـ FcR)s) المطابق.[4]
الوحدة الوظيفية الأساسية لكل جسم مضاد هي مونومر گلوبيولين مناعي (Ig) (يحتوي على وحدة Ig واحدة فقط) ؛ يمكن أيضًا أن تكون الأجسام المضادة المفرزة ثنائية الأبعاد بوحدتي Ig كما هو الحال مع IgA أو رباعي الوحدات مع أربع وحدات Ig مثل الاسماك العظمية IgM أو خماسي مع خمس وحدات Ig ، مثل IgM للثدييات.[42]
الأجزاء المتغيرة من الجسم المضاد هي مناطق V الخاصة به ، والجزء الثابت هو منطقة C الخاصة به.
نطاقات الگلوبولين المناعي
مونومر Ig هو جزيء على شكل حرف "Y" يتكون من أربع سلاسل پپتيد. سلسلتين ثقيلتان متطابقتان وسلسلتين خفيفتين متطابقتان متصلة بواسطة الروابط ثنائية الكبريتيد .[33] تتكون كل سلسلة من نطاقات هيكلية تسمى نطاقات الگلوبيولين المناعي . تحتوي هذه المجالات على حوالي 70-110 من الأحماض الأمينية ويتم تصنيفها إلى فئات مختلفة (على سبيل المثال ، متغير أو IgV وثابت أو IgC) وفقًا لحجمها ووظيفتها .[43] لديهم طية مميزة من الگلوبيولين المناعي حيث تقوم صحيفتا بيتا بإنشاء شكل "ساندويتش" ، يتم تثبيتهما معًا من خلال التفاعلات بين السيستئين المحفوظة والأحماض الأمينية المشحونة الأخرى.
السلسلة الثقيلة
هناك خمسة أنواع من السلاسل الثقيلة المناعية للثدييات يشار إليها بالحروف اليونانية : α و δ و ε و γ و μ . .[2] تحدد نوع السلسلة الثقيلة الموجودة فئة الأجسام المضادة ؛ تم العثور على هذه السلاسل في الأجسام المضادة IgA و IgD و IgE و IgG و IgM على التوالي .[1][44] تختلف السلاسل الثقيلة المميزة في الحجم والتكوين ؛ يحتوي α و γ تقريبا على ما يقرب من 450 من الأحماض الأمينية ، بينما يحتوي μ و ε تقريبا على ما يقرب من 550 من الأحماض الأمينية.[2]
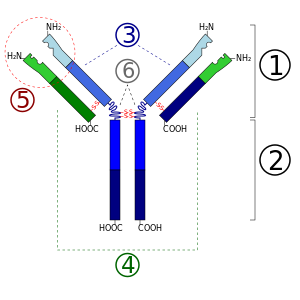
- منطقة ارتباط المستضد
- منطقة الجزء المتبلور
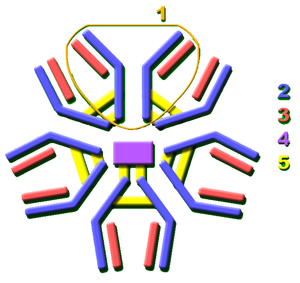
- Heavy chain (أزرق) مع واحدة متغيرة (VH) نطاق متبوع بثابتة (CH1), منطقة المفصل, و اتنين اخريين ثابتتين (CH2 and CH3) نطاقات
- Light chain (أخضر) مع واحدة متغيرة وواحدة ثابتة (VL) (CL) نطاق
- Antigen binding site (مستوقع)
- مناطق المفصل
في الثدييات هناك نوعان من السلاسل الخفيفة للگلوبولين المناعي ، والتي تسمى لامدا (λ) وكابا (κ) ).[2] تحتوي السلسلة الخفيفة على نطاقين متتاليين: نطاق ثابت واحد ونطاق متغير واحد. الطول التقريبي للسلسلة الخفيفة هو 211 إلى 217 حمضًا أمينيًا .[2] يحتوي كل جسم مضاد على سلسلتين خفيفتين متطابقتين دائمًا ؛ يوجد نوع واحد فقط من السلسلة الخفيفة ، κ أو λ ، لكل جسم مضاد في الثدييات. توجد أنواع أخرى من السلاسل الخفيفة ، مثل سلسلة أيوتا (ι) ، في الفقاريات الأخرى مثل أسماك القرش ( أسماك غضروفية ) والأسماك العظمية ( مكتملات العظام )
المنطقة CDRs، Fv، Fab ،Fc
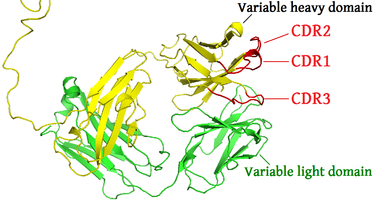
الأجزاء المختلفة من الجسم المضاد لها وظائف مختلفة. على وجه التحديد ، تحتوي "الأذرع" (وهي متطابقة بشكل عام) على مواقع يمكنها الارتباط بجزيئات محددة ، مما يتيح التعرف على مستضدات معينة. تسمى هذه المنطقة من الجسم المضاد منطقة Fab (جزء ، ربط المسضد) . وتتكون من نطاق واحد ثابت ومتغير واحد من كل سلسلة ثقيلة وخفيفة من الجسم المضاد.[45] يتم تشكيل المستوقع في الطرف الطرفي الأميني من مونومر الأجسام المضادة بواسطة النطاقات المتغيرة من السلاسل الثقيلة والخفيفة. يُشار إلى النطاق المتغير أيضًا باسم منطقة F V وهو أهم منطقة لارتباط المستضدات. لكي تكون محددة ومتغيرة من حلقات شرائط-بيتا ، كل منها على السلاسل الخفيفة (V L ) والثقيلة (V H ) هي المسؤولة عن الارتباط بالمستضد. يشار إلى هذه الحلقات باسم مناطق تحديد التكامل (CDRs). تم تجميع وتصنيف هياكل CDRs هذه بواسطة كوثيا واخرون..[46] ومؤخرا من قبل نورث واخرون. .[47] ونيكولوديس وآخرون .[48] في إطار نظرية الشبكة المناعية ، تسمى CDRs أيضًا الأنماط الذاتية وفقًا لنظرية الشبكة المناعية ، يتم تنظيم نظام المناعة التكيفي من خلال التفاعلات بين الأنماط الذاتية .
تلعب قاعدة Y دورًا في تعديل نشاط الخلايا المناعية. تسمى هذه المنطقة منطقة Fc (جزء ، متبلور) ، وتتكون من سلسلتين ثقيلتين تساهمان في نطاقين أو ثلاثة نطاقات ثابتة اعتمادًا على فئة الجسم المضاد .[2] وبالتالي ، فإن منطقة Fc تضمن أن كل جسم مضاد يولد استجابة مناعية مناسبة لمستضد معين ، من خلال الارتباط بفئة معينة من مستقبلات Fc ، وجزيئات مناعية أخرى ، مثل البروتينات التكميلية . وبذلك، فإنه يتحكم في التأثيرات الفسيولوجية المختلفة، بما في ذلك التعرف علي الجسيمات المستطهية (مرتبطة بFcγR)، تحلل الخلايا (مرتبطة بمكمل)، و زوال الحبيبات من الخلايا الصارية ، الخلايا القاعدية ، و الخلايا الحمضية (مرتبطة بFcεR).[33][49]
باختصار ، تحدد منطقة Fab الخاصة بالجسم المضاد خصوصية المستضد بينما تحدد منطقة Fc للجسم المضاد تأثير فئة الجسم المضاد. بما أن النطاقات الثابتة للسلاسل الثقيلة فقط تشكل منطقة Fc لجسم مضاد ، فإن فئات السلسلة الثقيلة في الأجسام المضادة تحدد آثارها الطبقية. تشمل الفئات المحتملة من السلاسل الثقيلة في الأجسام المضادة ألفا وغاما ودلتا وإبسيلون وميو ، وهي تحدد الأنماط الإيسوية للجسم المضاد IgA و G و D و E و M ، على التوالي. هذا يعني أن النظائر الإيسوية للأجسام المضادة لها تأثيرات فئة مختلفة بسبب مناطق Fc المختلفة المرتبطة بها وتنشيط أنواع مختلفة من المستقبلات. تشمل التأثيرات الطبقية المحتملة للأجسام المضادة: الطهاية ، التلازن ، انحلال الدم ، التنشيط التكميلي ، تحلل الخلايا الصارية، وإبطال مفعولها (على الرغم من أن هذا التأثير الطبقي قد يتم بوساطة منطقة Fab بدلاً من منطقة Fc). وهذا يعني أيضًا أن التأثيرات بوساطة Fab موجهة نحو الميكروبات أو السموم ، في حين يتم توجيه التأثيرات بوساطة Fc إلى الخلايا المستفعلة أو جزيئات المستفعل(انظر أدناه).
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الوظيفة
تشمل الفئات الرئيسية لعمل الأجسام المضادة ما يلي:
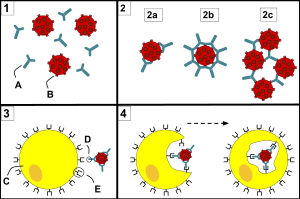
- تحييد ، حيث تحظر الأجسام المضادة المعادلة أجزاء من سطح الخلية البكتيرية أو الفيرون لجعل هجومها غير فعال
- التلازن ، حيث تقوم الأجسام المضادة "بلصقها معًا" الخلايا الغريبة في كتل تكون أهدافًا جذابة للبلعمة
- الترسيب ، حيث تقوم الأجسام المضادة "بالالتصاق معًا" في المستضدات غير القابلة للذوبان في المصل ، مما يجبرها على التعجيل بالخروج من المحلول في كتل تعتبر أهدافًا جذابة للبلعمة
- تنشيط المكمل (التثبيت) ، حيث تشجع الأجسام المضادة التي يتم تثبيتها على خلية غريبة على تكملة مهاجمتها بمعقدة مهاجمة الغشاء ، مما يؤدي إلى ما يلي:
تتمايز الخلايا البائية المنشّطة إما إلى خلايا منتجة للأجسام المضادة تسمى خلايا البلازما التي تفرز الأجسام المضادة القابلة للذوبان أو خلايا الذاكرة التي تبقى في الجسم لسنوات بعد ذلك من أجل السماح للجهاز المناعي بتذكر المستضد والاستجابة بشكل أسرع عند التعرض في المستقبل. .[6]
في مراحل الحياة قبل الولادة وحديثي الولادة ، يتم توفير الأجسام المضادة عن طريق المناعة السلبية من الأم. يختلف إنتاج الأجسام المضادة الداخلية المبكرة باختلاف أنواع الأجسام المضادة ، وعادة ما يظهر خلال السنوات الأولى من الحياة. بما أن الأجسام المضادة موجودة بحرية في مجرى الدم ، يقال إنها جزء من جهاز المناعة الخلطية. يتم إنتاج الأجسام المضادة المتداولة بواسطة خلايا بيتا النسيلية التي تستجيب بشكل خاص لمستضد واحد فقط (مثال على ذلك هو جزء من بروتين كبسولة الفيروس). تساهم الأجسام المضادة في الحصانة بثلاث طرق: تمنع مسببات الأمراض من دخول الخلايا أو إتلافها عن طريق الارتباط بها ؛ أنها تحفز إزالة مسببات الأمراض عن طريق الخلايا البلعمية والخلايا الأخرى عن طريق تغطية العامل الممرض ؛ وتؤدي إلى تدمير مسببات الأمراض عن طريق تحفيز الاستجابات المناعية الأخرى مثل المسار التكميلي(المتممة) .[50] ستؤدي الأجسام المضادة أيضًا إلى تحلل الأمين الوعائي الفعال للمساهمة في المناعة ضد أنواع معينة من المستضدات (الديدان ، مسببات الحساسية) .
تنشيط المكملات
الأجسام المضادة التي ترتبط بالمستضدات السطحية (على سبيل المثال ، على البكتيريا) سوف تجذب المكون الأول من سلسلة المتممة مع منطقة Fc الخاصة بها وتبدأ في تنشيط نظام المكمل(المتمم) "الكلاسيكي"..[50] هذا يؤدي إلى قتل البكتيريا بطريقتين .[5] أولاً ، يمثل ارتباط الجسم المضاد والجزيئات التكميلية علامة على الميكروب لابتلاع بواسطة الخلايا البلعمية في عملية تسمى الطهاية ؛ تنجذب هذه الخلايا البلعمية بواسطة جزيئات مكملة معينة ولدت في سلسلة التكميلية (المتممة). ثانيًا ، تشكل بعض مكونات النظام المكمل معقد مهاجمة الغشاء لمساعدة الأجسام المضادة على قتل البكتيريا مباشرة (التحلل البكتيري).[51]
تنشيط الخلايا المستجيبة
لمكافحة مسببات الأمراض التي تتكاثر خارج الخلايا ، ترتبط الأجسام المضادة بمسببات الأمراض لربطها معًا ، مما يؤدي إلى تراصها . بما أن الجسم المضاد يحتوي على ما لا يقل عن اثنين من المستوقعات ، فإنه يمكن أن يربط أكثر من مستضد واحد عن طريق ربط الحاتمات المماثلة التي تحمل على أسطح هذه المستضدات. من خلالتغطية العامل الممرض ، تحفز الأجسام المضادة وظائف المستجيب ضد العامل الممرض في الخلايا التي تتعرف على منطقة Fc.[5]
هذه الخلايا التي تتعرف على مسببات الأمراض المغلفة(المغطاة) لها مستقبلات Fc ، والتي ، كما يوحي الاسم ، تتفاعل مع منطقة Fc من الأجسام المضادة IgA و IgG و IgE. يؤدي إشراك جسم مضاد معين مع مستقبل Fc على خلية معينة إلى تشغيل وظيفة المستجيب لتلك الخلية ؛ سوف تقوم الخلايا البلعمية بالبلعمة والخلايا الصارية والعدلات بزوال حبيباتها ، وستطلق الخلايا القاتلة الطبيعية السيتوكينات والجزيئات السامة للخلايا ؛ التي ستؤدي في النهاية إلى تدمير الميكروب الغازي. يؤدي تنشيط الخلايا القاتلة الطبيعية بواسطة الأجسام المضادة إلى بدء آلية سمية للخلايا تعرف باسم السمية الخلية المعتمدة على الأجسام المضادة بوساطة الخلية (ADCC) - قد تفسر هذه العملية فعالية الاجسام المضادة وحيد النسيلة المستخدمة في العلاجات البيولوجية ضد السرطان . مستقبلات Fc هي خاصة بالنمط الإيسوي ، والتي تعطي مرونة أكبر لجهاز المناعة ، وتستدعي فقط آليات المناعة المناسبة لمسببات الأمراض المميزة.[2]
الأجسام المضادة الطبيعية
ينتج الإنسان والمقدمات العليا أيضًا "أجسامًا مضادة طبيعية" موجودة في مصل الدم قبل الإصابة الفيروسية. تم تعريف الأجسام المضادة الطبيعية على أنها الأجسام المضادة التي يتم إنتاجها دون أي عدوى سابقة أو التطعيم أو التعرض لمستضد خارجي غريب أو التمنيع السلبي . يمكن لهذه الأجسام المضادة تنشيط مسار المكمل الكلاسيكي الذي يؤدي إلى تحلل جزيئات الفيروس المغلفة قبل وقت طويل من تنشيط الاستجابة المناعية التكيفية. يتم توجيه العديد من الأجسام المضادة الطبيعية ضد الغالاكتوز (α (1،3 - الغالاكتوز (α-Gal) ، والذي يوجد كسكر نهائي على بروتينات سطح الخلية المگلكزة ، ويتم إنتاجه استجابةً لإنتاج هذا السكر بواسطة البكتيريا الموجودة في الأمعاء البشرية.[52] يُعتقد أن رفض الأعضاء الغريبة المزروعة هو ، جزئيًا ، نتيجة الأجسام المضادة الطبيعية المتداولة في مصل المستقبل المرتبط بمستضدات α-Gal المعبر عنها على الأنسجة المانحة .[53]
تنوع الگلوبولين المناعي
تقريبا جميع الميكروبات يمكن أن تؤدي إلى استجابة الأجسام المضادة. يتطلب التعرف على العديد من أنواع الميكروبات المختلفة والتخلص منها بنجاح التنوع بين الأجسام المضادة ؛ يختلف تكوين الأحماض الأمينية الخاصة بهم مما يسمح لهم بالتفاعل مع العديد من المستضدات المختلفة. .[54] تشير التقديرات إلى أن البشر يولدون حوالي 10 مليار من الأجسام المضادة المختلفة ، كل منها قادر على ربط حاتمة مميزة لمستضد. .[55] على الرغم من أن مجموعة كبيرة من الأجسام المضادة المختلفة يتم إنشاؤها في فرد واحد ، فإن عدد الجينات المتاحة لصنع هذه البروتينات محدود بحجم الجينوم البشري. تطورت العديد من الآليات الجينية المعقدة التي تسمح لخلايا الفقاريات البائية بتوليد مجموعة متنوعة من الأجسام المضادة من عدد صغير نسبيًا من جينات الأجسام المضادة.[56]
تغير النطاق
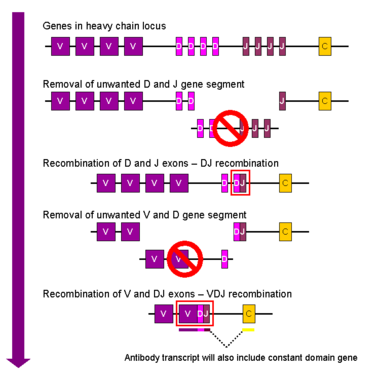
النطاق الكروموسومي الذي يشفر الجسم المضاد كبير ويحتوي على العديد من مواقع الجينات المميزة لكل نطاق من الأجسام المضادة - تم العثور على منطقة الكروموسوم التي تحتوي على جينات السلسلة الثقيلة ( IGH @ ) على الكروموسوم 14 ، والمكان الذي يحتوي على جينات سلسلة لامدا وكابا الخفيفة ( IGL @ و IGK @ ) في الكروموسومات 22 و 2 في البشر. يسمى أحد هذه النطاقات النطاق المتغير ، الموجود في كل سلسلة ثقيلة وخفيفة من كل جسم مضاد ، ولكن يمكن أن يختلف في الأجسام المضادة المختلفة المتولدة من الخلايا البائية المميزة. توجد الاختلافات بين النطاقات المتغيرة في ثلاث حلقات تعرف باسم المناطق شديدة التغير (HV-1 و HV-2 و HV-3) أو مناطق تحديد التكامل (CDR1 و CDR2 و CDR3). يتم دعم CDRs داخل النطاقات المتغيرة من خلال مناطق الإطار المحفوظة. يحتوي موضع السلسلة الثقيلة على حوالي 65 جينًا مختلفًا في مجال متغير تختلف جميعها في CDRs الخاص بها. يؤدي دمج هذه الجينات مع مجموعة من الجينات في نطاقات أخرى من الأجسام المضادة إلى توليد سلاح فرسان كبير من الأجسام المضادة بدرجة عالية من التباين. تسمى هذه التركيبة إعادة التركيب V (D) J الموضحة أدناه.[57]
إعادة تركيب V(D)J
التأشب الجسدي للگلوبيولين المناعي ، والمعروف أيضًا باسم إعادة التركيب V (D) J ، ينطوي على توليد منطقة متغيرة فريدة من الگلوبيولين المناعي. يتم تشفير المنطقة المتغيرة لكل سلسلة ثقيلة أو خفيفة من الگلوبيولين المناعي في عدة قطع - تُعرف باسم الأجزاء الجينية (الجينات الفرعية). تسمى هذه المقاطع مقاطع المتغير (V) والتنوع (D) والربط (J).[56] تم العثور على مقاطع V و D و J في سلاسل Ig الثقيلة ، ولكن تم العثور على مقاطع V و J فقط في سلاسل Ig الخفيفة . توجد نسخ متعددة من شرائح الجينات V و D و J ، ويتم ترتيبها جنبًا إلى جنب في جينومات الثدييات . في النخاع العظمي ، ستجمع كل خلية بائية نامية منطقة متغيرة من الگلوبولين المناعي عن طريق اختيار ودمج مقطع جيني واحد V و D و J واحد (أو V و J واحد في السلسلة الخفيفة). نظرًا لوجود نسخ متعددة من كل نوع من قطاعات الجينات ، ويمكن استخدام مجموعات مختلفة من شرائح الجينات لتوليد كل منطقة متغيرة من الگلوبولين المناعي ، فإن هذه العملية تولد عددًا كبيرًا من الأجسام المضادة ، لكل منها مستوقعات مختلفة ، وبالتالي خصائص مختلفة للمستضد..[8] إعادة ترتيب العديد من الجينات الفرعية (أي عائلة V2) للگلوبولين المناعي بسلسلة خفيفة لامدا يقترن بتنشيط microRNA miR-650 ، مما يؤثر بشكل أكبر على بيولوجيا الخلايا البائية.
تلعب بروتينات RAG (البروتينات لجينات المنشطة للتأشب) دورًا هامًا مع إعادة التركيب V (D) J في قطع الحمض النووي في منطقة معينة .[8] بدون وجود هذه البروتينات ، لن يحدث إعادة التركيب V (D) J..[8]
بعد أن تنتج خلية بيتا جينًا مناعيًا وظيفيا أثناء إعادة التركيب V (D) J ، لا يمكنها التعبير عن أي منطقة متغيرة أخرى (عملية تعرف باسم الاستبعاد الأليلي ) وبالتالي يمكن لكل خلية بيتا إنتاج أجسام مضادة تحتوي على نوع واحد فقط من سلسلة متغيرة .[2][58]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
فرط التطفر وألفة النضج
بعد التنشيط بالمستضد ، تبدأ خلايا بيتا في التكاثر بسرعة. في هذه الخلايا التي تنقسم بسرعة ، تخضع الجينات المشفرة للنطاقات المتغيرة للسلاسل الثقيلة والخفيفة لمعدل مرتفع من الطفرة النقطية ، عن طريق عملية تسمى طفرة جسدية (SHM). ينتج SHM تغيرًا واحدًا تقريبًا في نيوكليوتايد لكل جين متغير ، في انقسام الخلية.[10] ونتيجة لذلك ، ستكتسب أي خلايا وليدة اختلافات طفيفة في الأحماض الأمينية في المجالات المتغيرة لسلاسل الأجسام المضادة.
يعمل هذا على زيادة تنوع تجمع الأجسام المضادة ويؤثر على ألفة ارتباط المستضد بالجسم المضاد .[59]ستؤدي بعض الطفرات النقطية إلى إنتاج أجسام مضادة لها تفاعل أضعف (ألفة منخفضة) مع المستضد من الجسم المضاد الأصلي ، وستولد بعض الطفرات أجسامًا مضادة ذات تفاعل أقوى (ألفة عالية). .[60] ستتلقى الخلايا البائية التي تعبر عن أجسام مضادة عالية الألفة على سطحها إشارة بقاء قوية أثناء التفاعل مع الخلايا الأخرى ، في حين أن الخلايا ذات الأجسام المضادة ذات الألفة المنخفضة لن تتلقى ، وسوف تموت بسبب الاستموات .[60] وبالتالي ، فإن الخلايا البائية التي تعبر عن أجسام مضادة ذات ألفة أعلى للمستضد ستفوق تلك التي لديها ألفة أضعف للوظيفة والبقاء مما يسمح بزيادة متوسط تقارب الأجسام المضادة بمرور الوقت. تسمى عملية توليد الأجسام المضادة ذات الارتباطات المتزايدة نضج الألفة . يحدث نضج الألفة في خلايا بيتا الناضجة بعد إعادة التركيب V (D) J ، ويعتمد على مساعدة الخلايا التائية المساعدة.[61]
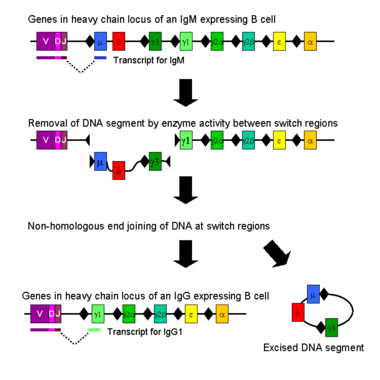
تبديل الفئة
النمط الإيسوي أو تبديل الفئة هو عملية بيولوجية تحدث بعد تنشيط الخلية بيتا ، والتي تسمح للخلية بإنتاج فئات مختلفة من الأجسام المضادة (IgA أو IgE أو IgG) ).[8] النمط الإيسوي أو تبديل الفئة هو عملية بيولوجية] تحدث بعد تنشيط الخلية بيتا ، والتي تسمح للخلية بإنتاج فئات مختلفة من الأجسام المضادة (IgA أو IgE أو IgG). [62] يتم تعريف الفئات المختلفة من الأجسام المضادة ، وبالتالي وظائف المستجيب ، من خلال المناطق الثابتة (C) للسلسلة الثقيلة من لگلوبولين المناعي. في البداية ، تعبر الخلايا البائية الساذجة في IgM و IgD على سطح الخلية فقط مع مناطق ربط مستضد متطابقة. يتم تكييف كل نوع إيسوي لوظيفة مميزة ؛ لذلك ، بعد التنشيط ، قد تكون هناك حاجة لجسم مضاد مع وظيفة المستجيب IgG أو IgA أو IgE للتخلص بشكل فعال من المستضد. يسمح تبديل الفئة لخلايا وليدة مختلفة من نفس الخلية بيتا المنشطة بإنتاج أجسام مضادة ذات أنماط إيسوية مختلفة. فقط المنطقة الثابتة من السلسلة الثقيلة للجسم المضاد تتغير خلال تبديل الفئة ؛ تبقى المناطق المتغيرة ، وبالتالي خصوصية المستضد ، دون تغيير. وبالتالي يمكن أن ينتج سلالة خلية بيتا واحدة أجسام مضادة ، كلها محددة لنفس المستضد ، ولكن مع القدرة على إنتاج وظيفة المستجيب المناسبة لكل تحدي مستضد. يتم تحفيز تبديل الفئة بواسطة السيتوكينات. يعتمد النموذج المتولد الناتج على السيتوكينات الموجودة في بيئة الخلية البائية.[63]
يحدث تبديل الفئة في موضع الجين ذو السلسلة الثقيلة بواسطة آلية تسمى تأشب تبديل الفئة (CSR). تعتمد هذه الآلية على زخارف النيوكليوتايد المحفوظة ، وتسمى مناطق التبديل (S) ، الموجودة في الدنا العلوي لكل جين منطقة ثابتة (باستثناء السلسلة δ). يتم كسر شريط الدنا بواسطة نشاط سلسلة من الإنزيمات في منطقتين S محددتين.[64][65] يتم إعادة انضمام إكسون النطاق المتغير من خلال عملية تسمى الانضمام النهائي غير المتماثل (NHEJ) إلى المنطقة الثابتة المطلوبة (γ أو α أو ε). تؤدي هذه العملية إلى جين الگلوبولين المناعي الذي يشفر جسمًا مضادًا من نوع متماثل مختلف .[66]
التعيينات المتخصصة
يمكن أن يسمى الجسم المضاد احادي النوعية إذا كان له خصوصية لنفس المستضد أو الحاتمة ,[67] أو ثنائي النوعية إذا كان لديه تقارب بين مستضدين مختلفين أو حاتمتين مختلفتين على نفس المستضد .[68] يمكن أن تسمى مجموعة من الأجسام المضادة متعددة التكافؤ (أو غير محددة ) إذا كان لديهم تقارب مع مستضدات مختلفة [69] أو كائنات دقيقة .[69] يتكون الگلوبولين المناعي الوريدي من مجموعة متنوعة من IgG مختلفة (IgG متعدد النسائل). في المقابل ، الأجسام المضادة وحيدة النسيلة هي أجسام مضادة متطابقة تنتجها خلية بائية واحدة.
الأجسام المضادة الغير متناظرة
الأجسام المضادة غير المتماثلة ، والتي هي أيضًا غير متناظرة والأجسام المضادة ، تسمح بمرونة أكبر وتنسيقات جديدة لربط مجموعة متنوعة من الأدوية بأذرع الجسم المضاد. أحد التنسيقات العامة للجسم المضاد غير المتغاير هو تنسيق "المقابض في الثقوب". هذا التنسيق خاص بجزء السلسلة الثقيلة من المنطقة الثابتة في الأجسام المضادة. تم تصميم جزء "المقابض" عن طريق استبدال حمض أميني صغير بآخر أكبر. تناسبها في "الحفرة" ، التي صممت عن طريق استبدال حمض أميني كبير مع أصغر. ما يربط "المقابض" بـ "الثقوب" هي روابط ثنائية الكبريتيد بين كل سلسلة. يسهل شكل "المقابض في الثقوب" السمية الخلوية المعتمدة على الأجسام المضادة بوساطة الخلية. ترتبط الأجزاء المتغيرة ذات السلسلة الواحدة ( scFv ) بالنطاق المتغير للسلسلة الثقيلة والخفيفة عبر ببتيد رابط قصير. الرابط غني بالغليسين ، مما يمنحه المزيد من المرونة ، وسيرين / ثريونين ، مما يمنحه نوعية. يمكن ربط جزأين مختلفين من scFv معًا ، عبر منطقة مفصلة ، بالمجال الثابت للسلسلة الثقيلة أو المجال الثابت للسلسلة الخفيفة.[70] وهذا يعطي نوعية ثنائية للاجسام المضادة ، مما يسمح بنوعية الربط لمستضدين مختلفين .[71] يعمل تنسيق "المقابض في الثقوب" على تعزيز تشكيل مغاير ولكنه لا يمنع تكوين متطابق
لمزيد من تحسين وظيفة الأجسام المضادة المتغايرة ، يتطلع العديد من العلماء نحو التركيبات الاصطناعية. الأجسام المضادة الاصطناعية هي أشكال بروتينية متنوعة إلى حد كبير تستخدم الاستراتيجية الوظيفية لجزيء الجسم المضاد ، ولكنها ليست محدودة بالقيود الهيكلية للحلقة والإطار للجسم المضاد الطبيعي .[72] إن القدرة على التحكم في التصميم التوافقي للتسلسل والفراغ ثلاثي الأبعاد يمكن أن يتجاوز التصميم الطبيعي ويسمح بربط مجموعات مختلفة من الأدوية بالأذرع.
الأجسام المضادة غير المتجانسة لها نطاق أكبر في الأشكال التي يمكن أن تأخذها ولا يجب أن تكون الأدوية المرتبطة بالأذرع متشابهة في كل ذراع ، مما يسمح باستخدام مجموعات مختلفة من الأدوية في علاج السرطان. الأدوية قادرة على إنتاج الأجسام المضادة ثنائية النوعية وحتى متعددة النوعية. الدرجة التي يمكن أن تعمل بها مثيرة للإعجاب بالنظر إلى أن مثل هذا التغيير في الشكل من الشكل الطبيعي يجب أن يؤدي إلى انخفاض الوظائف.
التطبيقات الطبية
تشخيص الأمراض
إن الكشف عن أجسام مضادة معينة هو شكل شائع جدًا من التشخيص الطبي ، وتعتمد تطبيقات مثل علم الأمصال على هذه الأساليب. .[73] على سبيل المثال ، في فحوصات الكيمياء الحيوية لتشخيص المرض ,[74] يتم تقدير عيار الأجسام المضادة الموجهة ضد ڤيروس إپستاين-بار أو داء لايم من الدم. إذا كانت هذه الأجسام المضادة غير موجودة ، فإما أن الشخص غير مصاب أو أن العدوى حدثت منذ فترة طويلة جدًا ، وقد تلاشت خلايا بيتا التي تولد هذه الأجسام المضادة المحددة بشكل طبيعي
في علم المناعة السريري ، يتم قياس مستويات الفئات الفردية من الگلوبيولين المناعي بواسطة قياس الكدر (أو قياس العكر ) لتوصيف صورة الجسم المضاد للمريض .[75] تكون الارتفاعات في فئات مختلفة من الگلوبولين المناعي مفيدة في بعض الأحيان في تحديد سبب تلف الكبد في المرضى الذين لا يكون التشخيص واضحًا بالنسبة لهم .[1] على سبيل المثال ، يشير ارتفاع IgA إلى تليف الكبد الكحولي ، ويشير IgM المرتفع إلى التهاب الكبدي ڤيروسي وتليف الكبد الصفراوي الأولي ، بينما يرتفع IgG في التهاب الكبدي الڤيروسي والتهاب الكبد المناعي الذاتي وتليف الكبد.
غالبًا ما يمكن تتبع اضطرابات المناعة الذاتية إلى الأجسام المضادة التي تربط الحواتم الخاصة بالجسم ؛ يمكن الكشف عن العديد من خلال اختبارات الدم . تم الكشف عن الأجسام المضادة الموجهة ضد المستضدات السطحية لخلايا الدم الحمراء في فقر الدم التحللي بوساطة المناعة مع اختبار كومبس.[76] [77] يستخدم اختبار كومبس أيضًا لفحص الأجسام المضادة في تحضير نقل الدم وأيضًا لفحص الأجسام المضادة لدى النساء الحوامل.[76]
من الناحية العملية ، يتم استخدام العديد من طرق التشخيص المناعي القائمة على الكشف عن امركب الجسم المضاد-المتسضد لتشخيص الأمراض المعدية ، على سبيل المثال مقايسة امتصاصية مناعية للإنزيم المرتبط ، والتألق المناعي ، و لطخة ويسترن ، والانتشار المناعي ، والرحلان الكهربي المناعي ، والمقايسة المناعية المغناطيسية . يتم استخدام الأجسام المضادة المنشأة ضد موجهة الغدد التناسلية المشيمائية البشرية في اختبارات الحمل بدون وصفة طبية.
تتيح كيمياء الديوكسبورولان الجديدة وضع علامات على الأجسام المضادة للفلورايد المشع ( 18 فهرنهايت ) ، مما يسمح بالتصوير المقطعي بابتعاث البوزيترونات (PET) للسرطان . .[78]
علاج الأمراض
يتم استخدام العلاج بالأجسام المضادة وحيدة النسيلة المستهدفة لعلاج أمراض مثل التهاب المفاصل الرثياني ,[79] التصلب المتعدد,[80] الصدفية,[81] والعديد من أشكال السرطان بما في ذلك لمفوما لاهودجكينية,[82] سرطان القولون والمستقيم ، سرطان الرأس والعنق سرطان الثدي .[83]
تؤدي بعض أوجه القصور المناعية ، مثل فقد غاما گلوبولين الدم المرتبط بـ X ونقص غاما گلوبولين الدم ، إلى نقص جزئي أو كامل في الأجسام المضادة .[84] غالبًا ما يتم علاج هذه الأمراض عن طريق إحداث شكل قصير المدى من المناعة يسمى المناعة السلبية . يتم تحقيق المناعة السلبية من خلال نقل الأجسام المضادة الجاهزة في شكل مصل بشري أو حيواني ، أو الگلوبيولين المناعي المجمع أو الأجسام المضادة أحادية النسيلة ، إلى الفرد المصاب.[85]
علاج ما قبل الولادة
عامل Rh ، المعروف أيضًا باسم مستضد Rh D ، هو مستضد موجود على خلايا الدم الحمراء . الأفراد الذين هم إيجابيون Rh) Rh+) لديهم هذا المستضد على خلايا الدم الحمراء والأفراد الذين لديهم سلبية (Rh) (Rh–) لا يوجد لديهم. أثناء الولادة الطبيعية أو رضحة الولادة أو المضاعفات أثناء الحمل ، يمكن أن يدخل الدم من الجنين إلى نظام الأم. في حالة الأم والطفل غير متوافقين مع Rh ، قد يؤدي خلط الدم الناتج إلى تحسس Rh - الأم إلى مستضد Rh على خلايا الدم لدى Rh + child ، مما يعرض ما تبقى من الحمل وأي حالات حمل لاحقة لخطر مرض الانحلالي للمولود ..[86]
تكون الأجسام المضادة لـ (RhoD) المناعية للگلوبولين المناعي خاصة بمستضد RhD البشري .[87] تدار الأجسام المضادة لـ RhD كجزء من نظام معالجة ما قبل الولادة لمنع التحسس الذي قد يحدث عندما يكون لدى الأم Rh سلبي و جنين إيجابي الـ Rh. علاج الأم بالأجسام المضادة لـ RhD قبل وبعد الصدمة(الرضحة) مباشرة والولادة يدمر مستضد Rh في نظام الأم من الجنين. من المهم ملاحظة أن هذا يحدث قبل أن يتمكن المستضد من تحفيز خلايا بيتا الأم على "تذكر" مستضد Rh من خلال توليد خلايا ذاكرة بائية. لذلك ، لن يصنع جهاز المناعة الخلطي أجسام مضادة لـ Rh ، ولن يهاجم مستضدات Rh للأطفال الحاليين أو اللاحقين. يمنع علاج Rho (D) المناعي التحسس الذي يمكن أن يؤدي إلى مرض Rh ، لكنه لا يمنع أو يعالج المرض الأساسي نفسه.[87]
التطبيقات البحثية
يتم إنتاج الأجسام المضادة المحددة عن طريق حقن مستضد في الثدييات ، مثل الفأر أو الجرذ أو الأرانب أو الماعز أو الأغنام أو الحصان لكميات كبيرة من الأجسام المضادة. يحتوي الدم المعزول من هذه الحيوانات على أجسام مضادة متعددة النسائل - أجسام مضادة متعددة ترتبط بنفس المستضد - في المصل ، والذي يمكن أن يسمى الآن مصل مضاد . يتم حقن المستضدات أيضًا في الدجاج لتوليد أجسام مضادة متعددة النسائل في صفار البيض.[88] للحصول على الجسم المضاد الخاص بنوع واحد من المستضد ، يتم عزل الخلايا الليمفاوية التي تفرز الأجسام المضادة من الحيوان ويتم تخليدها عن طريق دمجها مع خط الخلايا السرطانية. تسمى الخلايا المنصهرة بالأورام الهجينة ، وسوف تنمو باستمرار وتفرز الأجسام المضادة في البيئة. يتم عزل خلايا الورم الهجين الفردي عن طريق استنساخ التخفيف لتوليد خلايا مستنسخة تنتج جميعها نفس الجسم المضاد ؛ هذه الأجسام المضادة تسمى الأجسام المضادة وحيدة النسيلة.[89] غالبًا ما يتم تنقية الأجسام المضادة متعددة النسيلة وحيدة النسيلة باستخدام البروتين A / G أو الكروماتوغرافيا ذات الألفة بالمستضد .[90]
في البحث ، يتم استخدام الأجسام المضادة المنقاة في العديد من التطبيقات. يمكن العثور على الأجسام المضادة لتطبيقات البحث مباشرة من موردي الأجسام المضادة ، أو من خلال استخدام محرك بحث متخصص. تستخدم الأجسام المضادة للأبحاث بشكل شائع لتحديد وتحديد البروتينات داخل الخلايا وخارج الخلية . تستخدم الأجسام المضادة في قياس التدفق الخلوي للتمييز بين أنواع الخلايا بواسطة البروتينات التي تعبر عنها ؛ أنواع مختلفة من الخلايا تعبر عن مجموعات مختلفة من جزيئات التمايز على سطحها ، وتنتج بروتينات مختلفة وسرية داخل الخلايا.[91] يتم استخدامها أيضًا في الترسيب المناعي لفصل البروتينات وأي شيء مرتبط بها (الترسيب المناعة المشترك) عن الجزيئات الأخرى في انحلال الخلية ,[92] في تحليلات لطخة ويسترن لتحديد البروتينات المفصولة بواسطة الرحلان الكهربائي ,[93] في كيمياء الأنسجة المناعية أو التألق المناعي إلى فحص التعبير البروتيني في أقسام الأنسجة أو لتحديد البروتينات داخل الخلايا بمساعدة المجهر .[91][94] يمكن أيضًا الكشف عن البروتينات وتحديدها بالأجسام المضادة ، باستخدام تقنيات ELISA و ELISpot .[95][96]
الأجسام المضادة المستخدمة في البحث هي بعض من الكواشف الأكثر قوة ، ولكن الأكثر إشكالية مع عدد هائل من العوامل التي يجب التحكم فيها في أي تجربة بما في ذلك التفاعل المتقاطع ، أو الأجسام المضادة التي تتعرف على الحواتم المتعددة والألفة ، والتي يمكن أن تختلف بشكل كبير اعتمادًا على الظروف التجريبية مثل الأس الهيدروجيني ، المذيبات ، حالة الأنسجة ، إلخ. تم إجراء محاولات متعددة لتحسين طريقة تحقق الباحثين من الأجسام المضادة [97][98] والطرق التي يبلغون بها عن الأجسام المضادة. يحتاج الباحثون الذين يستخدمون الأجسام المضادة في عملهم إلى تسجيلها بشكل صحيح من أجل السماح بإعادة إنتاج أبحاثهم (وبالتالي اختبارها وتأهيلها من قبل باحثين آخرين). يمكن التعرف بسهولة على أقل من نصف الأجسام المضادة البحثية المشار إليها في الأوراق الأكاديمية.[99] تزود المطبوعات المنشورة في F1000 في 2014 و 2015 الباحثين بدليل للإبلاغ عن استخدام الأجسام المضادة للأبحاث .[100][101] تم نشر بحث RRID بشكل مشترك في 4 مجلات قامت بتطبيق معيار RRIDs لاستشهاد مورد البحث ، والذي يرسم البيانات من antibodyregistry.org كمصدر معرفات الأجسام المضادة [102] ({نظر أيضًا المجموعة في Force11[103]).
التنظيمات
الإنتاج والاختبار
تقليديا ، يتم إنتاج معظم الأجسام المضادة بواسطة خطوط خلايا الورم الهجين من خلال تخليد الخلايا المنتجة للأجسام المضادة عن طريق الاندماج الكيميائي مع خلايا الورم النقوي. في بعض الحالات ، أدي الدمج الإضافي مع خطوط أخرى إلى إنشاء " خلية ثلاثية" و "خلية رباعية". يجب وصف عملية التصنيع والتحقق منها بشكل مناسب. يجب أن تتضمن دراسات التحقق على الأقل ما يلي:
- إثبات أن العملية قادرة على الإنتاج بجودة جيدة (يجب التحقق من صحة العملية)
- كفاءة تنقية الجسم المضاد (يجب التخلص من جميع الشوائب والفيروسات )
- توصيف الأجسام المضادة المنقاة (توصيف فيزيوكيميائي ، خواص مناعية ، أنشطة بيولوجية ، ملوثات ،. . . )
- تحديد دراسات إزالة الفيروس
قبل التجارب السريرية
- اختبار سلامة المنتج: التعقيم (البكتيريا والفطريات) ، والاختبار في المختبر وفي الجسم الحي للفيروسات البرانية، واختبار الفيروس القهقري للفأر. . بيانات سلامة المنتج اللازمة قبل بدء تجارب الجدوى في ظروف خطيرة أو مهددة للحياة على الفور ، تعمل على تقييم الإمكانات الخطيرة للمنتج.
- اختبار الجدوى: هذه دراسات تجريبية تتضمن أهدافها ، من بين أمور أخرى ، التوصيف المبكر للسلامة والدليل الأولي على المفهوم لدى مجموعة صغيرة محددة من المرضى (في المختبر أو في الاختبار الحي).
الدراسات قبل السريرية
- اختبار التفاعل المتبادل للأجسام المضادة: لإبراز التفاعلات غير المرغوب فيها (سمية) للاجسام المضادة ذات الأنسجة المميزة سابقًا. يمكن إجراء هذه الدراسة في المختبر (يجب تحديد تفاعل الجسم المضاد أو الاقتران المناعي باستخدام أنسجة بالغة التجميد السريع) أو في الجسم الحي (مع النماذج الحيوانية المناسبة).
- علم الصيدلة قبل السريرية واختبار السمية : تم تصميم اختبار السلامة للجسم المضاد قبل السريري لتحديد السمية المحتملة في البشر ، لتقدير احتمالية وشدة الاثار الجانبيةالمحتملة في البشر ، وتحديد جرعة البدء الآمنة وتصعيد الجرعة ، عندما يكون ذلك ممكنًا.
- دراسات سمية الحيوان: اختبار السمية الحادة ، اختبار سمية الجرعات المتكررة ، اختبار السمية على المدى الطويل
- اختبار الحرائك الدوائية والديناميكيات الدوائية: يستخدم لتحديد الجرعات السريرية وأنشطة الأجسام المضادة وتقييم الآثار السريرية المحتملة
التنبؤ بالبُنية والتصميم الحاسوبي للأجسام المضادة
تتطلب أهمية الأجسام المضادة في الرعاية الصحية وصناعة التكنولوجيا الحيوية معرفة هياكلها بدقة عالية . تُستخدم هذه المعلومات في هندسة البروتين ، وتعديل ألفة ارتباط المستضد ، وتحديد حاتمة ، لجسم مضاد معين. يعدعلم بلورات الآشعة السينية إحدى الطرق الشائعة الاستخدام لتحديد هياكل الأجسام المضادة. ومع ذلك ، فإن بلورة جسم مضاد غالبًا ما يكون مرهقًا ويستغرق وقتًا طويلاً. توفر المناهج الحسابية بديلاً أرخص وأسرع للبلورات ، ولكن نتائجها أكثر غموضًا ، لأنها لا تنتج هياكل تجريبية. تتيح خوادم الويب عبر الإنترنت مثل نمذجة الأجسام المضادة للويب (WA [104] والتنبؤ ببنية الجلوبيولين المناعي (PIGS)[105] لنمذجة الحسابية للمناطق المتغيرة للأجسام المضادة. Rosetta Antibody هو خادم جديد للتنبؤ بهيكل منطقة الأجسام المضادة F V ، والذي يتضمن تقنيات متطورة لتقليل حلقات CDR وتحسين الاتجاه النسبي للسلاسل الخفيفة والثقيلة ، بالإضافة إلى نماذج التنادد التي تتنبأ بالرسو الناجح للأجسام المضادة مع مستضدها الفريد.[106]
القدرة على وصف الجسم المضاد من خلال ألفة الارتباط بالمستضد يتم استكماله بمعلومات عن بنية الجسم المضاد وتسلسل الأحماض الأمينية لغرض مطالبات براءات الاختراع .[107] تم تقديم العديد من الطرق للتصميم الحسابي للأجسام المضادة بناءً على دراسات المعلوماتية الحيوية الهيكلية لأجسام CDRs للأجسام المضادة.[108][109][110]
هناك مجموعة متنوعة من الطرق المستخدمة لتسلسل جسم مضاد بما في ذلك تدهور ادمان ، و الدنا التكميلي ، وما إلى ذلك ؛ وإن كان أحد الاستخدامات الحديثة الأكثر شيوعًا لتحديد الببتيد / البروتين هي كروماتوگرافيا السائلة إلى جانب مطياف الكتلة الترادفية (LC-MS / MS).[111] تتطلب طرق تسلسل الأجسام المضادة ذات الحجم الكبير مناهج حسابية لتحليل البيانات ، بما في ذلك تسلسل ببتيدي جديد مباشرة من أطياف الكتلة الترادفية.[112][113] العديد من إصدارات تسلسل بروتين البندقية قادرة على زيادة التغطية باستخدام طرق التجزئة[114]CID/HCD/ETDوتقنيات أخرى ، وقد حققت تقدمًا كبيرًا في محاولة تسلسل البروتينات بشكل كامل ، وخاصة الأجسام المضادة. تفترض طرق أخرى وجود بروتينات متشابهة ,[115] تسلسل جينوم معروف ,[116] أو مجتمعة من أعلى إلى أسفل ومن أسفل إلى أعلى .[117] تتمتع التقنيات الحالية بالقدرة على تجميع تسلسلات البروتين بدقة عالية من خلال دمج الببتيدات المتتابعة الجديدة وكثافتها ونقاط الثقة الموضعية من عمليات البحث في قواعد البيانات المتناددة .[118]
تقليد الأجسام المضادة
مقلدات الأجسام المضادة هي مركبات عضوية ، مثل الأجسام المضادة ، التي يمكن أن تربط على وجه التحديد بالمستضدات. وعادة ما تكون ببتيدات أو بروتينات اصطناعية بكتلة مولارية تبلغ حوالي 3 إلى 20 كيلو دالتون. تُعتبر الأحماض النووية والجزيئات الصغيرة في بعض الأحيان بمثابة تقليد للأجسام المضادة ، ولكن لا تتكون الأجسام المضادة الاصطناعية وشظايا الأجسام المضادة وبروتينات الاندماج من هذه. المزايا الشائعة على الأجسام المضادة هي الذوبان بشكل أفضل ، واختراق الأنسجة ، والاستقرار تجاه الحرارة والإنزيمات ، وتكاليف الإنتاج المنخفضة نسبيًا. تم تطوير محاكيات الأجسام المضادة مثل Affimer و DARPin وتسويقها كعناصر بحثية وتشخيصية وعلاجية .[119]
انظر أيضاً
- Affimer
- تقليد الأجسام المضادة
- Anti-mitochondrial antibodies
- Anti-nuclear antibodies
- Aptamer
- Colostrum
- ELISA
- Humoral immunity
- Immunology
- Immunosuppressive drug
- Intravenous immunoglobulin (IVIg)
- Magnetic immunoassay
- Microantibody
- جسم مضاد وحيد النسيلة
- Neutralizing antibody
- أجسام مضادة ثانوية
- Single-domain antibody
- Slope spectroscopy
- Western blot normalization
المصادر
- ^ أ ب ت ث Rhoades RA, Pflanzer RG (2002). Human Physiology (5th ed.). Thomson Learning. p. 584. ISBN 978-0-534-42174-8.
- ^ أ ب ت ث ج ح خ د ذ Janeway, Charles (2001). Immunobiology (5th ed.). Garland Publishing. ISBN 978-0-8153-3642-6.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Litman GW, Rast JP, Shamblott MJ, Haire RN, Hulst M, Roess W, Litman RT, Hinds-Frey KR, Zilch A, Amemiya CT (January 1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire". Molecular Biology and Evolution. 10 (1): 60–72. doi:10.1093/oxfordjournals.molbev.a040000. PMID 8450761.
- ^ أ ب ت ث ج ح خ Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (February 2015). "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review". Journal of Autoimmunity. 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
- ^ أ ب ت Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 978-1-55581-246-1.
- ^ أ ب Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion". Immunologic Research. 36 (1–3): 27–32. doi:10.1385/IR:36:1:27. PMID 17337763.
- ^ أ ب Parker DC (1993). "T cell-dependent B cell activation". Annual Review of Immunology. 11 (1): 331–60. doi:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ^ أ ب ت ث ج ح Market E, Papavasiliou FN (October 2003). "V(D)J recombination and the evolution of the adaptive immune system". PLOS Biology. 1 (1): E16. doi:10.1371/journal.pbio.0000016. PMC 212695. PMID 14551913.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Williams CM, Galli SJ (May 2000). "The diverse potential effector and immunoregulatory roles of mast cells in allergic disease". The Journal of Allergy and Clinical Immunology. 105 (5): 847–59. doi:10.1067/mai.2000.106485. PMID 10808163.
- ^ أ ب Diaz M, Casali P (April 2002). "Somatic immunoglobulin hypermutation". Current Opinion in Immunology. 14 (2): 235–40. doi:10.1016/S0952-7915(02)00327-8. PMC 4621002. PMID 11869898.
- ^ أ ب ت ث Lindenmann J (April 1984). "Origin of the terms 'antibody' and 'antigen'". Scandinavian Journal of Immunology. 19 (4): 281–5. doi:10.1111/j.1365-3083.1984.tb00931.x. PMID 6374880.
- ^ Padlan EA (February 1994). "Anatomy of the antibody molecule". Molecular Immunology. 31 (3): 169–217. doi:10.1016/0161-5890(94)90001-9. PMID 8114766.
- ^ Sauter, Eric (10 November 2018). "New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus". News & Views. Vol. 8, no. 34. The Scripps Research Institute. Archived from the original on 10 January 2011. Retrieved 12 December 2008.
- ^ Pescovitz, David (22 October 2008). "Protein sculpture inspired by Vitruvian Man". boingboing (Blog). Archived from the original on 4 November 2010. Retrieved 12 December 2008.
- ^ Emil von Behring – Biographical. NobelPrize.org. Nobel Media AB 2020. Mon. 20 January 2020. <https://www.nobelprize.org/prizes/medicine/1901/behring/biographical/>
- ^ AGN (August 1931). "The Late Baron Shibasaburo Kitasato". Canadian Medical Association Journal. 25 (2): 206. PMC 382621. PMID 20318414.
- ^ Winau F, Westphal O, Winau R (July 2004). "Paul Ehrlich—in search of the magic bullet". Microbes and Infection. 6 (8): 786–9. doi:10.1016/j.micinf.2004.04.003. PMID 15207826.
- ^ Silverstein AM (May 2003). "Cellular versus humoral immunology: a century-long dispute". Nature Immunology. 4 (5): 425–8. doi:10.1038/ni0503-425. PMID 12719732.
- ^ Van Epps HL (January 2006). "Michael Heidelberger and the demystification of antibodies". The Journal of Experimental Medicine. 203 (1): 5. doi:10.1084/jem.2031fta. PMC 2118068. PMID 16523537.
- ^ Marrack JR (1938). Chemistry of antigens and antibodies (2nd ed.). London: His Majesty's Stationery Office. OCLC 3220539.
- ^ "The Linus Pauling Papers: How Antibodies and Enzymes Work". Archived from the original on 5 December 2010. Retrieved 5 June 2007.
- ^ Silverstein AM (December 2004). "Labeled antigens and antibodies: the evolution of magic markers and magic bullets" (PDF). Nature Immunology. 5 (12): 1211–7. doi:10.1038/ni1140. PMID 15549122. Archived from the original (PDF) on 25 March 2009.
- ^ Edelman GM, Gally JA (August 1962). "The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins". The Journal of Experimental Medicine. 116 (2): 207–27. doi:10.1084/jem.116.2.207. PMC 2137388. PMID 13889153.
- ^ Stevens FJ, Solomon A, Schiffer M (July 1991). "Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology". Biochemistry. 30 (28): 6803–5. doi:10.1021/bi00242a001. PMID 2069946.
- ^ أ ب Raju TN (September 1999). "The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917–85)". Lancet. 354 (9183): 1040. doi:10.1016/S0140-6736(05)76658-7. PMID 10501404.
- ^ Hochman J, Inbar D, Givol D (March 1973). "An active antibody fragment (Fv) composed of the variable portions of heavy and light chains". Biochemistry. 12 (6): 1130–5. doi:10.1021/bi00730a018. PMID 4569769.
- ^ Tomasi TB (October 1992). "The discovery of secretory IgA and the mucosal immune system". Immunology Today. 13 (10): 416–8. doi:10.1016/0167-5699(92)90093-M. PMID 1343085.
- ^ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E (October 2000). "Structural and functional properties of membrane and secreted IgD". Molecular Immunology. 37 (15): 871–87. doi:10.1016/S0161-5890(01)00006-2. PMID 11282392.
- ^ Johansson SG (2006). "The discovery of immunoglobulin E". Allergy and Asthma Proceedings. 27 (2 Suppl 1): S3–6. PMID 16722325.
- ^ Hozumi N, Tonegawa S (October 1976). "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions". Proceedings of the National Academy of Sciences of the United States of America. 73 (10): 3628–32. Bibcode:1976PNAS...73.3628H. doi:10.1073/pnas.73.10.3628. PMC 431171. PMID 824647.
- ^ أ ب ت ث Maxwell Myer, Wintrobe (2004). Greer, John G.; Foerster, John; Lukens, John N; Rodgers, George M; Paraskevas, Frixos (eds.). Wintrobe's clinical hematology (11 ed.). Hagerstown, MD: Lippincott Williams & Wilkins. pp. 453–456. ISBN 978-0-7817-3650-3.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Tolar P, Sohn HW, Pierce SK (February 2008). "Viewing the antigen-induced initiation of B-cell activation in living cells". Immunological Reviews. 221 (1): 64–76. doi:10.1111/j.1600-065X.2008.00583.x. PMID 18275475.
- ^ أ ب ت Woof JM, Burton DR (February 2004). "Human antibody-Fc receptor interactions illuminated by crystal structures". Nature Reviews. Immunology. 4 (2): 89–99. doi:10.1038/nri1266. PMID 15040582.
- ^ Underdown B, Schiff J, Immunoglobulin A: strategic defense initiative at the mucosal surface. Annu Rev Immunol 4 389-417.1986 PMID=3518747
- ^ أ ب Geisberger R, Lamers M, Achatz G, The riddle of the dual expression of IgM and IgD. Immunology 118 4 429-37. 2006. PMID 16895553
- ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةPier et al - ^ Goding JW (1978). Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation. Vol. 8. pp. 203–43. doi:10.1007/978-1-4684-0922-2_7. ISBN 978-1-4684-0924-6. PMID 357078.
{{cite book}}:|journal=ignored (help) - ^ Lundqvist ML, Middleton DL, Radford C, Warr GW, Magor KE (2006). "Immunoglobulins of the non-galliform birds: antibody expression and repertoire in the duck". Developmental and Comparative Immunology. 30 (1–2): 93–100. doi:10.1016/j.dci.2005.06.019. PMC 1317265. PMID 16150486.
- ^ Berstein RM, Schluter SF, Shen S, Marchalonis JJ (April 1996). "A new high molecular weight immunoglobulin class from the carcharhine shark: implications for the properties of the primordial immunoglobulin". Proceedings of the National Academy of Sciences of the United States of America. 93 (8): 3289–93. Bibcode:1996PNAS...93.3289B. doi:10.1073/pnas.93.8.3289. PMC 39599. PMID 8622930.
- ^ Reth, Michael (2013). "Matching cellular dimensions with molecular sizes" (PDF). Nature Immunology. 14 (8): 765–7. doi:10.1038/ni.2621. PMID 23867923.
{{cite journal}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Mattu TS, Pleass RJ, Willis AC, Kilian M, Wormald MR, Lellouch AC, Rudd PM, Woof JM, Dwek RA (January 1998). "The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fcα receptor interactions". The Journal of Biological Chemistry. 273 (4): 2260–72. doi:10.1074/jbc.273.4.2260. PMID 9442070.
- ^ Roux KH (October 1999). "Immunoglobulin structure and function as revealed by electron microscopy". International Archives of Allergy and Immunology. 120 (2): 85–99. doi:10.1159/000024226. PMID 10545762.
- ^ Barclay AN (August 2003). "Membrane proteins with immunoglobulin-like domains—a master superfamily of interaction molecules". Seminars in Immunology. 15 (4): 215–23. doi:10.1016/S1044-5323(03)00047-2. PMID 14690046.
- ^ Human Physiology (5th ed.). Thomson Learning. 2002. p. 584. ISBN 978-0-534-42174-8.
- ^ Putnam FW, Liu YS, Low TL (April 1979). "Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain". The Journal of Biological Chemistry. 254 (8): 2865–74. PMID 107164.
- ^ Al-Lazikani B, Lesk AM, Chothia C (November 1997). "Standard conformations for the canonical structures of immunoglobulins". Journal of Molecular Biology. 273 (4): 927–48. doi:10.1006/jmbi.1997.1354. PMID 9367782.
- ^ North B, Lehmann A, Dunbrack RL (February 2011). "A new clustering of antibody CDR loop conformations". Journal of Molecular Biology. 406 (2): 228–56. doi:10.1016/j.jmb.2010.10.030. PMC 3065967. PMID 21035459.
- ^ Nikoloudis D, Pitts JE, Saldanha JW (2014). "A complete, multi-level conformational clustering of antibody complementarity-determining regions". PeerJ. 2 (e456): e456. doi:10.7717/peerj.456. PMC 4103072. PMID 25071986.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Heyman B (December 1996). "Complement and Fc-receptors in regulation of the antibody response". Immunology Letters. 54 (2–3): 195–9. doi:10.1016/S0165-2478(96)02672-7. PMID 9052877.
- ^ أ ب Ravetch JV, Bolland S (2001). "IgG Fc receptors". Annual Review of Immunology. 19 (1): 275–90. doi:10.1146/annurev.immunol.19.1.275. PMID 11244038.
- ^ Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunologic Research. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578.
- ^ Racaniello, Vincent (6 October 2009). "Natural antibody protects against viral infection". Virology Blog. Archived from the original on 20 February 2010. Retrieved 22 January 2010.
- ^ Milland J, Sandrin MS (December 2006). "ABO blood group and related antigens, natural antibodies and transplantation". Tissue Antigens. 68 (6): 459–66. doi:10.1111/j.1399-0039.2006.00721.x. PMID 17176435.
- ^ Mian IS, Bradwell AR, Olson AJ (January 1991). "Structure, function and properties of antibody binding sites". Journal of Molecular Biology. 217 (1): 133–51. doi:10.1016/0022-2836(91)90617-F. PMID 1988675.
- ^ Fanning LJ, Connor AM, Wu GE (April 1996). "Development of the immunoglobulin repertoire". Clinical Immunology and Immunopathology. 79 (1): 1–14. doi:10.1006/clin.1996.0044. PMID 8612345.
- ^ أ ب Nemazee D (October 2006). "Receptor editing in lymphocyte development and central tolerance". Nature Reviews. Immunology. 6 (10): 728–40. doi:10.1038/nri1939. PMID 16998507.
- ^ Peter Parham. The Immune System. 2nd ed. Garland Science: New York, 2005. pg.47–62
- ^ Bergman Y, Cedar H (October 2004). "A stepwise epigenetic process controls immunoglobulin allelic exclusion". Nature Reviews. Immunology. 4 (10): 753–61. doi:10.1038/nri1458. PMID 15459667.
- ^ Honjo T, Habu S (1985). "Origin of immune diversity: genetic variation and selection". Annual Review of Biochemistry. 54 (1): 803–30. doi:10.1146/annurev.bi.54.070185.004103. PMID 3927822.
- ^ أ ب Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J (April 2007). "Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation". Immunological Reviews. 216: 130–41. doi:10.1111/j.1600-065X.2007.00507.x. PMID 17367339.
- ^ Neuberger MS, Ehrenstein MR, Rada C, Sale J, Batista FD, Williams G, Milstein C (March 2000). "Memory in the B-cell compartment: antibody affinity maturation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 355 (1395): 357–60. doi:10.1098/rstb.2000.0573. PMC 1692737. PMID 10794054.
- ^ قالب:استشهاد بدورية محكمة
- ^ Stavnezer J, Amemiya CT (August 2004). "Evolution of isotype switching". Seminars in Immunology. 16 (4): 257–75. doi:10.1016/j.smim.2004.08.005. PMID 15522624.
- ^ Durandy A (August 2003). "Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation". European Journal of Immunology. 33 (8): 2069–73. doi:10.1002/eji.200324133. PMID 12884279.
- ^ Casali P, Zan H (November 2004). "Class switching and Myc translocation: how does DNA break?". Nature Immunology. 5 (11): 1101–3. doi:10.1038/ni1104-1101. PMC 4625794. PMID 15496946.
- ^ Lieber MR, Yu K, Raghavan SC (September 2006). "Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations". DNA Repair. 5 (9–10): 1234–45. doi:10.1016/j.dnarep.2006.05.013. PMID 16793349.
- ^ p. 22 in: Shoenfeld, Yehuda.; Meroni, Pier-Luigi.; Gershwin, M. Eric (2007). Autoantibodie. Amsterdam; Boston: Elsevier. ISBN 978-0-444-52763-9.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Spiess C, Zhai Q, Carter PJ (October 2015). "Alternative molecular formats and therapeutic applications for bispecific antibodies". Molecular Immunology. 67 (2 Pt A): 95–106. doi:10.1016/j.molimm.2015.01.003. PMID 25637431.
- ^ أ ب Farlex dictionary > polyvalent Citing: The American Heritage Medical Dictionary. 2004
- ^ Gunasekaran K, Pentony M, Shen M, Garrett L, Forte C, Woodward A, Ng SB, Born T, Retter M, Manchulenko K, Sweet H, Foltz IN, Wittekind M, Yan W (June 2010). "Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG". The Journal of Biological Chemistry. 285 (25): 19637–46. doi:10.1074/jbc.M110.117382. PMC 2885242. PMID 20400508.
- ^ Muller KM (1998). "The first constant domain (CH1 and CL) of an antibody used as heterodimerization domain for bispecific miniantibodies". FEBS Letters. 422 (2): 259–264. doi:10.1016/s0014-5793(98)00021-0. PMID 9490020.
- ^ Gao C, Mao S, Lo CH, Wirsching P, Lerner RA, Janda KD (May 1999). "Making artificial antibodies: a format for phage display of combinatorial heterodimeric arrays". Proceedings of the National Academy of Sciences of the United States of America. 96 (11): 6025–30. Bibcode:1999PNAS...96.6025G. doi:10.1073/pnas.96.11.6025. PMC 26829. PMID 10339535.
- ^ "Animated depictions of how antibodies are used in ELISA assays". Cellular Technology Ltd.—Europe. Archived from the original on 14 June 2011. Retrieved 8 May 2007.
- ^ "Animated depictions of how antibodies are used in ELISPOT assays". Cellular Technology Ltd.—Europe. Archived from the original on 16 May 2011. Retrieved 8 May 2007.
- ^ Stern P (2006). "Current possibilities of turbidimetry and nephelometry" (PDF). Klin Biochem Metab. 14 (3): 146–151. Archived from the original (PDF) on 10 April 2008.
- ^ أ ب Dean, Laura (2005). "Chapter 4: Hemolytic disease of the newborn". Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US).
{{cite book}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help); Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Dean, Laura (2005). "Chapter 4: Hemolytic disease of the newborn". Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US).
{{cite book}}: External link in|chapterurl=|chapterurl=ignored (|chapter-url=suggested) (help); Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Rodriguez EA, Wang Y, Crisp JL, Vera DR, Tsien RY, Ting R (May 2016). "New Dioxaborolane Chemistry Enables [(18)F]-Positron-Emitting, Fluorescent [(18)F]-Multimodality Biomolecule Generation from the Solid Phase". Bioconjugate Chemistry (in الإنجليزية). 27 (5): 1390–1399. doi:10.1021/acs.bioconjchem.6b00164. PMC 4916912. PMID 27064381.
- ^ Feldmann M, Maini RN (2001). "Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?". Annual Review of Immunology. 19 (1): 163–96. doi:10.1146/annurev.immunol.19.1.163. PMID 11244034.
- ^ Doggrell SA (June 2003). "Is natalizumab a breakthrough in the treatment of multiple sclerosis?". Expert Opinion on Pharmacotherapy. 4 (6): 999–1001. doi:10.1517/14656566.4.6.999. PMID 12783595.
- ^ Krueger GG, Langley RG, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley LT, Lebwohl M (February 2007). "A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis". The New England Journal of Medicine. 356 (6): 580–92. doi:10.1056/NEJMoa062382. PMID 17287478.
- ^ Plosker GL, Figgitt DP (2003). "Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia". Drugs. 63 (8): 803–43. doi:10.2165/00003495-200363080-00005. PMID 12662126.
- ^ Vogel CL, Cobleigh MA, Tripathy D, Gutheil JC, Harris LN, Fehrenbacher L, Slamon DJ, Murphy M, Novotny WF, Burchmore M, Shak S, Stewart SJ (2001). "First-line Herceptin monotherapy in metastatic breast cancer". Oncology. 61. 61 Suppl 2 (Suppl. 2): 37–42. doi:10.1159/000055400. PMID 11694786.
- ^ LeBien TW (July 2000). "Fates of human B-cell precursors". Blood. 96 (1): 9–23. doi:10.1182/blood.V96.1.9. PMID 10891425. Archived from the original on 29 April 2010.
- ^ Ghaffer A (26 March 2006). "Immunization". Immunology — Chapter 14. University of South Carolina School of Medicine. Archived from the original on 18 October 2010. Retrieved 6 June 2007.
- ^ Urbaniak SJ, Greiss MA (March 2000). "RhD haemolytic disease of the fetus and the newborn". Blood Reviews. 14 (1): 44–61. doi:10.1054/blre.1999.0123. PMID 10805260.
- ^ أ ب Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid GJ, Aerde JV, Wilson RD, Davies G, Désilets VA, Summers A, Wyatt P, Young DC (September 2003). "Prevention of Rh alloimmunization". Journal of Obstetrics and Gynaecology Canada. 25 (9): 765–73. doi:10.1016/S1701-2163(16)31006-4. PMID 12970812.
- ^ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (March 2002). "Generation and application of chicken egg-yolk antibodies". Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology. 131 (3): 569–74. doi:10.1016/S1095-6433(01)00508-6. PMID 11867282.
- ^ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (June 1984). "Human monoclonal antibodies". Molecular and Cellular Biochemistry. 62 (2): 109–20. doi:10.1007/BF00223301. PMID 6087121.
- ^ Kabir S (2002). "Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis". Immunological Investigations. 31 (3–4): 263–78. doi:10.1081/IMM-120016245. PMID 12472184.
- ^ أ ب Brehm-Stecher BF, Johnson EA (September 2004). "Single-cell microbiology: tools, technologies, and applications". Microbiology and Molecular Biology Reviews. 68 (3): 538–59, table of contents. doi:10.1128/MMBR.68.3.538-559.2004. PMC 515252. PMID 15353569.
- ^ Williams NE (2000). Immunoprecipitation procedures. Methods in Cell Biology. Vol. 62. San Diego, CA : Academic Press. pp. 449–53. doi:10.1016/S0091-679X(08)61549-6. ISBN 978-0-12-544164-3. PMID 10503210.
- ^ Kurien BT, Scofield RH (April 2006). "Western blotting". Methods. 38 (4): 283–93. doi:10.1016/j.ymeth.2005.11.007. PMID 16483794.
- ^ Scanziani E (1998). Immunohistochemical staining of fixed tissues. Vol. 104. Totowa, N.J. : Humana Press. pp. 133–40. doi:10.1385/0-89603-525-5:133. ISBN 978-0-89603-525-6. PMID 9711649.
{{cite book}}:|journal=ignored (help) - ^ Reen DJ (1994). Enzyme-linked immunosorbent assay (ELISA). Vol. 32. pp. 461–6. doi:10.1385/0-89603-268-X:461. ISBN 978-0-89603-268-2. PMC 2366430. PMID 7951745.
{{cite book}}:|journal=ignored (help) - ^ Kalyuzhny AE (2005). Chemistry and biology of the ELISPOT assay. Vol. 302. pp. 15–31. doi:10.1385/1-59259-903-6:015. ISBN 978-1-59259-903-5. PMID 15937343.
{{cite book}}:|journal=ignored (help) - ^ Saper CB (December 2005). "An open letter to our readers on the use of antibodies". The Journal of Comparative Neurology. 493 (4): 477–8. doi:10.1002/cne.20839. PMID 16304632.
- ^ "NOT-OD-16-011: Implementing Rigor and Transparency in NIH & AHRQ Research Grant Applications". grants.nih.gov.
- ^ Vasilevsky, Nicole A.; Brush, Matthew H.; Paddock, Holly; Ponting, Laura; Tripathy, Shreejoy J.; Larocca, Gregory M.; Haendel, Melissa A. (2 September 2013). "On the reproducibility of science: unique identification of research resources in the biomedical literature". PeerJ. 1: e148. doi:10.7717/peerj.148. PMC 3771067. PMID 24032093.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Bandrowski A, Brush M, Grethe JS, Haendel MA, Kennedy DN, Hill S, Hof PR, Martone ME, Pols M, Tan S, Washington N, Zudilova-Seinstra E, Vasilevsky N (2015). "The Resource Identification Initiative: A cultural shift in publishing". F1000Research. 4: 134. doi:10.12688/f1000research.6555.2. PMC 4648211. PMID 26594330.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Helsby, Matthew A.; Fenn, Joe R.; Chalmers, Andrew D. (23 August 2013). "Reporting research antibody use: how to increase experimental reproducibility". F1000Research. 2: 153. doi:10.12688/f1000research.2-153.v2. PMC 3829129. PMID 24358895.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "The Antibody Registry". antibodyregistry.org.
- ^ "Resource Identification Initiative". FORCE11. 14 August 2013. Retrieved 18 April 2016.
- ^ Archived 17 يوليو 2011 at the Wayback Machine
WAM - ^ Marcatili P, Rosi A, Tramontano A (September 2008). "PIGS: automatic prediction of antibody structures". Bioinformatics. 24 (17): 1953–4. doi:10.1093/bioinformatics/btn341. PMID 18641403. Archived from the original on 26 November 2010.
Prediction of Immunoglobulin Structure (PIGS) - ^ Archived 19 يوليو 2011 at the Wayback Machine
RosettaAntibody - ^ Park, Hyeongsu. "Written Description Problems of the Monoclonal Antibody Patents after Centocor v. Abbott". jolt.law.harvard.edu. Archived from the original on 13 December 2014. Retrieved 12 December 2014.
- ^ Adolf-Bryfogle, J; Kalyuzhniy, O; Kubitz, M; Weitzner, BD; Hu, X; Adachi, Y; Schief, WR; Dunbrack, RL (April 2018). "RosettaAntibodyDesign (RAbD): A general framework for computational antibody design". PLOS Computational Biology. 14 (4): e1006112. Bibcode:2018PLSCB..14E6112A. doi:10.1371/journal.pcbi.1006112. PMC 5942852. PMID 29702641.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lapidoth, GD; Baran, D; Pszolla, GM; Norn, C; Alon, A; Tyka, MD; Fleishman, SJ (August 2015). "AbDesign: An algorithm for combinatorial backbone design guided by natural conformations and sequences". Proteins. 83 (8): 1385–406. doi:10.1002/prot.24779. PMC 4881815. PMID 25670500.
- ^ Li, T; Pantazes, RJ; Maranas, CD (2014). "OptMAVEn--a new framework for the de novo design of antibody variable region models targeting specific antigen epitopes". PLOS One. 9 (8): e105954. Bibcode:2014PLoSO...9j5954L. doi:10.1371/journal.pone.0105954. PMC 4143332. PMID 25153121.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Pham, Victoria; Henzel, William J.; Arnott, David; Hymowitz, Sarah; Sandoval, Wendy N.; Truong, Bao-Tran; Lowman, Henry; Lill, Jennie R. (2006). "De novo proteomic sequencing of a monoclonal antibody raised against OX40 ligand". Analytical Biochemistry. 352 (1): 77–86. doi:10.1016/j.ab.2006.02.001. PMID 16545334.
- ^ Zhang, Jing; Xin, Lei; Shan, Baozhen; Chen, Weiwu; Xie, Mingjie; Yuen, Denis; Zhang, Weiming; Zhang, Zefeng; Lajoie, Gilles A.; Ma, Bin (2012). "PEAKS DB:De Novo Sequencing Assisted Database Search for Sensitive and Accurate Peptide Identification". Molecular & Cellular Proteomics. 11 (4): M111.010587. doi:10.1074/mcp.M111.010587. PMC 3322562. PMID 22186715.
- ^ Perkins, David N.; Pappin, Darryl J. C.; Creasy, David M.; Cottrell, John S. (1999). "Probability-based protein identification by searching sequence databases using mass spectrometry data". Electrophoresis. 20 (18): 3551–3567. doi:10.1002/(SICI)1522-2683(19991201)20:18<3551::AID-ELPS3551>3.0.CO;2-2. PMID 10612281.
- ^ Bandeira, Nuno; Tang, Haixu; Bafna, Vineet; Pevzner, Pavel (2004). "Shotgun Protein Sequencing by Tandem Mass Spectra Assembly". Analytical Chemistry. 76 (24): 7221–7233. doi:10.1021/ac0489162. PMID 15595863.
- ^ Liu, Xiaowen; Han, Yonghua; Yuen, Denis; Ma, Bin (2009). "Automated protein (Re)sequencing with MS/MS and a homologous database yields almost full coverage and accuracy". Bioinformatics. 25 (17): 2174–2180. doi:10.1093/bioinformatics/btp366. PMID 19535534.
- ^ Castellana, Natalie E.; Pham, Victoria; Arnott, David; Lill, Jennie R.; Bafna, Vineet (2010). "Template Proteogenomics: Sequencing Whole Proteins Using an Imperfect Database". Molecular & Cellular Proteomics. 9 (6): 1260–1270. doi:10.1074/mcp.M900504-MCP200. PMC 2877985. PMID 20164058.
- ^ Liu, Xiaowen; Dekker, Lennard J. M.; Wu, Si; Vanduijn, Martijn M.; Luider, Theo M.; Tolić, Nikola; Kou, Qiang; Dvorkin, Mikhail; Alexandrova, Sonya; Vyatkina, Kira; Paša-Tolić, Ljiljana; Pevzner, Pavel A. (2014). "De Novo Protein Sequencing by Combining Top-Down and Bottom-Up Tandem Mass Spectra". Journal of Proteome Research. 13 (7): 3241–3248. doi:10.1021/pr401300m. PMID 24874765.
- ^ Tran, Ngoc Hieu; Rahman, M. Ziaur; He, Lin; Xin, Lei; Shan, Baozhen; Li, Ming (2016). "Complete de Novo Assembly of Monoclonal Antibody Sequences". Scientific Reports. 6: 31730. Bibcode:2016NatSR...631730T. doi:10.1038/srep31730. PMC 4999880. PMID 27562653.
- ^ Gebauer M, Skerra A (June 2009). "Engineered protein scaffolds as next-generation antibody therapeutics". Current Opinion in Chemical Biology. 13 (3): 245–55. doi:10.1016/j.cbpa.2009.04.627. PMID 19501012.
وصلات خارجية
- Mike's Immunoglobulin Structure/Function Page at University of Cambridge
- Antibodies as the PDB molecule of the month Discussion of the structure of antibodies at RCSB Protein Data Bank
- Microbiology and Immunology On-line Textbook at University of South Carolina
- A hundred years of antibody therapy History and applications of antibodies in the treatment of disease at University of Oxford
- How Lymphocytes Produce Antibody from Cells Alive!
- Antibody applications Fluorescent antibody image library, University of Birmingham