حساسية
| ICD-10 | T78.4 |
|---|---|
| ICD-9 | 995.3 |
| DiseasesDB | 33481 |
| MedlinePlus | 000812 |
| eMedicine | med/1101 |
| MeSH | D006967 |
الحساسية Allergy تفاعل يحدُث في الجسم لأشخاص لديهم حساسية لبعض المواد.وقد تكون إحدى المواد غير الضارة لشخص غير مصاب بالحساسية سببًا لحدوث أعراض تتراوح ما بين أعراض شديدة وخفيفة إذا تعرض لها شخص مصاب بالحساسية. والإصابة بالحساسية تحدث للشخص في أي وقت، ولكن في معظم الأحيان، يبدأ ظهور الأعراض في مرحلة الطفولة.
تشمل الصور العامة للحساسية الربو وحمى القش والحساسية الأنفية التي يُطلَق عليها اسم التهاب الأنف التحسسي الدائم. وهناك أنواع أخرى وهي الإكزيما (تورمات حمراء مع هرش على الجلد) والشَرَى والصداع التحسسي، والاضطرابات الهضمية التحسسية.
يُطلق على المادة التي تُسبب الحساسية اسم المُستَأرج، وتشمل المُستأرِجَات التي تُسَبب معظم حالات الربو وحمى القش وحساسيات الجهاز التنفسي الأخرى، غبار المنزل، وبعض أنواع الفطر الصغيرة، وحبوب اللقاح وقشور أو شعر الحيوانات الأليفة الموجودة بالمنزل. وقد تُسبب أغذية كثيرة تفاعلات الحساسية. وتشمل هذه الأغذية الشيكولاتة ولبن البقر والبيض والقمح وبعض الأغذية البحرية، وبخاصة الأسماك الصدفية. ومن المُستَأرِجات الشائعة المواد المضافة إلى الأغذية، مثل المواد الملونة للغذاء والمواد الحافظة.
تؤكد المصادر المختلفة أنه من المُحتمل أن يكون البشر قد أصيبوا بأمراض الحساسية منذ أزمان سحيقة، ومازالت هذه الأمراض موجودة في كثير من الحيوانات والناس. بيد أن الأطباء لم يبدأوا تفهم الأسباب الخاصة بالحساسية ومواصفاتها حتى بداية القرن العشرين وغالبًا ما يُستعَمَل المصطلح حساسية في هذه الأيام إشارة إلى مجال تخصصي في الطب، واختصاصي الحساسية هو طبيب يعالج أمراض الحساسية.
إكتشاف الحساسية
ترجع دراسة تاريخ ظاهرتي الأرجية allergie وفرط التحسس hypersinsibilité إلى عام 1837 حين سجل ماجندي Magendie الملاحظات الأولى حول هاتين الظاهرتين من دون أن يوثقهما تجريبياً. كما أن الدراسات الرائدة التي أجراها ريشه وبورتييه Richet et Portier في مطلع القرن العشرين جعلت من هاتين الظاهرتين لغزاً محيراً، ذلك أن الأمر كان يتعلق برد فعل يناقض الحماية المألوفة التي توفرها عادة الاستجابة المناعية. وعلى الرغم من أن دور الأضداد في إحداث ظاهرتي الأرجية وفرط التحسس قد اتضح بالدراسات التي أجراها براوسنيتز Prausnitz عام 1921 على مساعده كوستنر Kustner، إذ اكتشف هذا الباحث تفاعل التأق المنفعل anaphylaxie Passive، أو تفاعل براوسنيتز - كوستنر المعروف. وعلى الرغم من ذلك، فإن الأساس المناعي الواضح لظاهرتي الأرجية وفرط التحسس لم يثبت إلا في عام 1966، عندما اكتشف إيشيزاكا Ishizaka وزوجته في دنفر بالولايات المتحدة الأمريكية الغلوبلين المناعي (IgE)E، وبيّنا دور الخلايا البدينة mastocytes والخلايا الأسِسَة (الأسِسَات) basophiles في حدوث هاتين الظاهرتين. ولقد سمح اكتشاف المستأرجات allergenes التي تثير التفاعلات المؤدية إلى حدوث الأرجية لأول مرة في أواخر الستينات بوضع تعريف علمي محدد للأرجية وفرط التحسس العاجل يمكن تلخيصه على النحو التالي: تنجم هاتان الظاهرتان عن التأثير المتبادل بين المستأرج والغلوبلين المناعي (IgE)E، الذي يتثبت على سطح الخلية البدينة أو الخلية الأسسَه، مسبباً زوال الحبيبات الموجودة داخل هذه الخلايا، وتحرر محتوياتها من المواد الوسيطة médiateurs (الهيستامين histamine في الإنسان) المسؤولة عن التأثيرات الموضعية والعامة. أما أنماط فرط التحسس الأخرى غير فرط التحسس العاجل، فإنها تبدأ، هي الأخرى، بتفاعل الضد والمستضد، ولا تتطلب بالضرورة وجود IgE ولا تحرر الهيستامين. وكما يتضح مما سبق، فإن التفاعلات التي تنتهي بحدوث الأرجية وفرط التحسس تبدأ بتفاعل المستضد antigéne مع الضد anticorps.
وعلى ذلك فإن إيضاح الأساس المناعي لهاتين الظاهرتين يقتضي تلخيص الأفكار الأساسية عن الجهاز المناعي وعن الاستجابة المناعية، وذلك قبل عرض المعطيات المتوافرة عن الأرجية وفرط التحسس.
كيف تنشأ الحساسية
يتفاعل الشخص المصاب بالمرض مع مُستَأرِج معين أو عدة مُستأرجات كان الجسم قد تعرض لها من قبل. ويستطيع المُستأرج تحفيز الجسم لإنتاج بروتينات تسمى أجسامًا مضادة وتتفاعل المُستأرجات مع الأجسام المضادة بعد ذلك، حيث تفرز خلايا الجسم مواد معينة في الدم، وسوائل الجسم الأخرى. وتُسبب هذه المواد التي يُطلَق عليها اسم المواد الهـائية حدوث تفاعلات في خلايا أو أنسجة أخرى. ويُحتَمل أن يُسَبِب كثير من المواد الهائية تفاعلات الحساسية في الناس والحيوانات. ويعد الهستامين المادة الهائية الرئيسية التي تُسَبِب الحساسية عند الناس.
تؤثر المواد الهائية التي تُفرَز في الجسم على أنسجة تحسسية مستهدفة، تشمل معظم هذه الأنسجة الشعيرات الدموية (أوعية دموية صغيرة) أو الغدد المخاطية أو العضلات الملساء (عضلات المعدة وأعضاء داخلية أخرى باستثناء القلب). ويُحَدد موقع هذه الأنسجة في الجسم بالإضافة إلى استجابتها الخاصة لمواد هائية ـ المرض التحسسي المعين. كما يُسبب الهستامين بوجه عام تضخم الشعيرات الدموية وإفراز الغدد المُخاطية وشدًّا في العضلات الملساء.
وبعد إنتاج جسم شخص ما للأجسام المضادة استجابة لمُستأرِج معين، فإن أي تعرض لهذا المُستأرِج في المستقبل سوف يحرض على إنتاج الجسم المضاد. بيد أن هذه الأجسام المضادة التحسسية لا تسلك الطريقة نفسها التي تَسلكها الأجسام المضادة الدفاعية التي يُنتجها جسم الشخص عند مقاومته للعدوى. وتُكافح الأجسام المضادة الدفاعية الكائنات المسببة للمرض وتُدمرها أو تَجعلها غير ضارة. وإذا استمر الجسم في إنتاج تلك الأجسام المضادة، بعد تدمير الكائنات، يُحتَمل أن يكتسب الشخص مناعة ضد المرض.
عوامل انفعالية
لايفسر التفاعل بين المُستأرِج والجسم المضاد له موضوع الحساسية تفسيرًا وافيًا لأن الأنسجة التحسسية المستهدفة تكون تحت سيطرة الجهاز العصبي التلقائي أساسًا. يميل الجهاز العصبي إلى المحافظة على هذه الأنسجة لتكون في حالة توازن طبيعية. ولكن الجهاز العصبي التلقائي نفسه يدخل في استجاباتٍ بدنيةٍ أخرى، مثل الانفعالات. ولذلك فإن الانفعالات القوية تُؤثر أيضًا في تفاعل النسيج التحسسي المُستَهدَف. وتشمل أنماط الانفعالات التي تزيد من احتمال الاستجابة التحسسية الغضب والخوف والاستياء والقلق وعدم الثقة بالنفس.
وتشترك المراكز العصبية في الدماغ في الاستجابات الانفعالية، حيث يتحكم تحت المهاد البصري ـ وهو جزء من الدماغ ـ في الجهاز العصبي التلقائي ويوجهه. ويتأثرتحت المهاد البصري بدوره تأثرًا بَيِّنًا بقشرة المخ في الدماغ. فحينما تَصل مؤثرات معينة إلى الدماغ نتيجة رؤية أو سمع، فإنها تشكل رسالة في قشرة المخ. وإذا كانت الرسالة من الرسائل التي قد تُسبب أي نوع من الاستجابة الانفعالية، فإنها تتجه إلى تحت المهاد البصري (الوطاء) الذي يرسل بدوره حينئذ الرسالة إلى الأنسجة التحسسية المستهدفة عن طريق الجهاز العصبي التلقائي. وإذا استقبلت الأنسجة التحسسية المستهدفة رسالة انفعالية مؤلمة، فإنها تصبح أكثر قابلية للاستجابة للهستامين انظر: الدماغ.
عوامل وراثية
هناك أمراض حساسية، مثل الربو وحمى القش والإكزيما والتهابات الأنف والتحسسية الدائمة، وبعض أنواع الصداع التحسسي، كلها أمراض تميل إلى الانتشار في بعض العائلات. فقد يصاب فردٌ من أفراد أسرة ما بالربو ويصاب فرد آخر بحمى القش، وربما أصيب فردٌ غيره بالإكزيما وحمى القش. وقد لاحظ بعض الأطباء أن هناك نزعة وراثية للإصابة بالحساسية. فإذا كان الوالدان مصابين بالحساسية، فإن هناك احتمالاً بنسبة 75% أن يصاب كل طفل من أطفالهما بمرضٍ من الأمراض التحسسية. وإذا كان أحد الوالدين فقط مصابًا بالحساسية، فإن الاحتمال ينخفض إلى 50% أو أقل.
ويبدو أن النزعة الوراثية تجاه الحساسية لا تتبع أي قاعدة وراثية ثابتة، لذلك، فإنه من الأفضل أن يُقال عن الحساسية في هذه الحالات إنها عائلية على أن يقال إنها وراثية مباشرة.
حدود الحساسية
قد تؤثر عوامل كثيرة إلى جانب الانفعالات والوراثة في استجابة شخص ما إلى المُستأرِجات. فكل مرضى الحساسية لديهم حدود تحسسية وهي المستوى الخاص لمقاومة أجسامهم للمرض. وتختلف حدود الحساسية باختلاف نمط وخطورة العوامل المختلفة في وقت معين. على سبيل المثال، يعتمد احتمال ظهور مرض الربو من عدمه في بعض الناس ـ حينما يتعرضون لحبوب لقاح أو غبار ـ على حالتهم الانفعالية أو تغير الطقس. وقد يعتمد أيضًا على ما إذا كان المرضى مصابين بمرضٍ آخر أو أنهم مجهدون. فالزيادة في واحد أو أكثر من هذه العوامل قد تخفض مستوى حدود الحساسية للمريض بدرجة كافية لإحداث نوبة تحسسية. وعلى الجانب الآخر، فإن النقص في واحد أو أكثر من هذه العوامل قد يؤدي إلى رفع حدود الحساسية وانخفاض احتمالات النوبة.
وعندما يقوم اختصاصي الحساسية بتشخيص وعلاج أي حالة من حالات الحساسية، ينبغي عليه أن يضع في الاعتبار كل القوى المؤثرة على المريض التي قد تُسهِم في حالته. ويساعد هذا الأسلوب في معرفة السبب وراء طول المدة التي يستغرقها العلاج الدقيق للحساسية في حالات كثيرة.
التشخيص والعلاج
ليس هناك شفاء كامل من المرض. وقد يستطيع الناس تجنب أعراض مرض تحسسي معين، وذلك بتجنب المُستأرِج الذي يسببه، وبالرغم من ذلك، فإنهم يظلون حساسين لهذه المادة.
وعلى جانب آخر، من الممكن التحكم في الحساسية، حيث يمكن أن يقل معدل حدوث وخطورة النوبات، كما يمكن منع المضاعفات. وإذا ابتدأ العلاج في معظم الحالات بمجرد التعرف على الأعراض الأولى، واستمر على أُسس منتظمة، فإن هذا يؤدي إلى نتائج علاجية طيبة. وفي حالة عدم علاج الحساسية، فإنها تميل إلى الأسوأ أكثر من ميلها إلى الأحسن.
وفي بادئ الأمر، يفحص الطبيب المريض فحصًا بدنيًًا، ويُشخص وجود مرض تحسسي من خلال أعراض المرض. وتستخدم اختبارات جلدية دقيقة للتعرف على المُستأرِجات التي سببت المرض. ويحقن الطبيب أكثر المواد المسببة للحساسية شيوعًا، تحت الجلد مباشرة وذلك في مناطق متفرقة. وتؤدي المواد التي تسبب حساسية عند المريض لاحمرار الجلد وتورم خفيف في موضع الحقن. ويسبب هذا الإجراء بعض المتاعب الخفيفة،سرعان ما تزول.
بعد ذلك، يقارن اختصاصي الحساسية نتائج اختبار الجلد بنتائج الفحص البدني للمريض وتاريخه الطبي. ولا تُعطي اختبارات الجلد دائمًا إجابات مؤكدة، ولكنها تفيد كدلائل للتعرف على المُستأرجات. يساعد في التشخيص أيضًا اختبارات الدم وفحص عينات من المخاط الأنفي للمريض.
ولا يمكن التعرف على الحساسية الغذائية بوساطة اختبارات الجلد إذا كان الغذاء يسبب الإصابة بالحساسية فقط بعد تغيره خلال عملية الهضم. وللتأكد من هذه الحساسية التي يسببها الغذاء، يضع الطبيب الغذاء الذي يتناوله المريض تحت المراقبة. ويوصي اختصاصي الحساسية بتجنب تناول كل الأطعمة التي غالبًا ما تسبب الإصابة بالحساسية بوجه عام، وعدم إدراجها في وجبات المريض. قد يؤدي هذا الإجراء إلى تخفيف الأعراض. وإذا حدث ذلك يُوصي الطبيب بالعودة إلى تلك الأطعمة وإدماجها ضمن وجبات المريض، كل منها في وقت مختلف عن الآخر. وإذا انطلقت الحساسية مرة أخرى بعد أن يتناول الشخص أحد هذه الأطعمة، فإنه يحتمل أن يكون لديه حساسية لهذا الطعام.
وبعد التعرف على المادة أو المواد التي تؤدي إلى الإصابة بالحساسية، فإنه من الضروري أن يتجنبها المريض بقدر الإمكان. وقد يُصبح هذا الأمر سهلاً تمامًا إذا كانت المادة طعامًا، مثل الشيكولاتة أو شعرًا لنوعٍ من الحيوانات. أما إذا كان المُستأرِج غبار المنزل أو بذورًا من عشب، فإن الشخص قد يجد صعوبة بالغة في محاولة تجنبه.
وفي حالة عدم إمكانية تجنب المُستأرج، فإن الطبيب قد يُعطي المريض أدوية لتخفيف الأعراض. وتشمل هذه الأدوية مضادات الهستامين. وفي الحالات الشديدة جدًا يفضل استعمال الإستيرويدات.
يُفيد علاج يطلق عليه اسم إنقاص الحساسية أو إزالة الحساسية في بعض أنماط حساسية الجهاز التنفسي، وبخاصة الربو وحمى القش والتهاب الأنف التحسسي الدائم. ويَستَهدِف علاج إنقاص الحساسية على وجه التخصيص التفاعل بين المُستأرِج والجسم المضاد. ويَحْقِن الطبيب المريض بجرعة مُتناهية الصغر من حبوب اللقاح أو أي مُستأرج آخر بصفة مُنتظمة. وفي معظم الحالات، يُحقن المريض مرتين أسبوعيًا لمدة شهرين تقريبًا، ثم يُحقن مرةً واحدةً في الأسبوع بعد ذلك. ويزيد الطبيب من كمية المُستأرج تدريجيًا إلى أن يصل إلى جرعة يُطلق عليها اسم الجرعة الاستمرارية. وتُسبب الحقنات في هذه الحالة تكوين أجسام مضادة مع المُستأرجات، وهذا ما يؤدي بدوره إلى تفاعل ضئيل مع المستأرجات، التي تُتْرك طليقة بدون اتحاد مع الأجسام العادية المضادة للحساسية.
خلايا الجهاز المناعي
إذا كانت خاصة التعرف وخاصة اختزان المعلومات (الذاكرة) معيارين لدرجة تطور أجهزة جسم الإنسان، فإن الجهاز المناعي يأتي في المقدمة. إن خلايا الجهاز المناعي تستطيع أن تميز مكونات الجسم (الذات self أو soi)، من المواد الغريبة (اللاذات nonself أو nonsoi)، كما تستطيع الخلية الواحدة أن تتعرف جزيئات بروتينية معينة توجد على سطح خلية أخرى، فتستجيب بردود فعل محددة. كما يمكن لخلايا هذا الجهاز أن تختزن المعلومات الناجمة عن هذه الاستجابات، لتسترجعها عندما تقتضي الحالة ذلك. ومع أن معظم الكريات البيض تدخل في بنية الجهاز المناعي، فإن هذا البحث سيقتصر على الخلايا الرئيسة في هذا الجهاز، أي البلاعم macrophages والبائيات cllules B والتائيات cellules T. كما أن البحث لن نتعرض للجزيئات البيولوجية التي تفرزها هذه الخلايا (الأنترلوكينات interleukines واللمفوكينات lymphokines)، والتي تؤثر في مستوى الاستجابة المناعية.
البلاعم
تتشكل البلاعم، شأنها شأن خلايا الدم الأخرى، في نقي العظم، وتتجول في الدم واللمف. كما تصادف بين خلايا النسج الضامة لجميع الأعضاء تقريباً، وخاصة أسناخ الرئتين، والكبد، والطحال، والصفاق، إذ تصل إلى هذه الأعضاء من الشعريات الدموية بالانسلال diapédése. وتتصف البلعميات بشكلها المتغير وأرجلها الكاذبة، وغنى سيتوبلاسماها بالجسيمات الحالة المشحونة بعدد من الأنظيمات وخاصة الأنظيمات الحالة للبروتين. وتزداد كمية هذه الأنظيمات عند تفعيل البلعميات.
تقوم البلعميات بوظيفة تخليص الدوران والنسج من الأجسام الغريبة، فتدخل هذه الأجسام، بغض النظر عن طبيعتها، إلى سيتوبلاسماها بعملية الالتقام الخلوي endocytose، وتقوم عندئذ بحلمهة مكوناتها بوساطة أنظيمات الحلمهة. إن البلعميات تنجز إذن وظيفة دفاعية غريزية وغير نوعية. وإضافة إلى هذه الوظيفة المناعية البدائية فإن البلعميات تقوم في الفقاريات العليا، وخاصة الثدييات والإنسان، بوظيفة مناعية على درجة كبيرة من الأهمية، فهي لا تحلمه الأجسام الغريبة، وخاصة المستضدات، بغية التخلص منها فحسب، إنما تعرض على سطحها قطعاً من جزيء المستضد، يعرف باسم المحددة المستضدية determinant antigénique مربوطة إلى بروتين آخر موجود أصلاً على سطح البلعمية، وتعرف بمستضد الكريات البيض البشرية human leukocyte antigen (أو HLA-D، أصل الاسم بالإنكليزية)، وتشكل جزءاً من بروتينات معقد التوافق النسيجي الرئيسي أوcomplexe majeur d,histocompatibilité (أو CMH). فالجسم الغريب لا يصبح استضدادياً إلا إذا عرض على سطح البلعمية مرتبطاً بمستضد الكريات البيض البشرية HLA-D، حيث تستطيع الخلية التائية تعرّفه. إن البلعمية إذن تقوم بدور خلية مقدِّمة للمستضد (CPA) cellule presentant L,antigene. إن الاستجابة المناعية لا تحدث من دون هذا التقديم.
البائيات
اكتشف هذه الخلايا أول مرة عند الطيور في جراب فبريسيوس bourse de Fabricius (ومن هنا أتى الحرف B اسماً لهذه الخلايا). وتتشكل هذه الخلايا عند الإنسان والثدييات في نقي العظم (bone marrow - بالإنكليزية - ولهذا استبقي الاسم نفسه)، وتتمايز فيه، أي إن كل خلية بائية تصطنع نوعاً معيناً من الغلوبلين المناعي M و D (IgM) و(IgD) تضعه على سطحها فيعمل مستقبلاً نوعياً للمستضد. وتختلف نوعية كل مستقبل في كل خلية بائية عن نوعية أي مستقبل آخر في أية خلية أخرى. ويقدر عدد أنواع البائيات الوظيفية في الإنسان بنحو 1×10 7 نوع أو نسيلة clone، في حين يبلغ عدد البائيات الكلي نحو 1×10 10 خلية. وهكذا، فإن عدد خلايا النسيلة الواحدة يبلغ 1×10 3 خلية تقريباً. وكما سيأتي، فإن تفعيل الخلية البائية من قبل الخلية التائية يؤدي إلى نضجها.
ويتضمن النضج انقسام الخلية البائية عدداً من المرات، حيث تعطي في النهاية نمطين من الخلايا، يبلغ مجموعها نحو ألف خلية وهي: الخلايا المَصوَّرية plasmocyte، التي تفرز أضداداً نوعية ضد المستضد الذي استهل الاستجابة المناعية، وخلايا الذاكرة cellules à mémoire، التي تبقى هاجعة مدة طويلة نسبياً (أحياناً بضع سنوات)، فإذا ما دخل المستضد من جديد، فإنها تتعرفه وتبدأ بإفراز الضد النوعي. وكما هو معروف فإن الضد يرتبط بمستضده في الدوران، ويتشكل معقد يسهل على الجسم التخلص منه. وكما يتضح من هذا العرض فإن البائيات مسؤولة عن المناعة الخلطية immunité humorale. وتجدر الإشارة هنا إلى أن عدد أنواع الأضداد التي تصطنعها البائيات يساوي عدد نسائلها (أي نحو 1×10 7 نوع، ويتجاوز هذا العدد نظرياً الرقم 1×10 9 نوع).
التائيات
لقد تم تعرف هذه الخلايا لأول مرة في التيموس thymus، ومن هنا أتى الحرف T اسماً لهذه الخلايا. تتشكل التائيات في نقي العظم، وتنتقل بالدوران إلى التيموس، حيث تتمايز فيها وتنضج (تخضع لعملية تربية).
أي تصطنع بروتينات تضعها على سطحها تعرف بمستقبلات الخلية التائية، وهي أداة المعرفة الأولى لهذه الخلايا. وتختلف هذه المستقبلات بين خلية وأخرى. وتتساوى التائيات تقريباً مع البائيات من حيث العدد الكلي ومن حيث عدد النسائل (أي 1×10 10 خلية، و1×10 7 نسيلة). إن تمايز التائيات ونضجها في التيموس يؤدي إلى تربية ثلاثة أنماط من التائيات: التائيات المؤازرة T helpers والتائيات الكابتة Tsuppressives والتائيات السامة للخلاياT cytotoxiques. وتتفعل الخلية التائية عندما تلتقي بالمستضد معروضاً على سطح البلعمية، أو على سطح الخلية التائية عندما تلتقي بالمستضد معروضاً على سطح البلعمية، أو على سطح الخلية البائية (التي تدخل بالالتقام الخلوي، تماماً كما تفعل البلعمية). فتصبح هذه الخلية التائية خلية تائية مساعدة نوعية، وتقوم عندئذ بتفعيل الخلية البائية التي تحمل على سطحها نوع المحددة المستضدية نفسه، التي عرضتها البلعمية، مرتبطة أيضاً ببروتين HLA- Dأما الخلية التائية الكابتة فتثبط فاعلية الخلية التائية المساعدة والخلية البائية المفَعَّلة عندما يرتفع تركيز الضد في الدم فوق مستوى معين. وتتعرف الخلية التائية القاتلة للخلايا الخلية المخموجة بالحمة (بالفيروس)، والخلية الطافرة، وخلية الطعم (في حالة النسج والأعضاء المزروعة)، وتعمل على حلها.
ويتضح من هذا العرض أن المناعة الخلوية Immunité cellulaire ترتبط ارتباطاً أساسياً بوظائف نمط من أنماط الخلية التائية (التائيات القاتلة للخلايا). ولا بد من التنويه هنا بنوع خلوي ذي أصل مجهول حالياً، يرجح أنه ينتمي إلى التائيات، ويعرف باسم القاتلة الطبيعية NK- natural killer (أصل الاسم بالإنكليزية)، وتقوم هذه الخلايا، هي الأخرى، بقتل الخلايا الغريبة، أو الطافرة، عن طريق إطلاق جذور كيمياوية غنية فوق الأكاسيد، تحرق الخلية الهدف.
الاستجابة المناعية
تتلخص الوظيفة النهائية للاستجابة المناعية بحماية الجسم من المواد الغريبة (البروتينات والجراثيم، والفيروسات، والفطور، والطفيليات وغيرها). وتنجز المناعة الخلطية وظيفة التخلص من الأجسام الغريبة الموجودة بالدوران، إذ تعمل هذه الأجسام، أو مكوناتها، مستضدات، فيشكل لها الجسم أضداداً تتحد بها، فينشأ عندئذ معقد يسهل على الجسم التخلص منه بوساطة البلاعم macrophages والبعلميات phagocytes عامة. أما المناعة الخلوية، فتحمي الجسم من الحمات (الفيروسات)، والطفيليات، والخلايا الطافرة، كما تقوم بدور في رفض الطعم، ذلك أن عملية نقل الأعضاء لا تحدث في الطبيعة، وهي عمل صنعي استحدثه الإنسان. يتضح من التعريف السابق أن الاستجابة المناعية تشتمل على جانبين اثنين:
1ـ التأثيرات المتبادلة المناعية. 2ـ خصائص الأضداد. وفيما يلي لمحة عن هاتين الناحيتين.
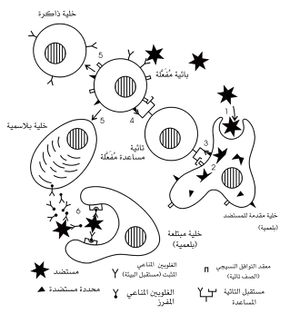
مراحل حدوث الاستجابة المناعية: تحدث الاستجابة المناعية وفقاً للخطوات التالية (الشكل1):
ـ دخول المستضد إلى الجسم، ويشترط في هذا المستضد أن يكون مستمنعاً immunogénique.
ـ يؤخذ المستضد من قبل إحدى البلعميات أو بعضها، ومن قبل خلية بائية محددة تحمل على سطحها مستقبلاً (IgD و IgM) تتطابق منطقته المتغيرة فراغياً region variable بالتتامية complémentarité مع المحددة المستضدية، أو الموضع المستضدي épitope.
ـ تتعرف خلية تائية معينة المحددة المستضدية المرتبطة مع بروتين HLA- D والمعروضة على سطح البلعمية، فتتفعل الخلية التائية عندئذ، وتتحول إلى خلية تائية مساعدة.
ـ تقوم الخلية التائية المساعدة بتفعيل الخلية البائية التي تعرض على سطحها نوع المحددة المستضدية نفسه. فتنقسم عدداً من المرات (نحو عشرة انقسامات) وتعطي 1000 خلية تقريباً (تشكل نسيلة واحدة)، معظمها يتحول إلى خلايا مصوّرية، تصطنع ضداً نوعياً، تفرزه في الدوران، في حين يتحول بعضها إلى خلايا ذاكرة، محتفظة على سطحها بالغلوبلين المناعي D، تتحول إلى خلايا مصورية (بلاسمية) مفرزة للضد عند دخول المستضد الجسم مرة ثانية. فإذا كان المستضد موجوداً في الدوران، فإن الضد الذي تفرزه الخلايا المصورية ينتسب إلى أحد صفيفات صف الغلوبلين المناعي G (IgG2 و IgG1 مثلاً). أما إذا كان المستضد موجوداً في أحد السوائل الإفرازية (اللعاب، والدموع، والعصارة الهضمية وغيرها)، فإن الغلوبلين المناعي المفرز هو (IgA) A. وإذا كان المستضد مادة مستأرجة allérgene (حبات الطلع أو الغبار المنزلي مثلاً)، فإن الغلوبلين المناعي المفرز هو IgE. وعندما يكون المستضد خلية مخموجة بالحمة (فيروس) أو خلية طافرة، أو طفيلياً (دودة البلهارسيا مثلاً)، أو خلايا من طعم أو عضو مزروع، فإن الخلية التائية التي تكتشف هذه الأجسام الغريبة تتفعل، وتصبح خليةً قاتلة للخلايا.
خصائص الأضداد
توجد في الثدييات ومنها الإنسان خمسة صفوف classes من الغلوبلين المناعي immunoglobulines (Ig)، هي: IgM، وIgD، و IgG، و IgA، و IgE. وتتألف الصفوف IgM، و IgG، و IgA. من صفيفات sous- classes. وتحمل كل خلية بائية عذراء على سطحها نوعاً محدداً من IgM و IgD. وعندما تُفعل وتنضج، فإنها تفرز في الدوران IgM خماسي الجزيء.
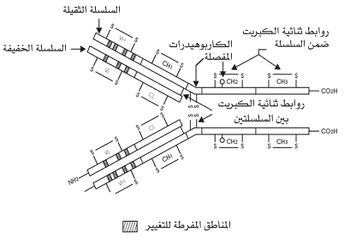
يتألف جزيء الضد، بصورة عامة، من نوعين من السلاسل المتعددة الببتيد: سلسلتين ثقيلتين، يرمز لكل منهما بالحرف H (من heavy)، وسلسلتين خفيفتين، يرمز لكل منهما بالحرف L (من light) هما السلسلة لامدا والسلسلة كابا. أما السلسلة الثقيلة فلها خمسة أنواع، يحدد كل نوع صفاً من صفوف الغلوبلين المناعي، أي أن هنالك السلاسل الثقيلة التالية: ميو، ودلتا، وغاما، والفا، وابسيلون (أعطيت السلاسل أحرفاً يونانية تماثل الأحرف اللاتينية للصفوف). وتتألف كل سلسلة من قسمين، ثابت C (من constant)، ومتغير V (من variable). وتشكل المنطقة الثابتة في السلسلة الثقيلة ربع السلسلة أو خمسها، وتتقاسم المنطقتان الثابتة والمتغيرة السلسلة الخفيفة مناصفة تقريباً. وهنالك روابط ثنائية الكبريت تربط السلاسل بعضها ببعض (روابط ضمن نوع السلسلة الواحدة، وروابط بين السلسلتين الثقيلة والخفيفة). ويأخذ الجزيء (الشكل2) شكل حرف Y منفلق الأطراف، يتألف جذعه من نصفي السلسلتين الثقيلتين، في حين يتألف كل ذراع من نصف السلسلة الثقيلة تقريباً وكامل السلسلة الخفيفة. وتأخذ نهاية كل ذراع من الذراعين (نهاية المنطقتين المتغيرتين للسلسلتين الثقيلة والخفيفة) شكلاً فراغياً محدداً، يبدو على شكل جيب سطحي، يطلق عليه اسم الموضع الضدي site d,anticorps (أو paratope). ويختلف نوع الغلوبلين المناعي باختلاف الشكل الفراغي لهذا الجيب. فهناك إذن نحو 1×10 7 نوع من الأشكال الفراغية، الذي يمثل كل واحد منها نسيلة من النسائل الخلوية البائية.
ويلخص الجدول (1) بعض خصائص صفوف وصفيفات الغلوبلينات المناعية.
ولا تخرج ظاهرتا الأرجية وفرط التحسس عن كونهما نمطين خاصين من أنماط الاستجابة المناعية المتطرفة.
الأرجية
تنجم ظاهرة الأرجية وفرط التحسس العاجل hypersensibilité immediate كما أشير في البدء عن التأثير المتبادل بين المستضد (المستأرج) وبين أحد صفوف الغلوبلين المناعي، وخاصة IgE الذي يتثبت على سطح الخلايا البدينة أو الأسسه، مسبباً تحرر الهيستامين الذي كان يوجد داخل هذه الخلايا. وقد قدمت الظاهرتان في تعريف واحد لأن الأرجية تدرس الآن على أنها شكل خاص من أشكال فرط التحسس العاجل. ولا بد من التأكيد أن تحرر الهيستامين والمواد الوسيطة الأخرى في الاستجابة المناعية السوية المتوازنة هو عمل دفاعي يسهم في
| الگلوبلين المناعي | IgG1 | IgG2 | IgG3 | IgG4 | IgM | IgA1 | IgA2 | SIgA | IgD | IgE |
|---|---|---|---|---|---|---|---|---|---|---|
| السلسلة الثقيلةاگاما 1 | غاما 2 | غاما 3 | غاما 4 | ميو | الفا 1 | الفا 2 | الفا 1 أو الفا 2 | دلتا | ابسيلون | |
| متوسط التركيز في المصل (ميكرو غرام/ميلي لتر) | 9 | 3 | 1 | 0.5 | 1.5 | 3.0 | 0.5 | 0.05 | 0.03 | 0.0005 |
| ثابت التثفل (مقدراً بالوحدة س) | 7 | 7 | 7 | 7 | 19 | 7 | 7 | 11 | 7 | 8 |
| الوزن الجزيئي (كيلو دالتون) | 146 | 146 | 170 | 146 | 970 | 60 | 160 | 385 | 184 | 188 |
| الوزن الجزيئي للسلسلة الثقيلة | 51 | 51 | 60 | 61 | 65 | 56 | 52 | 25-56 | 69.7 | 72.5 |
| السكريات (%) | 2-3 | 2-3 | 2-3 | 2-3 | 12 | 7-11 | 7-11 | 7-11 | 9-14 | 12 |
التخلص من المستضد ومن تأثيراته الممرضة (في حالة الخمج بالجراثيم مثلاً). أما في الأرجية وفرط التحسس العاجل فإن الاستجابة المناعية تكون عنيفة، وتُحرر، بالتالي، كمية كبيرة من الهيستامين والأمينات الأخرى الفاعلة وعائياً.
توجد الأرجية في نحو 10 بالمئة من السكان، وتنجم إما عن غبار الطلع لعدد من النباتات، وإما عن الغبار المنزلي (الذي يحوي مفصليات أرجل دقيقة جداً تدخل الجسم عن طريق التنفس)، وإما عن وبر الثدييات أو رياش الطيور. كما يمكن أن تكون الأغذية مصدراً للأرجية لدى بعض الأفراد. ويتطلب حدوث الاستجابة المناعية الأرجية دخول المستأرج الجسم في المرة الأولى، مما يسبب تحسيس الفرد نحو هذا المتسأرج، أي إن الخلايا البائية تصطنع الغلوبلين المناعي (IgE)E. الذي يصبح في الدم، فيرتبط عندئذ بسطح الخلايا البدينة أو الأسسة. ولدى دخول المستأرج الجسم في المرة الثانية يحدث التفاعل الأرجي.
ولأن التماس الأول مع المستأرج يسبب تشكل الغلوبلين المناعي E (التحسيس) فلقد صُمم اختبار من قبل الباحث أوفاري Ovary عام 1964 للكشف في ثدييات المخبر عن وجود IgE فعال نحو مستأرج معين. وتؤخذ، في هذا الاختبار، كمية معينة من مصل أحد الثدييات (الفأر مثلاً) الذي يحتوي على IgE نوعي نحو مستضد معين، وتحقن تحت جلد الجرذ.
ويتم في اليوم التالي حقن الجرذ عن طريق الوريد (بعيداً عن مكان الحقن الأول) بمحلول المستضد نفسه والذي أضيف إليه صباغ أزرق ايفانbleu d,Evans. وحيثما يلتقي المستضد بالغلوبلين المناعي E، الذي يكون عادة مثبتاً على سطح الخلايا البدينة للجلد، وخاصة في منطقة الحقن الأولى، يتم تحرر السيروتونين sérotonine والمواد الوسيطة الأخرى. وتسبب هذه المواد توسع الأوعية الدموية وزيادة نفوذيتها، مما يؤدي إلى تسرب جزيئات الصباغ من الشعريات الدموية في منطقة الحقن الأولى إلى النسج المحيطة، فتظهر عندئذ بقعة زرقاء. ويتناسب قطر البقعة الزرقاء مع كمية IgE التي حُقنت تحت الجلد. ولقد أطلق على هذا الاختبار تفاعل التأق الجلدي المنفعل reaction d,anaphylaxie cutanée passive (لأن الأضداد أتت من خارج الجسم). إن هذا التفاعل على درجة عالية من الحساسية، ويمكن الكشف بوساطته عن نانوغرام واحد فقط (1×10 –9 غرام) من IgE.
أما في الإنسان، فيستخدم تفاعل بروسنيتز - كوستنر الذي يماثل أساساً تفاعل التأق الجلدي المنفعل. تُؤخذ في هذا الاختبار كمية محددة وتُحقن تحت الجلد في فرد متطوع لا أرجي. وإثر انقضاء يوم أو يومين، يحقن المستضد في منطقة الحقن الأولى، فإذا كان الضد IgE موجوداً في المصل الذي حقن أولاً، فإن الموقع الجلدي ينتفخ محمراً، ويأخذ شكل دولاب. وهذا ما يعرف أيضاً بتفاعل الدولاب والحُمامى reaction de roue d,érythéme، ويعبّر قطر الدولاب كما هي الحال في تفاعل أوفاري، تعبيراً دقيقاً عن تركيز الضد IgE الذي حقن في المرة الأولى.
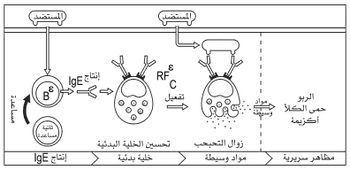
أما فيما يتعلق بآلية حدوث الاستجابة المناعية الأرجية، فتمر في طورين اثنين: طور التحسس، وطور فرط التحسس. ويمكن تلخيص الآلية الجزئية للأرجية على النحو التالي:
ينتهي وصول المستأرج إلى الدم إلى ارتباطه بمستقبل نوعي على سطح إحدى الخلايا البائية.
كما تأخذ هذا المستأرج إحدى البلعميات بالالتقام الخلوي، وتحلمهه، وتعرض مكونه الاستضدادي الاستمناعي على سطحها، مقروناً إلى بروتين الصف الثاني لمعقد التوافق النسيجي CMH، أي بروتين HLA-D. تتعرف عندئذ إحدى الخلايا التائية هذا المعقد، وتتحول إلى خلية تائية مساعدة، تُفَعِّل الخلية البائية التي صادفت المستأرج. تنقسم هذه الخلية عدداً من المرات، وتفرز الخلايا المصورية (البلاسمية) المشتقة منها الضد IgE النوعي للمستأرج. إن جزيء الضد هذا يرتبط بمنطقته الثابتة بمستقبلات خاصة على سطح الخلية البدينة أو الأسسة، وهذا هو طور التحسيس.
وعندما يدخل المستأرج الجسم من جديد، فإن كل جزيء منه يرتبط بجزيئين من IgE مثبتين على سطح الخلية البدينة أو الأسسة.
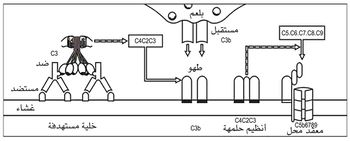
ويثير هذا الارتباط سلسلة من التفاعلات، تنتهي بتمزق الحويصلات الموجودة داخل هذه الخلايا، وتحرر محتوياتها من الهيستامين والمواد الوسيطة الأخرى. وتعرف هذه الظاهرة بزوال تحبحب dégranulation الخلايا البدينة. وهذا هو طور فرط التحسس. ويمثل الشكل 3 آلية حدوث الاستجابة المناعية الأرجية.
ولا بد من الإشارة إلى أن الدراسات الوبائية قد أظهرت وجود استعداد وراثي للإصابة بالأرجية. فلقد اتضح أن احتمال إصابة الأبناء المنحدرين من أبوين أرجيين هو قرابة ضعف الاحتمال الموجود لدى أبناء منحدرين من أبوين أحدهما أرجي، وإن هذا الاحتمال الأخير هو ضعف الاحتمال الموجود لدى أفراد منحدرين من أبوين كلاهما غير أرجي.
فرط التحسس
 مقالة مفصلة: فرط التحسس
مقالة مفصلة: فرط التحسس
ينجم فرط التحسس عن استجابة مناعية متطرفة. فعندما يتعرض المرء لمستضد كان قد تعرض له مسبقاً تحدث استجابة مناعية، تكون عادة سوية متوازنة، وظيفتها الدفاع عن الجسم.
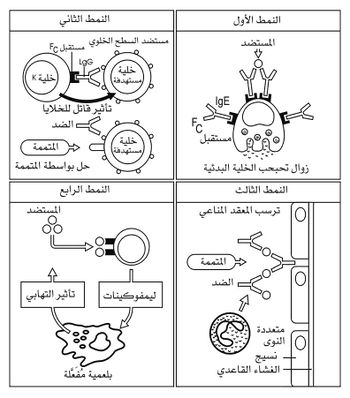
ولكن يحدث في بعض الأحيان أن يكون التفاعل المناعي عنيفاً، فيؤدي عندئذ إلى تلف نسيجي، تتوافق أهميته ومدى إفراط الاستجابة المناعية. وهذا ما يحدث عندما يكون تركيز المستضد مرتفعاً، أو عندما يكون مستوى الحالة المناعية الخلطية والخلوية عالياً. ووفقاً للدراسات التي قام بها كومبس Coombs وغيل Gell عام 1975 يمكن تصنيف حالات فرط التحسس في الأنماط الأربعة التالية (الشكل 4):
النمط الأول: فرط التحسس العاجل hypersensibilité immediate، وتشكل الأرجية الظاهرة الرئيسة في هذا النمط.
النمط الثاني: فرط التحسس السام للخلايا المنوط بالضد hypersensibilité cytotoxique dépendant d,anticorps
النمط الثالث: فرط التحسس ذو المعقد المناعي hypersensibilité à le complexe immun.
النمط الرابع: فرط التحسس الآجل hypersensibilité retardée وفيما يلي الملامح الأساسية لكل نمط من هذه الأنماط.
1ـ فرط التحسس العاجل: تمثل ظاهرة الأرجية الجانب الأساسي في فرط التحسس العاجل.
والتأثير الضار للاستجابة المناعية المتطرفة غالباً ما يكون محدوداً، بيد أن هناك فرط تحسس عاجل، يتناول الجسم بكامله، ينتهي بالمصاب إلى الموت. ولقد لوحظت ظاهرة فرط التحسس العاجل الشامل هذه، أول ما لوحظت، في خنزير الهند (القبيعة) cobaye. فإذا حُقن هذا الحيوان بمقدار ميلي غرام واحد من مستضد بروتيني ما، كألبومين البيض مثلاً، فإن الحيوان لا يبدي أية ردود فعل مناعية ظاهرية، أما إذا كُرر الحقن بعد انقضاء أسبوعين أو ثلاثة على الحقن الأول، فإن القبيعة التي تم تحسيسها بالحقن الأول (طور التحسيس، يرجع إلى الأرجية) ترد رداً عنيفاً، ويحدث فيها تأق شامل فتعاني من أزيز ربوي wheezing حاد، وتموت بعد بضع دقائق اختناقاً نتيجة التضيق الشديد في المجاري التنفسية، وينجم هذا التضيق عن التقلص العنيف للعضلات الملس. ويرافق ذلك توسع واضح في الأوعية الشعرية الدموية (طور فرط التحسس).
وتحدث هذه الأعراض نتيجة زوال تحبحب الخلايا البدينة والأسسة، وتحرر كميات كبيرة من الهيستامين، والأمينات الأخرى الفاعلة وعائياً amines vasoactives ويمكن القول إن فرط التحسس العاجل هو تفاعل أرجي شامل ومبالغ فيه.
2ـ فرط التحسس السام للخلايا المنوط بالضد: يمكن تعريفه بأنه استجابة مناعية يستهلها تفاعل ضد نوعي مع مستضد خلوي أونسيجي وتنتهي هذه الاستجابة بتدمير الخلايا الهدف والنسج المحيطة بها. إن الاستجابة المناعية تحدث إذن بسبب وجود خلايا أو نسج غريبة، تعمل بروتينات أغشيتها مستضدات.
كما أن تدمير هذه العناصر اللاذاتية يتطلب إسهام المتممة complément، أو خلايا مستفعلة cellules effectrices، كالقاتلات الطبيعية NK والعدلات neutrophiles، والبلاعم، والوحيدات monocytes ويبدو إسهام هذه العناصر اللاخلوية (المتممة) والخلوية أمراً بديهياً إذا عرف أن الاستجابة المناعية موجهة نحو خلايا ونسج (كالخلايا الطافرة والطفيليات - دودة البلهارسيا مثلاً - والأعضاء المزروعة)، ليس ضد جزيئات بروتينية منحلة.
إن القطاعين الثابتين الثاني والثالث من السلسلة الثقيلة للجزيء، واللذين يعرفان بالرمزين CH2 و CH3، ويشكلان جذع حرف Y. إن هذين القطاعين يحملان مستقبلاً نوعياً للمتممة، ومستقبلاً نوعياً آخر للوحيدات، وربما للقاتلات الطبيعية والعدلات أيضاً. وتحدث عملية تدمير الخلايا الغريبة عندما يتم تفعيل المتممة أو الخلايا المستفعلة المشار إليها آنفاً بارتباطها بالمستقبل النوعي في جزيء الضد المقترن بالمستضد، يؤدي هذا التفعيل إلى حل lysis غشاء الخلية الهدف، أو حرقها بالجذور الغنية بفوق الأكاسيد. ويلخص الشكل 5 آلية تأثير المتممة في ظاهرة فرط التحسس القاتل للخلايا المنوط بالضد (النمط الثاني).
والمتممة هي جملة أنظيمات بروتينية تشاهد في مصل الدم السوي، وتتحد مع المعقد المستضدي - الضدي antigen- antibody.
تتألف المتممة من تسعة مركبات يرمز إلى كل واحد منها بالحرف C وتعطي أرقاماً متسلسلة من C1 حتى C9. وتنقسم C1 إلا ثلاثة أقسام هي: C1S و C1r و C1q.
تحل جملة المتممة الخلايا التي تم تحسيسها بالضد النوعي فتسبب حل الجراثيم والكريات الحمر، كما أنها تقوي تأثير التفاعل بين المستضد والضد. إن أي ضد من صنف IgG أو IgM قادر على تفعيل activation العامل الأول C1 وهذا بدوره يفعِّل C4 و C2 وهما يفعلان C3 وهو العامل الموجود بمقادير أوفر من سواه في مصل الدم. ثم تتفعل العوامل التالية واحداً بعد آخر بالترتيب الرقمي ليتم تفعيل الجملة بكاملها.
تنشطر جزيئات C3 المفعلة إلى C3a الذي ينطلق وC3b الذي يبقى متصلاً بالمستضد. يقوم C3a بعمل ذيفان متئق anaphylatoxine فيسبب انطلاق الهيستامين وسائر الكينينات Kinins فيحدث توسعاً وعائياً وازدياداً في نفوذية الأوعية وتقبضاً في القصبات. كما أنه يجتذب كثيرات النوى وسائر الخلايا الالتهابية إلى مكان التفاعل الالتهابي بآلية كيمياوية.
أما الجزيء C3b فيتحد مع C1 و C4 وC2، على سطح الخلية المستهدفة target ويحرض على التصاق البلاعم وكثيرات النوى بها، ومن ثم بلعمة المعقدات المناعية.
ويكون عمل C5 و C6 وC7 اجتذاب كثيرات النوى وسائر الخلايا الالتهابية إلى مكان التفاعل الالتهابي. ويحدث تفعيل C8 و C9 تخرب الغشاء الخلوي إذا جرى التفاعل على جرثومة أو كرية حمراء.
3ـ فرط التحسس ذو المعقد المناعي:
من المعروف أن يتم في كل مرة يلتقي فيه ضد بمستضده تشكل معقد مناعي يتخلص الجسم منه عادة بخلايا الجهاز البطاني الشبكي. ولكن يحدث في بعض الحالات أن يثير تشكل هذا المعقد تفاعل فرط التحسس. وهذا هو فرط التحسس ذو المعقد المناعي. ويمكن تصنيف الحالات المرضية التي تنجم عن فرط التحسس هذا في مجموعات ثلاث: ففي المجموعة الأولى عندما يكون هناك خمج مزمن، كالتهاب الشغاف الذي تسببه المكورات العقدية من النمط الفا الحالّة للدم أو المكورات العنقودية، أو كالبرداء paludisme، التي تسببها المتصورة النشيطة plasmodium vivax أو التهاب الكبد الحُمَوي (الفيروسي) المنشأ hépatite virale فإن استمرار وجود العامل الخمجي المترافق مع استجابة مناعية ضعيفة، يؤدي إلى تشكل معقدات مناعية تترسب تدريجياً في النسج المصابة.
وفي المجموعة الثانية، تنجم عن بعض الأمراض ذات المعقدات المناعية مضاعفات تزيد من حدة عدد من أمراض المناعة الذاتية maladies auto- immunes. ذلك أن التشكل المستمر لأضداد موجهة باستمرار إلى تكوّن معقدات مناعية. ولأن البلاعم والبلعميات الأخرى المسؤولة عن التقام الأجسام الغريبة، تكون مثقلة بهذه المعقدات. فإن هذه الجزيئات تترسب في النسج المعنية. وهذه هي حالة الذَّأَب الحُمامي المنتشر lupus érythémateux disséminé (LED).
وفي المجموعة الثالثة، يمكن أن تتشكل المعقدات المناعية بوجود مستضدات «خارجية المنشأ»، وهذا ما يحدث في الرئتين مثلاً نتيجة الاستنشاق المتكرر لمستضدات نباتية أو فطرية أو حيوانية المنشأ، ويمكن ملاحظة هذه الظاهرة في الأسناخ الرئوية الأرجية بمستأرج خارجي المنشأ، وذك كما هي الحال في رئتي مفرطي التدخين، أو الفلاحين الذين يتعرضون باستمرار للكلأ الرطب إذ تتشكل في دمائهم أضداد مضادة لعدد من الفطور، أو مربي الطيور الذين يستنشقون باستمرار حُمات (فيروسات) طيرية. إن الأضداد التي تتشكل ضد هذه المستضدات ليست IgE الذي يسبب عادة فرط التحسس العاجل (النمط الأول)، إنما هي IgG بصورة أساسية.
وبديهي، وفقاً لما سبق، أن يسبب فرط التحسس ذو المعقد المناعي التهاب النسج التي تصبح مكاناً لترسب هذا المعقد، وغالباً ما ينجم هذا الالتهاب عن تفعيل بروتيني المتممة C3 و C5 (يرجع إلى النمط الثاني من فرط التحسس).
ويتضمن هذا التفعيل شطر كل من المركبين C3 و C5 إلى قطعة كبيرة هي C3b أو C5b، وقطعة صغيرة هي C3a، أو C5a. وتتمتع القطعتان C3a و C5a بخاصتين أساسيتين: فهما ذيفان مُتئق، وجاذب كيماوي chimiotactique. إن وجود هذين البروتينين في نسيج ما يسبب تحرر الأمينات الفاعلة وعائياً amines vasoactives من الخلايا البدينة ومن الأسسات، مما يؤدي إلى ازدياد النفوذ الوعائي وتوارد عدد كبير من متعددات النوى. إن توضع المعقد المناعي في النسيج المعني يجعل التقامها من قبل متعددات النوى التي انجذبت إلى ذلك الموضع أمراً صعباً.
ويدفع هذا الوضع بمتعددات النوى لتحرر أنظيمات جسيماتها الحالّة في النسيح المصاب، مما يؤدي في نهاية الأمر إلى تكوّن آفة نسيجية تنكسية.
ويمكن دراسة تفاعل أرتوس reaction d,Arthus طرازاً تجريبياً لفرط التحسس ذي المعقد المناعي، الذي يُعد ارتكاساً موضعياً ينجم عن وجود مستضد خارجي المنشأ.
ويعمد عملياً إلى إيضاح تفاعل أرتوس في منطقة محددة من الجسم تحتل جدار وعاء دموي وجزءاً من المنطقة المحيطية بهذا الجدار، وغالباً ما يبرهن على حدوث هذا التفاعل في الجلد. ويتم عادة تحسيس حيوان التجربة بإعطائه جرعات منتظمة من المستضد حتى يرتفع تركيز الضد القابل للترسب، وخاصة الغلوبلين المناعي (IgG) G ارتفاعاً واضحاً، وحينما يحقن المستضد تحت الجلد يحدث تفاعل التهابي، يبلغ ذروته في 4 إلى 10 ساعات (وسطياً 5 إلى 6 ساعات). وتتشكل في منطقة الحقن وذمة يتناسب حجمها وكمية المستضد المحقونة. وغالباً ما يترافق هذا التشكل مع حدوث نزف داخلي. ويتراجع التفاعل تدريجياً، ولا تبقى منه إلا آثار محدودة بعد 24ساعة.
لقد بينت الدراسات التي استخدمت فيها تقنية التألق المناعي immunofluorescence أن المستضد، والضد، والمتممة تترسب كلها على جدار الوعاء الدموي المعني، ويعقب هذا الترسب اجتياح متعددات النوى تلك المنطقة، مما يؤدي إلى تكدس الصفيحات، التي قد تسبب، في الحالات المتطرفة، انسداد الوعاء، وحدوث نخر خلوي. ويتم بعد مضي مدة تراوح بين 24 و 48 ساعة على عملية الحقن الاستعاضة عن عديدات النوى بعدد مماثل من وحيدات النوى، ترافقها أحياناً بعض الخلايا المصورية (البلاسمية). ولقد أوضحت هذه الدراسات أيضاً أن تفعيل المتممة شرط أساسي لحدوث تفاعل أرتوس، وأن غياب عديدات النوى يجعل التفاعل مقتصراً على وذمة متوسطة الحجم غير مترافقة مع نزف داخلي.
إن شدة التفاعل، كما هو متوقع، ترتبط بنسبة الضد إلى المستضد، إذ أن كمية المعقدات المتشكلة في حال تعادل تركيز عنصري التفاعل تكون أعلى مما لو كانت هنالك زيادة في الضد، أوزيادة في المستضد. ويكون التفاعل في الحالتين الأخيرتين كلتيهما أقل حدة.
4ـ فرط التحسس الآجل: بناء على التصنيف الذي وضعه كومبس وغيل فإن ظاهرة فرط التحسس الآجل (فرط التحسس ذي الوساطة الخلوية hypersinsibilité à mediation cellulaire) تضم كل حالات فرط التحسس التي يتطلب ظهور الأعراض فيها أكثر من اثنتي عشرة ساعة، خلافاً لأنماط فرط التحسس الثلاثة السابقة، فإن فرط التحسس الآجل لا يمكن نقله من حيوان إلى آخر بوساطة المصل إنما يمكن نقله بالخلايا التائية، التي تؤدي، على ما يبدو، دوراً بارزاً في فرط التحسس الآجل.
ويجمع المؤلفون على أنه يمكن وضع حالات فرط التحسس الآجل كافة في أربع مجموعات، تضم الثلاث الأولى منها حالات فرط التحسس التي يحتاج ظهور الأعراض فيها إلى مدة تراوح بين 12 و 72 ساعة بعد دخول المستضد الجسم.
أما في المجموعة الرابعة فإن ظهور الأعراض يتطلب أسابيع. ولكن على الرغم من هذا التصنيف، الذي اتُخذ فيه زمن ظهور الأعراض معياراً أساسياً، فإن فرط التحسس الذي يصيب الأفراد غالباً ما تدخل أعراضه في أكثر من مجموعة، كما يمكن للمستضد الواحد أن يثير فرط تحسس يمكن تصنيف مراحله في مجموعتين مختلفتين، تتعاقبان الواحدة إثر الأخرى.
المجموعة الأولى: فرط تحسس جونس موت: تظهر أعراض هذه المجموعة إثر انقضاء مدة 24 ساعة حداً أقصى على التعرض للمستضد.
ويمكن إحداث فرط تحسس جونس موت بالقبيعة بحقن مستضد بروتيني، كألبومين البيض ovalbumine مثلاً مع مساعد فروند غير التام adjuvant incomplet de Freund (الذي هو زيت معدني خاص) في الجلد. وتظهر أول أعراض فرط التحسس عندئذ إثر انقضاء نحو 10 ساعات، وتبلغ ذروتها بعد 14 ساعة.ويتميز فرط تحسس جونس موت باجتياح الأسسات لأدمة منطقة الحقن. أما إذا حقنت القبيعة بالمستضد ذاته إنما مع مساعد فروند التام adjuvant complet de Freund (الذي هو خلاصة الجراثيم المتطفرة ممزوجة بالزيت المعدني) فتظهر عندئذ أعراض التفاعل السليني (المجموعة الثالثة)، وتجتاح المنطقة كريات بيض، لا تشكل الأسسات إلا جزءاً بسيطاً من مجموعها (خلافاً لفرط تحسس من نمط آخر يشبه كثيراً التفاعل السليني، وتظهر أعراضه متأخرة نسبياً، إذا ما حقنت القبيعة بألبومين البيض ممزوجاً مع مساعد فروند غير التام، ومن ثم عولج الحيوان بمادة السيكلوفوسفاميد cyclophosphamide.
يتضح مما سبق أن مستضداً محدداً يمكن، إذا ما حقن بشروط مختلفة، أن يسبب ظهور أعراض مجموعتين على الأقل من المجموعات الأربع لحالات فرط التحسس الآجل.
المجموعة الثانية: فرط تحسس التماس: يُتفق عامة على أن الحد الأدنى للزمن اللازم لظهور الأعراض الناجمة عن فرط تحسس التماس هو 48ساعة، وتصل الأعراض ذروتها إثر انقضاء 72 ساعة، على التعرض للمستضد، وتتميز هذه المجموعة سريرياً بحدوث إكزيمة (نملة) eczéma في منطقة التماس. ويشكل معدن النيكل ومادة الأكريليك، وكلاهما يدخلان في بنية الكاوتشوك، المحسس الأساس في أوربة، في حين تشكل أشجار السماق والسنديان السامة المصدر الرئيس للمستأرج في الولايات المتحدة الأمريكية.
ولأن جزيئات هذه المواد لا تثير بمفردها استجابة مناعية بسبب صغر وزنها الجزيئي، فقد أمكن البرهان على أن هذه المواد وبعد دخولها الجسم عن طريق الجلد، ترتبط بأحد بروتينات الذات (الجسم)، بروابط تكافئية أو لاتكافئية.
وغالباً ما يحدث هذا الارتباط بالزمرة الأمينية (NH2) للحمض الأميني الليزين الموجود في البروتين. عندئذ فقط يصبح المستأرج مستمنعاً، وتستطيع عندئذ التائيات أن تميز هذا المعقد المقترن والمؤلَّف من المستأرج والبروتين الحامل له، تميزه ككل تمييزاً نوعياً. وعلى ما يبدو، فإن ارتباط المستأرج بالبروتين الحامل يغير من الشكل الفراغي لهذا البروتين، إذ تستطيع التائيات تمييز بروتين الذات بعد أن اقترن بالمستأرج. وتجدر الإشارة هنا إلى أنه أمكن التوصل إلى هذه المعلومات عن طريق استخدام المستأرج الثنائي نيترو الكلوروبنزين dinitrochlorobenzéne.
المجموعة الثالثة: فرط التحسس السليني: كان كوخ Koch (مكتشف العصية السلية) أول من وصف فرط التحسس السليني، فقد لاحظ أن حقن مادة السلين tuberculine، وهي بروتين شحمي يستخلص من العصيات السلية، تحت الجلد يثير، لدى المرضى بالسل، تفاعلاً حمياً وتوعكاً عاماً. ويرافق هذا التفاعل تشكل جسوء induration وورم في نقطة الحقن وقد وجد فيما بعد أن مستضدات عدة قابلة للانحلال بالماء، استخلصت من المتفطرة السلية Mycobacterium tuberculosis والمتفطرة الجذامية Mycobacterium leprae، والليشمانية الاستوائية Leishmania tropica، تستطيع أن تثير تفاعلاً مماثلاً لدى أفراد محسسين نحو هذه المستضدات (أي تعرضوا مسبقاً للخمج بهذه العوامل الممرضة). وغالباً ما يستخدم هذا التفاعل الجلدي اختباراً لمعرفة احتمال أن يكون الفرد قد سبق وتعرض للخمج بجرثوم معين.
كما اتضح من الدراسات التي أجريت في هذا النطاق أن مستضدات غير جرثومية تستطيع إحداث التفاعل السليني. ولا بد من الإشارة هنا إلى أن السل والجذام يعدان مرضين من أمراض فرط التحسس ذي الورم الحبيبي.
أما التغيرات الخلوية - النسيجية التي ترافق حدوث هذا التفاعل، فإن منطقة الحقن تصبح، بعد انقضاء مدة 24 ساعة، مشحونة بالخلايا الوحيدة النواة، التي يكون نصفها تقريباً من اللمفويات، والنصف الآخر من البلاعم.
ويلاحظ في منطقة التفاعل لدى الإنسان ندرة متعددات النوى. ويزداد عدد اللمفويات بعد انقضاء 48 ساعة، إذ تتوضع بغزارة بين الألياف الضامة. أما نسبة البلاعم فتتناقص تدريجياً.
وعلى الرغم من أن التفاعل يصل في هذه المرحلة ذروته، فإن تحوله من النمط السليني إلى النمط الحبيبي أمر غير بعيد الاحتمال، ذلك أن هذا التحول يعتمد على استمرار وجود المستضد.
وتجدر الإشارة أخيراً إلى أن التفاعل السليني لا يتميز بوجود عدد كبير من الأسسات في منطقة الحقن.
المجموعة الرابعة: فرط التحسس ذو الورم الحبيبي: لأن فرط التحسس ذا الورم الحبيبي مسؤول عن معظم التأثيرات المرضية التي تشتمل على استجابة مناعية خلوية (وساطة التائيات) à médiation cellulaire T، فإن هذا النمط من فرط التحسس يعد، من الناحية السريرية، أهم أنماط فرط التحسس الآجل. وينجم فرط التحسس ذو الورم الحبيبي عن استمرار وجود مستضد ما - غالباً ما يكون أحد الأحياء المجهرية - في البلاعم التي لا تستطيع تدميره (أي حلمهة مكوناته). وقد ينجم فرط التحسس ذو الورم الحبيبي هذا عن استمرار وجود المعقد المناعي، كما هي الحال في الأسناخ الرئوية الأرجية.
الجدول 2 خصائص مجموعات فرط التحسس الآجل
المجموعة جونس - موت التماس
السليني الورم الحبيبي
زمن التفاعل 24ساعة 48ساعة 48ساعة 4أسابيع
المظاهر السريرية تورم الجلد إكزيمة جسوء موضعي وورم قد يترافق مع حمى جسوء جلدي
المظاهر النسيجية الأسسات واللمفيات ووحيدات النوى وحيدات النوى، تشكل وذمة، احتقان الأدمة وحيدات النوى واللمفيات والوحيدات، ندرة متعددات النوى خلايا ظهرانية ورمية، خلايا عملاقة، بلاعم نخر خلوي، تليف
المستضد المستضدات المحقونة في الجلد، كالبومين البيض تماس جلدي مع النيكل والمطاط مثلاً أشجار السماق والسنديان السامة حقن السلين في الجلد. مستضد المتفطرات السلية والجذامية والليشمانيات استمرار وجود المستضد أو المعقد المناعي ضمن البلاعم، أو المادة اللااستضدادية كالطلق مثلاً
وتؤدي الظاهرة إلى تشكل ورم حبيبي granulome، يتألف من خلايا ظهرانية èpithelioide. وعلى الرغم من أن المظهر النسيجي لفرط التحسس ذي الورم الحبيبي يختلف اختلافاً واضحاً عما يحدث في التفاعل السليني، فإن كليها يمكن أن يحدثا نتيجة تحسيس الجسم بمستضد واحد، كالمتفطرة السلية أو المتفطرة الجذامية مثلاً. وتجدر الإشارة إلى أنه يمكن لأرجية الزركونيوم أن تؤدي إلى تشكل ورم حبيبي مناعي المنشأ يشبه الورم ذا الأصل الجرثومي. كما يمكن تحريض تشكل الورم الحبيبي بمواد ليست استضدادية، كالطلق talc، مثلاُ، ذلك أن البلعميات لا تستطيع تفكيك هذه المادة. ويمكن تمييز هذا الورم الحبيبي اللامناعي بغياب اللمفيات من منطقة الآفة. وعلى الرغم من أن جميع حالات فرط التحسس ذي الورم الحبيبي تتميز بوجود الخلايا الظهرانية فإن أصل هذه الخلايا لا يزال مجهولاً، ويرجع البعض أنها مشتقة من البلعميات المفعَّلة. ويلاحظ أيضاً في فرط التحسس ذي الورم الحبيبي وجود خلايا لانغرهانس Langerhans.
وتشتمل هذه الخلايا العملاقة على عدة نوى محيطية التوضع، وعلى حويصلات تحتل المنطقة الموجودة تحت الغشاء الخلوي مباشرة، وعلى عدد من المتضمنات inclusions، كما تحوي هذه الخلايا شبكة هيولية داخلية reticulum endoplasmique ضامرة، وتبدو المصورات الحيوية (الكوندريوم) فيها، وكذلك الجسيمات الحالة، كأنها تعاني من التنكس.
ويمكن لهذا التنكس أن يزداد، مؤدياً إلى تخرب البنية الخلوية بأكملها، وحدوث النخر الخلوي المترافق مع التليف.
ويلخص (الجدول 2) الخصائص الأساسية لمجموعات فرط التحسس الآجل الأربع.
المصادر
أنظر أيضا
- Allergic inflammation
- Basophil activation
- Allergen
- Hypersensitivity
- فرط الحساسية
- IgE
- Immunoglobulin
- Multiple chemical sensitivity (MCS)
- Oral allergy syndrome
- إرتكاريا
- وشم طبي
مراجع
وصلات خارجية
- American College of Allergy, Asthma and Immunology
- American Academy of Allergy, Asthma & Immunology
- Asthma and Allergy Foundation of America – patient advocacy organization
- Allergy & Asthma Network Mothers of Asthmatics
- American Board of Allergy and Immunology – ABAI establishes qualifications and examines physicians to become recognized specialists in allergy and immunology in the U.S.