تراستوزوماب
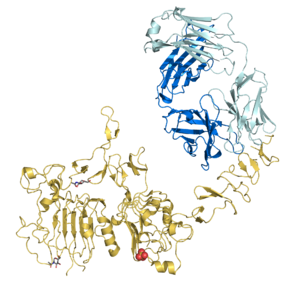 منطقة الفاب في التراستوزوماب (بالسماوي) ترتبط بپروتين HER2/neu (بالذهبي) | |
| الأجسام المضادة وحيدة النسيلة | |
|---|---|
| النوع | جسم مضاد كامل |
| المصدر | Humanized (from mouse) |
| الهدف | HER2/neu |
| البيانات السريرية | |
| الأسماء التجارية | هرسـِپتين، وأسماء أخرى [1] |
| AHFS/Drugs.com | Monograph |
| License data | |
| مسارات الدواء | عن طريق الوريد، تحت الجلد |
| رمز ATC | |
| بيانات الحركية الدوائية | |
| الأيض | غير معروف، ربما عن طريق الجهاز الشبكي البطاني |
| Elimination half-life | 2-12 days |
| المعرفات | |
| رقم CAS | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| ECHA InfoCard | 100.224.377 |
| Chemical and physical data | |
| التركيب | C6470H10012N1726O2013S42 |
| الكتلة المولية | 145531.5 g/mol |
| | |
التراستوزوماب Trastuzumab، يُباع تحت الاسم التجاري هرسـِپتين Herceptin، وأسماء أخرى، هو جسم مضادة وحيد النسيلة monoclonal antibody يستخدم لعلاج سرطان الثدي.[3] يستخدم بصفة خاصة لعلاج سرطان الثدي الإيجابي لمستقبل HER2.[3] قد يستخدم بمفرده أو مع علاج كيميائي آخر.[3] يُعطى التراستوزوماب بالحقن البطيء في الوريد والحقن تحت الجلد.[3][4]
من الآثار الجانبية الشائعة للتراستوزوماب الحمى، العدوى، السعال، الصداع، اضطرابات النوم والطفح الجلدي.[3] ومن الآثار الجانبية الخطرة فشل القلب، ردود الفعل التحسسية، وأمراض الرئة.[3] استخدامه أثناء الحمل قد يضر الجنين.[2] يعمل التراستوزوماب عن طريق الارتباط بمستقبل HER2 ويُبطيء نسخ الخلية.[3]
أُعتمد التراستوزوماب في الولايات المتحدة عام 1998.[3] وهو ضمن قائمة الأدوية الأساسية لمنظمة الصحة العالمية، للأدوية الأكثر تأثيراً وسلامة المطلوبة ضمن المنظومة الصحية.[5] يتراوح سعر بيعه بالجملة في الدول النامية ما بين 1.800 و1.955 دولار لكل زجاجة 440 مگ.[6] في المملكة المتحدة، تصل تكلفة الزجاجة 150 مگ ضمن المنظومة الصحية الوطنية 407.00 جنيه إسترليني.[4]
الاستخدام الطبي
سلامة وتأثير العلاجات التي تحتوي على التراستوزوماب (مع العلاج الكيميائي، حاصرات الهرمون hormone blockers، أو اللاپاتينيب lapatinib) لعلاج سرطان الثدي النقيلي metastatic breast cancer. وكانت نسب الخطر الشاملة للبقاء على قيد الحياة عموماً والبقاء على قيد الحياة بدون تقدم المرض 0.82 و0.61، على التوالي. كان من الصعوبة تحديد على وجه الدقة أثر التراستوزوماب على البقاء على قيد الحياة، في ثلاثة من سبعة تجارب، سُمح لأكثر من نصف المرضى في ذراع التحكم بالمرور وتلقي التراستوزوماب بعد بدء تطور السرطان.[7] بالتالي، من المحتمل أن يقلل هذا التحليل من الفائدة الحقيقية للبقاء على قيد الحياة والمرتبطة بعلاج التراستوزوماب في هذه العينة.[8] في هذه التجارب، يزيد التراستوزوماب أيضاً من خطر مشكلات القلب، بما يتضمن فشل القلب heart failure وتراجع الضخ البطيني الأيسر left ventricular ejection fraction decline.
في المرحلة المبكرة (القابلة للشفاء curable) من سرطات الثدي الإيجابي لـHER2، تحسن الأنظمة العلاجية المحتوية على التراستوزوماب مع المعدل الإجمالي للبقاء على قيد الحياة (HR = 0.66) والبقاء بلا مرض (HR = 0.60). تزيد من خطر فشل القلب (RR = 5.11) ويخفض من الضخ البطيني الأيسر (RR = 1.83) كما ظهر من التجارب أيضاً. التجربتان التي تضمنتا علاجاً قصير الأجل بالتراستوزوماب لم تختلف في فعالية التجارب ذات فترة العلاج الأطول، ولكنها أنتجت سمية أقل في القلب.[9]
توضح الدراسات الأصلية للتراستوزوماب أنه يحسن البقاء الإجمالي على قيد الحياة في المرحلة المتأخرة (مرحلة تفشي المرض metastatic) لسرطان الثدي الإيجابي لـHER2 من 20.3 إلى 25.1 شهر.[10] في المرحلة المبكرة من سرطان الثدي الإيجابي لـHER2، يقلل التراستوزوماب من خطر عودة السرطان بعد الجراحة. كان الانخفاض المطلق لخطر عودة السرطان في غضون 3 سنوات 9.5 ٪، وانخفض الحد المطلق لخطر الوفاة في غضون 3 سنوات بنسبة 3 ٪. ومع ذلك، فإن التراستوزوماب يزيد من مشكلات القلب الخطرة بنسبة خطر مطلق تبلغ 2.1%، على الرغم من أن إمكانية حل هذه المشكلات بإيقاف العلاج.[11]
للتراستوزوماب "أثراً كبيراً في علاج سرطان الثدي النقيلي الإيجابي لـHER2"[12] الجمع بين التراستوزوماب والعلاج الكيميائي أظهر زيادة في معدل البقاء والاستجابة، مقارنة بالعلاج بالتراستوزوماب بمفرده.[13]
من الممكن تحديد "حالة erbB2" للورم، والتي قد تستخدم للتنبؤ بكفاءة العلاج بالتراستوزوماب. إذا تم تحديد أن المرض يحتوي بشكل مفرط على الجين الورمي erbB2 ولم يعاني المريض من مرض قلبي ظاهر قبل العلاج، عندئذ يكون المريض مؤهلاً للعلاج بالتراستوزوماب.[14] من المثير للدهشة أنه على الرغم من أن التراستوزوماب مرتبط بشكل كبير بالـ HER2 ويمكن إعطاء جرعات عالية (بسبب سُميته المنخفضة)، 70% من الحالات HER2+ لا تستجيب للعلاج. في الواقع، فإن مقاومة العلاج تتطور بشكل سريع، في جميع المرضى تقريباً. تتضمن آلية المقاومة فشل downregulate p27 (Kip1) [15] بالإضافة لكبت نقل p27 للنوية في سرطان الثدي، مما يُمَكن cdk2 من حث الخلية على التكاثر.[16]
مدة العلاج
المدة المثالية للعلاج بالتراستوزوماب غير معلومة حالياً. بصفة عامة، يُتفق على العلاج لمدة عام واحد بناءاً على أدلة التجارب السريرية الحالية التي أظهرت تفوق العلاج لمدة سنة واحدة.[17][18] ومع ذلك، فقد أظهرت إحدى التجارب الفنلندية المحدودة أيضاً تحسناً مماثلاً بالعلاج لمدة تسعة أسابيع.[19] لعدم وجود إمكانية للمقارنة المباشرة بين التجارب السريرية، لا يعلم ما إذا كانت مدة العلاج الأقصر تكون أكثر فعالية (مع آثار جانبية أقل) عن المدة المقبولة حاليا للعلاج والتي تصل لعام واحد. أصبح النقاش حول مدة العلاج قضية ذات صلة للعديد من صانعي سياسات الصحة العامة لأن العلاج بالتراستوزوماب لمدة عام مكلف للغاية. ونتيجة لذلك، اختارت بعض الدول التي لديها نظام صحة عامة ممول من دافعي الضرائب، مثل نيوزيلندا، تمويل العلاج المساعد المحدود.[20] ومع ذلك، قامت نيوزيلندا بعد ذلك بتنقيح سياستها وتمول الآن علاج التراستوزوماب لمدة تصل إلى 12 شهر.[21] أظهرت بيانات التجارة السريرة من روش أن العلاج لمدة عام واحد يوازن بين الفعالية والآثار الجانبية الضارة.[22][23]
الآثار الجانبية
بعض الآثار الجانبية الشائعة للتراستوزوماب تشبه أعراض الإنفلونزا (مثل الحمى، القشعريرة والألم الخفيف)، الغثيان والإسهال.[24]
ومن أكثر المضاعفات خطورة للتراستوزوماب تأثيره على القلب، على الرغم من أنه نادر الحدوث.[24] في 2-7% من الحالات،[25] يرتبط التراستوزوماب بقصور القلب، والذي يشمل بقصور القلب الاحتقاني congestive heart failure. نتيجة لذلك، من الشائع إجراء تصوير القلب العادي سواء مع تصوير البطين بالنظائر المشعة MUGA scan أو تخطيط القلب Echocardiography أثناء فترة العلاج بالتراستوزوماب. يظهر التراجح في الضخ البطيني الأيسر قابل للانعكاس.[26]
يخفض التراستوزوماب neuregulin-1 (NRG-1)، والذي يعتبر أساسياً لتنشيط مسارات بقاء الخلية في الخلايا العضلية القلبية ويحافظ على وظائف القلب. ينشط NRG-1 مسار MAPK ومسار PI3K/AKT بالإضافة كيناز الالتصاق المركزي (FAK). تعتبر هذه جميعها ذات أهمية للخلايا العضلية القلبية. ومن ثم يمكن للتراستوزوماب أن يؤدي إلى قصور القلب.[27]
حوالي 10% من الأشخاص غير قادرين على تحمل الدواء بسبب مشكلات سابقة في القلب؛ يوازن الأطباء بين خطر عودة السرطان والخطر الأعلى للوفاة بسبب الأمراض القلبية بين هذه الحالات. يتزايد خطر اعتلال عضلة القلب عند الجمع بين التراستوزوماب والعلاج الكيميائي بالأنثراسيكلين anthracycline (والذي يرتبط هو نفسه بسمية القلب).
منع الحمل
النساء الذين تأتيهن الدورة الشهرية (أو من توقفت دورتهن الشهرية بسبب العلاج الكيميائي) قد يحتاجون لاستخدام وسيلة لمنع الحمل (مثل الواقي الذكري) أثناء علاجهم بالتراستوزوماب، وبعد توقف العلاج لمدة ستة أشهر على الأقل. يرجع السبب في هذا إلى إحتمال تأثيره على تطور الجنين developing fetus.[28]
آلية العلاج
جين HER2 (يعرف أيضاً بجين HER2/neu وErbB2)، يكون مضخماً بنسبة 20-30% في المرحلة المبكرة من سرطان الثدي.[15] التراستوزوماب هو جسم مضاد وحيد النسيلة يستهدف الـHER2، ويحث الاستجابة المناعية مما يتسبب في استبطان وانخفاض نسبة HER2. كما قد يؤدي إلى زيادة مثبطات الدورة الخلوية مثل p21Waf1 وp27Kip1.[29]
يعزز مسار الـHER2 نمو الخلية وانقسامها عندما يعمل بشكل طبيعي؛ ومع ذلك، فإنه عندما يتواجد بإفراط، يؤدي إلى تسارع نمو الخلية عن حدودها الطبيعية. في بعض أنواع السرطان، يتم استغلال المسار لتعزيز النمو السريع للخلايا وانتشارها وبالتالي تكوين الورم.[30] يشمل مسار EGF المستقبلات HER1 (EGFR)، HER2، HER3، ،HER4؛ ارتباط الربيطات (أي EGF وغيرها) بمستقبلات HER مطلوباً لتنشيط المسار.[30] يُطلق المسار مسار الكيناز المنشطة بالميتوجين بالإضافة لمسار كيناز PI3 /AKT، الذي ينشط بدوره مسار NF-κB.[31] في الخلايا السرطانية يمكن للپروتين HER2 أن يتواجد بنسبة تزيد 100 ضعف عن نسبته في الخلايا الطبيعية (2 مليون مقابل 20.000 لكل خلية).[32] هذا التواجد المفرط يؤدي إلى إشارة تكاثرية قوية وثابتة وبالتالي تكون الورم. قد يسبب التواجد المفرط للپروتين HER2 أيضاً إلى إخماد نقاط التنظيم، مما يسمع بتزايد أكبر للتكاثر الخلوي.
مستقبلات HER هي پروتينات مدمجة في غشاء الخلية وتوصل الإشارات الجزيئية من خارج الخلية (جزيئات تسمى عوامل نمو البشرة EGFs) لداخل الخلية، وتشغل وتوقف الجينات. پروتين HER (مستقبل معامل نمو البشرة)، يرتبط بمعامل نمو البشرة المؤنسن، ويحفز تكاثر الخلية. في بعض أنواع السرطان، وأشهرها بعض أنواع سرطانات الثدي، يتواجد الپروتين HER2 بشكل مفرط ويدفع الخلايا السرطانية إلى التكاثر بشكل لا يمكن التحكم فيه.[10]
تشير التجارب على الحيوانات إلى أن الأجسام المضادة، ومنها التراستوزوماب، عند ارتباطها بالخلية، تحث الخلايا المناعية على قتل الخلية، مثل هذه سمية الخلية المعتمدة على الأجسام المضادة آلية هامة أخرى للعمل.[33]
قد تكون هناك آليات أخرى غير مكتشفة للتراستوزوماب تحفز تراجع السرطان.
توقع الاستجابة
يثبط التراستوزوماب آثار التواجد المفرط للپروتين HER2. إذا كان سرطان الثدي لا غير مفرط الـHER2، فلن يكون للتراستزوماب أثراً مفيداً (وقد يكون مضراً). يستخدم الأطباء التحاليل المعملية لاكتشاف ما إذا كان الـHER2 متواجداً بشكل مفرد أم لا. في المعمل السريري الروتيني، من أكثر الطرق المستخدمة شيوعاً الكيمياء الهيستولوجية المناعية وإما الفضة، أو التهجين الموضعي المولد للون أو الفلوري (SISH/CISH/FISH). يمكن الكشف عن تضخيم الـHER2 عن طريق التنميط النووي الافتراضي للورم المضمن للپارافين المثبت بالفورمالين. للتنميط النووي الافتراضي ميزة إضافية لتقييم التغييرات في عدد النسخ في جميع أجزاء الجينوم، بالإضافة إلى الكشف عن تضخيم HER-2 (وليس تواجد بإفراط). المنهجيات المتعددة المعتمدة على PCR وُصفت أيضاً في الأدبيات الطبية.[34] ومن الممكن أيضاً تقدير عدد نسخ HER2 من بيانات المصفوفة الصغروية.[35]
هناك مجموعتين تجاريتين معتمدتين من ادارة الغذاء والدواء متاحتين لـHER2 IHC؛ Dako HercepTest[36] and Ventana Pathway.[37] وتعتبر معايير شبه قياسية، تقسم مستويات التواجد إلى؛ 0 (<20.000 خلية لكل مستقبل، ليس هناك تواجد مرئي)، 1+ (~100.000 مستقبل لكل خلية، صبغة غشائية جزئية، < 10% من الخلايا بها HER-2)، 2+ (~500.000 مستقبل لكل خلية، صبغة غشائية كاملة من خفيفة إلى متوسطة، > 10% من الخلايا تحتوي على HER-2 بشكل مفرط)، و3+ (~2.000.000 مستقبل لكل خلية، صبغة غشائية كاملة قوية، > 10% من الخلايا تحتوي على HER-2 بشكل مفرط). وجود التعبير السيتوپلازي مهملاً. يُنصح بالعلاج بالتراستوزوماب للحالات التي يتواجد فيها HER2 بدرجة +3. ومع ذلك، فقد ثبت أن هناك الكثير من القيود لـIHC، سواء التقنية أو التفسيرية، والذي وُجد أنه يؤثر على استنساخ النتائج ودقتها، لا سيما عند مقارنته بمنهجيات ISH. كما أظهرت بعض التقارير أن IHC يوفر علاقة ممتازة بين عدد نسخ الجينات وتواجد الپروتين.
المقاومة
من التحديات التي تواجهنا في علاج المصابين بسرطان الثدي باستخدام التراستوزوماب هو فهمنا لمقاومة التراستوزوماب. في العقد الأخير، أجريت الكثير من التجارب لفهم آلية مقاومة التراستوزوماب مع/بدون الأدوية التكميلية. مؤخراً، جُمعت هذه المعلومات كلها على شكل قاعدة بيانات HerceptinR.[38] قاعدة بيانات HerceptinR هذه هي مجموعة تجارب عُقدت لاختبار حساسية مقاومة التراستوزوماب تجاه خطوط خلايا سرطان الثدي. توفر قاعدة البيانات هذه معلومات شاملة عن أداء البيانات التجريبية لفهم العوامل الكامنة وراء مقاومة التراستوزوماب بالإضافة لتجارب أُجريت لتحسين حساسية التراستوزوماب بمساعدة الأدوية التكميلية. تم تطوير قاعدة البيانات تلك لفهم مقاومة التراستوزوماب والتي يمكن استخدامها لتصميم المؤشرات الحيوية الحساسة للتراستوزوماب.
التاريخ
ُأُكتشف الدواء لأول مرة بواسطة د. أكسد أولريخ ود. هـ. مايكل شڤارد من مركز جونسون الشامل للسرطان التابع [[جامعة كاليفورنيا، لوس أنجلس|لجامعة كاليفورنيا، لوس أنجلس.[39] كانت الاكتشافات المبكرة عن الجين الورمي الجديد بواسطة معمل روبرت واينبرگ[40] أما معمل مارك گرين فقد اكتشف تعرف الجسم المضاد وحيد النسيلة على مستقبل الجين الورمي [41] كما ساهم في تأسيس العلاجات المستهدفة لـHER2. لاحقاً، عمل د. دنيس سلامون على تطوير التراستوزوماب. تم تحويل كتاب يدور عن عمل د. سالمون إلى فيلم تلفزيوني باسم Living Proof، عُرض في 2008. طورت جينتك التراستوزوماب بالاشتراك مع جامعة كاليفورنيا، لوس أنجلس، بدءاً بتجارب سريرية تضمنت 15 امرأة عام 1992.[42] بحلول 1996، توسعت التجارب السريرية لتضم 900 امرأة، لكن بسبب ضغط من المدافعين بناءاً على النجاح المبكر، عملت جينتك مع ادارة الغذاء والداء على إنشاء نظام يناصيب يسمح بحصول 100 امرأة بصفة ربع سنوية على العلاج خارج التجارب.[43] مُنح هرسـِپتين حالة تتبع سريع من قبل ادارة الغذاء والدواء وأُعتمد في سبتمبر 1998.
حصلت بيوكون المحدودة وشريكتها مايلان على اعتماقد منظم لبيع البديل الحيوي في 2014 لكن روش طعنت في قانونية الاعتماد؛ وانتهت القضية في 2016 وطرحت بيوكون ومايلان بدائلهما الحيوية..[44]
المجتمع والثقافة
التكلفة
تبلغ تكلفة التراستوزوماب 70.000 يورو لدورة العلاج الكاملة،[45] حقق التراستوزوماب أرباح قيمتها 327 مليون دولار لجينتك في الربع الأخير من 2007.
تفاوضت أستراليا على سعر أقل لدورة العلاج بلغت 50.000 دولار أسترالي.[46]
منذ أكتوبر 2006 أصبح التراستزوماب متوفراً للأستراليين في المرحلة المبكرة من سرطان الثدي عن طريق برنامج المستحقات الصيدلانية. تُقدر تكلفة العلاج ضمن البرنامج أكثر 470 مليون دولار أسترالي على مدار 4 سنوات.[47]
أعطت روش تصريحاً لشركة إموكيور في الهند لصنع نسخة مخفضة من الراستوزوماب لتوفيرها في السوق الهندي.[48]
غيرت روش اسمها التجاري للدواء وأعادت طرح نسخة منخفضة السعر في السوق الهندي. يحمل الدواء الجديد اسم هركلون وتبلغ تكلفته حوالي 75.000 روبية هندية (1.200 دولار أمريكي)[مطلوب توضيح] في السوق الهندي.[بحاجة لمصدر]
في 16 سبتمبر 2014، أخطرت جينتك المستشفيات بأنه من أكتوبر، لا يمكن شراء التراستوزوماب إلا عن طريق موزعي الأدوية المختارين وليس عند طريق بائعي الأدوية بالجملة. بإجبارهم على شراء الدواء من الصيدليات المتخصصة، ستخسر المستشفيات فرق السعر عن طريق شراء الدواء من بائعي الجملة وقدرتها على التفاوض في الحصول على خصومات منهم.[49]
البدائل الحيوية
حوالي 20 شركة في العالم، وخاصة من الأسواق الناشئة، تعمل على تطوير بدائل حيوية من الهرسـِپين بعد انتهاء براءة اختراع روش/جينتك في أوروپا عام 2014، وفي الولايات المتحدة عام 2019.[50] عام 2013، جددت روش/جينتك براءة اختراعها للدواء في الهند لصعوبة بيئة IP هناك. في يناير 2015، أعلنت بيوكاد عن أول بديل حيوي للتراستوزوماب والمعتمد من وزارة الصحة الروسية. كما اعتمد إيران نسختها الخاصة من الجسم المضاد وحيد النسيلة في يناير 2016، وأعلنت عن استعدادها لتصدير الدواء لبلدان أخرى في الشرق الأوسط وآسيا الوسطى عندما تُرفع العقوبات التجارية عنها.[1][51]
أظهر البديل الحيوي الخاضع للبحث MYL-1401O فعالية وأمان مقارن بالنسبة للتراستوزوماب الذي يحمل الاسم التجاري هرسـِپتين.[52]
أُعتمد Trastuzumab-dkst (Ogivri, Mylan GmbH) من ادارة الغذاء والدواء الأمريكية في 1 ديسمبر 2017 "لعلاج المصابين بسرطان الثدي أو السرطان المعدي أو السرطان الغدي المعدي ممن تحتوي أورامهم على الجين HER-2 بدرجة مفرطة."[53]
أعلنت المفوضية الأوروپية في 17 نوفمبر 2017 عن تصريح تسويق الأونتروزانت Ontruzant، بديل حيوي للتراستوزوماب من إنتاج شركة سامسونگ بيوإپيس، لعلاج سرطان الثدي المبكر، سرطان الثدي النقيلي وسرطان المعدة النقيلي. الأونتروزانت هو أول بديل حيوي للتراستوزماب يحصل على موافقة تنظيمية في أوروپا.[54]
المصادر
- ^ أ ب "Trastuzumab - Drugs.com". www.drugs.com. Archived from the original on 7 April 2017. Retrieved 21 December 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب "Trastuzumab (Herceptin) Use During Pregnancy". www.drugs.com. Archived from the original on 21 December 2016. Retrieved 21 December 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب ت ث ج ح خ د "Trastuzumab". The American Society of Health-System Pharmacists. Archived from the original on 21 December 2016. Retrieved 8 December 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ أ ب British national formulary : BNF 69 (69 ed.). British Medical Association. 2015. p. 626. ISBN 9780857111562.
- ^ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. April 2015. Archived from the original (PDF) on 13 December 2016. Retrieved 8 December 2016.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "Trastuzumab". International Drug Price Indicator Guide. Archived from the original on 6 April 2017. Retrieved 28 November 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Balduzzi S, Mantarro S, Guarneri V, Tagliabue L, Pistotti V, Moja L, D'Amico R (2014). "Trastuzumab-containing regimens for metastatic breast cancer" (PDF). Cochrane Database Syst Rev. 6 (6): CD006242. doi:10.1002/14651858.CD006242.pub2. PMID 24919460.
- ^ Wilcken, Nicholas (2014). "Treating metastatic breast cancer: The evidence for targeted therapy". The Cochrane Database of Systematic Reviews (6): ED000083. doi:10.1002/14651858.ED000083. PMID 25032250.
{{cite journal}}:|chapter=ignored (help); Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Moja L, Tagliabue L, Balduzzi S, Parmelli E, Pistotti V, Guarneri V, D'Amico R (2012). "Trastuzumab containing regimens for early breast cancer". Cochrane Database Syst Rev. 4 (4): CD006243. doi:10.1002/14651858.CD006243.pub2. PMID 22513938.
- ^ أ ب Hudis, CA (2007). "Trastuzumab--mechanism of action and use in clinical practice". N Engl J Med. 357 (1): 39–51. doi:10.1056/NEJMra043186. PMID 17611206.
- ^ Moja L, Tagliabue L, Balduzzi S, et al. (2012). "Trastuzumab containing regimens for early breast cancer". Cochrane Database Syst Rev. 4: CD006243. doi:10.1002/14651858.CD006243.pub2. PMID 22513938.
- ^ Tan, AR; Swain SM (2002). "Ongoing adjuvant trials with trastuzumab in breast cancer". Seminars in Oncology. 30 (5 Suppl 16): 54–64. doi:10.1053/j.seminoncol.2003.08.008. PMID 14613027.
- ^ Nahta, R; Esteva1 FJ (2003). "HER-2-Targeted Therapy –Lessons Learned and Future Directions". Clinical Cancer Research. 9 (14): 5078–84. PMID 14613984.
{{cite journal}}: CS1 maint: numeric names: authors list (link) - ^ Yu, D; Hung M (2000). "Overexpression of ErbB2 in cancer and ErbB2-targeting strategies". Oncogene. 19 (53): 6115–6121. doi:10.1038/sj.onc.1203972. PMID 11156524.
- ^ أ ب XF Le; Franz Pruefer; Robert Bast. (2005). "HER2-targeting antibodies modulate the cyclin-dependent kinase inhibitor p27Kip1 via multiple signaling pathways". Cell Cycle. 4 (1): 87–95. doi:10.4161/cc.4.1.1360. PMID 15611642.
- ^ خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةKute - ^ Romond, EH; Perez EA; Bryant J; et al. (2005). "Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer". New England Journal of Medicine. 353 (16): 1673–1684. doi:10.1056/NEJMoa052122. PMID 16236738.
- ^ Piccart-Gebhart MJ, MJ; Procter M; Leyland-Jones B; et al. (2005). "Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer". New England Journal of Medicine. 353 (16): 1659–1672. doi:10.1056/NEJMoa052306. PMID 16236737.
- ^ Joensuu H, Kellokumpu-Lehtinen PL, Bono P, et al. (2006). "Adjuvant docetaxel or vinorelbine with or without trastuzumab for breast cancer". N Engl J Med. 354 (8): 809–20. doi:10.1056/NEJMoa053028. PMID 16495393.
- ^ Metcalfe, S; Evans J; Priest G. (2007). "PHARMAC funding of 9-week concurrent trastuzumab (Herceptin) for HER2-positive early breast cancer". N Z Med J. 120 (1256): 1U2593. PMID 17589560.
- ^ "12-month Herceptin treatment now available". New Zealand Government. Archived from the original on 20 January 2017. Retrieved 2 May 2017.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "Final analysis of Phase III HERA trial confirmed one year of Herceptin treatment as standard of care in early-stage HER2-positive breast cancer". Roche. Archived from the original on 2013-09-25. Retrieved 2013-01-06.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "View - European Society for Medical Oncology". ESMO. Retrieved 2013-01-06.
- ^ أ ب "Breast Cancer Care Trastuzumab factsheet" (PDF). Breast Cancer Care. Archived from the original (PDF) on 23 October 2013. Retrieved 22 October 2013.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Seidman, A; et al. (2002). "Cardiac Dysfunction in the Trastuzumab Clinical Trials Experience". Journal of Clinical Oncology. 20 (5): 1215–1221. doi:10.1200/JCO.20.5.1215. PMID 11870163.
- ^ van Hasselt; et al. (2011). "Population pharmacokinetic-pharmacodynamic analysis of trastuzumab-associated cardiotoxicity". Clin Pharmacol Ther. 90 (1): 126–32. doi:10.1038/clpt.2011.74. PMID 21633346.
- ^ Zeglinski, M., Ludke, A., Jassal, D. S. & Singal, P. K. Trastuzumab-induced cardiac dysfunction: A 'dual-hit'. Exp. Clin. Cardiol. 16, 70-74 (2011)
- ^ "Breast Cancer Care Trastuzumab factsheet" (PDF). Archived from the original (PDF) on 23 October 2013. Retrieved 22 October 2013.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Bange, J; Zwick E; Ullrich A. (2001). "Molecular targets for breast cancer therapy and prevention". Nature Medicine. 7 (5): 548–552. doi:10.1038/87872. PMID 11329054.
- ^ أ ب "Targeted Therapies for Breast Cancer Tutorial". National Cancer Institute. Archived from the original on 29 March 2011. Retrieved 19 April 2011.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Feldman, A M; Koch, W J; Force, T L (28 March 2007). "Developing Strategies to Link Basic Cardiovascular Sciences with Clinical Drug Development: Another Opportunity for Translational Sciences". Clinical Pharmacology & Therapeutics. 81 (6): 887–892. doi:10.1038/sj.clpt.6100160. PMID 17392727.
- ^ Winer, Eric. "HER2 Disease in the Metastatic and Adjuvant Settings". Medscape Education. Archived from the original on 10 April 2011. Retrieved 20 April 2011.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Clynes, RA; Towers, TL; Presta, LG; Ravetch, JV (2000). "Inhibitory Fc receptors modulate in vivo cytoxicity against tumor targets". Nat Med. 6 (4): 443–6. doi:10.1038/74704. PMID 10742152.
- ^ Jennings, B; Hadfield JE; Worsley SD; Girling A; Willis G. (1997). "A differential PCR assay for the detection of c-erbB 2 amplification used in a prospective study of breast cancer". Molecular Pathology. 50 (5): 254–256. doi:10.1136/mp.50.5.254. PMC 379641. PMID 9497915.
- ^ Curtis, C; Shah, SP; Chin, SF; Turashvili, G; Rueda, OM; Dunning, MJ; Speed, D; Lynch, AG; Samarajiwa, S; Yuan, Y; Gräf, S; Ha, G; Haffari, G; Bashashati, A; Russell, R; McKinney, S; METABRIC, Group; Langerød, A; Green, A; Provenzano, E; Wishart, G; Pinder, S; Watson, P; Markowetz, F; Murphy, L; Ellis, I; Purushotham, A; Børresen-Dale, AL; Brenton, JD; Tavaré, S; Caldas, C; Aparicio, S (18 April 2012). "The genomic and transcriptomic architecture of 2,000 breast tumours reveals novel subgroups". Nature. 486 (7403): 346–52. doi:10.1038/nature10983. PMC 3440846. PMID 22522925.
- ^ "Archived copy". Archived from the original on 2009-05-23. Retrieved 2008-06-24.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help)CS1 maint: archived copy as title (link) - ^ "ventanamed.com". ventanamed.com. 2012-05-25. Archived from the original on 2011-11-27. Retrieved 2013-06-16.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Ahmad S (2014). "Herceptin Resistance Database for Understanding Mechanism of Resistance in Breast Cancer Patients". Nature. 4. Archived from the original on 2014-03-30.
{{cite journal}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ "cancer.ucla.edu". cancer.ucla.edu. Archived from the original on 2013-06-11. Retrieved 2013-06-16.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Schechter, A. L.; Stern, D. F.; Vaidyanathan, L.; Decker, S. J.; Drebin, J. A.; Greene, M. I.; Weinberg, R. A. (1984 Dec 6-12). "The neu oncogene: an erb-B-related gene encoding a 185,000-Mr tumour antigen". Nature. 312 (5994): 513–516. ISSN 0028-0836. PMID 6095109.
{{cite journal}}: Check date values in:|date=(help) - ^ Drebin, J. A.; Link, V. C.; Weinberg, R. A.; Greene, M. I. (1986-12). "Inhibition of tumor growth by a monoclonal antibody reactive with an oncogene-encoded tumor antigen". Proceedings of the National Academy of Sciences of the United States of America. 83 (23): 9129–9133. ISSN 0027-8424. PMC 387088. PMID 3466178.
{{cite journal}}: Check date values in:|date=(help) - ^ "Biotechnology Breakthrough In Breast Cancer Wins FDA Approval". Genentech. 1998-09-25. Archived from the original on 2016-07-01. Retrieved 2016-05-30.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Altman, Lawrence (1998-05-18). "Drug Is Shown to Shrink Tumors in Breast Cancer Characterized by Gene Defect". New York Times. Archived from the original on 2016-06-30. Retrieved 2016-05-30.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Palmer, Eric (March 3, 2017). "Mylan and Biocon finally win right to sell Herceptin biosim in India even as they have taken it to U.S. and EU". FiercePharma (in الإنجليزية). Archived from the original on September 8, 2017.
{{cite news}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Fleck L (2006). "The costs of caring: Who pays? Who profits? Who panders?". Hastings Cent Rep. 36 (3): 13–7. doi:10.1353/hcr.2006.0040. PMID 16776017.
- ^ "Listing of Herceptin on PBS". Australian Government, Dept of Health and Ageing. 2006-10-01. Archived from the original on 2009-09-12.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Australian Government, Dept of Health and Ageing "Listing of Herceptin on PBS", 2006-10-1. "Archived copy". Archived from the original on 2013-10-23. Retrieved 2013-10-20.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help)CS1 maint: archived copy as title (link) - ^ "Emcure signs deal to manufacture Roche's anti-cancer drugs". The Times Of India. 2012-03-02.
- ^ Saporito, Bill (27 October 2014). "Hospitals Furious at Cancer-Drug Price Hikes". Time. Archived from the original on 20 October 2015. Retrieved 26 October 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (|url-status=suggested) (help) - ^ Cynthia A. Challener (Apr 01, 2014). Monoclonal Antibodies Key to Unlocking the Biosimilars Market Archived 2016-03-01 at the Wayback Machine. BioPharm international.com 27 (4).
- ^ Dominik Feldges (Febr. 2016). Brustkrebspräparat Herceptin im Fokus Archived 2016-03-02 at the Wayback Machine (in German). Neue Zürcher Zeitung (Wirtschaft). Retrieved 19 February 2016.
- ^ Biosimilar Matches Trastuzumab in Metastatic HER2-Positive Breast Cancer. June 2016 Archived 2016-06-11 at the Wayback Machine
- ^ FDA approves Ogivri, first biosimilar for certain breast, stomach cancers. Dec 2017
- ^ Samsung Bioepis Receives Regulatory Approval for Europe’s First Trastuzumab Biosimilar. Nov 2017
قراءات إضافية
- Bazell, Robert. Her-2: the making of Herceptin, a revolutionary treatment for breast cancer. Random House, 1998. 214 pages. ISBN 0-679-45702-X.
- The Guardian. "The selling of a wonder drug". 29 March 2006
- Dent S, Verma S, Latreille J, Rayson D, Clemons M, Mackey J, Verma S, Lemieux J, Provencher L, Chia S, Wang B, Pritchard K (2009). "The role of her2-targeted therapies in women with her2-overexpressing metastatic breast cancer". Curr Oncol. 16 (4): 25–35. doi:10.3747/co.v16i4.469. PMC 2722050. PMID 19672422.
وصلات خارجية
- Herceptin (manufacturer's website)
- NCI Drug Information Summary for Patients
- CS1 errors: unsupported parameter
- CS1 errors: chapter ignored
- CS1 maint: numeric names: authors list
- Articles with hatnote templates targeting a nonexistent page
- Template:drugs.com link with non-standard subpage
- Chemicals that do not have a ChemSpider ID assigned
- Articles with changed EBI identifier
- ECHA InfoCard ID from Wikidata
- Infobox-drug molecular-weight unexpected-character
- Pages using infobox drug with unknown parameters
- Articles without InChI source
- Drugs with no legal status
- Drug has EMA link
- Drugboxes which contain changes to verified fields
- Drugs that are a monoclonal antibody
- جميع الصفحات التي تحتاج تنظيف
- مقالات بالمعرفة تحتاج توضيح from August 2017
- أجسام مضادة وحيدة النسيلة لعلاج الأورام
- علم المناعة
- الأدوية الأساسية حسب منظمة الصحة العالمية
- أدوية تخصصية
- RTT