علاج موجه
العلاج الموجه Targeted therapy أو العلاج الموجه الجزيئي molecularly targeted therapy، هو أحد أساليب العلاج الطبي الرئيسية (العلاج الدوائي) لمرض السرطان، أما الأساليب العلاجية الأخرى فهي العلاج الهرموني والعلاج الكيميائي السام للخلايا. كأحد أشكال الطب الجزيئي، يوقف العلاج المستهدف نمو الخلايا السرطانية من خلال التداخل مع جزيئات مستهدفة معينة اللازمة لنمو الورم وتكوينه،[1] عوضاً عن التداخل البسيط مع خلايا سريعة الانقسام كما في العلاج الكيميائي المعتاد. ولا يعد العلاج الإشعاعي نوعاً من أنواع العلاج الموجه حتى وإن كان الغرض من أن يكون موجهاً نحو الورم.
العلاجات الموجه للسرطان يفترض أنها ستكون أكثر فعالية وأقل ضرراً للخلايا الطبيعية من العلاجات الحالية.
توجد علاجات مستهدفة لسرطان القولون، سرطان الرأس والعنق، سرطان الثدي، الورم النخاعي المتعدد، اللمفوما، سرطان البروستاتا، الورم النخاعي، وأنواع أخرى من السرطان.[2]
عادة ما تستلزم المؤشرات الحيوية للمساعدة في اختيار المرضى الذين من المرجح استجابتهم للعلاج الموجه.[3]
مزايا العلاجات الموجهة
تتميز هذه العلاجات عن طرق العلاج الكيماوي التقليدي بدقتها؛ حيث يتم استهداف "أهداف جزيئية" محددة ترتبط مع مرض السرطان، بينما يستهدف العلاج الكيماوي أي خلايا سريعة الانقسام سواء كانت خلايا طبيعية أو سرطانية. وبينما تعمل علاجات السرطان الموجه على منع انقسام الخلايا السرطانية وانتشارها، يعمل العلاج الكيميائي التقليدي على قتل الخلايا سريعة الانتشار بشكل مباشر.
تمثل هذه الأدوية حجر الزاوية في الطب الدقيق، الذي يستخدم المعلومات المتاحة حول جينات الشخص لمنع وتشخيص وعلاج الأمراض الخاصة به. لهذا تكمن الميزة الأساسية لهذا النوع من العلاج في قدرته على التأثير بشكل أساسي في خلايا السرطان وحدها دون أن يؤثر على الخلايا الطبيعية.
تعيين الدواء الموجه
1- التعرف على الأهداف التي يمكن استهدافهها، وتكوين علاجات ضدها ليس سهلاً، فتحديد أهداف مناسبة يمكن أن تؤثرعلى نمو السرطان وانتشاره يستغرق وقتاً وجهداً من الباحثين. إحدى هذه الطرق هي مقارنة نسبة العديد من البروتينات في الخلايا السرطانية مع تلك الموجودة في الخلايا الطبيعية. البروتينات الموجودة في الخلايا السرطانية دون الخلايا الطبيعية أو الموجودة بنسبة أعلى في الخلايا السرطانية قد تكون أهدافاً محتملة، وخاصة إذا كانت معروفة بدورها في نمو الخلايا أو بقائها على قيد الحياة. كما قد يكون هذا البروتين المستهدف بروتيناً طبيعياً موجوداً على سطح الخلية، لكن حدوث إحدى الطفرات فيه أدت إلى حدوث السرطان أو انتشاره.
2- بعد التعرف على هذا الهدف يعمل الباحثون لإيجاد طريقة أو مركب يتعامل مع هذا الهدف ليساعد على منع نمو أو تطور الورم.
3- بعدها يتم اختبار هذا العلاج لضمان فاعليته.
الأنواع
التصنيفات الرئيسية الحالية للعلاج الموجه هي الجزيئات الصغيرة والأجسام المضادة وحيدة الخلية.
الجزيئات الصغيرة
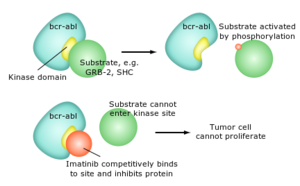
- الإيماتينيب (گليڤيك ويعرف أيضاً باسم STI–571) تم الموافقة عليه كعلاج لابيضاض المحببات المزمن، السرطان الغدي المعدي المعوي وبعض الأنواع الأخرى من السرطان. أظهرت التجارب السريرية المبكرة أن الإمياتينيب قد يؤثر في علاج الساركومة الليفية الجلدية الحدبية.
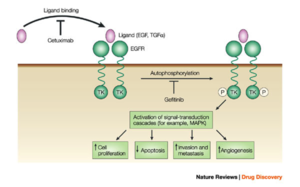
- الگفيتينيب، يستهدف مستقبل عامل نمو البشرة كيناز التيروسين وتمت الموافقة عليه في الولايات المتحدة لعلاج سرطان الرئة للخلايا الغير صغيرة.
- الإرولتينيب (يسوق تحت اسم تارسـِڤا). يثبط الإرولتينيب مستقبل عامل نمو البشرة،[4] ويعمل من خلال آلية مشابهة للگفيتينيب. أوضح الإرولتينيب زيادة الشفاء للمصابين بسرطان الرئة للخلايا الغير صغيرة عند استخدامه كعلاج من الخط الثاني. بسبب هذه النتائج، حل الإرولتينيب بدلاً عن الگفيتينيب لعلاج مثل هذه الحالات
- السورافنيب (نـِكساڤار)[5]
- سونيتينيب (سوتـِنت)
- داساتينيب (سپريسل)
- لاپاتينيب (تيكرب)
- نيلوتينيب (تاسيگنا)
- بورتزوميب (ڤلكاد)
- تاموكسيفن.[6]
- توفاسيتينيب
- كريزوتينيب
- اولاتوكلاكس
- ناڤيتوكلاكس
- گوسيپول.[7]
- إنيپاريب
- پريفوسين
- أپاتينيب.[8] [9]
متقارنات أدوية الجزيئات الصغيرة
مستقبلات كيناز السرين/الثيرونين (الجزيئات الصغيرة)
- تمسيروليموس (توريسل)
- إڤروليموس (أفينيتور)
- ڤمورافنيب (زلابوراف)
- ترامتينيب (مكينيست)
- دابرافنيب (تافينلار)
الأجسام المضادة وحيدة النسيلة
هناك العديد من التطورات في علاج الأجسام المضادة وحيدة النسيلة، وبعضها حصل على ترخيص من ادارة الغذاء والدواء واللجنة الأوروپية. ومن أمثلة الأجسام المضادة وحيدة النسيلة الحاصلة على ترخيص:
- ريتوكسيماب ويستهدف سي دي 20 الموجود على الخلايا البائية. ويستخدم لعلاج اللمفوما اللاهودجكينية.
- تراستوزوماب ويستهدف Her2/neu (وتعرف أيضاً باسم ErbB2) مستخدم موجود في بعض أنواع سرطان الثدي.
- ألمتوزوماب
- سيتوكسيماب يستهدف مستقبل عامل نمو البشرة. تم الموافقة على استخدامه في علاج سرطان القولون النقيلي،[11][12] وسرطان الخلايا الحرشفية بالرأس والعنق.[13][14]
- پانيتوموماب يستهدف أيضاً EGFR. تمت الموافقة على استخدامه في علاج سرطان القولون النقيلي.
- باڤاسيزوماب يستهدف circulating VEGF ligand. تمت الموافقة على استخدامه لعلاج سرطان القولون، سرطان الثدي، سرطان الرئة للخلايا الغير صغيرة، وتحت البحث لعلاج الساركوما. موصى باستخدامه لعلاج أورام المخ.[15]
- إپيليموماب (إيرڤوي)
عيوب العلاجات الموجهة
لكن برغم أن العلاج الموجه يحمل هذه المميزات، لكن هناك بعض العيوب والمشاكل التي يجب أخذها في الاعتبار.
- فهذه الأنواع من العلاج قد لا تناسب كل المرضى، حيث يجب أن يتم أولاً تحديد ما إذا كان المريض يملك الطفرة الجينية المحددة التي تمثل هدفاً لهذا العلاج. كما يتم استخدام هذه العلاجات بشكل تجريبي لدى بعض المرضى الذين لا يستجيبون لأنواع العلاج الأخرى.
- هناك مشكلة أخرى قد تحدث أثناء العلاج وهي أن الخلايا السرطانية قد تقاوم هذه الأنواع من الأدوية، لذلك يفضل استخدام هذه الأدوية مع أنواع أخرى من العلاج الكيماوي التقليدي. [16]
- بالإضافة إلى ذلك، هناك بعض الأعراض الجانبية لهذه الأدوية، فبعض أنواع هذه الأدوية قد تتسبب في حدوث التهابات في الكبد أو مشاكل تتعلق بتجلط الدم والتئام الجروح، كما قد يتسبب بعضها في ارتفاع ضغط الدم أو تثبيط المناعة أو العديد من المشاكل الجلدية.
- كما أن الجانب الاقتصادي في استخدام هذه الأدوية لا يمكن إغفاله. فمعظم هذه الأدوية غالية وبعضها باهظ الثمن، وهو ما يمثل عقبة كبيرة في استخدامها خاصة في الدول النامية.
الآثار الجانبية المحتملة
تُسَبِّب أدوية العلاج الكيميائي تلفًا في الحمض النووي، يحفز موت الخلايا السرطانية سريعة الانقسام، وتلك الأدوية هي العلاج النموذجي لعديد من السرطانات، لكنْ لأنها تؤثر أيضًا على الخلايا السليمة المنقسمة، فإن أدوية العلاج الكيميائي تلك قد تسبِّب أضرارًا غير مرغوب فيها، إذ تؤدي إلى حدوث تأثيرات جانبية قصيرة المدى، كالغثيان، وسقوط الشعر. ويحمل تلف الحمض النووي الناجم عن العلاج الكيميائي أيضًا إمكانية زيادة عدد الطفرات، التي قد تؤدي على المدى الطويل إلى ظهور سرطانات أخرى، أو تمكين الورم الأصلي من تطوير مقاوَمة للعلاج. لذا.. صُمّمت العلاجات الموجَّهة لحصار مسارات جزيئية معينة في الخلايا السرطانية، ولتحفيز موت الخلايا الورمية، دون التسبب في تلف الحمض النووي. وفي بحث نُشر مؤخرًا في دورية Nature، أشار كومبانيو وزملاؤه2 إلى دراسات لنماذج لفئران وخلايا بشرية، أظهرت أن عقارَيْن موجهَين شائِعَيْ الاستخدام كبديل للعلاج الكيميائي في علاج بعض أنواع سرطان الدم يزيدان - بشكل غير متوقَّع - من تلف الحمض النووي في كل من الخلايا السليمة، والخلايا الورمية.
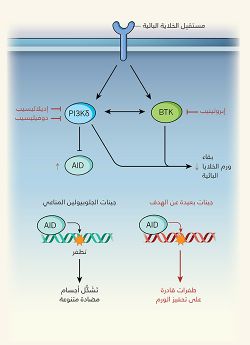
وحسب تقرير نشرته مجلة نيتشر، عن الآثار الجانبية المحتملة للأدوية الموجهة، والتي تتسبب في تثبيط مستقبلات الخلايا البائية. العقاران الموجَّهان موضع البحث هما "إبروتينيب" ibrutinib (واسمه التجاري "إمبروفيكا" Imbruvica)، و"إديلاليسيب" idelalisib (واسمه التجاري "زيديليج" Zydelig). وهذان المركبان هما المِثالان الأوّلان للفئة الجديدة الظاهرة على الساحة الآن من العوامل العلاجية الموجَّهة، التي أحدثت ثورة في علاج بعض الأورام الناشئة عن الخلايا المناعية المعروفة باسم الخلايا البائية. وقد حصل المركّبان على موافقة "إدارة الغذاء والدواء الأمريكية" على استخدامهما في العلاج. وهذان العلاجان - اللذان كثيرًا ما يُوصَفان بأنهما مثبِطان لمستقبِل الخلايا البائية - يعرقِلان عمل الإنزيمات التي تنقل الإشارات من البروتينات المستقبلة الموجودة على سطوح الخلايا البائية. تديم هذه المستقبِلات البقاء، وتحافظ على الخلايا الورمية في مواقع تشريحية، توفِّر لها بيئة مغذية. كما تساعد هذه الآلية الخاصة بالخلايا البائية - دون غيرها - على تفسير مدى فعالية الأدوية، ونمط تأثيرها الجانبي الحميد نسبيًّا.
كشفت التجارب الإكلينيكية لعقاري "إبروتينيب" و"إديلاليسيب" عن معدلات تراجع غير مسبوقة في أورام سرطان الدم، وتحديدًا في النوع الأكثر شيوعًا بين البالغين، وهو سرطان الدم الليمفاوي المزمن (CLL)، بما في ذلك المجموعات المعرَّضة للخطر من المصابين به، الذين يميلون إلى عدم التجاوب مع الفئات العلاجية الأخرى6, 7. كما أن عقار "إبروتينيب" قد حاز على الموافقة لعلاج أنواع أخرى من السرطان، مثل سرطان خلايا مانتل الليمفاوية الراجع، ومرض فالدنستروم، لوجود الجلوبيولين المتضخم في الدم8. ورغم عدم استجابة كافة المرضى لهذه الأدوية، ولا تحمّلهم لآثارها، أدَّى معدل التجاوب العالي وظهور خيارات أخرى للعلاج الموجّه إلى انخفاض استخدام العلاج الكيميائي النموذجي، خاصة في حالات سرطان الدم الليمفاوي المزمن9.
لا يُسَبِّب عقارا "إبروتينيب" و"إديلاليسيب" تلف الحمض النووي بشكل مباشر، ولا يعطلان عمل إنزيمات إصلاح الحمض النووي، لكن عقار "إبروتينيب" يستهدف أحد إنزيمات التأشير المعروفة باسم PI3Kδ، ويعمل على تثبيط تعبير الإنزيم AID (المرجعان 10, 11)، الذي قد تكون له قدرة خطرة على التأثير على سلامة الحمض النووي. وفي الأحوال العادية، يعمل AID على تحويل قواعد السيتوزين إلى قواعد يوراسيل، في تسلسل الحمض النووي لجينات الجلوبيولين المناعي، التي تشكل الأجسام المضادة، ما يؤدي إلى ظهور طفرات وإعادة تركيب (أحداث تبادل تسلسلات الحمض النووي)، التي تُعَدّ ضرورية لإنتاج أجسام مضادة متنوعة لمكافحة العدوى12. ويعبّر عن إنزيم AID في الخلايا البائية المفعّلة فقط، التي تحدث فيها استجابة مناعية، ويتم التحكم في عمل الإنزيم بقوة، كي يستهدف جينات الجلوبيولين المناعي بشكل تفضيلي، إذ إنّ التغيرات في تسلسلات الحمض النووي الأخرى قد تسبِّب السرطان. وقد تسهم تأثيرات إنزيم AID النادرة و"البعيدة عن الهدف" على الجينات غير المشفرة للجلوبيولين المناعي في تطوير أورام معينة في الخلايا البائية البشرية5.
لاحظ كومبانيو وزملاؤه أن عقار "إديلاليسيب"، أو عقار "دوفيليسيب" المثبط لإنزيمات PI3Kδ - وهو عقار تجريبي - يدعمان تعبير إنزيم AID في الخلايا البائية المفعّلة. وكما هو متوقع، ترافقت هذه الزيادة مع حدوث عدد أكبر من الطفرات في الهدف، وأحداث إعادة تركيب لجينات الجلوبيولين المناعي. قد تُغَيِّر هذه النتيجة استجابات الأجسام المضادة، لكنها في الغالب لن تؤثر على صحة المرضى. أمّا ما استدعى قلقًا أكبر، فكان زيادة إعادة تركيب الحمض النووي بعيدًا عن الهدف، التي لوحظت في الخلايا البائية المفعّلة، وأدَّت إلى حدوث بعض التغيرات في الحمض النووي، التي توجَد عادةً في سرطانات الخلايا البائية. وقد أدَّى العلاج بواسطة عقاري "إديلاليسيب"، و"دوفيليسيب" إلى زيادة عدم الاستقرار الجينومي، وذلك عند اختبارهما في خلايا سرطان خلايا مانتل الليمفاوية البشري في المختبَر. وباستخدام الخلايا البائية من الفئران المفتقرة إلى إنزيم AID، والخلايا البائية البشرية ذات الجينوم المعدل، الخالية من إنزيم AID، أثبت الباحثون أن تلف الحمض النووي الناجم عن مثبطات PI3Kδ يعتمد على الإنزيم AID.[17]
يقوم عقار "إبروتينيب" بتثبيط إنزيم يُعرف باسم BTK. وفي مسارات تأشير مستقبِلات الخلايا البائية الأكثر ذكرًا، يعمل إنزيم BTK في مرحلة لاحقة بعد PI3Kδ، ولا يُعتقد أنه يشارك في المسار الذي ينظم التعبير عن إنزيم AID. ومع ذلك.. تشير دراسات إلى أن الإنزيمين PI3Kδ وBTK يعملان معًا في مركّب كبير متعدد البروتينات، ويدعمان نشاط بعضهما البعض13. وقد لاحظ كومبانيو وزملاؤه أن تثبيط إنزيم BTK بواسطة عقار "إبروتينيب" قد خفَّض نشاط إنزيم PI3Kδ (الذي تتحكم فيه عملية فسفرة بروتين AKT)، وزاد تعبير إنزيم AID في الخلايا البائية. وبالمقارنة بالعلاج بواسطة مثبطات PI3Kδ، لُوحِظ أن عقار "إبروتينيب" أدَّى أيضًا إلى زيادات في التطفر الجينومي في الحمض النووي، وفي أحداث إعادة التركيب، وإنْ كان ذلك بدرجة أقل.
ثمة تجربتان رئيستان تدعمان أهمية هذه النتائج في الجسم الحي. أولًا، يذكر كومبانيو وزملاؤه أن عقاقير "إديلاليسيب"، و"دوفيليسيب"، و"إبروتينيب" جميعها تزيد من ظهور الأورام المعتمِدة على إنزيم AID، والناشئة من الخلايا البائية في نموذج فأر. ثانيًا، أظهرت تحليلات الباحثين للحمض النووي المأخوذ من خلايا الدم ممن يعانون من سرطان الدم الليمفاوي المزمن - قبل تَلَقِّي العلاج بعقار "إديلاليسيب"، وبعده - زيادة كبيرة في الطفرات التي تحدث بعيدًا عن الهدف من قبل إنزيم AID.
وكما يشير الباحثون، ستكون هناك حاجة إلى متابعة المرضى المعالَجين بمثبطات مستقبلات الخلايا البائية لفترة أطول؛ لتقييم ما إذا كانت الأحداث التي ظهرت في الفئران - مثل زيادة تَكَوُّن الأورام المعتمدة على إنزيم AID - تحدث في البشر، أم لا. وقد حاز كل من "إبروتينيب"، و"إديلاليسيب" على موافقة "إدارة الغذاء والدواء الأمريكية" منذ أقل من خمس سنوات. وتظل هذه المركّبات تُعطَى لأجل غير مسمى، ويستمر العلاج بها بشكل عام، إلى أن يصبح المرض مقاومًا، أو أن يواجه المريض درجة غير مقبولة من السميّة. في المرحلة الثانية من التجارب الإكلينيكية لعقار "إبروتينيب"، تلقت إحدى المجموعات العقار بعد فشل العلاج الكيميائي، بينما تلقت المجموعة الأخرى العقار نفسه، لكن كعلاج أوَّلِيّ. في سنوات المتابعة الخمس لهذه التجربة، كان حوالي ثلث الأشخاص المتلقين لعقار "إبروتينيب" بعد فشل العلاج الكيميائي ما زالوا يتعاطون العقار؛ في حين كان ثلثا الأشخاص الذين تلقوا "إبروتينيب" كعلاج أوّلِيّ لا يزالون يُبْدُون تجاوبًا مع العلاج، ويتلقون الدواء.
ونظرًا إلى أن الهجوع التام عن طريق مثبطات مستقبِلات الخلايا البائية أمر غير شائع، فهناك حماس طفيف نحو إيقاف العلاج، على افتراض أن إيقافه سيؤدي إلى عودة المرض. وقد استطلعَتْ الاستراتيجيات التي طُبقت مؤخرًا أساليب جمع الجزيئات الصغيرة، مثل استخدام اثنين من مثبطات مستقبِلات الخلايا البائية، في محاولة لزيادة معدلات الهجوع التام، وتمكين إيقاف العلاج. ونظرًا إلى أن نتائج كومبانيو وزملائه تُظْهِر أن الأدوية التي تُعتبر غير ضارة بالحمض النووي قد تحفِّز - في حقيقة الأمر - عدم الاستقرار الجينومي، قد يصبح إمكان إيقاف العلاج مفهومًا أكثر جاذبية، يمكن التركيز عليه في التجارب الإكلينيكية المستقبلية.
التطورات والمستقبل
في الولايات المتحدة، Molecular Targets برنامج تطوير العلاجات المستهدفة الجزيئية التابع للمعهد القومي للسرطان يهدف لحديد وتطوير العلاجات المستهدفة الجزيئية التي قد تكون مرشحة للتطوير الدوائي.
انظر أيضاً
المصادر
- ^ "Definition of targeted therapy - NCI Dictionary of Cancer Terms".
- ^ NCI: Targeted Therapy tutorials
- ^ Syn, Nicholas Li-Xun; Yong, Wei-Peng; Goh, Boon-Cher; Lee, Soo-Chin (2016-08-01). "Evolving landscape of tumor molecular profiling for personalized cancer therapy: a comprehensive review". Expert Opinion on Drug Metabolism & Toxicology. 12 (8): 911–922. doi:10.1080/17425255.2016.1196187. ISSN 1744-7607. PMID 27249175.
- ^ Katzel JA, Fanucchi MP, Li Z (January 2009). "Recent advances of novel targeted therapy in non-small cell lung cancer". J Hematol Oncol. 2 (1): 2. doi:10.1186/1756-8722-2-2. PMC 2637898. PMID 19159467.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lacroix, Marc (2014). Targeted Therapies in Cancer. Hauppauge, NY: Nova Sciences Publishers. ISBN 978-1-63321-687-7.
- ^ Jordan VC (January 2008). "Tamoxifen: catalyst for the change to targeted therapy". Eur. J. Cancer. 44 (1): 30–38. doi:10.1016/j.ejca.2007.11.002. PMC 2566958. PMID 18068350.
- ^ Warr MR, Shore GC (December 2008). "Small-molecule Bcl-2 antagonists as targeted therapy in oncology". Curr Oncol. 15 (6): 256–61. PMC 2601021. PMID 19079626.
- ^ Li J, Zhao X, Chen L, et al. (2010). "Safety and pharmacokinetics of novel selective vascular endothelial growth factor receptor-2 inhibitor YN968D1 in patients with advanced malignancies". BMC Cancer. 10: 529. doi:10.1186/1471-2407-10-529. PMC 2984425. PMID 20923544.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ http://clinicaltrials.gov/ct2/results?term=apatinib
- ^ [1]
- ^ “Therascreen KRAS RGQ PCR Kit – P110030“. Device Approvals and Clearances. U.S. Food and Drug Administration. 2012-07-06.
- ^ European medicines Agency (June 2014). “Erbitux® Summary of Product Characteristics (PDF).“ 2015-11-19.
- ^ “Cetuximab (Erbitux). About the Center of Drug Evaluation and Research." U.S. Food and Drug Administration. 2015-11-16.
- ^ "Merck KGaA: European Commission Approves Erbitux for First-Line Use in Head and Neck Cancer" 2015-11-16
- ^ Pollack, Andrew (2009-03-31). "F.D.A. Panel Supports Avastin to Treat Brain Tumor". New York Times. Retrieved 2009-08-13.
- ^ العلاج الموجه.. سلاح جديد في مواجهة السرطان، صحتك
- ^ "عِلاج مُوَجَّه له مخاطر بعيدة عن الهدف". نيتشر. 2017-03-27. Retrieved 2017-12-11.
وصلات خارجية
- CancerDriver : a free and open database to find targeted therapies according to the patient's features.
- Targeted Therapy Database (TTD) [2] from the Melanoma Molecular Map Project [3]
- Targeted therapy Fact sheet from the U.S. National Cancer Institute
- Molecular Oncology: Receptor-Based Therapy Special issue of Journal of Clinical Oncology (April 10, 2005) dedicated to targeted therapies in cancer treatment
- Targeting Targeted Therapy New England Journal of Medicine (2004)
- Targeting tumors with medicinal cannabis oil - publication list from Spain