مستقبل عامل نمو البشرة
| epidermal growth factor receptor | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | erb-b2 receptor tyrosine kinase 1cell proliferation-inducing protein 61receptor tyrosine-protein kinase erbB-1epidermal growth factor receptor tyrosine kinase domainEGFRavian erythroblastic leukemia viral (v-erb-b) oncogene homologproto-oncogene c-ErbB-1cell growth inhibiting protein 40 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| External IDs | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
مستقبل عامل نمو البشرة epidermal growth factor receptor (اختصاراً EGFR؛ ErbB-1؛ HER1 في البشر)، هو پروتين غشائي ومستقبل لجميع أعضاء عائلة مستقبل نمو البشرة الربيطات الپروتينات خارج الخلية.[1]
مستقبل عامل نمو البشرة هو عضو عائلة مستقبلات ErbB، عائلة فرعية تضم أربع كينازات تايروسين المستقبل شديدة الارتباط: EGFR (ErbB-1), HER2/neu (ErbB-2), Her 3 (ErbB-3) وHer 4 (ErbB-4). في الكثير من أنواع السرطان، تؤثر الطفرات على تعبير مستقبل عامل نمو البشرة أو قد تتسبب في نشاط السرطان.[2]
اكتشف عامل نمو البشرة ومستقبلاته من قبل [[ستانلي كوهن (كيميائي حيوي)|ستانلي كوهن] من جامعة ڤدربيلت. تشارك كوهن جائزة نوبل في الطب عام 1986 مع ريتا لڤي مونتالشيني لاكتشافهما عوامل النمو.
ترتبط إشارة نقص مستقبل عامل نمو البشرة وكينازات تايروسين المستقبل الأخرى في البشر بأمراض مثل ألزايمر، بينما يرتبط فرط تعبيرهما بتطور مجموعة واسعة من الأورام. إعاقة إشارات مستقبل عام نمو البشرة، سواء بحصر مواقع ارتباط مستقبل عامل نمو البشرة على النطاق الخارج-خلوي للمستقبل أو بتثبيط نشاط كيناز التايروسين الخلوي، قد يمنع نمو الأورام المعبر عنها بمستقبل عامل نمو البشرة وتحسين حالة المريض.
الوظيفة
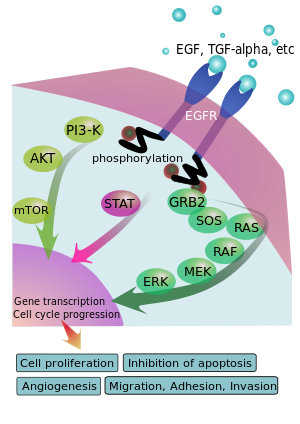
مستقبل عامل نمو البشرة هو پروتين غشائي يُنشط بالارتباط بربيطاته المحددة، وتشمل عامل نمو البشرة وعامل النمو المحول ألفا (TGFα)[3] تمتلك عائلة پروتينات ErbB2 اتجاه غير معروف لتنشيط الربيطة، وقد تكون في حالة نشطة بشكل أساسي أو تصبح نشطة عند الديمرة المتغايرة مع أعضاء العائلات الأخرى مثل مستقبل عامل نمو البشرة.
عند تنشيطه بربيطات عامل النمو الخاصة به، يخضع مستقبل عامل نمو البشرة للانتقال من الشكل المونوموري الخامل إلى الهوموديمر النشط.[4] – على الرغم من عدم وجود دليل على أن الديمرات الخاملة قد تتواجد أيضاً قبل ارتباط الربيطة.[بحاجة لمصدر] بالإضافة إلى تشكل الهوموديمرات بعد ارتباط الربيطة، قد يرتبط مستقبل عامل نمو البشرة بأفراد آخرين في عائلة مستقبلات ErbB، مثل ErbB2/Her2/neu، لتخليق هتروديمر منشط. هناك أيضاً دليل يشير إلى مجموعات مستقبل عامل نمو البشرة النشطة، على الرغم من أنه لا زال غير واضحاً ما إذا كان التجمع هاماً لتنشيطها أو لحدوث التنشيط اللاحق للديمرات الفردية.[بحاجة لمصدر]
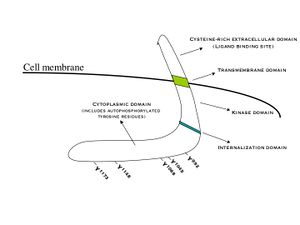
ديمرة مستقبل عامل نمو البشرة يحفز نشاط پروتينه الخلوي-كيناز التايروسين. نتيجة لذلك، فالفسفرة الذاتية لمختلف التايروسينات (Y) يترسب في [[نطاقات الپروتين|النطاق الطرفي-سي لمستقبل عامل نمو البشرة. يتضمن هذا Y992، Y1045، Y1068، Y1148 وY1173، كما هو موضح في المخطط أعلاه.[5] تثير عملية الفسفرة الذاتية هذه تنشيط downstream والتأثير بواسطة الپروتينات الأخرى التي ترتبط بالتايروسينات المسفسفرة عن طريق نطاقات SH2 المرتبطة بالتايروسين المفسفر الخاص بها. پروتنيات التأشير هذه تبدأ تدفقات نقل الإشارة المختلفة، وبصفة رئيسية مسارات MAPK، Akt وJNK، مما يؤدي إلى تخليق الدنا وتكاثر الخلية.[6] تعدل هذه النوعية من الپروتينات الأنماط الظاهرية مثل هجرة، التساق، وتكاثر الخلية. تنشيط المستقبل عاملاً هاماً للاستجابة المناعية الفطرية في جلد الإنسان. نطاق كيناز مستقبل عامل نمو البشرة قد يرسب أيضاً تايروسين فوسفورلات المستقبلات الأخرى التي يتجمع معها، وقد يُنشط هو ذاته بهذه الطريقة.
الأدوار الحيوية
مستقبل عامل نمو البشرة أساسياً للتطور القنوي للغدد الثديية،[7][8][9] وناهضات مستقبل عامل نمو البشرة مثل الأمفيرگولين، TGF-α، والهرگولين تحفز كلاً من التطور القنوي والأسناخ الثديية حتى مع غياب الإستروجين والپروجسترون.[10][11]
دوره في الأمراض البشرية
السرطان
ترتبط الطفرات التي تؤدي إلى فرط تعبير مستقبل عامل نمو البشرة (ما يُعرف بفرط التنظيم أو التضخيم) بعدد من السرطانات، تشمل السرطانة الغدية الرئوية adenocarcinoma of the lung (40% من الحالات)، سرطانات الشرج،[12] الورم الأرومي الدبقي (50%) وأورام الرأس والعنق الطلائية (80-100%).[13] تؤدي هذه الطفرات الجسدية المرتبطة بمستقبل عامل نمو البشرة إلى تنشيطه بشكل مستمر، مما يُنتج انقسام خلوي غير منضبط.[14] في الورم الأرومي الدبقي، هناك طفرة معينة في مستقبل عامل نمو البشرة، تسمى EGFRvIII، عادة ما يتم رصدها.[15] الطفرات أو التضخيمات أو خطأ التنظيم في مستقبل عامل نمو البشرة أو أفراد عائلة تلك المستقبلات يسهم بحوالي 30% من جميع حالات سرطان النسيج الطلائي..[بحاجة لمصدر]
الأمراض الالتهابية
يرتبط شذوذ إشارات مستقبل عامل نمو البشرة بالصدفية، الإكزيما وتصلب الشرايين.[16][17] إلا أن دوره المحدد في هذه الحالات غير معروف على وجه الدقة.
المرض أحادي المنشأ
وُجد أن طفل واحد يظهر أعراض الالتهاب الطلائي متعدد الأعضاء لديه فقدان متماثل في طفرة وظيفية في طين مستقبل عامل نمو البشرة. دُعمت مرضية طفرات عامل نمو البشرة من خلال التجارب المعملية والتحليل الوظيفي لخزعة الجلد. ينعكس النمظ الظاهري الحاد من خلال العديد من نتائج البحوث السابقة حول وظيفة مستقبل عامل نمو البشرة. تضمنت سماته السريرية طفح حطاطي بثري، جفاف الجلد، الإسهال المزمن، شذوذ في نمو الشعر، صعوبات في التنفس والاختلال الكهرلي.[18]
التئام الجروح والتليف
تبين أن مستقبل عامل نمو البشرة يلعب دوراً حيوياً في تمايز الخلايا الليفية اليافعة المعتمدة على TGF-beta1 إلى خلايا ليفية عضلية.[19][20] قد يؤدي التصلب الشاذ للخلايا الليفية العضلية داخل الأنسجة إلى تليف تدريجي في الأنسجة، مضعفاً وظيفة الأنسجة أو الأعضاء (على سبيل المثال الندبات الضخامية أو جدرات لجلد، التليف الكبدي، التليف القلبي، أمراض الكلى المزمنة).
التطبيقات الطبية
كهدف للأدوية
أدى تعريف مستقبل عامل نمو البشرة كجين ورمي إلى تطوير العلاجات المضادة للسرطان الموجهة لمستقبل عامل نمو البشرة (المسماة "مثبطات عامل نمو البشرطة")، ومنها الگفتينيب gefitinib،[21] الإرلوتينيب erlotinib، الأفاتينيب afatinib، البريگاتينيب brigatinib، الإكوتينيب {{إنج1|icotinib[22] بعلاج سرطان الرئة، والسـِتوكسيماب cetuximab لعلاج سرطان القولون. كما طورت أسترازنكا مؤخراً دواء الأوسيمرتينيب Osimertinib، مثبط كيناز التايروسين من الجيل الثالث.[23]
وضعت الكثير من المناهج العلاجية مستقبل عامل نمو البشرة هدفاً لها. السـِتوكسيماب والپانيتوموماب panitumumab من أمثلة مثبطات إنزيم الأجسام المضادة وحيدة النسيلة. إلا أن الأخير هو أحد أنواع IgG1، بينما يتبع الأول نوع IgG2؛ حيث يمكن أن يكون تأثيرهما على السمية الخلوية المعتمدة على الأجسام المضادة مختلف تماماً.[24] أما الأجسام المضادة الأخرى قيد التطوير فتشمل الزالوتوموماب zalutumumab، [[نيموتوزوماب|النيموتوزوماب nimotuzumab والماتوزوماب matuzumab. تحصر الأجسام المضادة وحيدة النسيلة نطاق ارتباط الربيطة خارج الخلية. بحصر موقع الارتباط، لن يصبح بمقدور جزيئات الإشارة الالتصاق هناك وينشط كيناز التايروسين.
ومن الطرق الأخرى استخدام الجزيئات الصغيرة لتثبيط كيناز تايروسين مستقبل عامل نمو البشرة، الموجود على الجانب السيتوپلازمي للمستقبل. في غياب نشاط الكيناز، لن يتمكن مستقبل عامل نمو البشرة من تنشيط نفسه، وهو شرط أساسي لربط downstream adaptor proteins. ظاهريا عن طريق إيقاف سلسلة الإشارة في الخلايا التي تعتمد على هذا المسار للنمو، يقل انتشار الورم ووانتقاله من مكان لآخر. الگفيتينيب Gefitinib، الإروتينيب erlotinib، البريگاتينيب brigatinib واللاپاتينيب lapatinib (مثبط مختلط لـEGFR وERBB2) هم أمثلة لمثبطات كيناز الجزيئات الصغيرة.
CimaVax-EGF، لقاح يستهدف عامل نمو البشرة كربيطة أساسية لعامل نمو البشرة، يستخدم منهجيات مختلفة، يرفع الأجسام المضادة لعامل نمو البشرة نفسه، ومن ثم يمنع حافز انقسام السرطانات المعتمدة على عامل نمو البشرة؛[25] وهو قيد الاستخدام كعلاج لسرطان الرئة ذو الخلايا غير الصغيرة (من أكثر سرطان الرئة شيوعاً) في كوبا، وتخضع للمزيد من التجارب من أجل الترخيص المحتمل في اليابان وأوروپا والولايات المتحدة.[26]
هناك العديد من الأساليب الكمية المتاحة التي تستخدم الكشف عن فسفرة الپروتين لتحديد مثبطات عائلة مستقبل عامل نمو البشرة.[27]
الأدوية الجديدة مثل الأوسيمرتينيب osimertinib، الگفيتينيب gefitinib، الإرلوتينيب erlotinib والبريگاتينيب brigatinib، تستهدف بصفة مباشرة عامل نمو البشرة. ينقسم المرضى إلى مجموعتين، مجموعة إيجابية لعامل نمو البشرة، ومجموعة سلبية لعامل نمو البشرة، بناء على ما إذا كان اختبار الأنسجة يظهر وجود طفرة. المرضى الإيجابيين لعامل نمو البشرة يظهرون معدل استجابة 60%، الذي يتعدى معدل الاستجابة للعلاج الكيميائي التقليدي.[28]
ومع ذلك، فقد تطورت مقاومة لدى لكثير من الحالات. المصدران الرئيسيان للمقاومة هما طفرة T790M والجين الورمي MET.[28] ومع ذلك، اعتباراً من 2010، لم يكن هناك إجماع على المقاربة المقبولة لمواجهة المقاومة أو موافقة إدارة الأغذية والعقاقير على مجموعة محددة. النتائج المبلغ عنها للتجارب السريرية من المرحلة الثانية لاستهداف البريگيتينيب للطفرة T790M، وفي فبراير 2015 حصل البريگيتينيب على حالة تعيين دواء اختراقي من قبل ادارة الغذاء والدواء.
الآثار الجانبية الأكثر شيوعاً لمثبطات مستقبل عامل نمو البشرة، وُجد أن أكثر من 90% من الحالات، ظهر لديهم طفح حطاطي بثري الذي انتشر في الوجه والجذع؛ يرتبط وجود الطفح بتأثير الدواء المضاد للأورام.[29] في 10% إلى 15% من الحالات كانت الآثار خطيرة وتستلزم العلاج.[30][31]
تهدف بعض الاختبارات إلى التنبؤ بالاستفادة من علاج مستقبل عامل نمو البشرة، مثل الڤريستارت Veristrat.[32]
أظهرة الأبحاث المعملية على الفئران باستخدام الخلايا الجذعية المهندسة وراثياً لاستهداف مستقبل عامل نمو البشرة في عام 2014 نتائج واعدة.[33]
مستقبل عامل نمو البشرة هو هدف ثابت للأجسام المضادة وحيدة النسيلة ومثبطات محددة لكيناز التايروسين.[34]
هدف لعوامل التصوير
تطورت عوامل التصوير لتحديد السرطانات المرتبطة بمستقبل عامل نمو البشرة باستخدام عامل نمو البشرة المصنف.[35] أثبت العديد من الدراسات جدوى تصوير تعبير مستقبل عامل نمو البشرة في الأجسام الحية.[36][37]
التفاعلات
تبين أن مستقبل عامل نمو البشرة يتفاعل مع:
- AC،[38][39]
- ARF4،[40]
- CAV1،[41]
- CAV3,[41]
- CBL،[42][43][44][45][46]
- CBLB،[43][47]
- CBLC،[48][49]
- CD44،[19]
- CDC25A،[50]
- CRK،[47][51]
- CTNNB1،[52][53][54]
- DCN،[55][56]
- EGF،[57][58]
- GRB14،[59]
- Grb2،[47][57][59][60][61][62][63][64][65][66]
- JAK2،[67]
- MUC1،[68][69]
- NCK1،[60][70][71]
- NCK2،[60][72][73]
- PKC alpha،[74]
- PLCG1،[42][75]
- PLSCR1،[76]
- PTPN1،[77][78]
- PTPN11،[47][79]
- PTPN6،[79][80]
- PTPRK،[81]
- SH2D3A،[82]
- SH3KBP1،[83][84]
- SHC1،[47][85]
- SOS1،[65][86][87]
- Src،[67][88][89]
- STAT1،[67][90]
- STAT3،[67][91]
- STAT5A،[47][67]
- UBC،[44][45][92] و
- WAS.[93]
في ذبابة الفاكهة، يتفاعل مستقبل عامل نمو البشرة مع الپروتين سپيتز.[94]
المصادر
- ^ Herbst RS (2004). "Review of epidermal growth factor receptor biology". International Journal of Radiation Oncology, Biology, Physics. 59 (2 Suppl): 21–6. doi:10.1016/j.ijrobp.2003.11.041. PMID 15142631.
- ^ Zhang H, Berezov A, Wang Q, Zhang G, Drebin J, Murali R, Greene MI (August 2007). "ErbB receptors: from oncogenes to targeted cancer treatment". The Journal of Clinical Investigation. 117 (8): 2051–8. doi:10.1172/JCI32278. PMC 1934579. PMID 17671639.
- ^ note, a full list of the ligands able to activate EGFR and other members of the ErbB family is given in the ErbB article).
- ^ Yarden Y, Schlessinger J (March 1987). "Epidermal growth factor induces rapid, reversible aggregation of the purified epidermal growth factor receptor". Biochemistry. 26 (5): 1443–51. doi:10.1021/bi00379a035. PMID 3494473.
- ^ Downward J, Parker P, Waterfield MD (1984). "Autophosphorylation sites on the epidermal growth factor receptor". Nature. 311 (5985): 483–5. doi:10.1038/311483a0. PMID 6090945.
- ^ Oda K, Matsuoka Y, Funahashi A, Kitano H (2005). "A comprehensive pathway map of epidermal growth factor receptor signaling". Molecular Systems Biology. 1 (1): E1–E17. doi:10.1038/msb4100014. PMC 1681468. PMID 16729045.
- ^ Sebastian J, Richards RG, Walker MP, Wiesen JF, Werb Z, Derynck R, Hom YK, Cunha GR, DiAugustine RP (September 1998). "Activation and function of the epidermal growth factor receptor and erbB-2 during mammary gland morphogenesis". Cell Growth & Differentiation. 9 (9): 777–85. PMID 9751121.
- ^ McBryan J, Howlin J, Napoletano S, Martin F (June 2008). "Amphiregulin: role in mammary gland development and breast cancer". Journal of Mammary Gland Biology and Neoplasia. 13 (2): 159–69. doi:10.1007/s10911-008-9075-7. PMID 18398673.
- ^ Sternlicht MD, Sunnarborg SW (June 2008). "The ADAM17-amphiregulin-EGFR axis in mammary development and cancer". Journal of Mammary Gland Biology and Neoplasia. 13 (2): 181–94. doi:10.1007/s10911-008-9084-6. PMC 2723838. PMID 18470483.
- ^ Kenney NJ, Bowman A, Korach KS, Barrett JC, Salomon DS (May 2003). "Effect of exogenous epidermal-like growth factors on mammary gland development and differentiation in the estrogen receptor-alpha knockout (ERKO) mouse". Breast Cancer Research and Treatment. 79 (2): 161–73. doi:10.1023/a:1023938510508. PMID 12825851.
- ^ Kenney NJ, Smith GH, Rosenberg K, Cutler ML, Dickson RB (December 1996). "Induction of ductal morphogenesis and lobular hyperplasia by amphiregulin in the mouse mammary gland". Cell Growth & Differentiation. 7 (12): 1769–81. PMID 8959346.
- ^ Walker F, Abramowitz L, Benabderrahmane D, Duval X, Descatoire V, Hénin D, Lehy T, Aparicio T (November 2009). "Growth factor receptor expression in anal squamous lesions: modifications associated with oncogenic human papillomavirus and human immunodeficiency virus". Human Pathology. 40 (11): 1517–27. doi:10.1016/j.humpath.2009.05.010. PMID 19716155.
- ^ Kumar, Vinay; Abbas, Abul; Aster, Jon (2013). Robbins basic pathology. Philadelphia: Elsevier/Saunders. p. 179. ISBN 9781437717815.
{{cite book}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Lynch TJ, Bell DW, Sordella R, Gurubhagavatula S, Okimoto RA, Brannigan BW, Harris PL, Haserlat SM, Supko JG, Haluska FG, Louis DN, Christiani DC, Settleman J, Haber DA (May 2004). "Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib". The New England Journal of Medicine. 350 (21): 2129–39. doi:10.1056/NEJMoa040938. PMID 15118073.
- ^ Kuan CT, Wikstrand CJ, Bigner DD (June 2001). "EGF mutant receptor vIII as a molecular target in cancer therapy". Endocrine-Related Cancer. 8 (2): 83–96. doi:10.1677/erc.0.0080083. PMID 11397666.
- ^ Jost M, Kari C, Rodeck U (2000). "The EGF receptor - an essential regulator of multiple epidermal functions". European Journal of Dermatology. 10 (7): 505–10. PMID 11056418.
- ^ Dreux AC, Lamb DJ, Modjtahedi H, Ferns GA (May 2006). "The epidermal growth factor receptors and their family of ligands: their putative role in atherogenesis". Atherosclerosis. 186 (1): 38–53. doi:10.1016/j.atherosclerosis.2005.06.038. PMID 16076471.
- ^ Campbell P, Morton PE, Takeichi T, Salam A, Roberts N, Proudfoot LE, Mellerio JE, Aminu K, Wellington C, Patil SN, Akiyama M, Liu L, McMillan JR, Aristodemou S, Ishida-Yamamoto A, Abdul-Wahab A, Petrof G, Fong K, Harnchoowong S, Stone KL, Harper JI, McLean WH, Simpson MA, Parsons M, McGrath JA (October 2014). "Epithelial inflammation resulting from an inherited loss-of-function mutation in EGFR". The Journal of Investigative Dermatology. 134 (10): 2570–8. doi:10.1038/jid.2014.164. PMC 4090136. PMID 24691054.
- ^ أ ب Midgley AC, Rogers M, Hallett MB, Clayton A, Bowen T, Phillips AO, Steadman R (May 2013). "Transforming growth factor-β1 (TGF-β1)-stimulated fibroblast to myofibroblast differentiation is mediated by hyaluronan (HA)-facilitated epidermal growth factor receptor (EGFR) and CD44 co-localization in lipid rafts". The Journal of Biological Chemistry. 288 (21): 14824–38. doi:10.1074/jbc.M113.451336. PMC 3663506. PMID 23589287.
- ^ Midgley AC, Bowen T, Phillips AO, Steadman R (April 2014). "MicroRNA-7 inhibition rescues age-associated loss of epidermal growth factor receptor and hyaluronan-dependent differentiation in fibroblasts". Aging Cell. 13 (2): 235–44. doi:10.1111/acel.12167. PMC 4331777. PMID 24134702.
- ^ Paez JG, Jänne PA, Lee JC, Tracy S, Greulich H, Gabriel S, Herman P, Kaye FJ, Lindeman N, Boggon TJ, Naoki K, Sasaki H, Fujii Y, Eck MJ, Sellers WR, Johnson BE, Meyerson M (June 2004). "EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy". Science. 304 (5676): 1497–500. doi:10.1126/science.1099314. PMID 15118125.
- ^ Liang W, Wu X, Fang W, Zhao Y, Yang Y, Hu Z, Xue C, Zhang J, Zhang J, Ma Y, Zhou T, Yan Y, Hou X, Qin T, Dinglin X, Tian Y, Huang P, Huang Y, Zhao H, Zhang L (12 February 2014). "Network meta-analysis of erlotinib, gefitinib, afatinib and icotinib in patients with advanced non-small-cell lung cancer harboring EGFR mutations". PLoS ONE. 9 (2): e85245. doi:10.1371/journal.pone.0085245. PMC 3922700. PMID 24533047.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Greig SL (February 2016). "Osimertinib: First Global Approval". Drugs. 76 (2): 263–73. doi:10.1007/s40265-015-0533-4. PMID 26729184.
- ^ Yan L, Beckman RA (October 2005). "Pharmacogenetics and pharmacogenomics in oncology therapeutic antibody development". BioTechniques. 39 (4): 565–8. doi:10.2144/000112043. PMID 16235569.
- ^ Rodríguez PC, Rodríguez G, González G, Lage A (Winter 2010). "Clinical development and perspectives of CIMAvax EGF, Cuban vaccine for non-small-cell lung cancer therapy". MEDICC Review. 12 (1): 17–23. PMID 20387330.
- ^ Patel, Neel (11 May 2015). "Cuba Has a Lung Cancer Vaccine—And America Wants It". Wired. Retrieved 13 May 2015.
{{cite news}}: Unknown parameter|name-list-format=ignored (|name-list-style=suggested) (help) - ^ Olive DM (October 2004). "Quantitative methods for the analysis of protein phosphorylation in drug development". Expert Review of Proteomics. 1 (3): 327–41. doi:10.1586/14789450.1.3.327. PMID 15966829.
- ^ أ ب Jackman DM, Miller VA, Cioffredi LA, Yeap BY, Jänne PA, Riely GJ, Ruiz MG, Giaccone G, Sequist LV, Johnson BE (August 2009). "Impact of epidermal growth factor receptor and KRAS mutations on clinical outcomes in previously untreated non-small cell lung cancer patients: results of an online tumor registry of clinical trials". Clinical Cancer Research. 15 (16): 5267–73. doi:10.1158/1078-0432.CCR-09-0888. PMC 3219530. PMID 19671843.
- ^ Liu HB, Wu Y, Lv TF, Yao YW, Xiao YY, Yuan DM, Song Y (2013). "Skin rash could predict the response to EGFR tyrosine kinase inhibitor and the prognosis for patients with non-small cell lung cancer: a systematic review and meta-analysis". PLoS ONE. 8 (1): e55128. doi:10.1371/journal.pone.0055128. PMC 3559430. PMID 23383079.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Gerber PA, Meller S, Eames T, Buhren BA, Schrumpf H, Hetzer S, Ehmann LM, Budach W, Bölke E, Matuschek C, Wollenberg A, Homey B (2012). "Management of EGFR-inhibitor associated rash: a retrospective study in 49 patients". European Journal of Medical Research. 17 (1): 4. doi:10.1186/2047-783X-17-4. PMC 3351712. PMID 22472354.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Lacouture ME (October 2006). "Mechanisms of cutaneous toxicities to EGFR inhibitors". Nature Reviews. Cancer. 6 (10): 803–12. doi:10.1038/nrc1970. PMID 16990857.
- ^ Molina-Pinelo S, Pastor MD, Paz-Ares L (February 2014). "VeriStrat: a prognostic and/or predictive biomarker for advanced lung cancer patients?". Expert Review of Respiratory Medicine. 8 (1): 1–4. doi:10.1586/17476348.2014.861744. PMID 24308656.
- ^ Stuckey DW, Hingtgen SD, Karakas N, Rich BE, Shah K (February 2015). "Engineering toxin-resistant therapeutic stem cells to treat brain tumors". Stem Cells. 33 (2): 589–600. doi:10.1002/stem.1874. PMC 4305025. PMID 25346520.
- ^ Roskoski R Jr (2014). "The ErbB/HER family of protein-tyrosine kinases and cancer". Pharmacol Res. 79: 34–74. doi:10.1016/j.phrs.2013.11.002. PMID 24269963.
- ^ Lucas LJ, Tellez CA, Castilho ML, Lee CL, Hupman MA, Vieira LS, Ferreira I, Raniero L, Hewitt KC (May 2015). "Development of a sensitive, stable and EGFR-specific molecular imaging agent for surface enhanced Raman spectroscopy". Journal of Raman Spectroscopy. 46 (5): 434–446. doi:10.1002/jrs.4678.
- ^ Lucas LJ, Chen XK, Smith AJ, Korbelik M, Zeng, Haitian L, Lee PW, Hewitt KC (23 January 2015). "Aggregation of nanoparticles in endosomes and lysosomes produces surface-enhanced Raman spectroscopy". Journal of Nanophotonics. 9 (1): 093094–1–14. doi:10.1117/1.JNP.9.093094.
- ^ Andersson KG, Oroujeni M, Garousi J, Mitran B, Ståhl S, Orlova A, Löfblom J, Tolmachev V (December 2016). "Feasibility of imaging of epidermal growth factor receptor expression with ZEGFR:2377 affibody molecule labeled with 99mTc using a peptide-based cysteine-containing chelator". International Journal of Oncology. 49 (6): 2285–2293. doi:10.3892/ijo.2016.3721. PMC 5118000. PMID 27748899.
- ^ Bonaccorsi L, Carloni V, Muratori M, Formigli L, Zecchi S, Forti G, Baldi E (October 2004). "EGF receptor (EGFR) signaling promoting invasion is disrupted in androgen-sensitive prostate cancer cells by an interaction between EGFR and androgen receptor (AR)". International Journal of Cancer. 112 (1): 78–86. doi:10.1002/ijc.20362. PMID 15305378.
- ^ Bonaccorsi L, Muratori M, Carloni V, Marchiani S, Formigli L, Forti G, Baldi E (August 2004). "The androgen receptor associates with the epidermal growth factor receptor in androgen-sensitive prostate cancer cells". Steroids. 69 (8–9): 549–52. doi:10.1016/j.steroids.2004.05.011. PMID 15288768.
- ^ Kim SW, Hayashi M, Lo JF, Yang Y, Yoo JS, Lee JD (January 2003). "ADP-ribosylation factor 4 small GTPase mediates epidermal growth factor receptor-dependent phospholipase D2 activation". The Journal of Biological Chemistry. 278 (4): 2661–8. doi:10.1074/jbc.M205819200. PMID 12446727.
- ^ أ ب Couet J, Sargiacomo M, Lisanti MP (November 1997). "Interaction of a receptor tyrosine kinase, EGF-R, with caveolins. Caveolin binding negatively regulates tyrosine and serine/threonine kinase activities". The Journal of Biological Chemistry. 272 (48): 30429–38. doi:10.1074/jbc.272.48.30429. PMID 9374534.
- ^ أ ب Tvorogov D, Carpenter G (July 2002). "EGF-dependent association of phospholipase C-gamma1 with c-Cbl". Experimental Cell Research. 277 (1): 86–94. doi:10.1006/excr.2002.5545. PMID 12061819.
- ^ أ ب Ettenberg SA, Keane MM, Nau MM, Frankel M, Wang LM, Pierce JH, Lipkowitz S (March 1999). "cbl-b inhibits epidermal growth factor receptor signaling". Oncogene. 18 (10): 1855–66. doi:10.1038/sj.onc.1202499. PMID 10086340.
- ^ أ ب Pennock S, Wang Z (May 2008). "A tale of two Cbls: interplay of c-Cbl and Cbl-b in epidermal growth factor receptor downregulation". Molecular and Cellular Biology. 28 (9): 3020–37. doi:10.1128/MCB.01809-07. PMC 2293090. PMID 18316398.
- ^ أ ب Umebayashi K, Stenmark H, Yoshimori T (August 2008). "Ubc4/5 and c-Cbl continue to ubiquitinate EGF receptor after internalization to facilitate polyubiquitination and degradation". Molecular Biology of the Cell. 19 (8): 3454–62. doi:10.1091/mbc.E07-10-0988. PMC 2488299. PMID 18508924.
- ^ Ng C, Jackson RA, Buschdorf JP, Sun Q, Guy GR, Sivaraman J (March 2008). "Structural basis for a novel intrapeptidyl H-bond and reverse binding of c-Cbl-TKB domain substrates". The EMBO Journal. 27 (5): 804–16. doi:10.1038/emboj.2008.18. PMC 2265755. PMID 18273061.
- ^ أ ب ت ث ج ح Schulze WX, Deng L, Mann M (2005). "Phosphotyrosine interactome of the ErbB-receptor kinase family". Molecular Systems Biology. 1 (1): E1–E13. doi:10.1038/msb4100012. PMC 1681463. PMID 16729043.
- ^ Kim M, Tezuka T, Suziki Y, Sugano S, Hirai M, Yamamoto T (October 1999). "Molecular cloning and characterization of a novel cbl-family gene, cbl-c". Gene. 239 (1): 145–54. doi:10.1016/S0378-1119(99)00356-X. PMID 10571044.
- ^ Keane MM, Ettenberg SA, Nau MM, Banerjee P, Cuello M, Penninger J, Lipkowitz S (June 1999). "cbl-3: a new mammalian cbl family protein". Oncogene. 18 (22): 3365–75. doi:10.1038/sj.onc.1202753. PMID 10362357.
- ^ Wang Z, Wang M, Lazo JS, Carr BI (May 2002). "Identification of epidermal growth factor receptor as a target of Cdc25A protein phosphatase". The Journal of Biological Chemistry. 277 (22): 19470–5. doi:10.1074/jbc.M201097200. PMID 11912208.
- ^ Hashimoto Y, Katayama H, Kiyokawa E, Ota S, Kurata T, Gotoh N, Otsuka N, Shibata M, Matsuda M (July 1998). "Phosphorylation of CrkII adaptor protein at tyrosine 221 by epidermal growth factor receptor". The Journal of Biological Chemistry. 273 (27): 17186–91. doi:10.1074/jbc.273.27.17186. PMID 9642287.
- ^ Hazan RB, Norton L (April 1998). "The epidermal growth factor receptor modulates the interaction of E-cadherin with the actin cytoskeleton". The Journal of Biological Chemistry. 273 (15): 9078–84. doi:10.1074/jbc.273.15.9078. PMID 9535896.
- ^ Schroeder JA, Adriance MC, McConnell EJ, Thompson MC, Pockaj B, Gendler SJ (June 2002). "ErbB-beta-catenin complexes are associated with human infiltrating ductal breast and murine mammary tumor virus (MMTV)-Wnt-1 and MMTV-c-Neu transgenic carcinomas". The Journal of Biological Chemistry. 277 (25): 22692–8. doi:10.1074/jbc.M201975200. PMID 11950845.
- ^ Takahashi K, Suzuki K, Tsukatani Y (July 1997). "Induction of tyrosine phosphorylation and association of beta-catenin with EGF receptor upon tryptic digestion of quiescent cells at confluence". Oncogene. 15 (1): 71–8. doi:10.1038/sj.onc.1201160. PMID 9233779.
- ^ Santra M, Reed CC, Iozzo RV (September 2002). "Decorin binds to a narrow region of the epidermal growth factor (EGF) receptor, partially overlapping but distinct from the EGF-binding epitope". The Journal of Biological Chemistry. 277 (38): 35671–81. doi:10.1074/jbc.M205317200. PMID 12105206.
- ^ Iozzo RV, Moscatello DK, McQuillan DJ, Eichstetter I (February 1999). "Decorin is a biological ligand for the epidermal growth factor receptor". The Journal of Biological Chemistry. 274 (8): 4489–92. doi:10.1074/jbc.274.8.4489. PMID 9988678.
- ^ أ ب Wong L, Deb TB, Thompson SA, Wells A, Johnson GR (March 1999). "A differential requirement for the COOH-terminal region of the epidermal growth factor (EGF) receptor in amphiregulin and EGF mitogenic signaling". The Journal of Biological Chemistry. 274 (13): 8900–9. doi:10.1074/jbc.274.13.8900. PMID 10085134.
- ^ Stortelers C, Souriau C, van Liempt E, van de Poll ML, van Zoelen EJ (July 2002). "Role of the N-terminus of epidermal growth factor in ErbB-2/ErbB-3 binding studied by phage display". Biochemistry. 41 (27): 8732–41. doi:10.1021/bi025878c. PMID 12093292.
- ^ أ ب Daly RJ, Sanderson GM, Janes PW, Sutherland RL (May 1996). "Cloning and characterization of GRB14, a novel member of the GRB7 gene family". The Journal of Biological Chemistry. 271 (21): 12502–10. doi:10.1074/jbc.271.21.12502. PMID 8647858.
- ^ أ ب ت Braverman LE, Quilliam LA (February 1999). "Identification of Grb4/Nckbeta, a src homology 2 and 3 domain-containing adapter protein having similar binding and biological properties to Nck". The Journal of Biological Chemistry. 274 (9): 5542–9. doi:10.1074/jbc.274.9.5542. PMID 10026169.
- ^ Blagoev B, Kratchmarova I, Ong SE, Nielsen M, Foster LJ, Mann M (March 2003). "A proteomics strategy to elucidate functional protein-protein interactions applied to EGF signaling". Nature Biotechnology. 21 (3): 315–8. doi:10.1038/nbt790. PMID 12577067.
- ^ Oneyama C, Nakano H, Sharma SV (March 2002). "UCS15A, a novel small molecule, SH3 domain-mediated protein-protein interaction blocking drug". Oncogene. 21 (13): 2037–50. doi:10.1038/sj.onc.1205271. PMID 11960376.
- ^ Okutani T, Okabayashi Y, Kido Y, Sugimoto Y, Sakaguchi K, Matuoka K, Takenawa T, Kasuga M (December 1994). "Grb2/Ash binds directly to tyrosines 1068 and 1086 and indirectly to tyrosine 1148 of activated human epidermal growth factor receptors in intact cells". The Journal of Biological Chemistry. 269 (49): 31310–4. PMID 7527043.
- ^ Tortora G, Damiano V, Bianco C, Baldassarre G, Bianco AR, Lanfrancone L, Pelicci PG, Ciardiello F (February 1997). "The RIalpha subunit of protein kinase A (PKA) binds to Grb2 and allows PKA interaction with the activated EGF-receptor". Oncogene. 14 (8): 923–8. doi:10.1038/sj.onc.1200906. PMID 9050991.
- ^ أ ب Buday L, Egan SE, Rodriguez Viciana P, Cantrell DA, Downward J (March 1994). "A complex of Grb2 adaptor protein, Sos exchange factor, and a 36-kDa membrane-bound tyrosine phosphoprotein is implicated in ras activation in T cells". The Journal of Biological Chemistry. 269 (12): 9019–23. PMID 7510700.
- ^ Lowenstein EJ, Daly RJ, Batzer AG, Li W, Margolis B, Lammers R, Ullrich A, Skolnik EY, Bar-Sagi D, Schlessinger J (August 1992). "The SH2 and SH3 domain-containing protein GRB2 links receptor tyrosine kinases to ras signaling". Cell. 70 (3): 431–42. doi:10.1016/0092-8674(92)90167-B. PMID 1322798.
- ^ أ ب ت ث ج Olayioye MA, Beuvink I, Horsch K, Daly JM, Hynes NE (June 1999). "ErbB receptor-induced activation of stat transcription factors is mediated by Src tyrosine kinases". The Journal of Biological Chemistry. 274 (24): 17209–18. doi:10.1074/jbc.274.24.17209. PMID 10358079.
- ^ Schroeder JA, Thompson MC, Gardner MM, Gendler SJ (April 2001). "Transgenic MUC1 interacts with epidermal growth factor receptor and correlates with mitogen-activated protein kinase activation in the mouse mammary gland". The Journal of Biological Chemistry. 276 (16): 13057–64. doi:10.1074/jbc.M011248200. PMID 11278868.
- ^ Li Y, Ren J, Yu W, Li Q, Kuwahara H, Yin L, Carraway KL, Kufe D (September 2001). "The epidermal growth factor receptor regulates interaction of the human DF3/MUC1 carcinoma antigen with c-Src and beta-catenin". The Journal of Biological Chemistry. 276 (38): 35239–42. doi:10.1074/jbc.C100359200. PMID 11483589.
- ^ Tang J, Feng GS, Li W (October 1997). "Induced direct binding of the adapter protein Nck to the GTPase-activating protein-associated protein p62 by epidermal growth factor". Oncogene. 15 (15): 1823–32. doi:10.1038/sj.onc.1201351. PMID 9362449.
- ^ Li W, Hu P, Skolnik EY, Ullrich A, Schlessinger J (December 1992). "The SH2 and SH3 domain-containing Nck protein is oncogenic and a common target for phosphorylation by different surface receptors". Molecular and Cellular Biology. 12 (12): 5824–33. doi:10.1128/MCB.12.12.5824. PMC 360522. PMID 1333047.
- ^ Chen M, She H, Davis EM, Spicer CM, Kim L, Ren R, Le Beau MM, Li W (September 1998). "Identification of Nck family genes, chromosomal localization, expression, and signaling specificity". The Journal of Biological Chemistry. 273 (39): 25171–8. doi:10.1074/jbc.273.39.25171. PMID 9737977.
- ^ Tu Y, Li F, Wu C (December 1998). "Nck-2, a novel Src homology2/3-containing adaptor protein that interacts with the LIM-only protein PINCH and components of growth factor receptor kinase-signaling pathways". Molecular Biology of the Cell. 9 (12): 3367–82. doi:10.1091/mbc.9.12.3367. PMC 25640. PMID 9843575.
- ^ Gauthier ML, Torretto C, Ly J, Francescutti V, O'Day DH (August 2003). "Protein kinase Calpha negatively regulates cell spreading and motility in MDA-MB-231 human breast cancer cells downstream of epidermal growth factor receptor". Biochemical and Biophysical Research Communications. 307 (4): 839–46. doi:10.1016/S0006-291X(03)01273-7. PMID 12878187.
- ^ Bedrin MS, Abolafia CM, Thompson JF (July 1997). "Cytoskeletal association of epidermal growth factor receptor and associated signaling proteins is regulated by cell density in IEC-6 intestinal cells". Journal of Cellular Physiology. 172 (1): 126–36. doi:10.1002/(SICI)1097-4652(199707)172:1<126::AID-JCP14>3.0.CO;2-A. PMID 9207933.
- ^ Sun J, Nanjundan M, Pike LJ, Wiedmer T, Sims PJ (May 2002). "Plasma membrane phospholipid scramblase 1 is enriched in lipid rafts and interacts with the epidermal growth factor receptor". Biochemistry. 41 (20): 6338–45. doi:10.1021/bi025610l. PMID 12009895.
- ^ Sarmiento M, Puius YA, Vetter SW, Keng YF, Wu L, Zhao Y, Lawrence DS, Almo SC, Zhang ZY (July 2000). "Structural basis of plasticity in protein tyrosine phosphatase 1B substrate recognition". Biochemistry. 39 (28): 8171–9. doi:10.1021/bi000319w. PMID 10889023.
- ^ Zhang ZY, Walsh AB, Wu L, McNamara DJ, Dobrusin EM, Miller WT (March 1996). "Determinants of substrate recognition in the protein-tyrosine phosphatase, PTP1". The Journal of Biological Chemistry. 271 (10): 5386–92. doi:10.1074/jbc.271.10.5386. PMID 8621392.
- ^ أ ب Tomic S, Greiser U, Lammers R, Kharitonenkov A, Imyanitov E, Ullrich A, Böhmer FD (September 1995). "Association of SH2 domain protein tyrosine phosphatases with the epidermal growth factor receptor in human tumor cells. Phosphatidic acid activates receptor dephosphorylation by PTP1C". The Journal of Biological Chemistry. 270 (36): 21277–84. doi:10.1074/jbc.270.36.21277. PMID 7673163.
- ^ Keilhack H, Tenev T, Nyakatura E, Godovac-Zimmermann J, Nielsen L, Seedorf K, Böhmer FD (September 1998). "Phosphotyrosine 1173 mediates binding of the protein-tyrosine phosphatase SHP-1 to the epidermal growth factor receptor and attenuation of receptor signaling". The Journal of Biological Chemistry. 273 (38): 24839–46. doi:10.1074/jbc.273.38.24839. PMID 9733788.
- ^ Wang SE, Wu FY, Shin I, Qu S, Arteaga CL (June 2005). "Transforming growth factor {beta} (TGF-{beta})-Smad target gene protein tyrosine phosphatase receptor type kappa is required for TGF-{beta} function". Molecular and Cellular Biology. 25 (11): 4703–15. doi:10.1128/MCB.25.11.4703-4715.2005. PMC 1140650. PMID 15899872.
- ^ Lu Y, Brush J, Stewart TA (April 1999). "NSP1 defines a novel family of adaptor proteins linking integrin and tyrosine kinase receptors to the c-Jun N-terminal kinase/stress-activated protein kinase signaling pathway". The Journal of Biological Chemistry. 274 (15): 10047–52. doi:10.1074/jbc.274.15.10047. PMID 10187783.
- ^ Soubeyran P, Kowanetz K, Szymkiewicz I, Langdon WY, Dikic I (March 2002). "Cbl-CIN85-endophilin complex mediates ligand-induced downregulation of EGF receptors". Nature. 416 (6877): 183–7. doi:10.1038/416183a. PMID 11894095.
- ^ Szymkiewicz I, Kowanetz K, Soubeyran P, Dinarina A, Lipkowitz S, Dikic I (October 2002). "CIN85 participates in Cbl-b-mediated down-regulation of receptor tyrosine kinases". The Journal of Biological Chemistry. 277 (42): 39666–72. doi:10.1074/jbc.M205535200. PMID 12177062.
- ^ Sakaguchi K, Okabayashi Y, Kido Y, Kimura S, Matsumura Y, Inushima K, Kasuga M (April 1998). "Shc phosphotyrosine-binding domain dominantly interacts with epidermal growth factor receptors and mediates Ras activation in intact cells". Molecular Endocrinology. 12 (4): 536–43. doi:10.1210/me.12.4.536. PMID 9544989.
- ^ Qian X, Esteban L, Vass WC, Upadhyaya C, Papageorge AG, Yienger K, Ward JM, Lowy DR, Santos E (February 2000). "The Sos1 and Sos2 Ras-specific exchange factors: differences in placental expression and signaling properties". The EMBO Journal. 19 (4): 642–54. doi:10.1093/emboj/19.4.642. PMC 305602. PMID 10675333.
- ^ Qian X, Vass WC, Papageorge AG, Anborgh PH, Lowy DR (February 1998). "N terminus of Sos1 Ras exchange factor: critical roles for the Dbl and pleckstrin homology domains". Molecular and Cellular Biology. 18 (2): 771–8. doi:10.1128/mcb.18.2.771. PMC 108788. PMID 9447973.
- ^ Keely SJ, Calandrella SO, Barrett KE (April 2000). "Carbachol-stimulated transactivation of epidermal growth factor receptor and mitogen-activated protein kinase in T(84) cells is mediated by intracellular Ca2+, PYK-2, and p60(src)". The Journal of Biological Chemistry. 275 (17): 12619–25. doi:10.1074/jbc.275.17.12619. PMID 10777553.
- ^ Sato K, Kimoto M, Kakumoto M, Horiuchi D, Iwasaki T, Tokmakov AA, Fukami Y (September 2000). "Adaptor protein Shc undergoes translocation and mediates up-regulation of the tyrosine kinase c-Src in EGF-stimulated A431 cells". Genes to Cells. 5 (9): 749–64. doi:10.1046/j.1365-2443.2000.00358.x. PMID 10971656.
- ^ Xia L, Wang L, Chung AS, Ivanov SS, Ling MY, Dragoi AM, Platt A, Gilmer TM, Fu XY, Chin YE (August 2002). "Identification of both positive and negative domains within the epidermal growth factor receptor COOH-terminal region for signal transducer and activator of transcription (STAT) activation". The Journal of Biological Chemistry. 277 (34): 30716–23. doi:10.1074/jbc.M202823200. PMID 12070153.
- ^ Yuan ZL, Guan YJ, Wang L, Wei W, Kane AB, Chin YE (November 2004). "Central role of the threonine residue within the p+1 loop of receptor tyrosine kinase in STAT3 constitutive phosphorylation in metastatic cancer cells". Molecular and Cellular Biology. 24 (21): 9390–400. doi:10.1128/MCB.24.21.9390-9400.2004. PMC 522220. PMID 15485908.
- ^ Sehat B, Andersson S, Girnita L, Larsson O (July 2008). "Identification of c-Cbl as a new ligase for insulin-like growth factor-I receptor with distinct roles from Mdm2 in receptor ubiquitination and endocytosis". Cancer Research. 68 (14): 5669–77. doi:10.1158/0008-5472.CAN-07-6364. PMID 18632619.
- ^ She HY, Rockow S, Tang J, Nishimura R, Skolnik EY, Chen M, Margolis B, Li W (September 1997). "Wiskott-Aldrich syndrome protein is associated with the adapter protein Grb2 and the epidermal growth factor receptor in living cells". Molecular Biology of the Cell. 8 (9): 1709–21. doi:10.1091/mbc.8.9.1709. PMC 305731. PMID 9307968.
- ^ Shilo BZ (March 2003). "Signaling by the Drosophila epidermal growth factor receptor pathway during development". Experimental Cell Research. 284 (1): 140–9. doi:10.1016/S0014-4827(02)00094-0. PMID 12648473.
قراءات إضافية
- Carpenter G (1987). "Receptors for epidermal growth factor and other polypeptide mitogens". Annual Review of Biochemistry. 56 (1): 881–914. doi:10.1146/annurev.bi.56.070187.004313. PMID 3039909.
- Boonstra J, Rijken P, Humbel B, Cremers F, Verkleij A, van Bergen en Henegouwen P (May 1995). "The epidermal growth factor". Cell Biology International. 19 (5): 413–30. doi:10.1006/cbir.1995.1086. PMID 7640657.
- Carpenter G (August 2000). "The EGF receptor: a nexus for trafficking and signaling". BioEssays. 22 (8): 697–707. doi:10.1002/1521-1878(200008)22:8<697::AID-BIES3>3.0.CO;2-1. PMID 10918300.
- Filardo EJ (February 2002). "Epidermal growth factor receptor (EGFR) transactivation by estrogen via the G-protein-coupled receptor, GPR30: a novel signaling pathway with potential significance for breast cancer". The Journal of Steroid Biochemistry and Molecular Biology. 80 (2): 231–8. doi:10.1016/S0960-0760(01)00190-X. PMID 11897506.
- Tiganis T (January 2002). "Protein tyrosine phosphatases: dephosphorylating the epidermal growth factor receptor". IUBMB Life. 53 (1): 3–14. doi:10.1080/15216540210811. PMID 12018405.
- Di Fiore PP, Scita G (October 2002). "Eps8 in the midst of GTPases". The International Journal of Biochemistry & Cell Biology. 34 (10): 1178–83. doi:10.1016/S1357-2725(02)00064-X. PMID 12127568.
- Benaim G, Villalobo A (August 2002). "Phosphorylation of calmodulin. Functional implications". European Journal of Biochemistry / FEBS. 269 (15): 3619–31. doi:10.1046/j.1432-1033.2002.03038.x. PMID 12153558.
- Leu TH, Maa MC (January 2003). "Functional implication of the interaction between EGF receptor and c-Src". Frontiers in Bioscience. 8 (1–3): s28–38. doi:10.2741/980. PMID 12456372.
- Anderson NL, Anderson NG (November 2002). "The human plasma proteome: history, character, and diagnostic prospects". Molecular & Cellular Proteomics. 1 (11): 845–67. doi:10.1074/mcp.R200007-MCP200. PMID 12488461.
- Kari C, Chan TO, Rocha de Quadros M, Rodeck U (January 2003). "Targeting the epidermal growth factor receptor in cancer: apoptosis takes center stage". Cancer Research. 63 (1): 1–5. PMID 12517767.
- Bonaccorsi L, Muratori M, Carloni V, Zecchi S, Formigli L, Forti G, Baldi E (February 2003). "Androgen receptor and prostate cancer invasion". International Journal of Andrology. 26 (1): 21–5. doi:10.1046/j.1365-2605.2003.00375.x. PMID 12534934.
- Reiter J, Maihle NJ (May 2003). "Characterization and expression of novel 60-kDa and 110-kDa EGFR isoforms in human placenta". Annals of the New York Academy of Sciences. 995 (1): 39–47. doi:10.1111/j.1749-6632.2003.tb03208.x. PMID 12814937.
- Adams TE, McKern NM, Ward CW (June 2004). "Signalling by the type 1 insulin-like growth factor receptor: interplay with the epidermal growth factor receptor". Growth Factors. 22 (2): 89–95. doi:10.1080/08977190410001700998. PMID 15253384.
- Ferguson KM (November 2004). "Active and inactive conformations of the epidermal growth factor receptor". Biochemical Society Transactions. 32 (Pt 5): 742–5. doi:10.1042/BST0320742. PMID 15494003.
- Chao C, Hellmich MR (December 2004). "Bi-directional signaling between gastrointestinal peptide hormone receptors and epidermal growth factor receptor". Growth Factors. 22 (4): 261–8. doi:10.1080/08977190412331286900. PMID 15621729.
- Carlsson J, Ren ZP, Wester K, Sundberg AL, Heldin NE, Hesselager G, Persson M, Gedda L, Tolmachev V, Lundqvist H, Blomquist E, Nistér M (March 2006). "Planning for intracavitary anti-EGFR radionuclide therapy of gliomas. Literature review and data on EGFR expression". Journal of Neuro-Oncology. 77 (1): 33–45. doi:10.1007/s11060-005-7410-z. PMID 16200342.
- Scartozzi M, Pierantoni C, Berardi R, Antognoli S, Bearzi I, Cascinu S (April 2006). "Epidermal growth factor receptor: a promising therapeutic target for colorectal cancer". Analytical and Quantitative Cytology and Histology. 28 (2): 61–8. PMID 16637508.
- Prudkin L, Wistuba II (October 2006). "Epidermal growth factor receptor abnormalities in lung cancer. Pathogenetic and clinical implications". Annals of Diagnostic Pathology. 10 (5): 306–15. doi:10.1016/j.anndiagpath.2006.06.011. PMID 16979526.
- Ahmed SM, Salgia R (November 2006). "Epidermal growth factor receptor mutations and susceptibility to targeted therapy in lung cancer". Respirology. 11 (6): 687–92. doi:10.1111/j.1440-1843.2006.00887.x. PMID 17052295.
- Zhang X, Chang A (March 2007). "Somatic mutations of the epidermal growth factor receptor and non-small-cell lung cancer". Journal of Medical Genetics. 44 (3): 166–72. doi:10.1136/jmg.2006.046102. PMC 2598028. PMID 17158592.
- Cohenuram M, Saif MW (2007). "Epidermal growth factor receptor inhibition strategies in pancreatic cancer: past, present and the future". JOP. 8 (1): 4–15. PMID 17228128.
- Mellinghoff IK, Cloughesy TF, Mischel PS (January 2007). "PTEN-mediated resistance to epidermal growth factor receptor kinase inhibitors". Clinical Cancer Research. 13 (2 Pt 1): 378–81. doi:10.1158/1078-0432.CCR-06-1992. PMID 17255257.
- Nakamura JL (April 2007). "The epidermal growth factor receptor in malignant gliomas: pathogenesis and therapeutic implications". Expert Opinion on Therapeutic Targets. 11 (4): 463–72. doi:10.1517/14728222.11.4.463. PMID 17373877.
وصلات خارجية
- MeSH Epidermal+Growth+Factor+Receptor
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Epidermal growth factor receptor