كيمياء كهربية
الكيمياء الكهربية Electrochemistry أحد فروع الكيمياء التي تدرس التفاعلات التي تحدث عند سطوح النواقل الكهربائية (مثل الإلكترودات المؤلفة من المعادن) أو نصف ناقل (مثل الغرافيت) أو النواقل الشاردية مثل المحاليل الشاردية (إلكتروليت) .
إذا استطاع تفاعل كيميائي أن يتم بفضل جهد كهربائي voltage، أو استطاع التفاعل أن يولد جهدا كهربائيا كما في حالة البطاريات، عندها ندعو مثل هذا التفاعل الكتروكيميائي، وبشكل عام تتعامل الكهرباء الكهربائية مع وضعيات تحدث فيها تفاعلات أكسدة وإرجاع بشكل منفصل تفصل بينهما مسافة معينة يتم خلالها انتقال للالكترونات مما يتيح فرصة لتشكل جهد كهربائي وتيار كهربائي. أما انتقال الشحنة المباشر من جزيئة إلى اخرى فلا يدخل في نطاق اهتمامات الكيمياء الكهربائية .
تعريف
الكيمياء الكهربائية، بمعناها الضيق، تعنى بدراسة محاليل الإلكتروليتات (الكهرليتات) والتآثرات التي تتم على الإلكترودات (المساري) electrodes المغموسة في هذه المحاليل، أي دراسة التفاعلات الكيميائية المولِّدة لتيار كهربائي أو الناجمة عنه.[1]
أدى نشوء الكيمياء الكهربائية إلى بروز الكيمياء الفيزيائية علماً مستقلاً متميزاً. فالمجلة الأولى في الكيمياء الفيزيائية Die Zeitschrift fur physikalische chemie أسسها فلهم أوستفالد Wilhelm Ostwald عام 1887 وقد خصِّصَت الأعداد الأولى منها لأبحاث أوستفالد، وفانت هوف، وكولراوش Kohlrausch، وأرنيوس وغيرهم وكانت جميعها في حقل الكيمياء الكهربائية.
التاريخ
المباديء
تفاعلات الأكسدة والاختزال
 مقالة مفصلة: تفاعلات الأكسدة والاختزال
مقالة مفصلة: تفاعلات الأكسدة والاختزال
الأكسدة والاختزال تعبيران يستخدمان لوصف التغير الطارئ على الشحنة الكهربائية لعنصر من العناصر أثناء التفاعل الكيميائي. ومن الأمثلة البسيطة على الأكسدة والاختزال ذلك التغير الذي يحدث في بنية الصوديوم والكلور عند اتحادهما لتشكيل كلوريد الصوديوم (أي ملح الطعام). إن التفاعل الكيميائي هنا ينطوي على انتقال أحد الإلكترونات (والإلكترونات ذات شحنات سالبة) من ذرة الصوديوم إلى ذرة الكلور. ونحن نقول في وصف العنصر الذي فقد بعض إلكتروناته واكتسب شحنات موجبة إنه (مؤكسد)، ونطلق على العملية اسم (الأكسدة). ونقول في وصف العنصر الذي اكتسب بعض الإلكترونات إنه (مختزل)، ونطلق على العملية اسم (الاختزال). أما اتحاد العنصرين فندعوه (تفاعل الأكسدة والاختزال) لأنه يؤدي إلى أكسدة الصوديوم واختزال الكلور.
الأكسدة و الإختزال
العناصر التي تدخل في التفاعلات الكهروكيميائية تتميز بعدد الإلكترونات التي يملكها كل عنصر . حيث ندعو عدد الإلكترونات التي قام الايون باستقبالها أو منحها مقارنة مع حالته الطبيعية بحالة الأكسدة oxidation state. أي عنصر في حالته الطبيعية يتميز بعدد أكسدة معدوم (0). إذا قامت ذرة أو شاردة (أيون) بمنح إلكترون أثناء تفاعل كهروكيماوي فإن حالة الأكسدة لها تزداد ، أما إذا استقبل إلكترونا فإن حالة الأكسدة تنقص.
مثلا : اتحاد الصوديوم مع الكلور، يقوم الصوديوم بمنج إلكترون واحد و يصبح حالة الأكسدة له (+1). أما الكلور فيقوم بقبول إلكترون و تصبح حالة الأكسدة له (−1). إشارة حالة الأكسدة (+/-) تشير إلى الشحنة الإلكترونية للشاردة المتشكلة . يحدث الآن انجذاب بين الشارديتين (الصوديوم و الكلور) المشحونتين بشكل متعاكس مما يؤدي لتشكل رابطة شاردية .
في الحقيقة، أي عملية فقدان للإلكترونات تدعى أكسدة وأي عملية اكتساب للإلكترونات تدعى إرجاع. "الأكسدة فقدان، والإرجاع اكتساب".
المادة التي تملك إمكانية فقدان إلكترونات (تمنح ألكترونات) توفر فرصة لإرجاع مواد أخرى فتدعى (عامل مرجع) (بكسر الجيم) reducing agent أو مرجع reductant ، أما المادة التي تملك إمكانية إكتساب الإلكترونات فتدعى عامل مؤكسد oxidizing agent أو مؤكسد oxidant . لذلك فإن العامل المؤكسد يتم إرجاعه في التفاعل لتتم أكسدة المادة الخرى ، و العامل المرجع تتم أكسدته ليتم إرجاع المادة الأخرى . في الحقيقة أي تفاعل أكسدة-إرجاع يحوي عامل مؤكسد و عامل مرجع .
أصل كلمة "أكسدة" أتى من أكسجين أي اكتساب الأكسجين (و في الحقيقة الاتحاد مع الأكسجين يشمل فقدان الكترونين له)، ثم تم تمديده لخسارة الهيدرجين، ثم تم اعتباره خسارة الكترونات أي زيادة عدد الأكسدة . و ينطبق عكس هذا الكلام على عملية إختزال.
موازنة معادلات الأكسدة-إرجاع
 مقالة مفصلة: معادلة كيميائية
مقالة مفصلة: معادلة كيميائية
التفاعلات الكهروكيميائية في الماء يتم فهمها بشكل أفضل عن طريق موازنة تفاعلات الأكسدة-إرجاع باستخدام طريقة أيون-إلكترون حيث توضع البروتونات و شوارد OH- و H2O والإلكترونات (التي تعوض تغيرات الأكسدة) يتم اضافتهم إلى التفاعلات النصفية للبطارية للأكسدة والإختزال.
وسط حامضي
في الوسط الحامضي شوارد H+ والماء تتم اضافتهم إلى التفاعلات النصفية لموازنة التفاعل الإجمالي. فعلى سبيل المثال, عندما يتفاعل المنگنيز مع بزموتات الصوديوم.
Finally the reaction is balanced by multiplying the number of electrons from the reduction half reaction to oxidation half reaction and vice versa and adding both half reactions, thus solving the equation.
المعادلة موزونة:
وسط قاعدي
في الوسط القاعدي شوارد OH- والماء يتم اضافتهم إلى التفاعلات النصفية لموازنة التفاعل الإجمالي. فعلى سبيل المثال في التفاعل بين برمنجنات البوتاسيوم وكبريتيت الصوديوم.
The same procedure as followed on acid medium by multiplying electrons to opposite half reactions solve the equation thus balancing the overall reaction.
المعادلة موزونة:
وسط متعادل
نفس العملية المستخدمة في الوسط الحامضي تـُطبق, فعلى سبيل المثال عند الموازنة باستخدام طريقة شارد الإلكترون من أجل احتراق تام لغاز البروبين.
وكما في الوسطين الحامضي والقاعدي, الإلكترونات التي تم استخدامها لتعويض تغيرات الأكسدة are multiplied to opposite half reactions, thus solving the equation.
المعادلة موزونة:
بطاريات كيميائية كهربية
 مقالة مفصلة: بطارية كيميائية كهربية
مقالة مفصلة: بطارية كيميائية كهربية
البطارية الگلڤانية ذات الأقطاب الكهربية المصنوعة من الزنك والنحاس مغمورين في كبريتات الزنك وكبريتات النحاس, بالترتيب, تـُعرف باسم بطارية دانيالز.
التفاعلات النصفية لبطارية دانيال هي:
A cell diagram can be used to trace the path of the electrons in the electrochemical cell. For example, here is a cell diagram of a Daniells cell:
Standard electrode potential
For example, the standard electrode potential for a copper electrode is:
At standard temperature, pressure and concentration conditions, the cell's emf (measured by a multimeter) is 0.34 V. by definition, the electrode potential for the SHE is zero. Thus, the Cu is the cathode and the SHE is the anode giving
Or,
Changes in the stoichiometric coefficients of a balanced cell equation will not change value because the standard electrode potential is an intensive property.
Spontaneity of Redox reaction
The emf of the cell at zero current is the maximum possible emf. It is used to calculate the maximum possible electrical energy that could be obtained from a chemical reaction. This energy is referred to as electrical work and is expressed by the following equation:
where work is defined as positive into the system.
Since the free energy is the maximum amount of work that can be extracted from a system, one can write:
The relation between the equilibrium constant and the Gibbs free energy for an electrochemical cell is expressed as follows:
Rearranging to express the relation between standard potential and equilibrium constant yields
Previous equation can use Briggsian logarithm as shown below:
Cell emf dependency on changes in concentration
Nernst Equation
The standard potential of an electrochemical cell requires standard conditions for all of the reactants. When reactant concentrations differ from standard conditions, the cell potential will deviate from the standard potential. In 1900s German chemist Walther Hermann Nernst proposed a mathematical model to determine the effect of reactant concentration on electrochemical cell potential.
In the late 1800s Willard Gibbs formulated a theory to predict whether a chemical reaction is spontaneous based on the free energy
- ,
Where:
ΔG = change in Gibbs free energy, T = absolute temperature, R = gas constant, ln = natural logarithm, Q = reaction quotient.
Gibbs key contribution was to formalize the understanding of the effect of reactant concentration on spontaneity.
Based on Gibbs's work, Nernst extended the theory to include the contribution from electric potential on charged species. As shown in the previous section, the change in Gibbs free energy for an electrochemical cell can be related to the cell potential. Thus, Gibbs theory becomes
Where:
n = number of electrons/mole product, F = Faraday constant (coulombs/mole), and ΔE = cell potential.
Finally, Nernst divided through by the amount of charge transferred to arrive at a new equation which now bears his name:
Assuming standard conditions () and R = the equation above can be expressed on Base—10 logarithm as shown below:
Concentration cells
Le Chatelier's principle indicates that the reaction is more favourable to reduction as the concentration of ions increases. Reduction will take place in the cell's compartment where concentration is higher and oxidation will occur on the more dilute side.
The following cell diagram describes the cell mentioned above:
Where the half cell reactions for oxidation and reduction are:
Where the cell's emf is calculated through Nernst equation as follows:
's value of this kind of cell is zero, as electrodes and ions are the same in both half-cells. After replacing values from the case mentioned, it is possible to calculate cell's potential:
However, this value is only approximate, as reaction quotient is defined in terms of ion activities which can be approximated with the concentrations as calculated here.
The Nernst equation plays an important role in understanding electrical effects in cells and organelles. Such effects include nerve synapses and cardiac beat as well as the resting potential of a somatic cell.
Block quote
البطارية
 مقالة مفصلة: بطارية (كهرباء)
مقالة مفصلة: بطارية (كهرباء)
البطارية الجافة
 مقالة مفصلة: بطارية جافة
مقالة مفصلة: بطارية جافة
أنصاف تفاعلات لكلانشيه المبسطة مبينة أدناه:
The voltage obtained from the بطارية زنك-كربون is around 1.5 V.
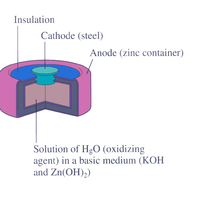
بطارية الزئبق
The mercury battery has many applications in medicine and electronics. The battery consists of a steel—made container in the shape of a cylinder acting as the cathode, where an amalgamated anode of mercury and zinc is surrounded by a stronger alkaline electrolyte and a paste of أكسيد الزنك و أكسيد الزئبق الثنائي .
Mercury battery half reactions are shown below:
There are no changes in the electrolyte's composition when the cell works. Such Mercurium batteries provide 1.35 V of direct current.
بطارية الرصاص-الحامض
The Lead-acid battery used in automobiles, consists of a series of six identical cells assembled in series. Each cell has a lead anode and a cathode made from ثاني أكسيد الرصاص packed in a metal plaque. Cathode and anode are submerged في محلول
نصف تفاعلات الخلية في بطارية الرصاص-الحامض مبينة أدناه:
بطارية الليثيوم القابلة لإعادة الشحن
Flow battery/ Redox flow battery
خلايا الوقود
Oxygen-hydrogen fuel cell reactions are shown bellow:
تآكل
يعبر لفظ تآكل (Corrosion) عن صدأ الفلزات الناتج عن عمليات كهروكيميائية Most people are likely familiar with the corrosion of iron, in the form of reddish rust. Other examples include the black tarnish on silver, and red or green corrosion that may appear on copper and its alloys, such as brass. The cost of replacing metals lost to corrosion is in the multi-billions of dollars per year.
Iron corrosion
For iron rust to occur the metal has to be in contact with oxygen and water, although chemical reactions for this process are relatively complex and not all of them are completely understood, it is believed the causes are the following:
- Electron transferring (Reduction-Oxidation)
- One area on the surface of the metal acts as the anode, which is where the oxidation (corrosion) occurs. At the anode, the metal gives up electrons.
- Electrons are transferred from iron reducing oxygen in the atmosphere into water on the cathode, which is placed in another region of the metal.
- Global reaction for the process:
- Standard emf for iron rusting:
- One area on the surface of the metal acts as the anode, which is where the oxidation (corrosion) occurs. At the anode, the metal gives up electrons.
Iron corrosion takes place on acid medium; H+ ions come from reaction between carbon dioxide in the atmosphere and water, forming carbonic acid. Fe2+ ions oxides, following this equation:
Iron(III) oxide hydrated is known as rust. Water associated with iron oxide it varies, thus chemical representation is presented as . The electric circuit works as passage of electrons and ions occurs, thus if an electrolyte is present it will facilitate oxidation, this explains why rusting is quicker on salt water.
Corrosion of common metals
Prevention of Corrosion
Coating
Sacrificial anodes
Electrolysis
Electrolysis of molten sodium chloride
Reactions that take place at Down's cell are the following:
This process can yield large amounts of metallic sodium and gaseous chlorine, and is widely used on mineral dressing and metallurgy industries.
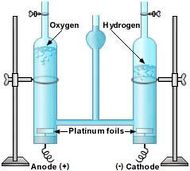
Electrolysis of water
Electrolysis of aqueous solutions
Electrolysis of a solution of Sodium chloride
The following half reactions describes the process mentioned:
The overall reaction for the process according to the analysis would be the following:
Quantitative electrolysis & Faraday Laws
Below a simplified equation of Faraday's first law:
Where,
- m is the mass of the substance produced at the electrode (in grams),
- Q is the total electric charge that passed through the solution (in coulombs),
- n is the valence number of the substance as an ion in solution (electrons per ion),
- M is the molar mass of the substance (in grams per mole).
Second law
المصادر
- ^ "الكيمياء الكهربائية". الموسوعة العربية. Retrieved 2012-09-01.
وصلات خارجية
- Electrochemistry net
- The Electrochemical Society
- International Society of Electrochemistry (ISE)
- Electrochemistry Encyclopedia at Case Western Reserve University
- Electrochemistry Dictionary at Case Western Reserve University (size ~ 388KB)
- Experiments in Electrochemistry at Fun Science















































![{\displaystyle E=E^{o}-{0.0257V \over 2}ln{[Cu^{2+}]_{diluted} \over [Cu^{2+}]_{concentrated}}\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9f6302a4b3e635dfa4f313b8ec1ec3485f91ef05)