إندومورفين
الإندومورفينات Endomorphins، هي ناقلات عصبية شبه أفيونية طبيعية أساسية لتسكين الألم.[1] الإندومورفينان المعروفان، إندومورفين-1 وإندومورفين-2، هما رباعي پپتيد، يتألف من حمض أميني بتسلسل Tyr-Pro-Trp-Phe وTyr-Pro-Phe-Phe على التوالي.[2] تنطوي هذه التسلسلات إلى بنى رباعية شديدة التخصص والألفة لمستقبلات أشباه الأفيونيات-μ، حيث ترتبط به حصرياً وبقوة. عادة ما تحفز رابطة مستقبلات أشباه الأفيونيات -μ الآثار التثبيطية على النشاط العصبوني.[3] داخل الجهاز العصبي المركزي والمحيطي يوجد نشاط مناعي شبيه بالإندومورفين، حيث يبدو أن الإندومورفين-1 يتركز في المخ وجذع المخ العلوي، بينما يتركز الإندومورفين-2 في الحبل الشوكي وجذع المخ السفلي.[2] نظراً لأن الإندومورفين ينشط مستقبلات أشباه الأفيونيات-μ، وهو المستقبل المستهدف للمورفين ومشتقاته، تتمتع الإندومورفين بإمكانات كبيرة كمسكنات للألم مع انخفاض الآثار الجانبية وخطر الإدمان.[4]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
أشباه الأفيونيات والمستقبلات
تنتمي الإندومورفينات لصف الپپتيدات العصبية الشبه أفيونية (الناقلات العصبية الپروتينية). أشباه الأفيوينات هي روابط ترتبط بمستقبلات opium-binding[5] وتتواجد داخلياً واصطناعياً.[1] الأفيونيات داخلية المنشأ تشمل الإندورفينات، الإنكفالينات، الدينورفينات، والإندومورفينات.[5]
يسفر نسخ وترجمة جينات تشفير الأفيونيات عن تشكيل بادئات الأفيونيات ما قبل الپپتيدية، التي يتم تعديلها في الشبكة الإندوپلازمية لتصبح بادئات أفيونية propeptide، تُنقل لجهاز گولجي، ومن ثم تُعدل إلى منتج أفيوني.[5] لم يتم تحديد البادئات ما قبل الپپتيدية للإندومورفينات.[4] ولأن البادئات لم تُحدد ولم تتضح الآليات التي تُتنتج المورفينات من خلالها، فإن وضع الإندومورفينات كروابط شبه أفيونية داخلية المنشأ يعتبر وضعاً مؤقتاً.
تنتمي مستقبلات أشباه الأفيونيات إلى عائلة المستقبلات المرتبطة بالپروتين ج، وتشمل μ، κ، δ، ومستقبلات nociceptinorphanin-FQ.[6] بينما يؤدي تنشيط مستقبلات الأفيونيات إلى بدء مجموعة متنوعة من الاستجابات، فعادة ما تعمل المواد الأفيونية كعقاقير مسببة للاكتئاب، والتي تستخدم على نطاق واسع وجرى تطويرها كمسكنات للألم. بالإضافة إلى ذلك، فإن خلل الأفيونيات يرتبط بالفصام والتوحد.[5] تُظهر الإندومورفينات انتقائية عالية وتقارب لمستقبلات أشباه الأفيونياتμ-، التي تعمل على تخفيف الألم والتسمم.[1]
التركيب
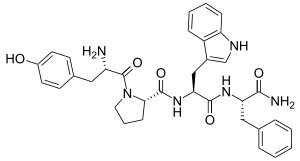
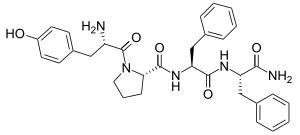
الإندومورفين-1 والإندومورفين-2 هما پپيتدات رباعية، تتألف من أربع أحماض أمينية. تسلسل الحمض الأميني للإندومورفين-1 هو Tyr-Pro-Trp-Phe، بينما تسلسل الحمض الأميني للإندمورفين-2 هو Tyr-Pro-Phe-Phe.[2] تُحدد الأحماض الأمينية المحددة في هذه التسلسلات سلوكي الطي الأحماض الأمينية المحددة في هذه التسلسلات تملي سلوك الطي والسلوك الناتج، أي القدرة على ربط مستقبلات أشباه الأفيونيات-μ، لهذه الجزيئات.
الوظيفة
تحافظ الإندومورفينات على مجموعة متنوعة من الوظائف. ميكانيكياً، ترتبط الإندومورفينات بمستقبلات الپروتين-ج التثبيطية لأشباه الأفيونيات-μ، والتي تعمل على إغلاق قنوات أيون الكاليوم وفتح قنوات أيون الپوتاسيوم في أغشية الخلايا العصبية المرتبطة.[3] القضاء على تدفق الكالسيوم وتسهيل تدفق أيون الپوتاسيوم يمنع الاستقطاب العصبي، ويمنع توليد كمون الفعل، ويخفض نشاط نشاط الخلايا العصبية المثيرة.[3] في حالات أخرى، يؤدي ارتباط الإندومورفين إلى الإثارة، حيث يؤدي تنشيطه للفوسفوليباز سي وسيكلاز أدنيل إلى زيادة في تركيز أيون الكالسيوم، وإزالة الاستقطاب الخلوي، وإطلاق النورإپينفرين والسروتونين.[4]
لا تزال الأدوار المحددة للإندومورفينات غير محددة بكل كبير وتعتمد على المسار المعني.[3] تؤثر الأنظمة الشبه أفيونية على العمليات الفسيولوجية للألم، المكافأة، والتوتر. كما تلعب دوراً في الاستجابات المناية ووظائف الجهاز الهضمي، التنفسي، القلبي الوعائي، والغدد الصم.[3]
التركيز والأثر النهائي لمعظم الناقلات العصبية، وتشمل الإندومورفينات، تحدده معدلات التخليق والانحلال. يشمل الانحلال انهيار الجزيئات الوظيفية للتشكيلات أو الأجزاء المعطوبة، مما يقلل من النشاط الكلي لنوع الجزيء. الإنزيم، DPP IV، يقسم الإندومورفين إلى أجزاء معطوبة، وبالتالي ينظم نشاط الإندومورفين.[7]
الموقع
تم عزل موقع نشاط الإندومورفين باستخدام المقايسة المناعية الإشعاعية والكيمياء السيتولوجية المناعية في الجهاز العصبلي للبشر، الجرذان، الفئران، والقردة.[2] قد تتواجد الپپتيدات الرباعية الإندومورفينية في بعض مناطق المخ. في المخ الأوسط، قد يوجد الإندوموفين-1 في الوطاء، المهاد، والجسم المخطط. أما في المخ الانتهائي، يتواجد الإندومورفين-1 في النواة المتكئة والحاجز الجانبي. في المخ الخلفي، فقد اكتشف عدد أكبر من الخلايا العصبونية التفاعلية للإندومورفين-1 مقارنة بالإندومورفين-2.[2] بالتناوب، غالباً ما يوجد الإندومورفين-2 في الحبل الشوكي، خاصة في الأطراف ما قبل المشبكية للعصبونات الواردة في المنطقة القرنية الظاهرية. عُثر على الإندومورفينات متوضعة مع الكالسيتونين بالإضافة للناقل العصبي الناحل للألم، المادة پ. لم يتم العثور على الإندومورفين-1 أو 2 في لوزة المخ أو الحـُصين.[2]
التطبيق السريري
بالإضافة للإندومورفينات، تُستهدف مستقبلات أشباه الأفيونيات-μ من قبل المورفين والأفيونيات شبيهة المورفين. وهكذا، يشكل الإندومورفين آمالاً واعدة كمسكن للألم وبديل للمورفين.[4] كشف التقييم المعملي للإندومورفينات كمسكنات للألم عن سلوك شبيه للمورفين والأفيوينات الأخرى، حيث يؤدي تحمل الدواء إلى الاعتياد والإدمان. أما الآثار الجانبية الأخرى الشائعة للأفيونيات مثل التوسيع الوعائي، ضيق التنفس، الاحتباس البولي، وتطور التفاعلات الهضمية.[4] ومع ذلك، فإن الآثار الجانبية المحفظة للإندومورفينات أثبتت أنها أقل حدة قليلاً من المسكنات المشتقة من المورفين والتي يشيع استخدامها اليوم. بالإضافة إلى ذلك، يحتمل أن ينتج الإندومورفين تأثيرات مسكنة أكثر قوة من نظيراته المشتقة من المورفين.[4]
على الرغم من أهليتها الصيدلانية، فإن نفاذية الغشاء المنخفضة وقابلية التعرض للتدهور الإنزيمي للاندومورفينات تحد من دمجها في الأدوية. نتيجة لذلك، يتم تحضير نظائر الإندومورفين مما يسمح لها بالإنتقال عبر الحاجز الدموي الدماغي، ويزيد من استقرارها، ويقلل من آثارها الجانبية.[8] تتضمن تعديلات الإندومورفين المعدلة التي تتعامل مع هذه المشكلات الگلكزة والليپدة. تضيف الگلكزة مجموعات الهيدروكربون لجزيئيات الإندومورفين، مما يسمح لها بالمرور عبر الأغشية من خلال ناقلات الگلوكوز. أما الليپد فتضيف الأحماض الأمينية الدهنية أو الأحماض الدهنية لجزئيات الإندومورفين، مما يزيد من كراهة الماء، ومن ثم، نفاذية الغشاء لهذه الجزئيات.[8]
التاريخ
في 2005 أظهرت الأبحاث المعملية التي تديرها مع فريقها منذ سنوات، خبيرة الأحياء العصبية شوتيما بويكانابو من جامعة مارتن لوثر الألمانية، وجود نوع آخر من المورفين، تنتجه خلايا الجسم البشري أو الحيواني، وقد يكون علاجاً شافياً لمرض پاركنسون أو الشلل الرعاش، ولأمراض القلب والشرايين وغيرها. وأكدتها لاحقاً أبحاث اختبارية مقارنة أجراها في الولايات المتحدة فريق البروفسور جورج ستيفانو من معهد علوم الأعصاب في نيويورك.[9]
على العكس تماماً من الاعتقاد السائد منذ أكثر من 6000 سنة حتى الآن، فإن المورفين ليس مادة نباتية فقط، بل إن هذه المادة المهدئة والمخدرة والأقوى مفعولاً، والتي كان السومريون قد اكتشفوها واستخدموها منذ الألفية الرابعة قبل الميلاد، هي أيضاً مادة حيوية خلوية تنتجها ذاتياً أجسام البشر والحيوانات.
وحسب بويكانابو، فإن مفعول الاندومورفين قصير الأجل لأن مكوناته تتحلل خلال دقيقتين، أي قبل أن تتمكن من الوصول إلى الدماغ، وفي المقابل يستمر مفعول المورفين ما بين عشرين وستين دقيقة، مما يعطيه الوقت الكافي للوصول إلى المخ والى إظهار مفعوله.
إلى ذلك، كانت أبحاث في الأحياء العصبية قد أظهرت في السبعينات وجود آثار مورفين عادي في أجسام الحيوانات والبشر، لكن العلماء فسروا ذلك في حينه بأنه ناجم عن بعض المواد الغذائية التي تحتوي عليه، كالحليب بصورة خاصة، غير أن ذلك التفسير لم يكن مقنعاً للجميع، من أمثال البروفيسورة 'شوتيما' التي ارتأت الشروع في أبحاثه لحسم هذه المسألة· تقول: "تجاه تعدد التفسيرات والآراء، كانت الطريقة الوحيدة لكشف الحقيقة هي في البحث عن آلية إنتاج الاندومورفين داخل خلايا الجسم مباشرة، وهذا تماماً ما فعلناه". ولإثبات أن المورفين الموجود في أجسامنا ليس متأتياً من المواد الغذائية، قامت شوتيما وفريقها بزراعة عينة من الخلايا العصبية البشرية إلى جانب خمس مواد من العناصر المستخدمة في تصنيع المورفين النباتي وذلك بهدف معرفة ما إذا كانت تلك العناصر سوف تتخالط مع المورفين الموجود في الخلايا العصبية البشرية.
يشار هنا إلى أنه، من الناحية الكيميائية، تحتوي كل خلية مورفين نباتي على ذرتين من الأكسجين 18، وهو أكسجين خاص أثقل من الأكسجين العادي· وكما تقول شوتيما: "إن الخلايا الجسمانية لا تنتج سوى كمية ضئيلة جداً من المورفين بحدود بضعة نانوجرام فقط، وهذا ما يوجب استخدام أجهزة خاصة وبالغة الحساسية في الاختبارات، منها مثلاً تقنية التصوير الكروموسومي في الحالة الغازية" وفي محصلة الاختبارات تبين أن المورفين الذي تنتجه الخلايا المزروعة إلى جانب الأكسجين 18 أثقل من المورفين العادي بأربعة أضعاف، وهذا ما يثبت بصورة حاسمة قدرة الخلايا الحيوانية على إنتاج المورفين.
الباحث الأمريكي البروفيسور'جورج ستيفانو الذي قام باختبارات تأكيدية لاختبارات البروفيسورة شوتيما يقول إنه أصبح ممكناً الآن تخفيف الألم من خلال زيادة كمية المورفين التي ينتجها جسم المريض نفسه، وذلك من خلال حقنه بمادة راتيكلين مثلاً، فإن هذا من شأنه التخلص من العوارض الجانبية التي تتسبب بها غالباً حقن المورفين الصيدلاني، ومن ضيق التنفس الذي قد تتسبب به جرعة زائدة من ذلك المورفين الغريب عن الجسم.
من جهتها، تسعى البروفيسورة شوتيما إلى استخدام هذا الاكتشاف في فهم مرض پاركنسون، تقول: "إن مادة الدوپامين التي يؤدي نقصها إلى ظهور أعراض هذا المرض، هي في الواقع من منتجات المورفين الجسماني، وبالتالي فإن التلاعب في ضبط هذا الإنتاج قد يؤدي إلى الشفاء من مرض پاركنسون".
المصادر
- ^ أ ب ت Koob, George F. (2014). Drugs, Addiction, and the Brain. Academic Press. pp. 133–171. ISBN 978-0-12-386937-1.
- ^ أ ب ت ث ج ح Bodnar, Richard J (2018). "Endogenous Opiates and Behavior: 2016". Peptides. 101: 167–212. doi:10.1016/j.peptides.2018.01.011. PMID 29366859.
- ^ أ ب ت ث ج Horvath, Gyöngyi (2000). "Endomorphin-1 and endomorphin-2: Pharmacology of the selective endogenous μ-opioid receptor agonists". Pharmacology & Therapeutics. 88 (3): 437–63. doi:10.1016/S0163-7258(00)00100-5. PMID 11337033.
- ^ أ ب ت ث ج ح Gu, Zheng-Hui; Wang, Bo; Kou, Zhen-Zhen; Bai, Yang; Chen, Tao; Dong, Yu-Lin; Li, Hui; Li, Yun-Qing (2017). "Endomorphins: Promising Endogenous Opioid Peptides for the Development of Novel Analgesics". Neurosignals. 25 (1): 98–116. doi:10.1159/000484909. PMID 29132133.
- ^ أ ب ت ث Purves (2018). Neuroscience. Sinauer Associates. p. 137. ISBN 978-1-60535-380-7.
- ^ Lazarus, Lawrence H; Okada, Yoshio (2012). "Engineering endomorphin drugs: State of the art". Expert Opinion on Therapeutic Patents. 22 (1): 1–14. doi:10.1517/13543776.2012.646261. PMC 3253703. PMID 22214283.
- ^ Fichna, J; Janecka, A; Costentin, J; Do Rego, J.-C (2007). "The Endomorphin System and Its Evolving Neurophysiological Role". Pharmacological Reviews. 59 (1): 88–123. doi:10.1124/pr.59.1.3. PMID 17329549.
- ^ أ ب Varamini, Pegah; Toth, Istvan (2013). "Lipid- and sugar-modified endomorphins: Novel targets for the treatment of neuropathic pain". Frontiers in Pharmacology. 4. doi:10.3389/fphar.2013.00155. PMC 3862115.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ "المورفين الحيواني ثورة علاجية". جريدة الاتحاد الإماراتية. 2005-08-02. Retrieved 2019-06-28.