كبريتات الكالسيوم
| |

| |
| الأسماء | |
|---|---|
| أسماء أخرى | |
| المُعرِّفات | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChEBI |
|
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.029.000 |
| رقم EC |
|
| E number | E516 (acidity regulators, ...) |
| مرجع Gmelin | 7487 |
| KEGG | |
PubChem CID
|
|
| رقم RTECS |
|
| UNII |
|
CompTox Dashboard (EPA)
|
|
| |
| |
| الخصائص | |
| الصيغة الجزيئية | CaSO4 |
| كتلة مولية | 136.14 g/mol (anhydrous) 145.15 g/mol (hemihydrate) 172.172 g/mol (dihydrate) |
| المظهر | صلب أبيض |
| الرائحة | عديم الرائحة |
| الكثافة | 2.96 g/cm3 (anhydrous) 2.32 g/cm3 (dihydrate) |
| نقطة الانصهار | |
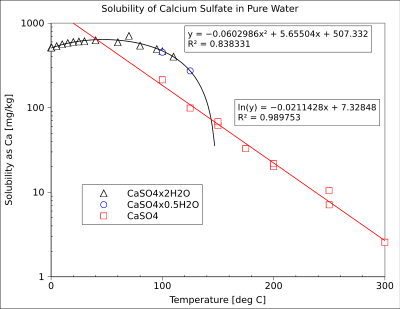
| قابلية الذوبان في الماء | 0.21g/100ml at 20 °C (anhydrous)[2] 0.24 g/100ml at 20 °C (dihydrate)[3] |
| نتاج قابلية الذوبان، Ksp | 4.93 × 10−5 mol2L−2 (anhydrous) 3.14 × 10−5 (dihydrate) [1] |
| قابلية الذوبان في glycerol | slightly soluble (dihydrate) |
| الحموضة (pKa) | 10.4 (anhydrous) 7.3 (dihydrate) |
| القابلية المغناطيسية | -49.7·10−6 cm3/mol |
| البنية | |
| البنية البلورية | معيني قائم |
| الكيمياء الحرارية | |
| الإنتالپية المعيارية للتشكل ΔfH |
-1433 kJ/mol[4] |
| Standard molar entropy S |
107 J·mol−1·K−1 [4] |
| المخاطر | |
| صفحة بيانات السلامة | ICSC 1589 |
| NFPA 704 (معيـَّن النار) | |
| نقطة الوميض | غير قابل للاشتعال |
| حدود التعرض الصحية بالولايات المتحدة (NIOSH): | |
PEL (المسموح)
|
TWA 15 mg/m3 (إجمالي) TWA 5 mg/m3 (resp) [for anhydrous form only][5] |
REL (الموصى به)
|
TWA 10 mg/m3 (إجمالي) TWA 5 mg/m3 (resp) [لامائي فقط][5] |
IDLH (خطر عاجل)
|
N.D.[5] |
| مركبات ذا علاقة | |
كاتيونات أخرى
|
كبريتات المغنسيوم كبريتات السترونشم كبريتات الباريوم |
مجففات ذات العلاقة
|
كلوريد الكالسيوم كبريتات المغنسيوم |
مركـّبات ذات علاقة
|
جص باريس الجبس |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
كبريتات الكالسيوم مركب كيميائي له الصيغة CaSO4، ويكون على شكل مسحوق أبيض. ويوجد في الطبيعة بعدة أشكال حسب محتوى ماء التبلور في البنية البلورية. فإذا كان كبريتات الكالسيوم خالي من الماء يسمى أنهدريت Anhydrite، أما إذا اشتركت جزيئتين من كبريتات الكالسيوم بجزيء ماء واحد (الصيغة تكون CaSO4.0.5H2O) يسمى باسينيت Bassanite، في حين أن الجص عبارة عن كبريتات كالسيوم ثنائية الهيدرات (CaSO4.2H2O).
الخواص
- انحلالية كبريتات الكالسيوم ضعيفة في الماء، وهذا الضعف في الانحلالية هو أحد أسباب التكلس المصادف بكثرة في المراجل والمبادلات الحرارية.
- بتسخين كبريتات الكالسيوم ثنائي الهيدرات (الجص) إلى درجات حرارة بين 100 و 150°س يحدث تفاعل نزع ماء (بلمهة) جزئي، حيث يتبخر 75% من الماء المتواجد في البنية حسب المعادلة:
- CaSO4.2H2O –Δ→ CaSO4·½H2O + 1½H2O (بخار)
تجري عملية التكليس صناعياً عند درجات حرارة أعلى من 170°س ويحصل من خلالها على الأنهدريت (الشكل الخالي من الماء).
الوفرة الطبيعية والتحضير
- يوجد كبريتات الكالسيوم في الطبيعة بشكل وافر، وعلى الأخص بشكل الجص الموجود في عدة مناطق من العالم بالإضافة إلى الأنهدريت. يعطي تعدين كبريتات الكالسيوم حوالي 127 مليون طن سنوياً على شكل جص. [6].
يحصل على كبريتات الكالسيوم أيضاً كناتج ثانوي من خلال عمليات نزع الكبريت من الوقود الأحفوري، حيث تمرر أكاسيد الكبريت على هيدروكسيد أو كربونات الكالسيوم، فينتج كبريتيت الكالسيوم (سلفيت الكالسيوم) والذي يؤكسد إلى الكبريتات.
كما ينتج أيضاً كناتج ثانوي أثناء تعدين الزنك، حيث تعالج محاليل من كبريتات الزنك مع هيدروكسيد الكالسيوم فيترسب كبريتات الكالسيوم.
تفاعلات الجفاف
تسخين الجبس إلى ما بين 100 °س و 150 °س (302 °ف) partially dehydrates the mineral by driving off approximately 75% of the water contained in its chemical structure. The temperature and time needed depend on ambient partial pressure of H2O. Temperatures as high as 170 °C are used in industrial calcination, but at these temperatures γ-anhydrite begins to form. The reaction for the partial dehydration is:
- CaSO4·2H2O + heat → CaSO4·½H2O + 1½H2O (steam)
المعدن المجفف جزئياً يسمى calcium sulfate hemihydrate أو calcined gypsum (ويشيع تسميته plaster of Paris) (CaSO4·nH2O), حيث n تكون في النطاق 0.5 إلى 0.8.[7]
الاستخدامات
The main use of calcium sulfate is to produce plaster of Paris and stucco. These applications exploit the fact that calcium sulfate which has been powdered and calcined forms a moldable paste upon hydration and hardens as crystalline calcium sulfate dihydrate. It is also convenient that calcium sulfate is poorly soluble in water and does not readily dissolve in contact with water after its solidification.
- لكبريتات الكالسيوم تطبيقات في البناء والعمارة (الجص).
- تستخدم كبريتات الكالسيوم في الزراعة من أجل تحضير التربة، حيث يساعد على تحويل أملاح الصوديوم إلى أملاح سهلة الذوبان في مياه الري، وبذلك تتحسن خواص التربة الكيماوية مما يساعد على تحسين عملية امتصاص العناصر. يكون أفضل معدل لامتصاص العناصر حينما تبلغ قيمة الأس الهيدروجيني pH لمزيج التربة مع الماء من 8 -8.5، ويطلق عليه الجبس الزراعي.
تفاعلات التميه وانتزاع الماء
With judicious heating, gypsum converts to the partially dehydrated mineral called bassanite or plaster of Paris. This material has the formula CaSO4·(nH2O), where 0.5 ≤ n ≤ 0.8.[7] Temperatures between 100 و 150 °C (212–302 °F) are required to drive off the water within its structure. The details of the temperature and time depend on ambient humidity. Temperatures as high as 170 °C (338 °F) are used in industrial calcination, but at these temperatures γ-anhydrite begins to form. The heat energy delivered to the gypsum at this time (the heat of hydration) tends to go into driving off water (as water vapor) rather than increasing the temperature of the mineral, which rises slowly until the water is gone, then increases more rapidly. The equation for the partial dehydration is:
- CaSO4 · 2 H2O → CaSO4 · 1/2 H2O + 1+1/2 H2O↑
The endothermic property of this reaction is relevant to the performance of drywall, conferring fire resistance to residential and other structures. In a fire, the structure behind a sheet of drywall will remain relatively cool as water is lost from the gypsum, thus preventing (or substantially retarding) damage to the framing (through combustion of wood members or loss of strength of steel at high temperatures) and consequent structural collapse. But at higher temperatures, calcium sulfate will release oxygen and act as an oxidizing agent. This property is used in aluminothermy. In contrast to most minerals, which when rehydrated simply form liquid or semi-liquid pastes, or remain powdery, calcined gypsum has an unusual property: when mixed with water at normal (ambient) temperatures, it quickly reverts chemically to the preferred dihydrate form, while physically "setting" to form a rigid and relatively strong gypsum crystal lattice:
- CaSO4 · 1/2 H2O + 1+1/2 H2O → CaSO4 · 2 H2O
This reaction is exothermic and is responsible for the ease with which gypsum can be cast into various shapes including sheets (for drywall), sticks (for blackboard chalk), and molds (to immobilize broken bones, or for metal casting). Mixed with polymers, it has been used as a bone repair cement. Small amounts of calcined gypsum are added to earth to create strong structures directly from cast earth, an alternative to adobe (which loses its strength when wet). The conditions of dehydration can be changed to adjust the porosity of the hemihydrate, resulting in the so-called α- and β-hemihydrates (which are more or less chemically identical).
On heating to 180 °C (356 °F), the nearly water-free form, called γ-anhydrite (CaSO4·nH2O where n = 0 to 0.05) is produced. γ-Anhydrite reacts slowly with water to return to the dihydrate state, a property exploited in some commercial desiccants. On heating above 250 °C, the completely anhydrous form called β-anhydrite or "natural" anhydrite is formed. Natural anhydrite does not react with water, even over geological timescales, unless very finely ground.
The variable composition of the hemihydrate and γ-anhydrite, and their easy inter-conversion, is due to their nearly identical crystal structures containing "channels" that can accommodate variable amounts of water, or other small molecules such as methanol.
الصناعات الغذائية
The calcium sulfate hydrates are used as a coagulant in products such as tofu.[8]
For the FDA, it is permitted in Cheese and Related Cheese Products; Cereal Flours; Bakery Products; Frozen Desserts; Artificial Sweeteners for Jelly & Preserves; Condiment Vegetables; and Condiment Tomatoes and some candies.[9]
It is known in the E number series as E516, and the FAO knows it as a firming agent, a flour treatment agent, a sequestrant, and a leavening agent.[9]
طب الأسنان
Calcium sulfate has a long history of use in dentistry.[10] It has been used in bone regeneration as a graft material and graft binder/extender and as a barrier in guided tissue regeneration. It is an unusually biocompatible material and is completely resorbed following implantation. It does not evoke a significant host response and creates a calcium-rich milieu in the area of implantation.[11]
استخدامات أخرى
When sold at the anhydrous state as a desiccant with a color-indicating agent under the name Drierite, it appears blue (anhydrous) or pink (hydrated) due to impregnation with cobalt(II) chloride, which functions as a moisture indicator.
Up to the 1970s, commercial quantities of sulfuric acid were produced in Whitehaven (Cumbria, UK) from anhydrous calcium sulfate. Upon being mixed with shale or marl, and roasted, the sulfate liberates sulfur trioxide gas, a precursor in sulfuric acid production, the reaction also produces calcium silicate, a mineral phase essential in cement clinker production.[12]
- CaSO4 + SiO2 → CaSiO3 + SO3
انظر أيضاً
- Calcium sulfate (data page)
- Alabaster
- Anhydrite
- Bathybius haeckelii
- Chalk (calcium carbonate)
- Gypsum
- Gypsum plaster
- Phosphogypsum
- Selenite (mineral)
- Flue-gas desulfurization
المراجع
- ^ D.R. Linde (ed.) "CRC Handbook of Chemistry and Physics", 83rd Edition, CRC Press, 2002
- ^ S. Gangolli (1999). The Dictionary of Substances and Their Effects: C. Royal Society of Chemistry. p. 71. ISBN 978-0-85404-813-7.
- ^ American Chemical Society (2006). Reagent chemicals: specifications and procedures : American Chemical Society specifications, official from January 1, 2006. Oxford University Press. p. 242. ISBN 978-0-8412-3945-6.
- ^ أ ب Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A21. ISBN 978-0-618-94690-7.
- ^ أ ب ت NIOSH Pocket Guide to Chemical Hazards 0095
- ^ http://minerals.usgs.gov/minerals/pubs/commodity/gypsum/mcs-2008-gypsu.pdf
- ^ أ ب خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةt - ^ "About tofu coagulant". www.soymilkmaker.com. Sanlinx Inc. 31 August 2015.
- ^ أ ب "Compound Summary for CID 24497 - Calcium Sulfate". PubChem.
- ^ Titus, Harry W.; McNally, Edmund; Hilberg, Frank C. (1933-01-01). "Effect of Calcium Carbonate and Calcium Sulphate on Bone Development". Poultry Science (in الإنجليزية). 12 (1): 5–8. doi:10.3382/ps.0120005. ISSN 0032-5791.
- ^ "Biphasic Calcium Sulfate - Overview". Augma Biomaterials. 2020-03-25. Retrieved 2020-07-16.
- ^ Whitehaven Coast Archeological Survey
وصلات خارجية
| أملاح وإستر أيون الكبريتات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2SO4 | He | ||||||||||||||||||
| Li2SO4 | BeSO4 | B | (RO)2SO3 | (NH4)2SO4 N2H6SO4 (NH3OH)2SO4 |
O | F | Ne | ||||||||||||
| Na2SO4 NaHSO4 |
MgSO4 | Al2(SO4)3 | Si | P | SO42− | Cl | Ar | ||||||||||||
| K2SO4 KHSO4 |
CaSO4 | Sc2(SO4)3 | Ti(SO4)2 | V2(SO4)3 VOSO4 |
CrSO4 Cr2(SO4)3 |
MnSO4 | FeSO4 Fe2(SO4)3 |
CoSO4, Co2(SO4)3 |
NiSO4 | CuSO4 | ZnSO4 | Ga2(SO4)3 | Ge | As | Se | Br | Kr | ||
| Rb2SO4 | SrSO4 | Y | Zr(SO4)2 | Nb | Mo | Tc | Ru | Rh | PdSO4 | Ag2SO4 | CdSO4 | In2(SO4)3 | SnSO4 | Sb2(SO4)3 | Te | I | Xe | ||
| Cs2SO4 | BaSO4 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2SO4, HgSO4 |
Tl2SO4 | PbSO4 | Bi2(SO4)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce2(SO4)3 Ce(SO4)2 |
Pr2(SO4)3 | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb2(SO4)3 | Lu | |||||
| Ac | Th | Pa | U(SO4)2 UO2SO4 |
Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||