قسطرة الشريان التاجي
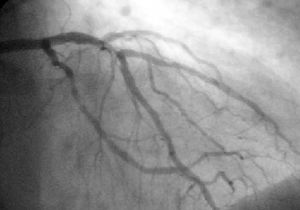
قسطرة الشرايين التاجية coronary catheterization، هي جراحة طفيفة التوغل للوصول إلى الدورة التاجية و حجرات القلب المملتئة بالدم باستخدام القسطرة.
قسطرة الشريان التاجي هو تدخل جراحي بسيط للوصول إلى الدورة الدموية التاجية وغرف القلب المليئة بالدم باستخدام قسطرة . يتم إجراؤه لأغراض التشخيص والعلاجية .
قسطرة الشريان التاجي هي واحدة من العديد من الاختبارات والإجراءات التشخيصية لأمراض القلب . على وجه التحديد ، قسطرة الشريان التاجي هي اختبار مفسر بصريًا للتعرف علي انسداد ، تضيق ، عودة التضيق ، تخثر أو تمدد تجاويف الشريان التاجي ; حجم غرفة القلب; أداء انقباض عضلة القلب ; وبعض جوانب وظيفة صمام القلب . قيم ضغط مهمة كضغط الدم الداخلي للقلب و الرئة لا يمكن قياسه من خارج الجسم،, يمكن قياسها بدقة من خلال هذا الاختبار. المشاكل ذات الصلة التي تتعامل مع اختبار الأكثر شيوعا يحدث نتيجة متقدمة تصلب الشرايين - عصيدة النشاط داخل جدار الشريان التاجي الشرايين . في كثير من الأحيان ، تكون مشاكل الصمامات أو عضلة القلب أو اضطراب نظم القلب هي المحور الأساسي للاختبار .
يقلل التضيق الوعائي للشريان التاجي من احتياطي تدفق الدم المؤكسج إلى القلب ، مما ينتج عنه ذبحة صدرية متقطعة. عادة ما ينتج عن الانسداد الوعائي المتقدم نوبة قلبية . ومع ذلك ، فقد تم الاعتراف بشكل متزايد ، منذ أواخر الثمانينيات ، أن القسطرة التاجية لا تسمح بالتعرف على وجود أو عدم وجود تصلب الشرايين التاجي نفسه ، فقط التغييرات الوعائية الهامة التي حدثت نتيجة لمضاعفات المرحلة النهائية من عملية تصلب الشرايين . انظر تصوير بالأمواج فوق الصوتية داخل الأوعية والورم العصيدى لفهم أفضل لهذه المشكلة.
التاريخ
تم تطوير تقنية تصوير الأوعية لأول مرة في عام 1927 من قبل الطبيب البرتغالي إيجاس مونيز لتوفير أشعة سينية متباينة من أجل تشخيص الأمراض العصبية ، مثل الأورام وأمراض القلب التاجية والتشوهات الشريانية الوريدية. وهو معروف كواحد من الرواد في هذا المجال.
تم إجراء قسطرة الشريان التاجي لأول مرة في عام 1929 عندما أدخل الطبيب الألماني فيرنر فورسمان أنبوبًا بلاستيكيًا في الوريد المرفقي ووجهه إلى الغرفة اليمنى للقلب. أخذ صورة بالأشعة السينية لإثبات نجاحه ونشرها في 5 نوفمبر 1929 بعنوان "Über die Sondierung des rechten Herzens" (حول فحص القلب الأيمن).. تم تقديم التصوير التاجي للقلب الأيسر في عام 1953 بتقرير من قبل مجموعة برتغالية ، نُشر في Cardiologia ، المحفوظات الدولية لأمراض القلب ، المجلد 22 ، الصفحات 45-61 ، بواسطة E.Coelho وآخرون ، بعنوان L'artériograpie des coronaires chez l'homme vivant. كانوا أول من حقنوا تباين الأشعة في الشرايين التاجية. في عام 1954 ، قام جورج سي ويليس بحقن الشرايين التاجية بوسائط تباين من أجل مراقبة انعكاس مرض الشريان التاجي بعد إثبات أن خنازير غينيا تعاني من تصلب الشرايين التاجية ذات الصلة بالإسقربوط مثل البشر الذين يفتقرون إلى فيتامين سي. عكس مرض الشريان التاجي أو توقيفه في 70٪ من عيّنته في مستشفيات سانت آن وكوين ماري فيرجينيا في مونتريال. ورقته البحثية "تصوير الشرايين التسلسلي في تصلب الشرايين" (GC Willis، AW Light، WS Cow. Canadian Med. Assn. J. Dec. 1954. Vol 71 Pp.562-568) هي التقرير الأول النهائي للنجاح في عكس المرض البشري مع فيتامين سي مما يجعل التطور اللاحق لمجرى الشريان التاجي غير ضروري. في عام 1960 ، قام ف. ميسون سونز ، طبيب قلب الأطفال في كليفلاند كلينك ، بحقن تباين الأشعة عن طريق الخطأ في الشريان التاجي بدلاً من البطين الأيسر. على الرغم من أن المريض كان يعاني من سكتة قلبية عكوسة ، فقد طور سونز وشيري الإجراء بشكل أكبر ، ويُنسب إليه الفضل في الاكتشاف (كونولي 2002) ؛ قاموا بنشر سلسلة من 1000 براءة اختراع في عام 1966 (Proudfit et al. ).
منذ أواخر سبعينيات القرن الماضي ، وبناءً على العمل الرائد لتشارلز دوتر في عام 1964 وخاصة أندرياس جرونتزيغ الذي بدأ في عام 1977 ، تم توسيع القسطرة التاجية لتشمل الاستخدامات العلاجية: (أ) أداء العلاج الطبيعي الأقل توغلاً للذبحة الصدرية وبعض مضاعفات تصلب الشرايين الشديد ، (ب) علاج النوبات القلبية قبل حدوث الضرر الكامل و (ج) البحث من أجل فهم أفضل لأمراض الشريان التاجي وتصلب الشرايين .اليوم ، وباستخدام أخلاقي أكبر للعمل النهائي لـ Michelson و Morganroth و Nichols و MacVaugh (Arch Intern Med. 1979 أكتوبر ؛ 139 (10): 1139-41) الذي أنشأ أقرب علاقة ممكنة بين تصلب الشرايين التاجية والشبكية ، يمكن الحكم عليه أكثر دقة في تحديد ما إذا كان يمكن عكس مرض الشرايين أم لا ، باستخدام مقياس CardioRetinometry لبوش ، ومدى سرعة عكسه ، قبل الشروع في جراحة القلب والصدر.
مشاركة المرضى
عادة ما يكون المريض الذي يتم فحصه أو معالجته مستيقظًا أثناء القسطرة ، من الناحية المثالية مع التخدير الموضعي فقط مثل ليدوكايين مع الحد الأدنى من التخدير العام ، طوال العملية . يعد إداء الإجراء مع المريض مستيقظًا أكثر أمانًا حيث يمكن للمريض الإبلاغ فورًا عن أي إزعاج أو مشاكل وبالتالي تسهيل التصحيح السريع لأي أحداث غير مرغوب فيها. فشل المراقبون الطبيون في إعطاء نظرة شاملة عن حالة المريض الفورية ؛ كيف يشعر المريض غالبًا هو مؤشر موثوق به للسلامة الإجرائية.
في أوائل الستينيات ، استغرقت القسطرة القلبية في كثير من الأحيان عدة ساعات وكانت تنطوي على مضاعفات كبيرة لما يصل إلى 2-3 ٪ من المرضى. مع العديد من التحسينات التدريجية بمرور الوقت ، فإن فحوصات القسطرة التاجية البسيطة تُجرى الآن بشكل أكثر سرعة وبنتائج محسّنة بشكل ملحوظ . تحدث الوفاة واحتشاء عضلة القلب والسكتة الدماغية وعدم انتظام ضربات القلب البطيني الخطير ومضاعفات الأوعية الدموية الرئيسية في أقل من 1٪ من المرضى الذين يخضعون للقسطرة .[1] على الرغم من أن جزء التصوير في الفحص غالبًا ما يكون موجزًا ، نظرًا لقضايا الإعداد والسلامة ، غالبًا ما يكون المريض في المختبر لمدة 20-45 دقيقة. يمكن لأي من الصعوبات الفنية المتعددة ، مع عدم تعريض المريض للخطر (تمت إضافته بالفعل لحماية مصالح المريض) إلى زيادة وقت الفحص بشكل كبير. .
الأجهزة
يتم إجراء قسطرة الشريان التاجي في معمل قسطرة ، يقع عادةً داخل المستشفى. مع التصاميم الحالية، يجب على المريض الاستلقاء نسبيا على طاولة ضيقة، مبطن قليلا، شفافة للأشعة . يقع مصدر الأشعة السينية ومعدات كاميرا التصوير على جانبي صدر المريض ويتحركان بحرية ، تحت سيطرة آلية ، حول صدر المريض بحيث يمكن التقاط الصور بسرعة من زوايا متعددة. تستخدم المعدات الأكثر تقدمًا ، التي يطلق عليها اسم مختبر القسطرة ثنائية المستوى ، مجموعتين من مصدر الأشعة السينية وكاميرات التصوير ، كل منها حر في التحرك بشكل مستقل ، مما يسمح بالتقاط مجموعتين من الصور مع كل حقنة من عامل التباين الراديوي.
عادةً ما يمثل إعداد المعدات والتركيب لإجراء مثل هذا الاختبار نفقات رأسمالية قدرها 2-5 مليون دولار أمريكي (2004) ، وأحيانًا أكثر من ذلك ، ويتم تكرارها جزئيًا كل بضع سنوات.
اجراءات التشخيص
أثناء قسطرة الشريان التاجي (غالبًا ما يشار إليها باسم القسطرة من قبل الأطباء) ، يتم تسجيل ضغط الدم وتسجيل الكشف الفلوري ( صورة الأشعة السينية المتحركة ) - جرامات الظل من الدم داخل الشرايين التاجية . من أجل إنشاء صور الأشعة السينية ، يوجه الطبيب جهازًا صغيرًا يشبه الأنبوب يسمى القسطرة ، عادةً ~ 2.0 مم (6-فرنسي) في القطر عبر الشرايين الكبيرة بالجسم حتى يصبح طرفها داخل فتحة أحد الشرايين التاجية . حسب التصميم ، تكون القسطرة أصغر من تجويف الشريان الذي توضع فيه ؛ يتم مراقبة ضغط الدم الداخلي (داخل الشرايين) من خلال القسطرة للتحقق من أن القسطرة لا تمنع تدفق الدم
تم تصميم القسطرة نفسها لتكون ظليلة اشعة من أجل الرؤية وتسمح بحقن عامل تباين إشعاعي واضح مائي ومتوافق مع الدم ، يُطلق عليه عادةً صبغة الأشعة السينية ، بشكل انتقائي وخلطه مع الدم المتدفق داخل الشريان. عادةً ما يتم حقن 3-8 سم مكعب من عامل التباين الإشعاعي لكل صورة لجعل تدفق الدم مرئيًا لمدة 3-5 ثوانٍ حيث يتم تصريف عامل التباين الراديوي سريعًا بعيدًا في الشعيرات الدموية التاجية ثم الأوردة التاجية. بدون حقن الصبغة بالأشعة السينية ، يظهر الدم وأنسجة القلب المحيطة ، على الأشعة السينية ، على أنها كتلة كثافة مائية متغيرة بشكل طفيف ، أو كتلة منتظمة من كثافة الماء ؛ لا توجد تفاصيل واضحة عن الدم وبنية الأعضاء الداخلية. يسمح التباين الإشعاعي داخل الدم بتصور تدفق الدم داخل الشرايين أو غرف القلب ، اعتمادًا على مكان الحقن.
إذا كانت عصيدة ، أو جلطات ، بارزة في التجويف ، مما يؤدي إلى تضييق ، فقد يُنظر إلى التضييق بدلاً من ذلك على أنه ضبابية متزايدة داخل صور ظل الأشعة السينية لعمود الدم / الصبغة داخل ذلك الجزء من الشريان ؛ هذا بالمقارنة مع المناطق المجاورة ، التي يُفترض أنها أكثر صحة ، وأقل تضيقًا .
انظر إلى الرسم التوضيحي أحادي الإطار لصورة تصوير الأوعية التاجية في صفحة توسيع الاوعية الدموية.
للحصول على إرشادات بشأن أوضاع القسطرة أثناء الفحص ، يعتمد الطبيب في الغالب على المعرفة التفصيلية للتشريح الداخلي ، وسلوك السلك التوجيهي والقسطرة ، ويستخدم بشكل متقطع التنظير الفلوري وجرعة منخفضة من الأشعة السينية للرؤية عند الحاجة. يتم ذلك دون حفظ تسجيلات لهذه النظرات المختصرة. عندما يكون الطبيب جاهزًا لتسجيل المشاهدات التشخيصية ، والتي يتم حفظها ويمكن فحصها بدقة أكبر لاحقًا ، يقوم بتنشيط الجهاز لتطبيق جرعة أعلى من الأشعة السينية ، يُطلق عليها اسم سينمائي ، من أجل إنشاء صور ذات جودة أفضل للصور المتحركة ، وتكون أكثر وضوحًا تباين الكثافة الإشعاعية ، عادةً بمعدل 30 إطارًا في الثانية. يتحكم الطبيب في كل من حقن التباين ، والكشف الفلوري ، وتوقيت تطبيق السينما لتقليل الكمية الإجمالية للحقن الإشعاعي ومرات الأشعة السينية للحقن وذلك لتقليل الكمية الإجمالية للأشعة السينية المستخدمة. يتم تسجيل جرعات عوامل التباين الإشعاعي وأوقات التعرض للأشعة السينية بشكل روتيني في محاولة لتحقيق أقصى قدر من السلامة.
على الرغم من عدم تركيز الاختبار ، إلا أن التكلس داخل جدران الشرايين ، الموجود في الحواف الخارجية لتصلب الشرايين داخل جدران الشرايين ، يمكن التعرف عليه أحيانًا في الكشف الفلوري (بدون حقن التباين) على شكل حلقات هالة ذات إشعاع إشعاعي تحيط جزئيًا ، ومنفصلة عن التجويف المملوء بالدم عن طريق توسط نسيج العصيدة الشعاعي والبطانة الغشائية . عادة ما يكون التكلس ، على الرغم من وجوده عادةً ، مرئيًا فقط عندما يتم عرض أقسام متكلسة ومتقدمة جدًا من جدار الشريان من نهايتها بشكل مماسي من خلال حلقات متعددة من التكلس ، وذلك لإنشاء كثافة إشعاعية كافية لتكون مرئية في الكشف الفلوري.
الاجراءات العلاجية
من خلال تغيير القسطرة التشخيصية إلى قسطرة توجيهية ، يمكن للأطباء أيضًا تمرير مجموعة متنوعة من الأدوات من خلال القسطرة إلى الشريان إلى موقع الإصابة . الأكثر شيوعًا هي أسلاك التوجيه بقطر 0.014 بوصة (0.36 مم) وقسطرة تمدد البالون
عن طريق حقن عامل التباين الإشعاعي من خلال ممر صغير يمتد أسفل قسطرة البالون وفي البالون ، يتم توسيع البالون تدريجياً. يتم اختيار الضغط الهيدروليكي وتطبيقه من قبل الطبيب وفقًا لكيفية استجابة البالون داخل التضيق ( تضيق غير طبيعي في الأوعية الدموية). تتم مشاهدة البالون المملوء بالتناقضات الإشعاعية تحت الكشف الفلوري(يفترض عادةً شكل "عظام الكلب" المفروض على السطح الخارجي للبالون بسبب تضيق البالون أثناء تمدد البالون) ، عند فتحه. يتم تطبيق قدر كبير من القوة الغاشمة الهيدروليكية حسب الحاجة ويتم تصورها لتكون فعالة لجعل تضيق تجويف الشريان يتضخم بشكل واضح.
يكون ضغط الشريان التاجي الطبيعي النموذجي في نطاق <200 مم زئبق (27 كيلو باسكال). قد تمتد الضغوط الهيدروليكية المطبقة داخل البالون إلى 19000 مم زئبق (2500 كيلو باسكال). يتم تحقيق الوقاية من الإفراط في التوسيع عن طريق اختيار البالونات المصنعة من أغشية بلاستيكية شفافة ذات مقاومة شد عالية. يتم طي البالون مبدئيًا حول القسطرة ، بالقرب من الطرف ، لإنشاء مقطع عرضي صغير لتسهيل المرور عبر مناطق التضيق اللمعي ، وهو مصمم للتضخم إلى قطر محدد مسبقًا. إذا تم تضخيم البالون بشكل مفرط ، فإن مادة البالون تمزق ببساطة وتسمح لعامل التباين الراديوي المتضخم بالهروب ببساطة إلى الدم.
بالإضافة إلى ذلك ، يمكن إدخال العديد من الأجهزة الأخرى في الشريان عن طريق قسطرة توجيهية. وتشمل هذه القسطرة بالليزر ، وقسطرة الدعامة ، وقسطرة تصوير بالأمواج فوق الصوتية داخل الأوعية ، وقسطرة دوبلر ، وقسطرة قياس الضغط أو درجة الحرارة ، وأجهزة الجلطة والطحن أو الإزالة المختلفة. لقد تبين أن معظم هذه الأجهزة هي أجهزة متخصصة ، مفيدة فقط في نسبة صغيرة من المواقف أو للبحث.
الدعامات ، التي يتم تصنيعها خصيصًا لأنابيب شبكية من الفولاذ المقاوم للصدأ قابلة للتمدد ، ومثبتة على قسطرة بالون ، هي أكثر الأجهزة استخدامًا بعد قسطرة البالون. عندما يتم وضع الدعامة / جهاز البالون داخل التضيق ، يتم نفخ البالون مما يؤدي بدوره إلى توسيع الدعامة والشريان. يُزال البالون وتبقى الدعامة في مكانها ، مما يدعم جدران الشريان الداخلي في الوضع الأكثر انفتاحًا واتساعًا. تبلغ تكلفة الدعامات الحالية بشكل عام حوالي 1000 إلى 3000 دولار لكل منها (دولار أمريكي 2004) ، والدعامات المغلفة بالدواء هي الأكثر تكلفة.
تطور القسطرة بالإعتماد على العلاج البدني
عانت الإجراءات التدخلية من عودة التضيق بسبب تكوين فرط نمو الأنسجة البطانية في موقع الآفة. عودة التضيق هو استجابة الجسم لإصابة جدار الوعاء الدموي من قسطرة والدعامة كجسم غريب . كما تم تقييمه في التجارب السريرية في أواخر الثمانينيات والتسعينيات ، باستخدام توسيع الاوعية الدموية باستخدام الوعاء بالبالون فقط (PRPVA ، توسيع الوعاء بالبالون القديم البسيط) ، عانى ما يصل إلى 50٪ من المرضى من عودة تضيق كبيرة ؛ ولكن هذه النسبة قد انخفضت إلى النطاق المكون من رقمين واحد إلى أقل من رقمين مع إدخال الدعامات التي تحتوي على الأدوية. سيروليموس و باكليتاكسيل و إيفيروليموس هي الأدوية الثلاثة المستخدمة في الطلاء والتي تمت الموافقة عليها حاليًا من قِبل إدارة الغذاء والدواء الأمريكية في الولايات المتحدة. على عكس المعدن العاري ، يتم تغطية الدعامات المملوءة بالأدوية بدواء يتم تشتيته ببطء بهدف قمع تفاعل عودة التضيق. كان مفتاح نجاح طلاء الدواء هو (أ) اختيار عوامل فعالة ، (ب) تطوير طرق لربط الأدوية بشكل مناسب بالسطح غير القابل للصدأ لسطح الدعامات (يجب أن يظل الطلاء مرتبطًا على الرغم من ضغوط المعالجة وتشوه الدعامة الملحوظ) ، و (ج) تطوير آليات إطلاق محكومة بالطلاء تطلق الدواء ببطء على مدى 30 يومًا تقريبًا
انظر أيضا
المصادر
الهوامش
- ^ Hurst, J. Willis; Fuster, Valentin; O'Rourke, Robert A. (2004). Hurst's The Heart. New York: McGraw-Hill, Medical Publishing Division. pp. 489–90. ISBN 0-07-142264-1.
{{cite book}}: CS1 maint: multiple names: authors list (link)
عام
- Connolly JE. The development of coronary artery surgery: personal recollections. Tex Heart Inst J 2002;29:10-4. PMID 11995842.
- Proudfit WL, Shirey EK, Sones FM Jr. Selective cine coronary arteriography. Correlation with clinical findings in 1,000 patients. Circulation 1966;33:901-10. PMID 5942973.
- Sones FM, Shirey EK. Cine coronary arteriography. Mod Concepts Cardiovasc Dis 1962;31:735-8. PMID 13915182.
- [1] Coronary CT angiography by Eugene Lin