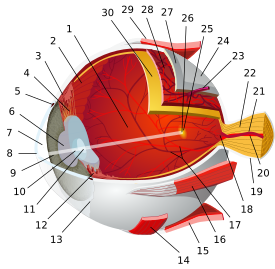
خلية عصوية
| الخلية العصوية | |
|---|---|
 قطاع مستعرض من الشبكية. تظهر الخلايا العصوية أقصى اليمين. | |
| Details | |
| الموقع | Retina |
| الشكل | عصوية الشكل |
| الوظيفة | خلية مستقبلة للضوء المنخفض |
| Neurotransmitter | الگلوتاميك |
| Presynaptic connections | لا |
| Postsynaptic connections | الخلايا ثنائية القطب و[[]] and الخلايا الأفقية |
| المُعرفات | |
| MeSH | D017948 |
| NeuroLex ID | nlx_cell_100212 |
| TH | TH {{{2}}}.html HH3.11.08.3.01030 .{{{2}}}.{{{3}}} |
| FMA | 67747 |
| المصطلحات التشريحية | |
الخلايا العصوية (إنگليزية: Rod cells)، هي خلايا مستقبلة للضوء في شبكية العين يمكن أن تعمل في ضوء منخفض بشكل أفضل من النوع الآخر من مستقبلات الضوء المرئية ، الخلايا المخروطية . عادة ما توجد العصويات المركزة عند الحواف الخارجية للشبكية وتستخدم في الرؤية المحيطية . في المتوسط ، هناك ما يقرب من 92 مليون خلية عصوية في شبكية العين البشرية.[1] تعد الخلايا العصوية أكثر حساسية من الخلايا المخروطية وهي مسؤولة بالكامل تقريبًا عن الرؤية الليلية . ومع ذلك ، فإن دور العصويات في رؤية الألوان ضئيل ، وهذا هو السبب الرئيسي لكون الألوان أقل وضوحًا في الضوء الخافت
البُنية
العصويات أطول قليلًا وأنحف من المخاريط ولكن لها نفس البنية الأساسية. توجد الأقراص التي تحتوي على أوبسين في نهاية الخلية المجاورة للظهارة الصبغية للشبكية ، والتي ترتبط بدورها بداخل العين . يسمح هيكل القرص المكدس لجزء الكاشف بالخلية بكفاءة عالية جدًا. العصيوات أكثر شيوعًا من المخاريط ، حيث تحتوي على حوالي 120 مليون خلية عصوية مقارنة بـ 6 إلى 7 ملايين خلية مخروطية.[2]
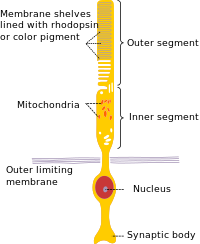
مثل المخاريط ، تحتوي الخلايا العصوية على طرف متشابك وجزء داخلي وجزء خارجي. تشكل المحطة المشبكية تشابكًا مع خلية عصبية أخرى ، عادة ما تكون خلية ثنائية القطب أو خلية أفقية . يتم توصيل الأجزاء الداخلية والخارجية بواسطة هدب,[3] الذي يبطن الجزء البعيد.[4] يحتوي الجزء الداخلي على عضيات ونواة الخلية ، بينما يحتوي الجزء الخارجي للعصوي (والمختصر بـ ROS) ، والذي يشير إلى الجزء الخلفي من العين ، على مواد تمتص الضوء.[3]
يبلغ قطر الخلية العصوية للإنسان حوالي 2 ميكرون وطولها 100 ميكرون.[5] ليست كل العصويات متماثلة من الناحية الشكلية ؛ في الفئران ، تعرض العصويات القريبة من الطبقة المشبكية الضفيرة الخارجية طولًا منخفضًا بسبب طرف متشابك قصير.[6]
الوظيفة
استقبال الضوء
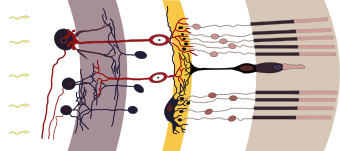
في الفقاريات ، تنشيط الخلية المستقبلة للضوء هو فرط استقطاب (تثبيط) للخلية. عندما لا يتم تحفيزها ، كما هو الحال في الظلام ، فإن الخلايا العصوية والخلايا المخروطية تزيل الاستقطاب وتطلق ناقلًا عصبيًا تلقائيًا. هذا الناقل العصبي يفرط في استقطاب الخلية ثنائية القطب . توجد الخلايا ثنائية القطب بين المستقبلات الضوئية والخلايا العقدية وتعمل على نقل الإشارات من المستقبلات الضوئية إلى الخلايا العقدية . نتيجة لفرط الاستقطاب للخلية ثنائية القطب ، فإنها لا تطلق الناقل الخاص بها عند المشبك ثنائي القطب والعقدة ولا يكون المشبك مثاراً
يؤدي تنشيط الصبغات الضوئية عن طريق الضوء إلى إرسال إشارة عن طريق الاستقطاب المفرط للخلية العصوية ، مما يؤدي إلى عدم إرسال الخلية العصوية لناقلها العصبي ، مما يؤدي إلى الخلية ثنائية القطب ثم إطلاق الناقل عند المشبك الثنائي القطب وإثارة المشبك.
يحدث إزالة استقطاب الخلايا العصوية (مما يتسبب في إطلاق ناقلها العصبي) لأنه في الظلام ، تحتوي الخلايا على تركيز مرتفع نسبيًا من أحادي الفوسفات الحلقي (cGMP) ، والذي يفتح القنوات الأيونية (قنوات الصوديوم إلى حد كبير ، على الرغم من أن الكالسيوم يمكن أن يدخل من خلالها هذه القنوات أيضًا). تعمل الشحنات الموجبة للأيونات التي تدخل الخلية أسفل تدرجها الكهروكيميائي على تغيير جهود غشاء الخلية ، وتسبب إزالة الاستقطاب ، وتؤدي إلى إطلاق الناقل العصبي الغلوتامات . يمكن للغلوتامات أن يزيل استقطاب بعض الخلايا العصبية ويزيد استقطاب بعضها الآخر ، مما يسمح للمستقبلات الضوئية بالتفاعل بطريقة مناهضة.
عندما يصطدم الضوء بالأصباغ المستقبلة للضوء داخل الخلية المستقبلة للضوء ، يتغير شكل الصباغ. الصباغ المسمى رودوبسين (يوجد كونوبسين في الخلايا المخروطية) يتكون من بروتين كبير يسمى أوبسين (الموجود في غشاء البلازما) ، والذي يرتبط به مجموعة صناعية مرتبطة تساهميًا: جزيء عضوي يسمى الشبكية (أحد مشتقات فيتامين أ ). توجد الشبكية في شكل 11-cis-retinal عندما تكون في الظلام ، ويؤدي التحفيز بالضوء إلى تغيير هيكلها إلى الشبكية بالكامل. يتسبب هذا التغيير الهيكلي في تقارب متزايد للبروتين التنظيمي المسمى ترانسديوسين (نوع من بروتين G). عند الارتباط بالرودوبسين ، تستبدل الوحدة الفرعية ألفا من البروتين G جزيء من GDP بجزيء GTP ويتم تنشيطها. يؤدي هذا الاستبدال إلى فصل الوحدة الفرعية ألفا من البروتين G عن وحدات بيتا وجاما الفرعية لبروتين G. نتيجة لذلك ، أصبحت الوحدة الفرعية ألفا الآن حرة في الارتباط بفوسفودايستريز غوانوزين احادي الفوسفات الحلقي (بروتين مؤثر).[8] تتفاعل وحدة ألفا الفرعية مع وحدات غاما فوسفودايستريز المثبطة وتمنعها من حجب المواقع المحفزة على الوحدتين الفرعيتين ألفا وبيتا من فوسفودايستريز ، مما يؤدي إلى تنشيط فوسفودايستريز غوانوزين احادي الفوسفات الحلقي ، الذي يحلل غوانوزين احادي الفوسفات الحلقي (المرسال الثاني) ، ويقسمه إلى 5'- غوانوزين احادي الفوسفات الحلقي..[9] يسمح التقليل في الغوانوزين احادي الفوسفات الحلقي للقنوات الأيونية بالإغلاق ، ومنع تدفق الأيونات الموجبة ، وفرط استقطاب الخلية ، ووقف إطلاق الناقل العصبي الغلوتامات (Kandel et al. ، 2000). على الرغم من أن الخلايا المخروطية تستخدم في المقام الأول مادة الناقل العصبي أستايل كولين ، فإن الخلايا العصوية تستخدم مجموعة متنوعة. العملية الكاملة التي يبدأ بها الضوء استجابة حسية تسمى النقل الضوئي البصري.
يمكن أن يؤدي تنشيط وحدة واحدة من رودوبسين ، الصبغة الحساسة للضوء في العصويات ، إلى تفاعل كبير في الخلية بسبب تضخيم الإشارة. بمجرد تنشيطه ، يمكن للرودوبسين تنشيط المئات من جزيئات الترانسديوسين ، كل منها بدوره ينشط جزيء فسفودايستراز ، والذي يمكن أن يتحلل أكثر من ألف جزيء غوانوزين احادي الفوسفات الحلقي في الثانية (Kandel et al. 2000). وبالتالي ، يمكن أن يكون للعصويات استجابة كبيرة لكمية صغيرة من الضوء.
نظرًا لأن المكون الشبكي للرودوبسين مشتق من فيتامين أ ، فإن نقص فيتامين أ يسبب نقصًا في الصبغة التي تحتاجها الخلايا العصوية. وبالتالي ، فإن عددًا أقل من الخلايا العصوية قادرة على الاستجابة بشكل كافٍ في الظروف المظلمة ، وحيث أن الخلايا المخروطية ضعيفة التكيف مع البصر في الظلام ، يمكن أن ينتج عن ذلك العمى. هذا هو العمى الليلي .
العودة إلى وضع الراحة
تستفيد العصويات من ثلاث آليات مثبطة (آليات ردود الفعل السلبية) للسماح بالعودة السريعة إلى حالة الراحة بعد وميض الضوء.
أولاً ، يوجد رودوبسين كيناز (RK) الذي من شأنه أن يفسفر الذيل الخلوي للرودوبسين المنشط على السيرينات المتعددة ، مما يثبط جزئيًا تنشيط الترانسديوسين. أيضًا ، يرتبط البروتين المثبط - أريستين بعد ذلك بالرودوبسين المفسفرة لزيادة تثبيط نشاط رودوبسين.
بينما يقوم الأريستين بإيقاف رودوبسين ، فإن بروتين منظم اشارة بروتين G (يعمل كبروتينات تنشيط GTPase (GAPs)) يدفع المحول (بروتين G) إلى حالة "إيقاف التشغيل" عن طريق زيادة معدل التحلل المائي لـ GTP المحدود إلىGDP
أيضًا نظرًا لأن القنوات الحساسة غوانوزين احادي الفوسفات الحلقي لا تسمح فقط بتدفق أيونات الصوديوم ، ولكن أيضًا أيونات الكالسيوم ، مع انخفاض تركيز غوانوزين احادي الفوسفات الحلقي ، يتم إغلاق القنوات الحساسة غوانوزين احادي الفوسفات الحلقي وتقليل التدفق الطبيعي لأيونات الكالسيوم. يؤدي الانخفاض في تركيز أيونات الكالسيوم إلى تحفيز البروتينات الحساسة لأيون الكالسيوم ، والتي من شأنها بعد ذلك تنشيط محلقة الغوانيليل لتجديد غوانوزين احادي الفوسفات الحلقي ، واستعادة تركيزها الأصلي بسرعة. تفتح عملية الاستعادة القنوات الحساسة لغوانوزين احادي الفوسفات الحلقي وتؤدي إلى إزالة الاستقطاب من غشاء البلازما..[10]
إزالة الحساسية
عندما تتعرض العصويات لتركيز عالٍ من الفوتونات لفترة طويلة ، فإنها تصبح غير حساسة (تتكيف) مع البيئة.
نظرًا لأن رودوبسين يتم فسفرته بواسطة رودوبسين كيناز (عضو في كينازات GPCR (GRKs)) ، فإنه يرتبط بدرجة عالية بالأريستين. يمكن أن يساهم الأريسيتن المربوط في عملية إزالة التحسس بطريقتين على الأقل. أولاً ، يمنع التفاعل بين البروتين G والمستقبل المنشط. ثانيًا ، يعمل كبروتين محول لمساعدة المستقبل لآلة الالتقام المعتمد على الكلاذرين (للحث على الالتقام الخلوي بوساطة المستقبلات)..[10]
الحساسية
تعتبر الخلية العصوية حساسة بدرجة كافية للاستجابة لفوتون واحد من الضوء[11] وهي أكثر حساسية لفوتون واحد بحوالي 100 مرة من المخاريط. نظرًا لأن العصويات تتطلب ضوءًا أقل للعمل من المخاريط ، فهي المصدر الأساسي للمعلومات المرئية في الليل ( الرؤية الظلامية). من ناحية أخرى ، تتطلب الخلايا المخروطية تنشيطًا من عشرات إلى مئات الفوتونات. بالإضافة إلى ذلك ، تتلاقى خلايا عصوية متعددة في عصبون متوسط واحد ، وتجمع وتضخم الإشارات. ومع ذلك ، فإن هذا التقارب يأتي على حساب حدة البصر (أو دقة الصورة ) لأن المعلومات المجمعة من خلايا متعددة أقل تميزًا مما لو كان النظام البصري قد تلقى معلومات من كل خلية عصوية على حدة.
تستجيب الخلايا العصوية أيضًا للضوء بشكل أبطأ من المخاريط ويتم إضافة المحفزات التي تتلقاها على مدار حوالي 100 مللي ثانية. في حين أن هذا يجعل العصويات أكثر حساسية للكميات الأصغر من الضوء ، فهذا يعني أيضًا أن قدرتها على استشعار التغيرات الزمنية ، مثل تغيير الصور بسرعة ، أقل دقة من قدرة المخاريط.[3]
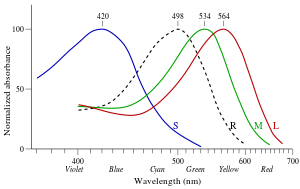
ظهرت التجارب التي أجراها جورج والد وآخرون أن العصويات هي الأكثر حساسية للأطوال الموجية للضوء حول 498 نانومتر (أخضر-أزرق) ، وغير حساسة للأطوال الموجية الأطول من حوالي 640 نانومتر (أحمر). هذا هو المسؤول عن تأثير بركنجي : عندما تخفت الشدة عند الشفق ، تستولي العصويات ، وقبل أن يختفي اللون تمامًا ، تتحول حساسية الذروة للرؤية نحو حساسية الذروة للعصويات (الأزرق والأخضر)).[13]
المصادر
- ^ Curcio, C. A.; Sloan, K. R.; et al. (1990). "Human photoreceptor topography". The Journal of Comparative Neurology. 292 (4): 497–523. doi:10.1002/cne.902920402. PMID 2324310. S2CID 24649779.
- ^ "The Rods and Cones of the Human Eye". hyperphysics.phy-astr.gsu.edu. Retrieved 25 April 2016.
- ^ أ ب ت Kandel E.R., Schwartz, J.H., Jessell, T.M. (2000). Principles of Neural Science, 4th ed., pp. 507–513. McGraw-Hill, New York.
- ^ "Photoreception" McGraw-Hill Encyclopedia of Science & Technology, vol. 13, p. 460, 2007
- ^ "How Big Is a Photoreceptor". Cell Biology By The Numbers. Ron Milo & Rob Philips.
- ^ Li, Shuai; Mitchell, Joe; Briggs, Deidrie J.; Young, Jaime K.; Long, Samuel S.; Fuerst, Peter G. (1 March 2016). "Morphological Diversity of the Rod Spherule: A Study of Serially Reconstructed Electron Micrographs". PLOS ONE. 11 (3): e0150024. Bibcode:2016PLoSO..1150024L. doi:10.1371/journal.pone.0150024. PMC 4773090. PMID 26930660. Retrieved 25 January 2017 – via PLoS Journals.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Human Physiology and Mechanisms of Disease by Arthur C. Guyton (1992) p. 373
- ^ "G Proteins". rcn.com. Retrieved 25 January 2017.
- ^ Muradov, Khakim G.; Artemyev, Nikolai O. (10 March 2000). "Loss of the Effector Function in a Transducin-α Mutant Associated with Nougaret Night Blindness". J. Biol. Chem. 275 (10): 6969–6974. doi:10.1074/jbc.275.10.6969. PMID 10702259. Retrieved 25 January 2017 – via www.jbc.org.
- ^ أ ب Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter (2008). Molecular Biology of The Cell, 5th ed., pp.919-921. Garland Science.
- ^ Okawa, Haruhisa; Alapakkam P. Sampath (2007). "Optimization of Single-Photon Response Transmission at the Rod-to-Rod Bipolar Synapse". Physiology. Int. Union Physiol. Sci./Am. Physiol. Soc. 22 (4): 279–286. doi:10.1152/physiol.00007.2007. PMID 17699881.
- ^ Bowmaker J.K. and Dartnall H.J.A. (1980). "Visual pigments of rods and cones in a human retina". J. Physiol. 298: 501–511. doi:10.1113/jphysiol.1980.sp013097. PMC 1279132. PMID 7359434.
- ^ Wald, George (1937b). "Photo-labile pigments of the chicken retina". Nature. 140 (3543): 545. Bibcode:1937Natur.140..545W. doi:10.1038/140545a0. S2CID 4108275.