إحساس الألم
إحساس الألم أو إدراك الألم (إنگليزية: Nociception، أو nocioception، من اللاتينية nocere 'بمعنى يؤذي أو يؤلم')، هو الجهاز العصبي الحسي في عملية ترميز المنبهات الضارة. في حالة الاحساس بالألم ، تنتج مادة كيميائية شديدة (مثل مسحوق الفلفل الحار) أو ميكانيكية (مثل القطع أو التكسير) أو التحفيز الحراري (الحرارة والبرودة) للخلايا العصبية الحسية التي تسمى مستقبلات الألم إشارة تنتقل على طول سلسلة من الألياف العصبية عبر الحبل الشوكي إلى الدماغ.[1] يؤدي الإحساس بالألم إلى مجموعة متنوعة من الاستجابات الفسيولوجية والسلوكية وعادة ما ينتج عنه تجربة ذاتية ، أو إدراك ، للألم في الكائنات الحساسة.[2]
الكشف عن المنبهات الضارة
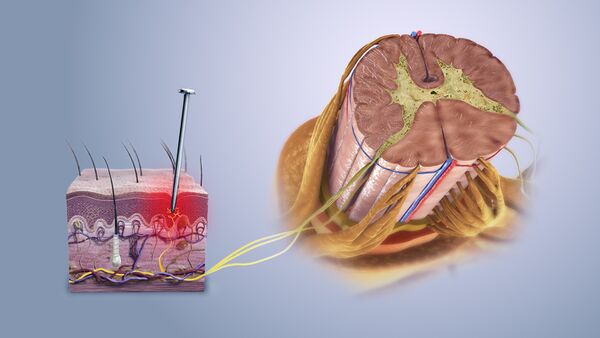
يتم الكشف عن المحفزات الميكانيكية والحرارية والكيميائية التي قد تكون ضارة عن طريق النهايات العصبية التي تسمى مستقبلات الألم ، والتي توجد في الجلد ، على الأسطح الداخلية مثل السمحاق ، وأسطح المفاصل ، وفي بعض الأعضاء الداخلية. بعض مستقبلات الألم عبارة عن نهايات عصبية حرة غير متخصصة لها أجسامها الخلوية خارج العمود الفقري في العقد الجذرية الظهرية.[3] تعتمد مستقبلات الألم الأخرى على هياكل متخصصة في الجلد لنقل المعلومات الضارة مثل خلايا شوان المسببة للألم.[4] يتم تصنيف مستقبلات الألم وفقًا للمحاور التي تنتقل من المستقبلات إلى النخاع الشوكي أو الدماغ. بعد إصابة العصب ، من الممكن أن يُنظر إلى ألياف اللمس التي تحمل عادةً محفزات غير ضارة على أنها ضارة..[5]
مستقبلات الألم لها عتبة معينة ؛ أي أنها تتطلب حدًا أدنى من شدة التحفيز قبل أن تطلق إشارة. بمجرد الوصول إلى هذه العتبة ، يتم تمرير إشارة على طول محور العصبون إلى الحبل الشوكي .
يطبق اختبار العتبة المسببة للألم عن عمد حافزًا ضارًا على الإنسان أو الحيوان من أجل دراسة الألم. في الحيوانات ، غالبًا ما تستخدم هذه التقنية لدراسة فعالية الأدوية المسكنة وتحديد مستويات الجرعات وفترة التأثير. بعد إنشاء خط الأساس ، يتم إعطاء الدواء قيد الاختبار ويتم تسجيل الارتفاع في العتبة في نقاط زمنية محددة. عندما يزول الدواء ، يجب أن تعود العتبة إلى القيمة الأساسية (ما قبل العلاج).
في بعض الحالات ، تصبح إثارة ألياف الألم أكبر مع استمرار منبهات الألم ، مما يؤدي إلى حالة تسمى فرط التألم .
نظرية
الاثار
يمكن أن يتسبب الشعور بالألم أيضًا في استجابات غير إرادية عامة قبل أو بدون الوصول إلى الوعي مما يسبب الشحوب والتعرق وتسرع القلب وفرط ضغط الدم والدوار والغثيان والإغماء . [6]
نبذة عن النظام
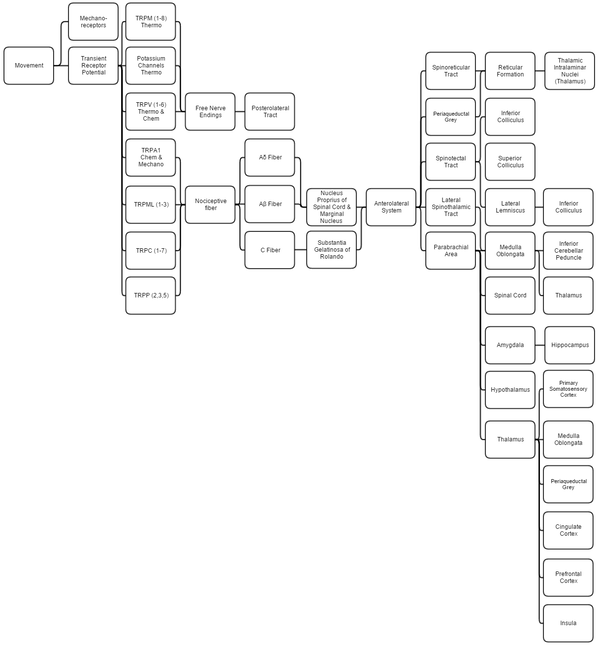
تناقش هذه النظرة العامة الحس العميق ، والاستقبال الحراري ، والإحساس الكيميائي ، والألم لأنها كلها مرتبطة بشكل متكامل
الميكانيكية
يتم تحديد استقبال الحس العميق باستخدام مستقبلات ميكانيكية قياسية (خاصة جسيمات روفيني (تمدد) و قنوات إمكانات المستقبلات العابرة (TRP)). يتم تغطية استقبال الحس العميق بالكامل داخل النظام الحسي الجسدي حيث يعالجها الدماغ معًا.
,يشير مصطلح "الاحساس الحراري" إلى منبهات درجات الحرارة المعتدلة 24–28 °C (75–82 °F) ، حيث أن أي شيء يتجاوز هذا النطاق يعتبر ألمًا وينتقل مستقبلات الألم. قنوات إمكانات المستقبلات العابرة والبوتاسيوم [TRPM (1-8) و TRPV (1-6) و TRAAK و TREK] تستجيب كل منها لدرجات حرارة مختلفة (من بين المحفزات الأخرى) التي تخلق إمكانات فعل في الأعصاب التي تنضم إلى نظام ميكانيكي (اللمس) في السبيل الخلفي الوحشي. ثم يتم تغطية الحس الحراري ، مثل الحس العميق ، من خلال نظام الحسية الجسدية..[7][8][9][10][11]
تنقل قنوات إمكانات المستقبلات العابرة التي تكتشف المحفزات الضارة (الألم الميكانيكي والحراري والكيميائي) تلك المعلومات إلى مستقبلات الألم التي تولد جهد فعل. تتفاعل قنوات إمكانات المستقبلات العابرة الميكانيكية مع تثبيط خلاياها (مثل اللمس) ، وتغير شكل إمكانات المستقبلات العابرة الحرارية في درجات حرارة مختلفة ، وتعمل إمكانات المستقبلات العابرة الكيميائية مثل براعم التذوق ، مما يشير إلى ما إذا كانت مستقبلاتها مرتبطة بعناصر / مواد كيميائية معينة.
العصبية
- تشكل الصفيحة 3-5 نواة خاصة في المادة الرمادية في العمود الفقري.
- تشكل الصفيحة 2 مادة جيلاتينية من رولاندو ، وهي مادة رمادية شوكية غير مبطنة. تتلقى المادة مدخلات من النواة الخاصة وتنقل ألمًا شديدًا ضعيفًا موضعياً.
- تسقط الصفيحة 1 في المقام الأول إلى المنطقة جارا العضدية والسنجابية المحيطة بالمسال ، والتي تبدأ في قمع الألم عن طريق تثبيط عصبي وهرموني. تتلقى الصفيحة 1 مدخلات من المستقبلات الحرارية عبر السبيل الخلفي الوحشي . النواة الهامشية للنخاع الشوكي هي إشارات الألم الوحيدة التي لا يمكن كبتها.
- تدمج منطقة الجارا عضدية معلومات الذوق والألم ، ثم تنقلها. تتحقق الجارا عضدية إذا كان الألم يتم تلقيه في درجات الحرارة العادية وما إذا كان النظام الذوقي نشطًا ؛ إذا كان كلاهما كذلك ، فمن المفترض أن يكون الألم ناتجًا عن السم.
- تتشابك ألياف Ao على الصفيحة 1 و 5 بينما تتشابك Ab على الصفيحة 1 و 3 و 5 و C. تتشابك ألياف C بالتحديد على الصفيحة 2.[12][13]
- تقوم اللوزة المخية والحصين بإنشاء وترميز الذاكرة والعاطفة بسبب محفزات الألم.
- إشارات ما تحت المهاد لإفراز الهرمونات التي تجعل كبت الألم أكثر فعالية ؛ بعض هذه الهرمونات هي الهرمونات الجنسية.
- سنجابية محيطة بالمسال (مع مساعدة هرمون الوطاء) يشير هرمونيًا إلى نوى التشكل الشبكي لإنتاج السيروتونين الذي يثبط نوى الألم الصفيحي.[14]
- يساعد السبيل النخاعي المهادي الوحشي في توطين الألم.
- السبيلان الشوكي الشبكي والنخاع السقفي هي مجرد مسارات ترحيل إلى المهاد تساعد في إدراك الألم واليقظة تجاهه. تعبر الألياف (يسارًا يمينًا) عبر الصوار الأبيض الشوكي الأمامي
- الفتيل الوحشي هو النقطة الأولى لتكامل معلومات الصوت والألم.[15]
- الأكيمة السفلية (IC) تساعد في توجيه الصوت إلى منبهات الألم..[16]
- الأكيمة العلوية تتلقى مدخلات الأكيمة السفلية ، وتدمج معلومات التوجيه البصري ، وتستخدم خريطة التوازن الطبوغرافية لتوجيه الجسم إلى محفزات الألم.[17][18]
- تدمج السويقة المخيخية السفلية معلومات التحفيز التحسسي والنواتج إلى المخيخ الدهليزي. السويقة ليست جزءًا من المسار الشوكي المهادي الوحشي ؛ يتلقى اللب المعلومات ويمررها إلى السويقة من مكان آخر (انظر نظام الحسية الجسدية ).
- المهاد هو المكان الذي يُعتقد أن الألم يدخل فيه إلى الإدراك ؛ كما أنه يساعد في قمع الألم وتعديله ، حيث يتصرف مثل الحارس ، ويسمح ببعض الشدة للوصول إلى المخ ورفض الآخرين.[19]
- تقوم القشرة الحسية الجسدية بفك تشفير معلومات مستقبلات الألم لتحديد الموقع الدقيق للألم والمكان الذي يتم فيه إحضار الحس العميق إلى الوعي ؛ السويقة المخيخية السفلية هي كل الحس العميق اللاواعي.
- يحكم الفص الجزيري على شدة الألم ويوفر القدرة على تخيل الألم.[20][21]
- يُفترض أن القشرة الحزامية هي مركز الذاكرة للألم.[22]
في الحيوانات غير الثديية
تم توثيق الشعور بالألم في الحيوانات غير الثديية ، بما في ذلك الأسماك[23] ومجموعة واسعة من اللافقاريات,[24] بما في ذلك العلق,[25] الديدان الخيطية,[26] الرخويات البحرية,[27] وذباب الفاكهة.[28] كما هو الحال في الثدييات ، تتميز الخلايا العصبية المسبب للألم في هذه الأنواع بالاستجابة التفضيلية لدرجات الحرارة المرتفعة (40 درجة مئوية أو أكثر) ، وانخفاض درجة الحموضة ، والكابسيسين ، وتلف الأنسجة
تاريخ المصطلح
صاغ تشارلز سكوت شيرينجتون مصطلح "الإحساس بالألم" لتمييز العملية الفسيولوجية (النشاط العصبي) عن الألم (تجربة ذاتية)).[29] مشتق من الفعل اللاتيني " nocēre " ، والذي يعني "الأذي".
المصادر
- ^ Portenoy, Russell K.; Brennan, Michael J. (1994). "Chronic Pain Management". In Good, David C.; Couch, James R. (eds.). Handbook of Neurorehabilitation. Informa Healthcare. ISBN 978-0-8247-8822-3.
- ^ Bayne, Kathryn (2000). "Assessing Pain and Distress: A Veterinary Behaviorist's Perspective". Definition of Pain and Distress and Reporting Requirements for Laboratory Animals: Proceedings of the Workshop Held June 22, 2000. National Academies Press. pp. 13–21. ISBN 978-0-309-17128-1.
- ^ Purves, D. (2001). "Nociceptors". In Sunderland, MA. (ed.). Neuroscience. Sinauer Associates.
- ^ Doan, Ryan A.; Monk, Kelly R. (16 August 2019). "Glia in the skin activate pain responses". Science. 365 (6454): 641–642. Bibcode:2019Sci...365..641D. doi:10.1126/science.aay6144. ISSN 1095-9203. PMID 31416950. S2CID 201015745.
- ^ Dhandapani, Rahul; Arokiaraj, Cynthia Mary; Taberner, Francisco J.; Pacifico, Paola; Raja, Sruthi; Nocchi, Linda; Portulano, Carla; Franciosa, Federica; Maffei, Mariano; Hussain, Ahmad Fawzi; de Castro Reis, Fernanda (2018-04-24). "Control of mechanical pain hypersensitivity in mice through ligand-targeted photoablation of TrkB-positive sensory neurons". Nature Communications (in الإنجليزية). 9 (1): 1640. Bibcode:2018NatCo...9.1640D. doi:10.1038/s41467-018-04049-3. ISSN 2041-1723. PMC 5915601. PMID 29691410.
- ^ Feinstein, B.; Langton, J. N. K.; Jameson, R. M.; Schiller, F. (October 1954). "Experiments on pain referred from deep somatic tissues". The Journal of Bone & Joint Surgery. 36 (5): 981–997. doi:10.2106/00004623-195436050-00007. PMID 13211692.
- ^ McCann, Stephanie (2017). Kaplan Medical Anatomy Flashcards: Clearly Labeled, Full-Color Cards. KAPLAN. ISBN 978-1-5062-2353-7.[صفحة مطلوبة]
- ^ Albertine, Kurt. Barron’s Anatomy Flash Cards[صفحة مطلوبة]
- ^ Hofmann, Thomas; Schaefer, Michael; Schultz, Günter; Gudermann, Thomas (28 May 2002). "Subunit composition of mammalian transient receptor potential channels in living cells". Proceedings of the National Academy of Sciences. 99 (11): 7461–7466. Bibcode:2002PNAS...99.7461H. doi:10.1073/pnas.102596199. PMC 124253. PMID 12032305.
- ^ Noël, Jacques; Zimmermann, Katharina; Busserolles, Jérome; Deval, Emanuel; Alloui, Abdelkrim; Diochot, Sylvie; Guy, Nicolas; Borsotto, Marc; Reeh, Peter; Eschalier, Alain; Lazdunski, Michel (12 March 2009). "The mechano-activated K+ channels TRAAK and TREK-1 control both warm and cold perception". The EMBO Journal. 28 (9): 1308–1318. doi:10.1038/emboj.2009.57. PMC 2683043. PMID 19279663.
- ^ Scholz, Joachim; Woolf, Clifford J. (November 2002). "Can we conquer pain?". Nature Neuroscience. 5 (11): 1062–1067. doi:10.1038/nn942. PMID 12403987. S2CID 15781811.
- ^ Braz, Joao M.; Nassar, Mohammed A.; Wood, John N.; Basbaum, Allan I. (September 2005). "Parallel 'Pain' Pathways Arise from Subpopulations of Primary Afferent Nociceptor". Neuron. 47 (6): 787–793. doi:10.1016/j.neuron.2005.08.015. PMID 16157274. S2CID 2402859.
- ^ Brown, A. G. (2012). Organization in the Spinal Cord: The Anatomy and Physiology of Identified Neurones. Springer Science & Business Media. ISBN 978-1-4471-1305-8.[صفحة مطلوبة]
- ^ van den Pol, Anthony N. (15 April 1999). "Hypothalamic Hypocretin (Orexin): Robust Innervation of the Spinal Cord". The Journal of Neuroscience. 19 (8): 3171–3182. doi:10.1523/JNEUROSCI.19-08-03171.1999. PMC 6782271. PMID 10191330.
- ^ Bajo, Victoria M.; Merchán, Miguel A.; Malmierca, Manuel S.; Nodal, Fernando R.; Bjaalie, Jan G. (10 May 1999). "Topographic organization of the dorsal nucleus of the lateral lemniscus in the cat". The Journal of Comparative Neurology. 407 (3): 349–366. doi:10.1002/(SICI)1096-9861(19990510)407:3<349::AID-CNE4>3.0.CO;2-5. PMID 10320216.
- ^ Oliver, Douglas L. (2005). "Neuronal Organization in the Inferior Colliculus". The Inferior Colliculus. pp. 69–114. doi:10.1007/0-387-27083-3_2. ISBN 0-387-22038-0.
- ^ Corneil, Brian D.; Olivier, Etienne; Munoz, Douglas P. (1 October 2002). "Neck Muscle Responses to Stimulation of Monkey Superior Colliculus. I. Topography and Manipulation of Stimulation Parameters". Journal of Neurophysiology. 88 (4): 1980–1999. doi:10.1152/jn.2002.88.4.1980. PMID 12364523.
- ^ May, Paul J. (2006). "The mammalian superior colliculus: Laminar structure and connections". Neuroanatomy of the Oculomotor System. Progress in Brain Research. Vol. 151. pp. 321–378. doi:10.1016/S0079-6123(05)51011-2. ISBN 9780444516961. PMID 16221594.
- ^ Benevento, Louis A.; Standage, Gregg P. (1 July 1983). "The organization of projections of the retinorecipient and nonretinorecipient nuclei of the pretectal complex and layers of the superior colliculus to the lateral pulvinar and medial pulvinar in the macaque monkey". The Journal of Comparative Neurology. 217 (3): 307–336. doi:10.1002/cne.902170307. PMID 6886056. S2CID 44794002.
- ^ Sawamoto, Nobukatsu; Honda, Manabu; Okada, Tomohisa; Hanakawa, Takashi; Kanda, Masutaro; Fukuyama, Hidenao; Konishi, Junji; Shibasaki, Hiroshi (1 October 2000). "Expectation of Pain Enhances Responses to Nonpainful Somatosensory Stimulation in the Anterior Cingulate Cortex and Parietal Operculum/Posterior Insula: an Event-Related Functional Magnetic Resonance Imaging Study". The Journal of Neuroscience. 20 (19): 7438–7445. doi:10.1523/JNEUROSCI.20-19-07438.2000. PMC 6772793. PMID 11007903.
- ^ Menon, Vinod; Uddin, Lucina Q. (29 May 2010). "Saliency, switching, attention and control: a network model of insula function". Brain Structure and Function. 214 (5–6): 655–667. doi:10.1007/s00429-010-0262-0. PMC 2899886. PMID 20512370.
- ^ Shackman, Alexander J.; Salomons, Tim V.; Slagter, Heleen A.; Fox, Andrew S.; Winter, Jameel J.; Davidson, Richard J. (March 2011). "The integration of negative affect, pain and cognitive control in the cingulate cortex". Nature Reviews Neuroscience. 12 (3): 154–167. doi:10.1038/nrn2994. PMC 3044650. PMID 21331082.
- ^ Sneddon, L. U.; Braithwaite, V. A.; Gentle, M. J. (2003). "Do fishes have nociceptors? Evidence for the evolution of a vertebrate sensory system". Proceedings of the Royal Society B. 270 (1520): 1115–1121. doi:10.1098/rspb.2003.2349. PMC 1691351. PMID 12816648.
- ^ Jane A. Smith (1991). "A Question of Pain in Invertebrates". Institute for Laboratory Animals Journal. 33 (1–2).
- ^ Pastor, J.; Soria, B.; Belmonte, C. (1996). "Properties of the nociceptive neurons of the leech segmental ganglion". Journal of Neurophysiology. 75 (6): 2268–2279. doi:10.1152/jn.1996.75.6.2268. PMID 8793740.
- ^ Wittenburg, N.; Baumeister, R. (1999). "Thermal avoidance in Caenorhabditis elegans: an approach to the study of nociception". PNAS. 96 (18): 10477–10482. Bibcode:1999PNAS...9610477W. doi:10.1073/pnas.96.18.10477. PMC 17914. PMID 10468634.
- ^ Illich, P. A.; Walters, E. T. (1997). "Mechanosensory neurons innervating Aplysia siphon encode noxious stimuli and display nociceptive sensitization". Journal of Neuroscience. 17 (1): 459–469. doi:10.1523/JNEUROSCI.17-01-00459.1997. PMC 6793714. PMID 8987770.
- ^ Tracey, W.Daniel; Wilson, Rachel I; Laurent, Gilles; Benzer, Seymour (April 2003). "painless, a Drosophila Gene Essential for Nociception". Cell. 113 (2): 261–273. doi:10.1016/s0092-8674(03)00272-1. PMID 12705873. S2CID 1424315.
- ^ Sherrington, C. (1906). The Integrative Action of the Nervous System. Oxford: Oxford University Press.[صفحة مطلوبة]