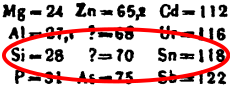جرمانيوم
 | |||||||||||||||
| جرمانيوم | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| المظهر | أبيض مائل للرمادي | ||||||||||||||
| الوزن الذري العياري Ar°(Ge) | |||||||||||||||
| جرمانيوم في الجدول الدوري | |||||||||||||||
| |||||||||||||||
| الرقم الذري (Z) | 32 | ||||||||||||||
| المجموعة | 14 | ||||||||||||||
| الدورة | period 4 | ||||||||||||||
| المستوى الفرعي | p-block | ||||||||||||||
| التوزيع الإلكتروني | [Ar] 3d10 4s2 4p2 | ||||||||||||||
| الإلكترونات بالغلاف | 2, 8, 18, 4 | ||||||||||||||
| الخصائص الطبيعية | |||||||||||||||
| الطور at د.ح.ض.ق | solid | ||||||||||||||
| نقطة الانصهار | 1211.40 K (938.25 °س، 1720.85 °F) | ||||||||||||||
| نقطة الغليان | 3106 K (2833 °س، 5131 °ف) | ||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 5.323 ج/سم³ | ||||||||||||||
| حين يكون سائلاً (عند ن.إ.) | 5.60 ج/سم³ | ||||||||||||||
| حرارة الانصهار | 36.94 kJ/mol | ||||||||||||||
| حرارة التبخر | 334 kJ/mol | ||||||||||||||
| السعة الحرارية المولية | 23.222 J/(mol·K) | ||||||||||||||
ضغط البخار
| |||||||||||||||
| الخصائص الذرية | |||||||||||||||
| الكهرسلبية | مقياس پاولنگ: 2.01 | ||||||||||||||
| طاقات التأين |
| ||||||||||||||
| نصف القطر الذري | empirical: 122 pm | ||||||||||||||
| نصف قطر التكافؤ | 122 pm | ||||||||||||||
| نصف قطر ڤان در ڤالز | 211 pm | ||||||||||||||
| خصائص أخرى | |||||||||||||||
| التواجد الطبيعي | primordial | ||||||||||||||
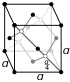
| البنية البلورية | موسطنة الوجه مكعبة ماسية | ||||||||||||||
| سرعة الصوت قضيب رفيع | 5400 م/ث (عند 20 °س) | ||||||||||||||
| قضيب رفيع | 60.2 W/(m·K) | ||||||||||||||
| التمدد الحراري | 6.0 µm/(m⋅K) | ||||||||||||||
| المقاومة الكهربائية | 1 Ω⋅m (at 20 °C) | ||||||||||||||
| فجوة النطاق | 0.67 eV (عند 300 ك) | ||||||||||||||
| الترتيب المغناطيسي | مغناطيسية معاكسة[1] | ||||||||||||||
| القابلية المغناطيسية | −76.84×10−6 cm3/mol[2] | ||||||||||||||
| معامل يونگ | 103 GPa[3] | ||||||||||||||
| معامل القص | 41 GPa[3] | ||||||||||||||
| معاير الحجم | 75 GPa[3] | ||||||||||||||
| نسبة پواسون | 0.26[3] | ||||||||||||||
| صلادة موز | 6.0 | ||||||||||||||
| رقم كاس | 7440-56-4 | ||||||||||||||
| التاريخ | |||||||||||||||
| التسمية | على اسم ألمانيا، موطن المكتشِف | ||||||||||||||
| التوقع | دميتري مندلييڤ (1869) | ||||||||||||||
| الاكتشاف | كلمنس ڤينكلر (1886) | ||||||||||||||
| نظائر الجرمانيوم | |||||||||||||||
| قالب:جدول نظائر جرمانيوم غير موجود | |||||||||||||||
الجرمانيوم ، هو عنصر كيميائي في الجدول الدوري، ورمزه Ge ، ورقمه الذري 32. وهو مادة صلبة ذات لون أبيض مائل للخضرة ومظهر فلزي. والجرمانيوم عنصر نادر، يوجد عادة بكميات صغيرة مخلوطًا مع فلزات أخرى. ويحصل عليه بتنقية النحاس والزنك والحديد.
والجرمانيوم من أَكثر المواد استخدامًا بوصفه شبه موصل. وهو شبه موصل جيد لأنّه لايحتوي على خواص فلزية قوية. ويستخدم الجرمانيوم في صناعة الأَجهزة شبْه الموصلة مثل الصِّمامات الثنائية، وبطاريات الطاقة الشمسية، والترانزستورات. ويستخدم أيضًا في صناعة عدسات مختلف أجهزة الأشعة تحت الحمراء البصرية. وبإضافة كميات من الجرمانيوم إلى البطاريات العاملة بالرصاص ـ الحمض يمكن إطالة عمرها التشغيلي. وأُكسيد الجرمانيوم، أحد مركبات الجرمانيوم، يستخدم في الطب. والعدد الذري للجرمانيوم 32، ووزنه الذري72,61. وينصهر الجرمانيوم عند درجة حرارة 937,4°م، ويغلي عند درجة حرارة 2830°م.
يُستخدم الجرمانيوم مشبه موصل في أجهزة الترانزستور والعديد من الأجهزة الإلكترونية الأخرى. تاريخيًا، كان العقد الأول من إلكترونيات أشباه الموصلات يعتمد بالكامل على الجرمانيوم. في الوقت الحاضر، الاستخدامات النهائية الرئيسية للجرمانيوم هي أنظمة الألياف البصرية، بصريات الأشعة تحت الحمراء، تطبيقات الخلايا الشمسية، والصمامات الثنائية الباعثة للضوء (الليد)
تُستخدم مركبات الجرمانيوم أيضًا في بلمرة المحفزات وقد استخدمت مؤخرًا في إنتاج أسلاك نانوية. يشكل هذا العنصر عددًا كبيرًا من مركبات الجرمانيوم العضوي، مثل رباعي إيثيل الجرمانيوم، وهو مفيد في الكيمياء الفلزية العضوية. يعتبر الجرمانيوم عنصر حرج تكنولوجياً.[4]
لا يُعتقد أن الجرمانيوم عنصر أساسي لأي عضية حية. على غرار السيليكون والألمنيوم، تميل مركبات الجرمانيوم التي تتواجد بشكل طبيعي إلى أن تكون غير قابلة للذوبان في الماء وبالتالي يكون لها القليل من السمية عن طريق الفم. ومع ذلك، فإن أملاح الجرمانيوم الاصطناعية القابلة للذوبان هي سامة كلوياً، ومركبات الجرمانيوم الاصطناعية المتفاعلة كيميائيًا مع الهالوجين والهيدروجين هي سموم ومواد مهيجة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التاريخ
في تقريره عن القانون الدوري للعناصر الكيميائية في 1869، توقع الكيميائي الروسي دميتري مندلييڤ وجود العديد من العناصر الكيميائي غير المعروفة، بما في ذلك عنصر يملأ فجوة في مجموعة الكربون، يقع بين السليكون والقصدير.[5] بسبب موقعه في جدوله الدوري، أسماه مندلييڤ إكا-سيليكون ekasilicon (Es)، وتوقع أن يكون وزنه الذري 70 (لاحقاً 72).في منتصف 1885، في منجم بالقرب من فرايبورگ، ساكسونيا، اِكتـُشِف معدن جديد، سـُمـِّيَ الأرجيروديت بسبب ارتفاع محتواه من الفضة.[note 1]
حلل الكيميائي كلمنز ڤنكلر المعدن الجديد وأثبت أنه جمع من الفضة والكبريت وعنصر جديد، عند عزله من معدن الأرجيروديت. تمكن ڤنكلر من عزل العنصر الجديد عام 1886 ووجده مشابهًا للأنتيمون. اعتبر في البداية أن العنصر الجديد هو إكا-أنتيمون، بدلاً من ذلك سرعان ما اقتنع بأنه كان إكا-سليكون.[7][8] قبل أن ينشر ڤنكلر نتائجه عن العنصر الجديد، قرر أنه سيطلق على عنصره اسم "النپتونيوم"، لأن الاكتشاف الأخير للكوكب نپتون عام 1846 سبقه بالمثل تنبؤات رياضية لوجوده.[note 2] ومع ذلك، فإن اسم "النپتونيوم" قد أُعطي بالفعل لعنصر كيميائي آخر مقترح (على الرغم من أنه ليس العنصر الذي يحمل اليوم اسم النبتونيوم، والذي اكتشف عام 1940).[note 3] بدلاً من ذلك، أطلق ڤنكلر على العنصر الجديد اسم الجرمانيوم (من الكلمة اللاتينية جرمانيا، وتعني ألمانيا، تكريماً لموطنه.[8] تجريبياً ثبت أن الأرجيروديت هو Ag8GeS6.
نظرًا لأن هذا العنصر الجديد أظهر بعض أوجه التشابه مع العناصر الزرنيخ والأنتيمون، فقد كان موضعه الصحيح في الجدول الدوري قيد الدراسة، لكن أوجه التشابه بينه وبين عنصر مندلييڤ المتنبأ به "إكا-سليكون" أكد هذا المكان في الجدول الدوري.[8][15]
مع مواد إضافية من 500 كيلوجرام من الخام من مناجم ساكسونيا، أكد ڤنكلر الخصائص الكيميائية للعنصر الجديد عام 1887.[7][8][16] كما حدد وزنًا ذريًا قدره 72.32 من خلال تحليل رباعي كلوريد الجرمانيوم النقي (GeCl 4)، بينما استنتج لكوك دى بوابودران الوزن الذري 72.3 من خلال مقارنة الخطوط في شرارة الطيفية للعنصر.[17]
تمكن ڤنكلر من تحضير عدة مركبات جديدة من الجرمانيوم، بما في ذلك الفلوريد، الكلوريدات، الكبريتيد، ثاني الأكسيد، وثلاثي إثير الجرمانيوم (Ge(C2H5)4)، أول جرمانيوم عضوي.[7]
البيانات الفيزيائية من تلك المركبات - والتي تتوافق بشكل جيد مع تنبؤات مندليڤ - جعلت الاكتشاف تأكيدًا مهمًا لفكرة مندليڤ عن العنصر الدوري. هنا مقارنة بين التنبؤ وبيانات ڤنكلر:[7]
| الخاصية | إيكاسيليكون توقع مندليڤ (1871) |
جرمانيوم ڤنكلر الاكتشاف (1887) |
|---|---|---|
| الكتلة الذرية | 72.64 | 72.63 |
| الكثافة (ج/سم3) | 5.5 | 5.35 |
| نقطة الانصهار (°س) | مرتفعة | 947 |
| اللون | رمادي | رمادي |
| نوع الأكسيد | ثاني أكسيد مقاوم للحرارة | ثاني أكسيد مقاوم للحرارة |
| كثافة الأكسيد (ج/سم3) | 4.7 | 4.7 |
| نشاط الأكسيد | قاعدي ضعيف | قاعدي ضعيف |
| نقطة غليان الكلوريد (°س) | تحت 100 | 86 (GeCl4) |
| كثافة الكلوريد (ج/سم3) | 1.9 | 1.9 |
حتى أواخر الثلاثينيات، كان يُعتقد أن الجرمانيوم فلز ضعيف التوصيل.[18] لم يصبح الجرمانيوم ذا أهمية اقتصادية إلا بعد عام 1945 عندما تم التعرف على خصائصه كشبه موصل إلكتروني. أثناء الحرب العالمية الثانية، استخدمت كميات صغيرة من الجرمانيوم في بعض الأجهزة الإلكترونية، معظمها صمامات ثنائية.[19][20] كان أول استخدام رئيسي هو صمام شوتكي بنقطة اتصال لاكتشاف نبضات الرادار أثناء الحرب.[18] أنتجت أول سبائك السيليكون-الجرمانيوم عام 1955.[21]
قبل عام 1945، كان ينتج بضع مئات من الكيلوجرامات فقط من الجرمانيوم في المصاهر سنوياً، ولكن بحلول نهاية الخمسينيات، بلغ الإنتاج العالمي السنوي 40 metric tons (44 short tons).[22]
عام 1948 فتح تطوير ترانزستور الجرمانيوم[23] أمام تطبيقات لا حصر لها من إلكترونيات الطور الصلب.[24] من عام 1950 حتى أوائل السبعينيات، وفرت هذه المنطقة سوقًا متزايدًا للجرمانيوم، ولكن بعد ذلك بدأ السيليكون عالي النقاء يحل محل الجرمانيوم في الترانزستورات والثنائيات والمقومات.[25]
على سبيل المثال، عام 1957 تأسست الشركة التي أصبحت معروفة باسم فيرتشايلد لأشباه الموصلات بهدف صريح هو إنتاج ترانزستورات السيليكون. يتمتع السيليكون بخصائص كهربائية فائقة، لكنه يتطلب درجة نقاء أكبر بكثير لا يمكن تحقيقها تجاريًا في السنوات الأولى من إلكترونيات أشباه الموصلات.[26]
في غضون ذلك، زاد الطلب على الجرمانيوم بشكل كبير لأنظمة الألياف البصرية وأنظمة الرؤية الليلية بالأشعة تحت الحمراء والبلمرة المحفزات.[22] تمثل هذه الاستخدامات النهائية 85٪ من استهلاك الجرمانيوم في جميع أنحاء العالم عام 2000.[25] حتى أن حكومة الولايات المتحدة صنفت الجرمانيوم كمادة إستراتيجية وحاسمة، داعية إلى توافر 146 طن قصير (132 طن) في مخزون الدفاع الوطني عام 1987.[22]
يختلف الجرمانيوم عن السيليكون من حيث أن العرض مقيد بتوافر المصادر القابلة للاستغلال، بينما يقتصر توريد السيليكون فقط على الطاقة الإنتاجية لأن السيليكون يأتي من الرمل العادي والكوارتز. بينما كان يمكن شراء السيليكون عام 1998 بأقل من 10 دولار للكيلوجرام،[22] كان سعر الجرمانيوم 800 دولار للكيلو.[22]
الخصائص
تحت الظروف القياسية، الجرمانيوم هو عنصر هش، أبيض فضي، شبه معدني.[27] يشكل هذا الشكل من التآصل المعروف باسم "ألفا-جرمانيوم"، والذي يحتوي على بريق معدني وبنية مكعبة ماسية، مثل الماس.[25] بينما في شكله البلوري، يتمتع الجرمانيوم بعتبة طاقة الإزاحة .[28] عند ضغط أعلى من 120 كيلو بار، يصبح الجرمانيوم بتآصل "بيتا-جرمانيوم" بنفس بنية بيتا-قصدير.[29] مثل السيليكون والجاليوم والبزموت والأنتيمون والماء، الجرمانيوم هو أحد المواد القليلة التي تتمدد في حالتها الصلبة (أي تتجمد) من حالة الانصهار.[29]
الجرمانيوم هو مادة شبه موصلة له فجوة نطاق غير مباشرة، كما هو الحال مع السيليكون البلوري. أدت تقنيات الصهر النطاقي إلى إنتاج الجرمانيوم البلوري لأشباه الموصلات التي تحتوي على شوائب من جزء واحد فقط في 1010،[30] مما يجعله من أنقى المواد التي تم الحصول عليها على الإطلاق.[31]
أول مادة فلزية تم اكتشافها (عام 2005) لتصبح موصل فائق في وجود مجال كهرومغناطيسي قوي للغاية كانت سبيكة من الجرمانيوم واليورانيوم والروديوم.[32]
من المعروف أن الجرمانيوم النقي ينبثق تلقائيًا screw dislocation لفترة طويلة جدًا، ويشار إليها باسم "شعيرات الجرمانيوم". يعد نمو هذه الشعيرات أحد الأسباب الرئيسية لفشل الثنائيات القديمة والترانزستورات المصنوعة من الجرمانيوم، حيث أنها قد تؤدي إلى حدوث قصر كهربائي اعتمادًا على ما تلمسه في النهاية.[33]
الكيمياء
يبدأ عنصر الجرمانيوم في التأكسد ببطء في الهواء عند حوالي 250 درجة مئوية، مكونًا أكسيد الجرمانيوم GeO2.[34] الجرمانيوم غير قابل للذوبان في الأحماض والقلويات المخففة لكنه يذوب ببطء في أحماض النيتريك والكبريتيك المركزة الساخنة ويتفاعل بعنف مع القلويات المنصهرة لإنتاج الجرمانات ([GeO 3]2− ). في معظم الأحيان يتواجد الجرمانيوم في حالة الأكسدة +4 على الرغم من أن هناك الكثير من المركبات المعروفة تتواجد في حالة الأكسدة +2.[35] حالات الأكسدة الأخرى نادرة: حالة الأكسدة +3 توجد في مركبات Ge2Cl6وحالة الأكسدة +3 و+1 موجودة على سطح الأكاسيد،[36] أو حالات الأكسدة السلبية في الجرمانيدات، مثل −4 في Mg 2Ge. أنيونات الجرمانيوم العنقودية (أنيونات زنتل) مثلGe42−، Ge94−, Ge92−، [(Ge9)2]6− تُحضر عن طريق استخلاص السبائك المحتوية على معادن قلوية وجرمانيوم في أمونيا سائلة في وجود ديامين الإيثيلين أو الكريبتاند.[35][37] The حالات أكسدة العنصر في هذه الأيونات ليست أرقاماً صحيحة - على غرار الأوزونيدات O3−.
هناك أكسيدين معروفين للجرمانيوم: ثاني أكسيد الجرمانيوم (GeO 2، الجرمانيا) وأحادي أكسيد الجرمانيوم، (GeO).[29] يمكن الحصول على ثاني الأكسيد، GeO2 بتحميص ثاني كبريتيد الجرمانيوم (GeS 2)، وهو مسحوق أبيض قابل للذوبان بشكل طفيف في الماء لكنه يتفاعل مع القلويات لتكوين الجرمانيت.[29] يمكن الحصول على أول الأكسيد، أكسيد الجرماني، عن طريق تفاعل GeO2 عند درجة حرارة عالية مع فلز الجرمانيوم.[29] ثاني الأكسيد (والأكاسيد والجرمانيت المعلقة به) يُظهر خاصية غير معتادة لامتلاكه معامل انكسار عالي للضوء المرئي، لكنه شفاف لضوء الأشعة تحت الحمراء.[38][39] يستخدم جرانيت البزموت، Bi4Ge3O12، (BGO) كوماض.[40]
المركبات الثنائية مع مركبات الكالكوجين الأخرى معروفة أيضًا، مثل ثنائي الكبريتيد (GeS 2) وثنائي السلنيد (GeSe 2)، وأحادي الكبريتيد (GeS)، أحادي السلنيد (GeSe)، وأحادي التلوريد (GeTe).[35] يتكون GeS2 على شكل راسب أبيض عندما يتم تمرير كبريتيد الهيدروجين من خلال محاليل حمضية قوية تحتوي علىGe(IV).[35] يكون ثاني الكبريتيد قابل للذوبان بشكل ملحوظ في الماء وفي محاليل القلويات الكاوية أو الكبريتيدات القلوية. ومع ذلك، فهو غير قابل للذوبان في الماء الحمضي، مما سمح لڤنكلر باكتشاف العنصر.[41] عن طريق تسخين ثاني الكبريتيد في تيار من الهيدروجين، يتشكل أحادي الكبريتيد (GeS)، والذي يترسب على شكل صفائح رقيقة ذات لون داكن وبريق معدني، وقابل للذوبان في محاليل القلويات الكاوية.[29] عند الصهر باستخدام كربونات قلوية وكبريت، تشكل مركبات الجرمانيوم أملاحًا تعرف باسم ثيوجرمانات-.[42]
هناك أربعة هاليدات رباعية معروفة. تحت الظروف العادية يكونGeI4 صلباً، ويكون GeF4 على شكل غاز وسوائل متطايرة أخرى. على سبيل المثال، رباعي كلوريد الجرمانيوم، GeCl4 يمكن الحصول عليه كسائل دخان عديم اللون يغلي عند 83.1 درجة مئوية عن طريق تسخين الفلز مع الكلور.[29] تتحلل رباعيات الهاليدات جميعها بسهولة إلى ثاني أكسيد الجرمانيوم المائي.[29] يستخدم GeCl4 في إنتاج مركبات الجرمانيوم العضوية.[35] جميع مركبات ثنائي الهاليدات الأربعة معروفة وعلى النقيض من رباعي الهاليدات فهي عبارة عن مواد صلبة بوليمرية.[35] بالإضافة إلى Ge2Cl6 هناك بعض المركبات الأعلى المعروفة، وصيغتها GenCl2n+2.[29] يُحضر مركب Ge6Cl16 الغير اعتيادي الذي يحتوي على Ge5Cl12 وحدة باستخدام بنية النيوپنتان.[43]
الجرمان (GeH4) هو مركب تشبه بنيته الميثان. أما المركبات عديدة الجرمان فهي تشبه في بنيتها الألكانات وصيغتها GenH2n+2 وتحتوي على خمس ذرات جرمانيوم.[35] الجرمانات أقل تقلبًا وأقل تفاعلًا من نظائرها من السيليكون.[35] يتفاعل GeH4 مع الفلزات القلوية في الأمونيا السائلة لتشكيل مادة بلورية بيضاء MGeH3 التي تحتوي على أنيون GeH3−.[35] هيدروليديات الجرمانيوم، التي تحتوي على واحدة أو اثنتان أو ثلاث ذرات هالوجين هي سوائل تفاعلية عديمة اللون.[35]
عام 1887 قام ڤنكلر بتحضير أو مركب جرمانيوم عضوي؛ نتج عن تفاعل رباعي كلوريد الجرمانيوم مع رباعي إيثيل الجرمان yielded ديثيلزينك (Ge(C 2H 5) 4).[7] الجرمانات العضوية من النوع R4Ge (حيث R يرمز إلى الألكيل) مثل رباعي ميثيل الجرمان]] (Ge(CH 3) 4) ثلاثي مثيل الجرمان يمكن تحضيرها من أرخص سلائف الجرمانيوم المتاحة، رباعي كلوريد الجرمانيوم والألكيل المحب للنواة. هيدرات الجرمانيوم العضوية مثل أيزوبوتيل الجرمانيوم ((CH 3) 2CHCH 2GeH 3) وُجد أنها أقل خطورة ويمكن استخدامها كبديل سائل للغازات السامة في تطبيقات أشباه الموصلات. هناك العديد من الوسائط التفاعلية المعروفة للجرمانيوم: الجذور الحرةgermyl ، الجرمانلينات (تشبه الكاربينات)، والجرمينات (تشبه الكارباينات).[44][45] عُرف مركب الجرمانيوم العضوي المعروف باسم 2-carboxyethylgermasesquioxane لأول مرة في السبعينيات، ولوقت ما كان يستخدم كمكمل غذائي وكان يعتقد أن لديه خصائص مضادة للأورام.[46]
استخدام ربيطة آيند (1,1,3,3,5,5,7,7-octaethyl-s-hydrindacen-4-yl) قادر على تكوين رابطة مزدوجة مع الأكسجين (جيرمانون). هيدريد الجرمانيوم ورباعي هيدريد الجرمانيوم قابلين للاشتعال للغاية بل ويمكن انفجارهما عند مزجهما بالهواء.[47]
النظائر
للجرمانيوم خمسة نظائر طبيعية: 72Ge، 70Ge، 74Ge، 73Ge، و76Ge. من بينههذه النظائر، يكون 76Ge مشع قليلًا، يتحلل عن طريق اضمحلال بيتا المزدوج بعمر نصف 1.78×1021 years. 74Ge هو النظير الأكثر شيوعاً، ويبلغ توافره الطبعي حوالي 36%. 76Ge هو النظير الأقل شيوعاً بتوافر طبيعي 7% تقريباً.[48] عند قصفه بجسيمات ألفا، فإن النظير 72Ge سيولد 77Se مستقراً، مطلقاً إلكترونات عالية الطاقة خلال هذه العملية.[49] من أجل هذا، فإنه يستخدم مع الرادون في صنع البطاريات الذرية.[49]
كما تم أيضاً تخليق ما لا يقل عن 27 نظير مشع، تتراوح كتلتها الذرية بين 58 إلى 89. أكثرها استقرارها هو 68Ge، الذي يتحلل باصطياد إلكترون ويبلغ عمره النصفي 270.95 days. أما أقلها استقراراً فهو 60Ge، بعمر نصف 30 ms. بينما تضمحل معظم نظائر الجرمانيوم المشعة عن طريق اضمحلال بيتا، فإن 61Ge و64Ge يضمحلان عن طريق [[انبعاث الپوزيترون انبعاث انبعاث الپوزيترون β+]] يضمحل عن طريق انبعاث الپروتون.[48] 84Ge عن طريق النظير 87Ge يظهر أيضاً β− الذي يضحمل عن طريق انبعاث النيوترون.[48]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التواجد
يتشكل الجرمانيوم بتفاعلات الانصهار النجمي، في الغالب عن طريق العملية إس في نجوم فرعية عملاقة مقاربة. العملية إس هي التقاط نيوترون بطيء لعناصر أخف داخل النجوم العملاقة الحمراء النابضة.[50] تم التحقق من وجود الجرمانيوم في بعض النجوم البعيدة[51] وفي الغلاف الجوي للمشترى.[52]
تبلغ وفرة الجرمانيوم في قشرة الأرض حوالي 1.6 جزء في المليون.[53] هناك عدد قليل من المعادن فقط مثل الأرجيروديت والبريارتيت والجرمانيت والرينيريت والسفاليريت تحتوي على كميات كبيرة من الجرمانيوم.[25][54] القليل منهم فقط (خاصة الجرمانيت)، من النادر للغاية وجودها بكميات قابلة للتعدين.[55][56][57] تحتوي بعض أجسام خام الزنك-النحاس-الرصاص على كمية كافية من الجرمانيوم لتبرير الاستخراج من مركز الخام النهائي.[53] تسبب عملية التخصيب الطبيعي غير العادية بتواجد نسبة عالية من الجرمانيوم في بعض طبقات الفحم، اكتشفها ڤيكتور موريتز گولدشميت خلال مسح واسع لرواسب الجرمانيوم.[58][59] أعلى تركيز عثر عليه كان في رماد الفحم في هارتلي مع ما يصل إلى 1.6٪ من الجرمانيوم.[58][59] تحتوي رواسب الفحم بالقرب من شيلينهاوتى، منغوليا الداخلية على ما يقدر بحوالي 1600 طن من الجرمانيوم.[53]
الجرمانيوم من العناصر الشديدة التبعثر أي لا توجد له مراقد هامة. من فلزاته: الأرجِيروديت k4Ag2S.GeS2 والجرمانيت 7CuS.FeS.GeS2 والرنييريت Renierite (CuFe.Ge.As)xSy والألترابازيت Ultrapasite (Pb.Ag.Ge.Sb)xSy ومن مصادره الهامة أيضاً الغبار المتطاير (الرماد) الناجم عن حرق بعض أنواع الفحم. ويتلخص تحضيره بتفاعل إرجاع ثنائي أكسيد الجرمانيوم GeO2 الناتج عن حلمهة رباعي كلوريد الجرمانيوم GeCl4 بواسطة الهيدروجين أو الكربون.
استعمالاته
للجرمانيوم تطبيقات كثيرة وهامة ناتجة من خواصه التي يتمتع بها، ولاسيما خواص أنصاف النواقل. فقد صُنع الترانزستور أول ما صُنِع من الجرمانيوم ثم استعمل الجرمانيوم في تطبيقات أخرى مثل الحاسوب وأنظمة التحكم في القذائف الموجهة، وفي صنع العدسات والمرشحات filters المستعملة في الأجهزة التي تعمل في مجال الأشعة تحت الحمراء. فالزجاج المحضَّر بوساطة ثنائي أكسيد الجرمانيوم يفوق كثيراً مثيلَه زجاج السيليكون في قرينة انكساره ومقدرة تبديده، ويمكن استعماله في عدسات آلات التصوير والمجاهر ذات الزاوية العريضة.[60]
الانتاج
عام 2011 أُنتج حوالي 118 طن من الجرمانيوم في العالم؛ معظمها في الصين (80 طن)، روسيا (5 طن)، والولايات المتحدة (3 طن).[25] يسترد الجرمانيوم كمنتج ثانوي من خام الزنك سفاليريت حيث يكون متركزاً بكميات تصل إلى 0.3% بحد أقصى،[61] خاصة من الرواسب ذات درجة الحرارة المنخفضة والهائلة، الزنك-الرصاص-النحاس)- الباريوم) ورواسب الزنك-الرصاص التي تحتوي على الكربونات.[62] وجدت دراسة حديثة أن ما لا يقل عن 10.000 طن من الجرمانيوم القابل للاستخراج موجود في احتياطيات الزنك المعروفة، لا سيما تلك المتضمنة في رواسب النوع مسيسيپي-ڤالي، بينما هناك 112.000 طن على الأقل في احتياطيات الفحم.[63][64] عام 2007، تمت تلبية 35٪ من الطلب عن طريق إعادة تدوير الجرمانيوم.[53]
| السنة | التكلفة ($/كج)[65] |
|---|---|
| 1999 | 1.400 |
| 2000 | 1.250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1.240 |
| 2008 | 1.490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1.625 |
| 2012 | 1.680 |
| 2013 | 1.875 |
| 2014 | 1.900 |
| 2015 | 1.760 |
| 2016 | 950 |
| 2017 | 1.358 |
| 2018 | 1.300 |
| 2019 | 1.240 |
| 2020 | 1.000 |
بينما ينتج بشكل أساسي من السفاليريت، فإنه يوجد أيضًا في خامات الفضة والرصاص والنحاس. مصدر آخر للجرمانيوم هو الرماد المتطاير من محطات الطاقة التي تعمل بالوقود من رواسب الفحم التي تحتوي على الجرمانيوم. استخدمت روسيا والصين هذا كمصدر للجرمانيوم.[66] توجد رواسب روسيا في أقصى شرق جزيرة سخالين، وشمال شرق ڤلاديڤوستوك. توجد الرواسب في الصين بشكل رئيسي في مناجم الليجنيت بالقرب من لينكانگ، يوننان؛ يستخرج الفحم أيضًا بالقرب من شيلينهاوتى، منغوليا الداخلية.[53]
تكون مركزات الخام في الغالب كبريتيدية؛ يتم تحويلها إلى أكسيد بالتسخين تحت الهواء في عملية تعرف بالتحميص:
- GeS2 + 3 O2 → GeO2 + 2 SO2
يترك بعض الجرمانيوم في الغبار الناتج، بينما يُحول الباقي إلى جرمانيتات، والتي يتم بعد ذلك ترشيحها (مع الزنك) من الجمرة بواسطة حمض الكبريتيك. بعد التعادل، يبقى الزنك فقط في المحلول بينما يترسب الجرمانيوم والمعادن الأخرى. بعد إزالة بعض الزنك في الراسب بواسطة عملية وايلز، يرشح أكسيد وايلز مرة ثانية. يحصل على ثاني أكسيد الجرمانيوم على شكل راسب وتحويله باستخدام غاز الكلور أو حمض الهيدروكلوريك إلى رباعي كلوريد الجرمانيوم، والذي تكون نقطة غليانه منخفضة ويمكن عزله عن طريق التقطير:[66]
- GeO2 + 4 HCl → GeCl4 + 2 H2O
- GeO2 + 2 Cl2 → GeCl4 + O2
يتحمل رابع كلوريد الجرمانيوم إلى أكسيد (GeO2) أو ينقى بالتقطير التجزيئي ثم يحلل بالماء.[66] GeO2 عالي النقاء مناسب الآن لإنتاج زجاج الجرمانيوم. يُختزل إلى العنصر عن طريق تفاعله مع الهيدروجين، وإنتاج الجرمانيوم المناسب لبصريات الأشعة تحت الحمراء وإنتاج أشباه الموصلات:
- GeO2 + 2 H2 → Ge + 2 H2O
عادةً ما يختزل الجرمانيوم المستخدم في إنتاج الصلب والعمليات الصناعية الأخرى باستخدام الكربون:[67]
- GeO2 + C → Ge + CO2
الصين
تعد الصين منتجاً رئيسياً لعشرين مادة خام أساسية بما في ذلك الجاليوم والجرمانيوم وما يعرف باسم معادن الأرض النادرة المستخدمة في الكثير من الصناعات الحيوية بدءاً من الإلكترونيات وحتى مركبات الفضاء.[68]
وتمتلك الصين حوالي 36% فقط من احتياطيات عناصر الأرض النادرة المعروفة في العالم، ولكن من خلال استراتيجية مدروسة ومنهجية، تسيطر بكين الآن على أكثر من 70% من قدرة الاستخراج في العالم، والأهم من ذلك أن الصين تسيطر على ما يقرب من 90% من قدرة معالجة هذه العناصر في العالم.
في 3 يوليو 2023، أعلنت وزارة التجارة والإدارة العامة للجمارك في الصين، إن الحكومة ستفرض قيودا على صادرات معدني الجاليوم والجرمانيوم المستخدمين في صناعة الرقائق الإلكترونية اعتباراً من أول أغسطس المقبل بدعوى حماية الأمن القومي والمصالح القومية للصين.[69]
وتثير القيود التي تفرضها الصين على تصدير هذه المعادن استياء الدول الغربية التي بدأت في السنوات الأخيرة التحرك لتقليل الاعتماد على استيراد المعادن الصينية.[70]
وقد أدى تحرك الصين لتقييد صادرات بعض المعادن شائعة الاستخدام في إنتاج أشباه الموصلات والسيارات الكهربائية والصناعات المتقدمة تقنياً إلى تصعيد الحرب التجارية مع الولايات المتحدة وقد تتسبب في تفاقم الاضطرابات في سلاسل التوريد العالمية.
وتسارع الشركات للرد على الأخبار المفاجئة. وقالت شركة أميركية منتجة لرقائق أشباه الموصلات، إنها تقدمت بطلب للحصول على تصاريح تصدير لطمأنة المستثمرين. وقال منتج للجرمانيوم في الصين، إن الاستفسارات من الخارج والأسعار ارتفعت بين عشية وضحاها.
وقالت وزارة التجارة الصينية إنها ستسيطر اعتباراً من أول أغسطس على صادرات 8 منتجات من الجاليوم و6 منتجات من الجرمانيوم لحماية أمنها القومي ومصالحها، في خطوة اعتبرها المحللون رداً على جهود واشنطن المتصاعدة للحد من التقدم التكنولوجي للصين.
وقال رئيس اتحاد الصين العالمي للتعدين، بيتر آركيل: "ضربت الصين قيود التجارة الأميركية في موضع مؤلم". وأضاف: "الجاليوم والجرمانيوم مجرد نوعين من المعادن الثانوية لكن المهمة جداً لطائفة من منتجات التكنولوجيا، والصين هي المنتج المهيمن لمعظم هذه المعادن. والاقتراح بأن دولة أخرى قد تحل محل الصين في المدى القصير أو حتى على المدى المتوسط ضرب من الخيال".
وتأتي القيود التي تفرضها الصين في الوقت الذي تدرس فيه واشنطن فرض قيود جديدة على تصدير الرقائق الدقيقة المتقدمة تقنياً إلى الصين، بعد سلسلة من القيود في السنوات القليلة الماضية. ومن المتوقع أيضاً أن تفرض الولايات المتحدة وهولندا قيوداً أخرى على بيع معدات إنتاج الرقائق لشركات تصنيع الرقائق الصينية هذا الصيف ضمن جهود تهدف إلى منع استخدام الجيش الصيني لتقنيتهما. وكان أخر رد من بكين على الضغط الأميركي على الرقائق في مايو حين منعت بعض القطاعات المحلية من شراء منتجات من شركة ميكرون الأمريكية لتصنيع رقائق الذاكرة.
التطبيقات
قُدرت الاستخدامات النهائية الرئيسية للجرمانيوم عام 2007، في جميع أنحاء العالم، بما يلي: 35٪ في صناعة الألياف البصرية، 30٪ بصريات الأشعة تحت الحمراء، 15٪ محفزات البلمرة، و15٪ في الإلكترونيات والتطبيقات الكهربائية الشمسية.[25] أما نسبة 5% المتبقية فتذهب لاستخدامات مثل الفسفورات، وتصنيع المعادن، والعلاج الكيميائي.[25]
البصريات
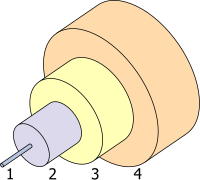
- Core 8 µm
- Cladding 125 µm
- Buffer 250 µm
- Jacket 400 µm
من أبرز خصائص الجرمانيا (GeO2) هو ارتفاع معامل الانكسار وانخفاض التشتت البصري. هذا يجعله مفيداً بشكل خاص في صناعة عدسات الكاميرات عريضة الزاوية والفحص المجهري والجزء الأساسي من الألياف البضرية.[71][72] لقد حل محل التيتانيا كعامل إشابة لألياف السيليكا، مما يلغي المعالجة الحرارية اللاحقة التي تجعل الألياف هشة.[73] في نهاية عام 2002 ، استهلكت صناعة الألياف الضوئية 60٪ من استخدام الجرمانيوم السنوي في الولايات المتحدة، وكن هذا أقل من 10٪ من الاستهلاك العالمي.[72] GeSbTe هي مادة متغيرة الطور تستخدم لخصائصها البصرية، مثل تلك التي تستخدم في أقراص الدي ڤي دي القابلة للتسجيل.[74]
نظرًا لأن الجرمانيوم شفاف في الأطوال الموجية للأشعة تحت الحمراء، فهو مادة أشعة تحت حمراء بصرية هامة يمكن قطعها وصقلها بسهولة إلى عدسات ونوافذ. يستخدم بشكل خاص كجهاز بصري أمامي في كاميرات التصوير الحراري التي تعمل في نطاق 8 إلى 14 ميكرون للتصوير الحراري السلبي ولاكتشاف النقاط الساخنة في الأنشطة العسكرية، والرؤية الليلية المتحركة، وتطبيقات مكافحة الحرائق.[67] كما يستخدم في مطياف الأشعة تحت الحمراء وغيرها من المعدات البصرية التي تتطلب كاشفات أشعة تحت حمراء حساسة للغاية.[72] وهو يتمتع بمعامل انكسار مرتفع للغاية (4.0) ويجب طلاءه بمواد مقاومة للانكسار. على وجه الخصوص، يعد الطلاء الخاص المقاوم للانكسار شديد الصلابة من الكربون الشبيه بالماس (DLC)، بمعامل الانكسار 2.0، يحدث تطابقًا جيدًا وينتج سطحًا صلبًا يمكن أن يتحمل الكثير من الإضرار بالبيئة.[75][76]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الإلكترونيات
يمكن خلط الجرمانيوم مع السيليكون، وسرعان ما أصبحت سبائك السليكون-جرمانيوم مادة شبه موصلة هامة للدوائر المتكاملة عالية السرعة. يمكن للدوائر التي تستخدم خصائص الوصلة غير المتجانسة للسليكون-جرمانيوم أن تكون أسرع بكثير من تلك التي تستخدم السيليكون وحده.[77] رقائق السليكون-جرمانيوم، بخصائصها عالية السرعة، يمكن صنعها بتكلفة منخفضة وتقنيات إنتاج راسخة في صناعة [[رقائق السليكون.[25]
تعد الكفاءة العالية للألواح الشمسية من الاستخدامات الرئيسية للجرمانيوم. نظرًا لأن الجرمانيوم وزرنيخيد الگاليوم متطابقان تقريبًا في ثابت الشبكة البلورية، يمكن استخدام ركائز الجرمانيوم لصنع خلايا زرنيخيد الگاليوم الشمسية.[78] الجرمانيوم هو ركيزة رقائق الخلايا الكهروضوئية متعددة الوصلات للتطبيقات الفضائية، مثل جوال استكشاف المريخ، والذي يستخدم زرنيخيد الگاليوم ثلاثي الوصلات على خلايا الجرمانيوم.[79] تعد مصابيح الليد عالية السطوع، المستخدمة في المصابيح الأمامية للسيارات ولشاشات الإل سي دي ذات الإضاءة الخلفية، من التطبيقات الهامة أيضًا.[25]
يُنظر إلى ركائز الجرمانيوم-على-عازل (GeOI) كبديل محتمل للسيليكون على رقائق مصغرة.[25] أفيد مؤخرًا عن دارة CMOS القائمة على ركائز GeOI.[80] تشمل الاستخدامات الأخرى في الإلكترونيات الفوسفور في المصابيح الفلورية[30] والصمامات الثنائية الباعثة للضوء في الحالة الصلبة (LEDs).[25] لا تزال ترانزستورات الجرمانيوم مستخدمة في بعض دواسات المؤثرات من قبل الموسيقيين الذين يرغبون في إعادة إنتاج الطابع النغمي المميز "للنغمات السريعة من بدايات عصر موسيقى الروك أند رول.[81]
تمت دراسة الجرمانيوم كمادة محتملة لأجهزة الاستشعار الإلكترونية الحيوية القابلة للزرع والتي يعاد امتصاصها في الجسم دون توليد غاز الهيدروجين الضار، لتحل محل تطبيقات أكسيد الزنك - وأكسيد الزنك الإنديوم.[82]
استخدامات أخرى

يستخدم ثاني أكسيد الجرمانيوم أيضًا في المحفزات من أجل البلمرة في إنتاج الپولي إيثيلين تيرفثالات (PET).[83] اللمعان العالي لهذا البوليستر مفضل بشكل خاص لصنع زجاجات PET التي تسوق في اليابان.[83]
في الولايات المتحدة، لا يستخدم الجرمانيوم في محفزات البلمرة.[25] بسبب التشابه بين السيليكا (SiO2) وثاني أكسيد الجرمانيوم (GeO2)، يمكن استبدال السيليكا في طورها الثابت في بعض أعمدة كروماتو=رافيا الغاز بثاني أكسيد الجرمانيوم.[84]
في السنوات الأخيرة، شهد الجرمانيوم استخدامًا متزايدًا في سبائك المعادن النفيسة. في سبائك الفضة الإسترلينية، على سبيل المثال، يقلل الجرمانيوم من مقياس النيران، ويزيد من مقاومة التشوه، ويحسن تصلب الترسيب. السبيكة الفضية المقاومة للتلطخ المسجلة كعلامة تجارية باسم الأرجنتينيوم تحتوي على 1.2٪ من الجرمانيوم.[25]
كاشفات أشباه الموصلات المصنوعة من الجرمانيوم أحادي البلورة عالية النقاء يمكنها تحديد مصادر الإشعاع بدقة - على سبيل المثال في أمن المطارات.[85] الجرمانيوم مفيد لخط الشعاع أحادي اللون في البلورات الأحادية من أجل تشتت النيوترون والأشعة السينية السنكروترونية. للانعكاسية مزايا مقارنة بالسيليكون في تطبيقات النيوترونات والأشعة السينية عالية الطاقة.[86]
تُستخدم بلورات الجرمانيوم عالية النقاء في أجهزة الكشف عن التحليل الطيفي لجاما والبحث عن المادة المظلمة.[87] تستخدم بلورات الجرمانيوم أيضًا في مطياف الأشعة السينية لتقدير الفوسفور والكلور والكبريت.[88]
يظهر الجرمانيوم كمواد هامة لتطبيقات الإلكترونيات الدورانية والتطبيقات القائمة على دوران الحوسبة الكمومية. عام 2010، استعرض الباحثون النقل الدوراني في درجة حرارة الغرفة[89] وفي الآونة الأخيرة، تبين أن دوران الإلكترون المانح في الجرمانيوم له أزمنة اتساق طويلة للغاية.[90]
الجرمانيوم والصحة
لا يعتبر الجرمانيوم ضروريًا لصحة النباتات أو الحيوانات.[91] للجرمانيوم في البيئة تأثير ضئيل أو معدوم على الصحة. ويرجع هذا في المقام الأول لأنه يتواجد عادة فقط كعنصر ضئيل في الخامات والمواد الكربونية، ويدخل ضمن التطبيقات الصناعية والإلكترونية المختلفة بكميات صغيرة جدًا من غير المحتمل أن يتم تناولها.[25] لأسباب مماثلة، فإن استخدام الجرمانيوم له تأثير ضئيل على البيئة باعتباره خطراً بيولوجياً. بعض المركبات الوسيطة التفاعلية من الجرمانيوم تكون سامة (انظر الاحتياطات أدناه).[92]
تم تسويق مكملات الجرمانيوم المصنوعة من الجرمانيوم العضوي وغير العضوي كمنتجات للطب البديل قادرة على علاج سرطان الدم والرئة.[22] ومع ذلك، لا توجد الأدلة الطبية على فوائدها العلاجية؛ وتشير بعض الأدلة إلى أن هذه المكملات ضارة للغاية.[91] خلصت أبحاث إدارة الغذاء والدواء الأمريكية إلى أن الجرمانيوم غير العضوي، عند استخدامه كمكمل غذائي، "يمثل مخاطر صحية بشرية محتملة".[46]
وُصفت بعض مركبات الجرمانيوم من قبل ممارسين طبيين بديلين كحلول قابلة للحقن غير مسموح بها من قِبل إدارة الأغذية والدواء. تسببت الأشكال غير العضوية القابلة للذوبان من الجرمانيوم المستخدمة في البداية، ولا سيما ملح سترات اللاكتات، في بعض حالات الخلل الوظيفي الكلوي، التنكس الدهني الكبدي، والاعتلال العصبي لدى الأفراد الذين يستخدمونها على المدى الطويل. كانت تركيزات الجرمانيوم في البلازما والبول لدى هؤلاء الأفراد، الذين توفي العديد منهم، أكبر بعدة مرات من المستويات الذاتية. الشكل العضوي الأحدث، بيتا كربوكسي إيثيل جرمانيوم سيسكوكسيد (پروپاجرميوم، لم يُظهر نفس طيف التأثيرات السامة.[93]
بعض مركبات الجرمانيوم منخفضة السمية بالنسبة الثدييات، لكن لها تأثيرات سامة ضد بعض أنواع البكتيريا.[27]
احتياطات لمركبات الجرمانيوم المتفاعلة كيميائياً
في حين أن استخدام الجرمانيوم نفسه لا يتطلب احتياطات، فإن بعض مركبات الجرمانيوم المنتجة صناعياً تكون تفاعلية تمامًا وتشكل خطرًا مباشرًا على صحة الإنسان عند التعرض. على سبيل المثال، كلوريد الجرمانيوم (سائل) والجرمان (GeH4، غاز)، يمكن أن يسببا تهيجاً قوياً للعينين والجلد والرئتين والحلق.[94]
انظر أيضاً
الهوامش
المصادر
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ^ أ ب ت ث "Properties of Germanium". Ioffe Institute.
- ^ Avarmaa, Katri; Klemettinen, Lassi; O’Brien, Hugh; Taskinen, Pekka; Jokilaakso, Ari (June 2019). "Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements". Minerals (in الإنجليزية). 9 (6): 367. Bibcode:2019Mine....9..367A. doi:10.3390/min9060367.
- ^ Kaji, Masanori (2002). "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF). Bulletin for the History of Chemistry. 27 (1): 4–16. Archived from the original (PDF) on 2008-12-17. Retrieved 2008-08-20.
- ^ Argyrodite – Ag 8GeS 6. Mineral Data Publishing. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://www.handbookofmineralogy.org/pdfs/argyrodite.pdf. Retrieved on 2008-09-01. - ^ أ ب ت ث ج Winkler, Clemens (1887). "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Chemie (in الألمانية). 36 (1): 177–209. doi:10.1002/prac.18870360119. Archived from the original on 2012-11-03. Retrieved 2008-08-20.
- ^ أ ب ت ث Winkler, Clemens (1887). "Germanium, Ge, a New Nonmetal Element". Berichte der Deutschen Chemischen Gesellschaft (in الألمانية). 19 (1): 210–211. doi:10.1002/cber.18860190156. Archived from the original on December 7, 2008.
- ^ Adams, J. C. (November 13, 1846). "Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet". Monthly Notices of the Royal Astronomical Society. 7 (9): 149–152. Bibcode:1846MNRAS...7..149A. doi:10.1093/mnras/7.9.149. Archived (PDF) from the original on May 2, 2019. Retrieved August 25, 2019.
- ^ Challis, Rev. J. (November 13, 1846). "Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus". Monthly Notices of the Royal Astronomical Society. 7 (9): 145–149. Bibcode:1846MNRAS...7..145C. doi:10.1093/mnras/7.9.145. Archived (PDF) from the original on May 4, 2019. Retrieved August 25, 2019.
- ^ Sears, Robert (July 1877). Scientific Miscellany. Vol. 24. p. 131. ISBN 978-0-665-50166-1. OCLC 16890343.
{{cite book}}:|journal=ignored (help) - ^ "Editor's Scientific Record". Harper's New Monthly Magazine. 55 (325): 152–153. June 1877. Archived from the original on 2012-05-26. Retrieved 2008-09-22.
- ^ van der Krogt, Peter. "Elementymology & Elements Multidict: Niobium". Archived from the original on 2010-01-23. Retrieved 2008-08-20.
- ^ Westgren, A. (1964). "The Nobel Prize in Chemistry 1951: presentation speech". Nobel Lectures, Chemistry 1942–1962. Elsevier. Archived from the original on 2008-12-10. Retrieved 2008-09-18.
- ^ "Germanium, a New Non-Metallic Element". The Manufacturer and Builder: 181. 1887. Archived from the original on 2008-12-19. Retrieved 2008-08-20.
- ^ Brunck, O. (1886). "Obituary: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (in الألمانية). 39 (4): 4491–4548. doi:10.1002/cber.190603904164. Archived from the original on 2020-08-01. Retrieved 2020-06-07.
- ^ de Boisbaudran, M. Lecoq (1886). "Sur le poids atomique du germanium". Comptes Rendus (in الفرنسية). 103: 452. Archived from the original on 2013-06-20. Retrieved 2008-08-20.
- ^ أ ب Haller, E. E. (2006-06-14). "Germanium: From Its Discovery to SiGe Devices" (PDF). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley. Archived (PDF) from the original on 2019-07-10. Retrieved 2008-08-22.
- ^ W. K. (1953-05-10). "Germanium for Electronic Devices". The New York Times. Archived from the original on 2013-06-13. Retrieved 2008-08-22.
- ^ "1941 – Semiconductor diode rectifiers serve in WW II". Computer History Museum. Archived from the original on 2008-09-24. Retrieved 2008-08-22.
- ^ "SiGe History". University of Cambridge. Archived from the original on 2008-08-05. Retrieved 2008-08-22.
- ^ أ ب ت ث ج ح Halford, Bethany (2003). "Germanium". Chemical & Engineering News. American Chemical Society. Archived from the original on 2008-05-13. Retrieved 2008-08-22.
- ^ Bardeen, J.; Brattain, W. H. (1948). "The Transistor, A Semi-Conductor Triode". Physical Review. 74 (2): 230–231. Bibcode:1948PhRv...74..230B. doi:10.1103/PhysRev.74.230.
- ^ "Electronics History 4 – Transistors". National Academy of Engineering. Archived from the original on 2007-10-20. Retrieved 2008-08-22.
- ^ أ ب ت ث ج ح خ د ذ ر ز س ش ص U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ^ Teal, Gordon K. (July 1976). "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit". IEEE Transactions on Electron Devices. ED-23 (7): 621–639. Bibcode:1976ITED...23..621T. doi:10.1109/T-ED.1976.18464. S2CID 11910543.
- ^ أ ب Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 506–510. ISBN 978-0-19-850341-5.
- ^ Agnese, R.; Aralis, T.; Aramaki, T.; Arnquist, I. J.; Azadbakht, E.; Baker, W.; Banik, S.; Barker, D.; Bauer, D. A. (2018-08-27). "Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors". Applied Physics Letters. 113 (9): 092101. arXiv:1805.09942. Bibcode:2018ApPhL.113i2101A. doi:10.1063/1.5041457. ISSN 0003-6951. S2CID 118627298.
- ^ أ ب ت ث ج ح خ د ذ Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd ed.). de Gruyter. ISBN 978-3-11-017770-1. OCLC 145623740.
- ^ أ ب "Germanium". Los Alamos National Laboratory. Archived from the original on 2011-06-22. Retrieved 2008-08-28.
- ^ Chardin, B. (2001). "Dark Matter: Direct Detection". In Binetruy, B (ed.). The Primordial Universe: 28 June – 23 July 1999. Springer. p. 308. ISBN 978-3-540-41046-1.
- ^ Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, A. (August 2005). "Magnetic field-induced superconductivity in the ferromagnet URhGe". Science. 309 (5739): 1343–1346. Bibcode:2005Sci...309.1343L. doi:10.1126/science.1115498. PMID 16123293. S2CID 38460998.
- ^ Givargizov, E. I. (1972). "Morphology of Germanium Whiskers". Kristall und Technik. 7 (1–3): 37–41. doi:10.1002/crat.19720070107.
- ^ Tabet, N; Salim, Mushtaq A. (1998). "KRXPS study of the oxidation of Ge(001) surface". Applied Surface Science. 134 (1–4): 275–282. Bibcode:1998ApSS..134..275T. doi:10.1016/S0169-4332(98)00251-7.
- ^ أ ب ت ث ج ح خ د ذ ر Greenwood, N. N. (1997). Chemistry of the Elements (2nd Edition ed.). Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
{{cite book}}:|edition=has extra text (help); Unknown parameter|coauthors=ignored (|author=suggested) (help) - ^ Tabet, N; Salim, M. A.; Al-Oteibi, A. L. (1999). "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates". Journal of Electron Spectroscopy and Related Phenomena. 101–103: 233–238. doi:10.1016/S0368-2048(98)00451-4.
- ^ Xu, Li; Sevov, Slavi C. (1999). "Oxidative Coupling of Deltahedral [Ge9]4− Zintl Ions". J. Am. Chem. Soc. 121 (39): 9245–9246. doi:10.1021/ja992269s.
- ^ Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. (2002). "Infrared Transparent Germanate Glass-Ceramics". Journal of the American Ceramic Society. 85 (12): 3114–3116. doi:10.1111/j.1151-2916.2002.tb00594.x.
- ^ Drugoveiko, O. P.; Evstrop'ev, K. K.; Kondrat'eva, B. S.; Petrov, Yu. A.; Shevyakov, A. M. (1975). "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products". Journal of Applied Spectroscopy. 22 (2): 191–193. Bibcode:1975JApSp..22..191D. doi:10.1007/BF00614256. S2CID 97581394.
- ^ Lightstone, A. W.; McIntyre, R. J.; Lecomte, R.; Schmitt, D. (1986). "A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography". IEEE Transactions on Nuclear Science. 33 (1): 456–459. Bibcode:1986ITNS...33..456L. doi:10.1109/TNS.1986.4337142. S2CID 682173.
- ^ Johnson, Otto H. (1952). "Germanium and its Inorganic Compounds". Chem. Rev. 51 (3): 431–469. doi:10.1021/cr60160a002.
- ^ Fröba, Michael; Oberender, Nadine (1997). "First synthesis of mesostructured thiogermanates". Chemical Communications (18): 1729–1730. doi:10.1039/a703634e.
- ^ Beattie, I.R.; Jones, P.J.; Reid, G.; Webster, M. (1998). "The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6". Inorg. Chem. 37 (23): 6032–6034. doi:10.1021/ic9807341. PMID 11670739.
- ^ Satge, Jacques (1984). "Reactive intermediates in organogermanium chemistry". Pure Appl. Chem. 56 (1): 137–150. doi:10.1351/pac198456010137. S2CID 96576323.
- ^ Quane, Denis; Bottei, Rudolph S. (1963). "Organogermanium Chemistry". Chemical Reviews. 63 (4): 403–442. doi:10.1021/cr60224a004.
- ^ أ ب Tao, S. H.; Bolger, P. M. (June 1997). "Hazard Assessment of Germanium Supplements". Regulatory Toxicology and Pharmacology. 25 (3): 211–219. doi:10.1006/rtph.1997.1098. PMID 9237323. Archived from the original on 2020-03-10. Retrieved 2019-06-30.
- ^ Broadwith, Phillip (25 March 2012). "Germanium-oxygen double bond takes centre stage". Chemistry World. Archived from the original on 2014-05-17. Retrieved 2014-05-15.
- ^ أ ب ت Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A 729: 3–128, doi:, Bibcode: 2003NuPhA.729....3A, https://hal.archives-ouvertes.fr/in2p3-00020241/document
- ^ أ ب Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010. PDF copy at the Wayback Machine (archived أكتوبر 12, 2007)
- ^ Sterling, N. C.; Dinerstein, Harriet L.; Bowers, Charles W. (2002). "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters. 578 (1): L55–L58. arXiv:astro-ph/0208516. Bibcode:2002ApJ...578L..55S. doi:10.1086/344473. S2CID 119395123.
- ^ Cowan, John (2003-05-01). "Astronomy: Elements of surprise". Nature. 423 (29): 29. Bibcode:2003Natur.423...29C. doi:10.1038/423029a. PMID 12721614. S2CID 4330398.
- ^ Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. (1982). "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio". Astrophysical Journal. 263: 443–467. Bibcode:1982ApJ...263..443K. doi:10.1086/160516.
- ^ أ ب ت ث ج Höll, R.; Kling, M.; Schroll, E. (2007). "Metallogenesis of germanium – A review". Ore Geology Reviews. 30 (3–4): 145–180. doi:10.1016/j.oregeorev.2005.07.034.
- ^ Frenzel, Max (2016). "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)". ResearchGate. Unpublished. doi:10.13140/rg.2.2.20956.18564. Archived from the original on 2018-10-06. Retrieved 2017-06-10.
- ^ Roberts, Andrew C.; et al. (December 2004). "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia". The Canadian Mineralogist. 42 (6): 1771–1776. doi:10.2113/gscanmin.42.6.1771.
- ^ "Archived copy" (PDF). Archived (PDF) from the original on 2018-10-06. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ "Archived copy" (PDF). Archived (PDF) from the original on 2020-03-20. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ^ أ ب Goldschmidt, V. M. (1930). "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2018-03-03. Retrieved 2008-08-25.
- ^ أ ب Goldschmidt, V. M.; Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2008-12-01. Retrieved 2008-08-25.
- ^ محمد علي المنجد. "الجرمانيوم". الموسوعة العربية.
- ^ Bernstein, L (1985). "Germanium geochemistry and mineralogy". Geochimica et Cosmochimica Acta. 49 (11): 2409–2422. Bibcode:1985GeCoA..49.2409B. doi:10.1016/0016-7037(85)90241-8.
- ^ Frenzel, Max; Hirsch, Tamino; Gutzmer, Jens (July 2016). "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis". Ore Geology Reviews. 76: 52–78. doi:10.1016/j.oregeorev.2015.12.017.
- ^ Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (2013-12-29). "On the geological availability of germanium". Mineralium Deposita. 49 (4): 471–486. Bibcode:2014MinDe..49..471F. doi:10.1007/s00126-013-0506-z. ISSN 0026-4598. S2CID 129902592.
- ^ Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (2014-01-19). "Erratum to: On the geological availability of germanium". Mineralium Deposita. 49 (4): 487. Bibcode:2014MinDe..49..487F. doi:10.1007/s00126-014-0509-4. ISSN 0026-4598. S2CID 140620827.
- ^ R.N. Soar (1977). USGS Minerals Information. January 2003, January 2004, January 2005, January 2006, January 2007, January 2010. ISBN 978-0-85934-039-7. OCLC 16437701. Archived from the original on 2013-05-07. Retrieved 2013-04-22.
{{cite book}}:|journal=ignored (help) - ^ أ ب ت Naumov, A. V. (2007). "World market of germanium and its prospects". Russian Journal of Non-Ferrous Metals. 48 (4): 265–272. doi:10.3103/S1067821207040049. S2CID 137187498.
- ^ أ ب Moskalyk, R. R. (2004). "Review of germanium processing worldwide". Minerals Engineering. 17 (3): 393–402. doi:10.1016/j.mineng.2003.11.014.
- ^ شروق نيوز (2023-07-03). "الصين تفرض قيودا على صادرات المعادن المستخدمة في صناعة الرقائق". جريدة الشروق المصرية.
- ^ بكين/شنغهاي – رويترز (2023-07-04). "الصين تضرب القيود الأميركية وتمنع تصدير أهم مواد تصنيع الرقائق". العربية نت.
- ^ الحرة / وكالات - واشنطن (2023-07-04). "تحرك صيني لتقليص صادرات مواد تصنيع الرقائق يفاقم مخاوف الإمدادات". الحرة.
- ^ Rieke, G. H. (2007). "Infrared Detector Arrays for Astronomy". Annual Review of Astronomy and Astrophysics. 45 (1): 77–115. Bibcode:2007ARA&A..45...77R. doi:10.1146/annurev.astro.44.051905.092436. S2CID 26285029.
- ^ أ ب ت Brown, Robert D. Jr. (2000). "Germanium" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2011-06-08. Retrieved 2008-09-22.
- ^ "Chapter III: Optical Fiber For Communications" (PDF). Stanford Research Institute. Archived (PDF) from the original on 2014-12-05. Retrieved 2008-08-22.
- ^ "Understanding Recordable & Rewritable DVD" (PDF) (First ed.). Optical Storage Technology Association (OSTA). Archived from the original (PDF) on 2009-04-19. Retrieved 2008-09-22.
- ^ Lettington, Alan H. (1998). "Applications of diamond-like carbon thin films". Carbon. 36 (5–6): 555–560. doi:10.1016/S0008-6223(98)00062-1.
- ^ Gardos, Michael N.; Bonnie L. Soriano; Steven H. Propst (1990). Feldman, Albert; Holly, Sandor (eds.). "Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium". Proc. SPIE. SPIE Proceedings. 1325 (Mechanical Properties): 99. Bibcode:1990SPIE.1325...99G. doi:10.1117/12.22449. S2CID 137425193.
- ^ Washio, K. (2003). "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems". IEEE Transactions on Electron Devices. 50 (3): 656–668. Bibcode:2003ITED...50..656W. doi:10.1109/TED.2003.810484.
- ^ Bailey, Sheila G.; Raffaelle, Ryne; Emery, Keith (2002). "Space and terrestrial photovoltaics: synergy and diversity". Progress in Photovoltaics: Research and Applications. 10 (6): 399–406. Bibcode:2002sprt.conf..202B. doi:10.1002/pip.446. hdl:2060/20030000611. S2CID 98370426.
- ^ Crisp, D.; Pathare, A.; Ewell, R. C. (January 2004). "The performance of gallium arsenide/germanium solar cells at the Martian surface". Acta Astronautica. 54 (2): 83–101. Bibcode:2004AcAau..54...83C. doi:10.1016/S0094-5765(02)00287-4.
- ^ Wu, Heng; Ye, Peide D. (August 2016). "Fully Depleted Ge CMOS Devices and Logic Circuits on Si" (PDF). IEEE Transactions on Electron Devices. 63 (8): 3028–3035. Bibcode:2016ITED...63.3028W. doi:10.1109/TED.2016.2581203. S2CID 3231511. Archived (PDF) from the original on 2019-03-06. Retrieved 2019-03-04.
- ^ Szweda, Roy (2005). "Germanium phoenix". III-Vs Review. 18 (7): 55. doi:10.1016/S0961-1290(05)71310-7.
- ^ Zhao, H.; Xue, Z.; et al. (21 July 2022). "Biodegradable germanium electronics for integrated biosensing of physiological signals". NPJ Flexible Electronics. 6. 63. doi:10.1038/s41528-022-00196-2. S2CID 250702946.
- ^ أ ب Thiele, Ulrich K. (2001). "The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation". International Journal of Polymeric Materials. 50 (3): 387–394. doi:10.1080/00914030108035115. S2CID 98758568.
- ^ Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul (2007). "Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography". Anal. Chem. 79 (24): 9441–9451. doi:10.1021/ac071056f. PMID 17994707.
- ^ Keyser, Ronald; Twomey, Timothy; Upp, Daniel. "Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use" (PDF). Oak Ridge Technical Enterprise Corporation (ORTEC). Archived from the original (PDF) on October 26, 2007. Retrieved 2008-09-06.
- ^ Ahmed, F. U.; Yunus, S. M.; Kamal, I.; Begum, S.; Khan, Aysha A.; Ahsan, M. H.; Ahmad, A. A. Z. (1996). "Optimization of Germanium for Neutron Diffractometers". International Journal of Modern Physics E. 5 (1): 131–151. Bibcode:1996IJMPE...5..131A. doi:10.1142/S0218301396000062.
- ^ Diehl, R.; Prantzos, N.; Vonballmoos, P. (2006). "Astrophysical constraints from gamma-ray spectroscopy". Nuclear Physics A. 777 (2006): 70–97. arXiv:astro-ph/0502324. Bibcode:2006NuPhA.777...70D. CiteSeerX 10.1.1.256.9318. doi:10.1016/j.nuclphysa.2005.02.155. S2CID 2360391.
- ^ Eugene P. Bertin (1970). Principles and practice of X-ray spectrometric analysis, Chapter 5.4 – Analyzer crystals, Table 5.1, p. 123; Plenum Press
- ^ Shen, C.; Trypiniotis, T.; Lee, K. Y.; Holmes, S. N.; Mansell, R.; Husain, M.; Shah, V.; Li, X. V.; Kurebayashi, H. (2010-10-18). "Spin transport in germanium at room temperature" (PDF). Applied Physics Letters. 97 (16): 162104. Bibcode:2010ApPhL..97p2104S. doi:10.1063/1.3505337. ISSN 0003-6951. Archived (PDF) from the original on 2017-09-22. Retrieved 2018-11-16.
- ^ Sigillito, A. J.; Jock, R. M.; Tyryshkin, A. M.; Beeman, J. W.; Haller, E. E.; Itoh, K. M.; Lyon, S. A. (2015-12-07). "Electron Spin Coherence of Shallow Donors in Natural and Isotopically Enriched Germanium". Physical Review Letters. 115 (24): 247601. arXiv:1506.05767. Bibcode:2015PhRvL.115x7601S. doi:10.1103/PhysRevLett.115.247601. PMID 26705654. S2CID 13299377.
- ^ أ ب Ades TB, ed. (2009). "Germanium". American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies (2nd ed.). American Cancer Society. pp. 360–363. ISBN 978-0944235713.
- ^ Brown, Robert D. Jr.. Commodity Survey:Germanium. US Geological Surveys. Archived from the original. You must specify the date the archive was made using the
|archivedate=parameter. http://minerals.usgs.gov/minerals/pubs/commodity/germanium/220798.pdf. Retrieved on 2008-09-09. - ^ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City, CA: Biomedical Publications. pp. 693–694.
- ^ Gerber, G. B.; Léonard, A. (1997). "Mutagenicity, carcinogenicity and teratogenicity of germanium compounds". Regulatory Toxicology and Pharmacology. 387 (3): 141–146. doi:10.1016/S1383-5742(97)00034-3. PMID 9439710.
وصلات خارجية
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
خطأ استشهاد: وسوم <ref> موجودة لمجموعة اسمها "note"، ولكن لم يتم العثور على وسم <references group="note"/>
- CS1 الألمانية-language sources (de)
- CS1: Julian–Gregorian uncertainty
- CS1 errors: periodical ignored
- CS1 الفرنسية-language sources (fr)
- CS1 errors: unsupported parameter
- CS1 errors: extra text: edition
- Short description is different from Wikidata
- Pages using infobox element with unknown parameters
- Articles with hatnote templates targeting a nonexistent page
- مواد استشعار تعمل بالأشعة تحت الحمراء
- أشباه فلزات
- مواد بصرية
- مواد شبه موصلة
- عناصر كيميائية
- معادن
- جرمانيوم