فلز

فى علم الكيمياء تعنى كلمة فلز metal ( الأصل الإغريقي : ميتالون ) العنصر الكيميائي الذى يكون أيونات ( كاتيونات ) وله رابطة فلزية ، كما يتم وصف الفلزات أيضا على أنها شبكة من الأيونات الموجبة ( كاتيونات ) داخل سحابة من الإلكترونات . وتقع الفلزات في الثلاث مجموعات للعناصر التى تتميز بتأينها وخواصها ، ومع أشباه الفلزات واللا فلزات .وعند رسم خط مائل في الجدول الدوري من البورون إلى البولونيوم فإن هاذ الخط يفصل الفلزات عن اللا فلزات ، وتكون العناصر الواقعة على هذا الخط هى أشباه الفلزات ، وتكون العناصر التى تقع أسفل يمين الخط هى الفلزات ، والتى تقع أعلى يسار الخط هى اللا فلزات .
اللافلزات متوفرة في الطبيعة أكثر من الفلزات ، ولكن الفلزات تكون أغلب الجدول الدوري . ومن الفلزات المشهورة الألومنيوم ، النحاس ، الذهب ، الحديد ، الرصاص ، الفضة ، التيتانيوم ، اليورانيوم ، الزنك .
الصور المتآصلة للفلزات تميل لأن يكون لها بريق ، لدنة ، قابلة للطرق ، موصلة ، بينما اللا فلزات بصفة عامة تكون هشه ( اللا فلزات الصلبة ) بدون بريق ، عازلة .
ويوجد تعريف حديث للفزات هى أن الفلزات توصيلها وتكافؤها يتعدى تركيبها الإلكتروني . ويفتح هذا التعريف الفرصة للبوليمرات الفلزية والفلزات العضوية الأخرى ، والتى تم تصنيعها بالأبحاث المتقدمة ويتم إستخدامها في الأجخزة ذات التقنية العالية .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخواص الكيميائية
معظم الفلزات متفاعلة كيميائياً, ويتفاعلن مع الاكسجين في الهواء مشكـِّلات اكسيدات بعد فترات مختلفة (فعلى سبيل المثال الحديد يصدأ بعد سنين بينما البوتاسيوم يشتعل في ثواني). الفلزات القلوية هي أسرع متفاعل ويليها الفلزات الأرضية القلوية, المتواجدة في المجموعتين في أقصى يسار الجدول الدوري.
أمثلة:
- 4Na + O2 → 2Na2O (اكسيد الصوديوم)
- 2Ca + O2 → 2CaO (اكسيد الكالسيوم)
- 4Al + 3O2 → 2Al2O3 (اكسيد الألومنيوم)
الخواص الفيزيائية

الفلزات لها خواص فيزيائية مميزة : فإنها غالبا ما تكون لامعة ( لها بريق ) ، ذات كثافة عالية ، يمكن سحبها ، يمكن طرقها ، وغالبا لها درجة إنصهار عالية ، كما أنها صلبة وجيدة التوصيل للكهرباء والحرارة . ويرجع هذا بصفة عامة لكثافتها القليلة ، وطراتها ، بينما الفلزات ذات درجة حرارة الإنصهار القليلة تكون نشيطة ونادرا ما يمكن تواجدها في حالتها العنصرية الفلزية .
خاصية التوصيل تحدث غالبا لأن كل ذرة يكون بها إلكترونات غير مرتبطة جيدا في غلافها الأخير (إلكترون تكافؤ) ، وعلى هذا فإن تكون ما يشبه البحر حول كاتيون نواة الفلز .
معظم الفلزات غير ثابتة كيميائيا ، تتفاعل مع الأكسجين في الهواء لتكوين أكاسيد بمرور الوقت ( الحديد يصدأ على مر السنين ، يحترق البوتاسيوم في ثواني ، الفضة تفقد لمعانها في شهور ). تتفاعل الفلزات القلوية أسرع ، يتبعها الفلزات القلوية الترابية والتى توجد في أيمن الجدول الدوري . وتأخذ الفلزات الإنتقالية وقت أطول لتتأكسد ( مثل الحديد ، النحاس ، النيكل ) بينما لا يتفاعل البالاديوم ، الذهب ، البلاتين مع الأكسجين الجوي على الإطلاق ( ولهذا يتم صنع المصاغ منهم ) . بعض الفلزات تكون طبقة ساترة من الأكسيد على سطحها والتى لا يمكن إختراقها بجزيئات الأكسجين ولهذا فإنها تحتفظ بخاصية اللمعان والتوصيل لعقود عديدة ( مقث الألومنيوم ، بعض انواع الصلب ، التيتانيوم وغيرها ) .
الطلاء والطلاء الكهربي طريقتان جيدتان لمنع التأكسد .
الكثافة
قابلية السحب والطرق
شحن كهربي
السبائك
السبيكة هى خليط من الخواص الفلزية وتحتوى على الأقل عنصر فلزي واحد . مثال ذلك الصلب ( الحديد والكربون ) ،النحاس الأصفر ( النحاس والزنك) ، البرونز ( النحاس والقصدير ) ، ديورالومين ( الألومنيوم والنحاس ) . يتم تصنيع السبائك لكافة التطبيقات البسيطة منها و الخاصة ، مثل المحركات النفاثة ، والتى تحتوى على أكتر من عشر عناصر .
تصنيفات
Base metal
Ferrous metal
حجر كريم
معدن نفيس

الاستخلاص
علم المعادن
التطبيقات
التجارة
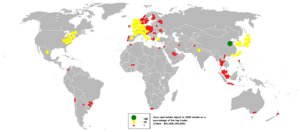
يصنف البنك الدولي الصين كأكبر مستورد للخامات والفلزات في 2005 ويليها الولايات المتحدة واليابان.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
تحليل الفلزات
العمليات التمهيدية لتحليل الفلزات
1- أخذ العينة الممثلة: الهدف من الحصول على عينة مناسبة هو أخذ جزء يمثل جميع المكوِّنات وكمياتها المحتواة في جسم العينة، فإذا كان جسم العينة متجانساً فليس هناك صعوبة في الحصول على عينة ذات حجم مخبري، أما حينما يكون جسم العينة غير متجانس فيجب أخذ احتياطات خاصة للحصول على عينة نموذجية. فمثلاً يختلف محتوى الحديد في قضيب مصنوع من سبيكة حديدية اختلافاً كبيراً عبر طول القضيب وعلى سطحه وفي مركزه. فلو كان القضيب متجانساً لما كان مهماً من أي جزء من القضيب اختيرت العينة، لأن تكوينه في هذه الحالة متجانس في كل أجزائه. وقد يختصر جسم العينة إلى حجم مخبري باختيار عرضي أو قد يختصر طبقاً لخطة إحصائية تعطي كل جسيم أو جزء من المادة فرصة متساوية للظهور في العينة. وعموماً فإن أخذ العينات بطريقة إحصائية يتطلب إزالة أجزاء من كل قسم في العينة ثم تدمج هذه الأجزاء وتخلط وتؤخذ منها عينة ذات حجم مخبري. أما أخذ العينات بطريقة عرضية ففيه صعوبة لأنه غالباً ما يكون للتحيز الشخصي تأثير في أخذ العينة الممثلة. ولا يجوز أن يعمل شيء للعينة قد يغير من تركيبها، ولذلك يجب سحقها وخزنها بحذر شديد. وتستخدم وسائل مختلفة لأخذ العينات، فإذا كانت العينة صلبة ومتجانسة يمكن اختيار أي جزء منها واعتباره ممثلاً لجسم العينة. أما بالنسبة للمادة الصلبة غير المتجانسة فيجب وضع خطة واعية تسمح إحصائياً باختيار جميع الأجزاء الممثلة لجسم العينة.
يمكن أخذ العينة يدوياً أو ميكانيكياً بوساطة آلة، وتكون الطريقة الميكانيكية مفيدة عندما يكون جسم العينة كتلة ضخمة. ومن غير الممكن دائماً اختيار عينة تكون إحصائياً ممثلة لجسم العينة. فإذا نُظِر إلى المهمة الصعبة لتعيين تركيب قشرة القمر يتضح أن الاختيار لعينة تمثل سطح القمر ليس ممكناً. لذلك بنيت عملية أخذ العينة لكمية محدودة من صخور القمر وترابه. فهذه الصخور غير متجانسة، ودقائقها مختلفة الحجم ومختلفة التركيب. وأفضل طريقة يعتمد عليها هي أخذ 1/50 إلى 1/100 من الكمية الكلية للحصول على العينة الإجمالية. ويتطلب تحويل عينة ضخمة إلى عينة مناسبة للتحليل:
أ ـ جعل العينة ذات حجم دقائق موحدة الحجم أي جعلها متجانسة.
ب ـ اختزال كتلة العينة.
وللحصول على حجم موحد لدقائق العينة توضع العينة إما في كسارات أو طواحين أو ساحقات أو هاونات ويمكن استعمال المناخل أيضاً. ومهما كانت الطريقة فإنه من الضروري التأكد أن هذه العمليات لا تؤدي إلى إدخال أي تلوث في العينة. وتسمح بعض الطرق التحليلية بإجراء القياسات من دون إتلاف العينة أو تغييرها، في حين تستهلك طرق أخرى العينة كلها أو تتطلب فقط كميات ضئيلة من مادتها.
2- التجفيف: بمجرد الحصول على العينة يتقرر فيما إذا كان التحليل سيجرى على العينة مباشرة أو بعد تجفيفها. فمعظم العينات يحتوي على كميات مختلفة من الرطوبة، وذلك إما لأن العينة متميعة أو لامتصاص الماء على سطحها. وإذا حللت العينة كما هي (عند استلامها) يعامل الماء كجزء من تكوين العينة، وعند التعامل مع العينة يجب ألا يحدث نقص أو كسب للماء قبل التحليل. أما تحليل العينة الجافة، فيعني أن الماء قد أزيل. ويزال الماء بتسخين العينة في فرن أو بوساطة مصباح بنزن. وعندما تستعمل الحرارة للتجفيف، فمن الممكن أن تتفكك العينة أو تفقد المكونات المتطايرة منها.
3- الوزن: يعدُّ هذا القياس في التحليل العادي أحد أصح القياسات التي يمكن إجراؤها في المختبر. توزن في العادة ثلاث عينات، وتُجرى التجربة على كل واحدة منها على حدة. أو توزن عينة وتُذاب في حجم معلوم في دورق محدود الحجم، ثم تؤخذ حجوم من هذا المحلول للتعيين الكمي، ويعتمد وزن العينة التي تؤخذ فعلاً على مستوى تركيز المواد المراد تحديدها في العينة.
4- الإذابة: وهي تلي عادة خطوة الوزن، فإذا كانت العينة قابلة للذوبان في الماء فإن مشكلة الإذابة تعدُّ محلولة، ولو أن العينة تتميه أحياناً لتكوّن أكاسيد مائية غير ذائبة. وتذوب المواد العضوية، عادة، في المذيبات العضوية أو مزائج المذيبات العضوية والماء، فيما إذا لم يكن الماء وحده مذيباً مناسباً. وعلى الرغم من أن الماء أسهل في الاستعمال، إلا أن هناك العديد من الطرق الكيميائية والآلية التي تتطلب استعمال مذيبات ذات تراكيب معينة. كما أنه في حالات أخرى تكون عملية الإذابة غير مطلوبة. فمثلاً، في الإصدار الذري حيث تتم إثارة العينة بوساطة قوس أو شرارة ثم تحلل الطاقة الصادرة آلياً، يمكن استعمال مادة صلبة أو سائلة مباشرة. وقد نتج من استعمال التقانات الحديثة تحليل عدد هائل من السبائك والمزائج العضوية وغير العضوية. وعند التعامل مع مثل هذه العينات تكون خطوة الإذابة ليست مجرد قواعد ذوبانية الأملاح؛ فإذا كان الجزء العضوي من المزيج هو الذي يراد تحليله يجب إتباع طرائق واستعمال مذيبات تخص الكيمياء العضوية. أما بالنسبة للتحليل غير العضوي، فإذا لم يكن الماء مذيباً مناسباً فيجب إذابة العينة في حمض أو صهرها مع مساعد صهر (صَهور) flux.
أ - المعالجة بالحموض: هناك أسئلة كثيرة تطرح عند استعمال الحموض وهي: هل هناك حاجة لحمض مؤكسِد أو غير مؤكسِد؟ ما هو نوع الأنيون المرغوب فيه، أو الأفضل للمحلول؟ ما هي الخواص الكيميائية للعينة؟ وهل من الضروري التخلص من الزيادة من الحمض؟ وهنا تبرز الحاجة إلى معرفة التفاعلات غير العضوية والمعرفة الكيميائية العامة للإجابة عن هذه الأسئلة. فمثلاً، لا يستعمل حمض الكبريت لإذابة عينة تحتوي على أيون أو معدن الباريوم، كما لا يستعمل حمض كلور الماء لإذابة عينة تحتوي على معدن الفضة أو ملح الفضة. وفي حالات أخرى يجب عدم المعالجة بحمض لأن العينة قد تتطاير. فمثلاً، معالجة عينات الكربونات والكبريتيدات مع الحمض يمكن أن تؤدي إلى فقد ثنائي أكسيد الكربون أو كبريتيد الهدروجين، إلا إذا اتخذت ترتيبات لحصر هذه الغازات. أما إذا كان التحليل غير معني بمحتوى الكبريتيد أو الكربونات في العينة فعندئذ لا توجد صعوبة. وفي بعض الحالات لا يمكن استعمال الحمض لأنه يتسبب في أن أجزاء من العينة تصبح غير فعالة، وليس لها دور في التفاعل وذلك بسبب تكوين غلاف من الأكسيد.
يصعب وصف الحمض اللازم لإذابة عينات غير عضوية، لأن جميع العينات ليست معادن نقية بسيطة، أو أكاسيد معادن أو سبائك. فمثلاً قد تحتوي سبيكة على ثلاثة عشر معدناً مختلفاً مثل Nb, Ta, W, Zn والأتربة النادرة. وفي بعض الأحيان، تستعمل طريقة لإذابة جزء من العينة وتستعمل طريقة أخرى لإذابة الباقي. وكدليل عام، فإنه من المفيد تقسيم الشروط الحمضية العامة تبعاً لكونها مؤكسِدة أو غير مؤكسِدة، فالحموض غير المؤكسِدة هي حمض كلور الماء وحمض الكبريت المدد وحمض فوق الكلور، بينما الحموض المؤكسِدة هي حمض الآزوت وحمض الكبريت المركز الساخن وحمض فوق الكلور المركز الساخن. إن إذابة المعادن في حموض غير مؤكسدة هي عملية إحلال للهدروجين لذلك فإن أي خطة لربط قدرة المعادن على إحلال الهدروجين يمكن أن تستعمل للتنبؤ كيفياً بالذوبان. ومثل هذه الخطة يتضمنها جدول كمونات الإرجاع القياسية، فالمعادن تحت الهدروجين في السلسلة تذوب في الحمض غير المؤكسِد. وتوجد حالات شاذة بسبب تكوين طبقة أكسيد أو تكوين ملح غير ذائب. باختصار يذيب حمض كلور الماء المعادن الموجودة فوق الهدروجين وأملاح الحموض الضعيفة والعديد من الأكاسيد، أما حمض الكبريت وحمض فوق الكلور فهما مفيدان للمعادن فوق الهدروجين مع الفارق في ذوبانية الأملاح المتكوِّنة. وغالباً ما يؤدي استخدام حمض الكبريت المركَّز مع التسخين إلى إذابة المعادن تحت الهدروجين، إلا أنه يجب مراعاة ذوبانية الأملاح المتكونة. ويذيب حمض الآزوت المعادنَ الموجودة في الجدول فوق الهدروجين وتحته، لأن القوة المؤكسِدة تختلف تبعاً لما إذا كان الحمض مركَّزاً أو ممدداً. وعمُوماً، فإن المعدن يتأكسد إلى أعلى حالات تأكسده، إلا في حالة بعض المعادن مثل الكروم والألمنيوم التي تصبح غير فعالة، وفي حالة معادن أخرى مثل التنگستن والأنتيموان والقصدير التي تكوّن حموضاً غير ذائبة. كذلك تذوب أملاح الكبريتيد وأملاح الأنيونات]] القابلة للتأكسد في حمض الآزوت. وقد تكون أقوى الشروط المؤكسدة هي التي يحصل عليها باستخدام حمض فوق الكلور الساخن المركز الذي يذيب جميع المعادن الشائعة. وغالباً ما يكون استعمال مزيج من الحموض مفيداً. وأكثر المزائج شيوعاً هو الماء الملكي (1:3 حمض كلور الماء - حمض الآزوت). ففي هذا المزيج يحتفظ كل حمض بمزاياه الخاصة، حيث يقدم حمض الآزوت القوة المؤكسدة، بينما يقدم حمض كلور الماء الحموضة القوية والمقدرة على تشكيل معقدات complexes، ذلك لأن أيونات بعض المعادن تحتفظ بذوبانيتها فقط بوجود كواشف تؤدي إلى تشكيل معقدات. وفي الواقع، إن هذه الطريقة جيدة لإذابة أملاح أيونية لا تذوب بطريقة أخرى. وأحياناً تؤدي إضافة البروم أو فوق أكسيد الهدروجين H2O2 إلى الحموض اللاعضوية إلى زيادة تأثير هذه الحموض كمذيبات. والميزة الإضافية الناتجة من مثل هذه الإضافات هي الإسراع في الأكسدة ومن ثمَّ إتلاف المواد العضوية في العينة. ويتميز حمض فلور الماء HF بوضع خاص، وذلك أنه حمض ضعيف وحمض غير مؤكسِد، إلا أنه مفيد لإذابة عينات معينة. فإذا لم يكن تعيين السيليكا مطلوباً، تتفكك عينات السيليكا بسهولة بوساطة حمض فلور الماء وتتطاير على شكل SiF4. ويتميز حمض فلور الماء من حمض كلور الماء في أنه يعطي أنيون الفلوريد الذي يعدُّ أنيوناً جيداً لتشكيل المعقدات. ولكن في حالات معينة يمكن أن يكون المعقد المتشكل صعب التفكك مما يؤثر في خطوات التحليل التالية. وبما أن حمض فلور الماء يسبب جروحاً بالغة إذا لامس الجلد فإن الطريقة المناسبة لتوليد حمض فلور الماء تكون بإضافة فلوريد الصوديوم إلى محلول العينة المحتوية على حمض كلور الماء.
إن حمض فوق الكلور الساخن المركَّز مؤكسِد قوي. فإذا سُخن محلول ممدد منه حتى الغليان وتبخر الماء تبخراً بطيئاً فإن قوته المؤكسدة تزداد تدريجياً حتى تصل إلى حدها الأقصى عندما يصبح تركيز الحمض 72%. والمزايا الأخرى لهذا الحمض هي تشكيل أملاح فوق الكلورات القابلة للذوبان كلية، وأنه نازع للماء، وأن الحمض المركز الساخن يؤكسد المواد العضوية أكسدة سهلة، وهذا ما يسمى بطريقة الحرق الرطب، حيث يستخدم مزيج من حمض الآزوت وحمض فوق الكلور ويتطلب التعامل بحذر مع هذا المزيج لأن استعماله بطريقة خاطئة يؤدي إلى انفجار مروع. يضاف حمض الآزوت أولاً ثم يسخن ويبرد ثم يضاف مزيج من حمض الآزوت وحمض فوق الكلور، وبذلك يعمل حمض الآزوت كقوة معدلة تؤكسد المركبات الأكثر نشاطاً عند درجات حرارة أخفض.
وغالباً ما تتطلب المعادن والصخور معالجة خاصة، مثل السيليكات والكبريتيدات والفوسفات والكربونات والكبريتات والمعادن المقاومة للحرارة والأكاسيد، وإذا كان تحليل الأنيون أيضاً مطلوباً تصبح معالجتها أصعب لأن بعض الحموض المستعملة يمكن أن يتسبب بتطاير هذا الجزء من العينة تطايراً سهلاً.
ب - المعالجة بصهور: هذه المعالجة هي ثاني طريقة للمعالجة، وهي أقوى وأكثر فعالية من المعالجة بالحمض لسببين: الأول أنه لما كان مساعد الصهر هو وسط ملحي منصهر فإن درجات الحرارة اللازمة لتوفير الشروط المناسبة (300-1000 درجة مئوية) هي أعلى بكثير مما هي الحال عليه عند المعالجة بالحمض. والثاني أن هناك تركيزاً أكبر من المادة المتفاعلة على اتصال بالعينة. كما أن الشروط المؤكسدة أو غير المؤكسدة تبقى متوافرة لتوافر صهورات مؤكسدة وغير مؤكسدة. لكن المصاعب في استعمال الصهورات عديدة، فهي تحتاج إلى أوعية خاصة تتحمل درجة حرارة التفاعل وشروطه. وتصنع البواتق الأكثر شيوعاً من البلاتين والفضة والنيكل والذهب والحديد، إلا أنه يجب معرفة مدى فعالية الصهور ونشاطه قبل اختيار البوتقة المناسبة. وعند انتهاء عملية الصهر وبعد التبريد تذاب المادة الصلبة عادة في الماء أو في حمض ممدد. وبما أن تركيز المحلول الناتج من الملح عال جداً لذا يجب أخذ هذا الأمر بالحسبان في الخطوات الكيميائية والآلية التالية. والشوائب هي إحدى المصاعب الأخرى التي يمكن أن يسببها إدخال الصهور، إضافة للتطاير الحادث نتيجة ارتفاع درجة الحرارة والفاقد الناشئ عن التناثر نتيجة للتفاعل. ويمكن تقسيم الصهورات تبعاً لما إذا كانت توفر شروطاً حمضية أو أساسية (قاعدية). فالكربونات والهدروكسيدات والبروكسيدات توفر شروطاً قاعدية بينما يوفر أكسيد البور والبيروكبريتات شروطاً حمضية.
ج - تفكك المادة العضوية: يمكن أن تتفكك المادة العضوية بطرق عدة. وتعتمد الطريقة المختارة عما إذا كان المطلوب تحليل المادة العضوية أو مجرد إزالتها.
إن طريقة الحرق الرطب التي تستعمل فيها مزائج حمض الآزوت وحمض فوق الكلور تقضي تماما على المادة العضوية. والحرق الجاف هو أبسط الطرق حيث توضع العينة عادة في بوتقة مفتوحة أو صحن وتسخن لدرجة الاحمرار بوجود الهواء أو الأكسجين إلى أن تتأكسد المادة الكربونية جميعها. وتتطلب طبيعة الطريقة بعض السيطرة لمنع فقدان الجزء المطلوب من العينة عن طريق التناثر أو التطاير.
طرق التحليل الكمي للفلزات
يمكن تحليل الفلزات بطرائق عدة، يُبنى بعضها على قياس الوزن أو الحجم في حين يُبنى بعضها الآخر على قياس الكمون (أو التيار) أو امتصاص الطاقة الإشعاعية وإصدارها، وتشمل معظم طرائق قياس الوزن ترسيب المادة المطلوب تحليلها بوساطة تفاعل كيميائي.
1 - الطريقة الوزنية: وتتلخص بالآتي:
أ - تسجيل وزن دقيق للعينة المطلوب تحليلها.
ب - إذابة العينة الموزونة.
ج - إزالة الأصناف التي قد تتداخل في الطريقة المختارة بطريقة فصل مناسبة.
د - تعديل الوسط التجريبي ويشمل ضبط الأس الهدروجيني (pH) أو تغيير حالة التأكسد أو تركيز العينة أو تمديدها أو إضافة مواد حاجبة.
هـ - إضافة كاشف ترسيب عضوي أو غير عضوي مناسب.
و - إتمام الترسيب عموماً في محلول ممدد ساخن.
ز - فصل الراسب عن المحلول.
ح - غسل الراسب.
ط - تجفيف الراسب أو حرقه للحصول على ناتج مناسب ثابت الوزن.
ي - تعيين المكوّن المطلوب تحليله في العينة بحسابه من وزن العينة ووزن الراسب بعد الأخذ بالاعتبار حساب المواد في التفاعل المؤدي إلى تحويل المكون في العينة إلى راسب.
وهناك طرق وزنية أخرى شائعة، مبنية على الترسيب الكهربائي (الطرق الكهروزنية) وتصاعد الغاز. ففي الأولى يؤدي التحكم بالتيار الكهربائي (أو الكمون) في خلية تحليل كهربائي تحتوي على العينة إلى حدوث تفاعل كهركيميائي ينتج منه ترسيب ناتج مميز للعينة بسبب الإرجاع عند المهبط cathode والتأكسد عند المصعد anode. ولما كان الصنف المراد تعيينه يطلى كمياً على المهبط لذا يسجل وزن القطب قبل الطلاء وبعده وبالطرح يحصل على كمية الصنف الموجود أصلاً في المحلول. أما الطريقة الثانية فتبنى على الفاقد في وزن العينة بسبب تبخيرها كلية أو بتبخير جزء منها. لذلك من الضروري تسجيل وزن العينة قبل عملية التبخير وبعدها. وفي بعض الحالات تتطاير المادة نفسها بالتسخين، وفي حالات أخرى تتفكك المادة إلى نواتج متطايرة مما يؤدي إلى النقص في الوزن. كما أن هناك طريقة بديلة يتم فيها جمع النواتج المتطايرة في وسط معين للإيقاع بها وتسجيل الزيادة في وزن هذا الوسط.
2 - طرق المقياسية الكهروزنية electrogravimetry: إن طرق المقياسية الوزنية هي الطرق التي يتم فيها طلاء كهربائي للمعدن كمياً على أحد الأقطاب الذي يكون عادة من البلاتين، وتعين كمية المعدن المطلية بالفرق بين وزن قطب البلاتين قبل عملية الطلاء الكهربائي وبعده. وفي عملية الطلاء الكهربائي يرغم تيار بالمرور بين مهبط، على شكل شبكة أسطوانية من البلاتين، ومصعد بلاتين على شكل سلك. وعند اكتمال ترسيب المعدن يؤخذ المهبط ويجفف ويوزن.
3 - طرق القياس الحجمي: تستخدم طرق القياس الحجمي استخداماً واسعاً في التحاليل التقليدية، وهي أكثر شيوعاً في هذا المجال من طرق القياس الوزني؛ لأنها سريعة وسهلة التنفيذ وغالباً ما تكون مرضية. وتستخدم طريقة القياس الحجمي (أو المعايرة) محلولاً قياسياً واحداً أو أكثر. والمحاليل القياسية هي محاليل لكواشف معلومة التركيز بدقة. وتستعمل المحاليل القياسية لإجراء المعايرات. إن المعايرات تعين كمية المادة المطلوب تحليلها بالمحلول من حجم المحلول القياسي المستهلَك. وتجري عادة المعايرة عن طريق إضافة محلول قياسي إضافة حذرة حتى يكتمل تفاعله مع المادة المطلوب تحليلها. بعدها يقاس حجم المحلول القياسي. وأحياناً من المناسب أو من الضروري إضافة فائض من المحلول القياسي الكاشف ثم تعيين هذا الفائض عن طريق المعايرة العكسية بمحلول كاشف قياسي آخر. وتتحدد صحة طريقة القياس بصحة تركيز المحلول القياسي المعلوم. ولهذا السبب تؤخذ الاحتياطات الكبيرة عند تحضير مثل هذه المحاليل. وإن الهدف من كل معايرة هو إضافة محلول قياسي بكمية تكافىء كيميائياً المادة التي تتفاعل معه. ويتحقق هذا الهدف عند نقطة التكافؤ. فمثلاً تحصل نقطة التكافؤ عند معايرة نترات الفضة بكلوريد الصوديوم عندما يضاف مول واحد من أيون كلوريد الصوديوم إضافة دقيقة لكل مول من أيون الفضة في العينة.
وتصنف طرق المعايرة طبقاً لأربعة أنواع من التفاعلات وهي: تفاعلات الترسيب وتشكيل المعقدات، والتعديل، والأكسدة - إرجاع. وكل نوع من هذه التفاعلات منفرد من حيث طبيعة التوازن والمشعرات المستعملة والمواد القياسية الأولية المتوافرة وتعريف الوزن المكافئ. وتستخدم معايرات الترسيب المعتمدة على تشكيل أملاح الفضة غير الذوابة استخداماً تقليدياً لتحليل الفضة وتعيين أيونات مثل الكلوريد والبروميد واليوديد والتيوسيانات.
يرتكز الكشف عن نقطة نهاية المعايرة في معايرات التعديل على التغير المفاجئ في pH الحادث بالقرب من نقطة التكافؤ. ويختلف مدى pH الذي يحدث ضمنه مثل هذا التغيير من معايرة إلى أخرى ويتعين هذا المدى بكل من طبيعة المادة المحللة والمادة المعايرة وتركيزهما. وتكون المحاليل القياسية المستخدمة في معايرات التعديل دائماً حموضاً أو أسساً قوية لأن هذه المواد تتفاعل تفاعلاً أكثر اكتمالاً من الحموض أو الأسس الضعيفة. ويمكن تعيين المواد غير العضوية والحية التي تتمتع بخواص حمضية أساسية بمعايرات التعديل، حيث تحول المادة المطلوب تحليلها إلى حمض أو أساس بمعالجة كيميائية مناسبة، ثم يلي ذلك معايرة العينة بمحلول حمض قوي أو أساس قوي.
وبما أن معظم العناصر لها أكثر من حالة تأكسد، فمن الممكن استعمال معايرات الأكسدة والإرجاع استعمالاً واسعاً. وتوصف عادة تفاعلات الأكسدة والإرجاع بمصطلحات كهركيميائية لأن نقل الإلكترونات يمكن أن يتم في الخلية الكهركيميائية من دون أن تتلامس المواد المرجعة أو المؤكسدة بعضها مع بعض، ولا يمثل تركيز المواد المتفاعلة عادة في منحنيات المعايرة ويمثل الكمون الكهركيميائي بدلاً عنه وذلك كدالة لحجم المحلول المعاير. تدعى هذه الطريقة بطريقة قياس الكمون، وتُستخدم لتعيين نقطة نهاية معايرة أنواع متعددة وكثيرة من تفاعلات الأكسدة والإرجاع غير العضوية والعضوية. هذا ويمكن تتبع تفاعل المادة المطلوب تحليلها بطريقة قياس الكمون من دون أن يحدث تغير في حالة تأكسدها. فإذا كان القطب المشعر يستجيب لتغير تركيز هذه المادة في المحلول فإن أي تفاعل يمكن بوساطته إزاحة هذه المادة أو إحداث تغير في تركيزها عند التوازن فإنه سيؤدي إلى تغيّر في كمون هذا القطب. وعليه فإن طرق المعايرة بالتعديل والترسيب وتشكيل المعقدات يمكن تتبعها بطريقة قياس الكمون. وتستخدم المعادن النبيلة أساساً للكشف عن التغير في كمون الأنظمة ويتمثل دورها في تحسس تركيز الشكل المؤكسِد أو المرجِع لثنائية أكسدة وإرجاع معينة. وهناك أقطاب مفيدة جداً للتحليل لا يرتكز مبدأ عملها على أنصاف خلايا الأكسدة والإرجاع، ولكنها تعتمد على وجود أغشية بها وبالتالي على كمونات التبادل لهذه الأغشية. تدعى هذه الأقطاب الأقطاب الانتقائية للأيونات، وتستخدم على نطاق واسع في الأبحاث والتحاليل الكيميائية التقليدية للأيونات المعدنية وغير المعدنية.
أما معايرات تشكل المعقدات فتتصف بتكون معقد ذوّاب في الماء، ويتفق تركيبه مع الحسابات الكيميائية وذلك عند إضافة المادة المعايرة إلى محلول العينة. ويمكن تلخيص المبادىء الأساسية لهذه المعايرة بالآتي:
(1) اختيار عامل ممخلِب chelating agent مناسب للمعايرة.
(2) اختيار الشروط المناسبة للعينة التي تعطي أفضل معايرة ممكنة وتتضمن ضبط قيمة pH أثناء المعايرة.
(3) اختيار طريقة مناسبة للكشف عن نقطة نهاية المعايرة. وتستخدم الأقطاب الانتقائية للأيونات لمتابعة معايرات تشكل المعقدات.
4 - الطرق الطيفية: ويمكن تعيين الأيونات المعدنية الأثر trace بطرق المقياسية الطيفية الضوئية، حيث تحول الأصناف التي لا تمتص الإشعاعات إلى أصناف تمتصها بوساطة إدخال عامل ممخلِب مما يؤدي إلى تشكل معقد مستقر ذي امتصاصية جزيئية عالية. وبما أن العامل الممخلب سيتفاعل في الغالب فقط مع أعداد قليلة جداً من الأيونات المعدنية فإن هذا يوفِّر شيئاً من الانتقائية للمعقد المتشكل. كما أنه في حال تشكيل أيونات معدنية متعددة معقدات مع العامل الممخلب نفسه فإن خصائص الامتصاص لكل منها ربما يختلف عن الآخر، لدرجة تسمح بتعيين أيون معين معقد بوجود الأيونات الأخرى. وتستخدم الطرق الطيفية الذرية استخداماً رئيسياً لتعيين المعادن الأثر في أنواع مختلفة من العينات المأخوذة من أوساط عضوية أو غير عضوية. وتتضمن الطرق الطيفية الذرية طرائق الإصدار الذري الطيفية وطرق الامتصاص الذري الطيفية. وفي الإصدار تتبخر ذرات المادة المراد تعيينها وذلك عند تزويدها بطاقة حرارية إما بالحرق أو التفريغ الكهربائي. وتتناسب شدة الإصدار طرداً مع تركيز الصنف الصادرة عنه الإشعاعات، وتعتمد في الوقت نفسه على درجة حرارة الوسط. أما في حالة الامتصاص، فإن الإشعاع الوارد على بخار معدن ما يسبب تهيّجاً إلكترونياً من الحالة الأدنى (الحالة الأرضية) إلى حالات تهيّج منتقاة. وتكون النسبة المقاسة عملياً بين استطاعة الإشعاع النافذ واستطاعة الإشعاع الوارد طرداً مع التركيز. وتعدُّ طرق الفلورة الذرية الطيفية أسلوباً تقانياً حديثاً ويرتكز مبدؤها على أن ارتطام الإشعاع ببخار عينة معدن معين يسبب ارتقاء الإلكترونات إلى مستويات التهيّج، ثم تعود الذرات بعد ذلك إلى الحالة الأدنى، ويصاحب ذلك إصدار للإشعاع، وتتطلب عملية قياس الإشعاع الصادر وضع المكشاف على زاوية معينة للإشعاع الوارد.[1]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المصادر
- ^ عصام قلق. "الفلَّزات (تحليل -)". الموسوعة العربية.
انظر أيضا:
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||
