لانثانم
| ||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض فضي
| ||||||||||||||||||||||||||||
| الخصائص العامة | ||||||||||||||||||||||||||||
| الاسم، الرمز، الرقم | لانثانم, La, 57 | |||||||||||||||||||||||||||
| تصنيف العنصر | لانثانيدات | |||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | n/a, 6, f | |||||||||||||||||||||||||||
| الوزن الذري القياسي | 138.90547 | |||||||||||||||||||||||||||
| التوزيع الإلكتروني | [Xe] 5d1 6s2 2, 8, 18, 18, 9, 2 | |||||||||||||||||||||||||||
| الخصائص الطبيعية | ||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||
| الكثافة (بالقرب من د.ح.غ.) | 6.162 g·cm−3 | |||||||||||||||||||||||||||
| الكثافة السائلة عند ن.إ. | 5.94 گ·سم−3 | |||||||||||||||||||||||||||
| نقطة الانصهار | 1193 ك, 920 °C, 1688 °F | |||||||||||||||||||||||||||
| نقطة الغليان | 3737 ك, 3464 °س, 6267 °ف | |||||||||||||||||||||||||||
| حرارة الانصهار | 6.20 كج·مول−1 | |||||||||||||||||||||||||||
| حرارة التبخر | 402.1 كج·مول−1 | |||||||||||||||||||||||||||
| السعة الحرارية المولية | 27.11 ج·مول−1·ك−1 | |||||||||||||||||||||||||||
| ضغط البخار (extrapolated) | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
| الخصائص الذرية | ||||||||||||||||||||||||||||
| حالات الأكسدة | 3, 2 (أكسيد شديد القاعدية) | |||||||||||||||||||||||||||
| سالبية كهربية | 1.10 (مقياس پولنگ) | |||||||||||||||||||||||||||
| طاقات التأين | الأولى: 538.1 كج·مول−1 | |||||||||||||||||||||||||||
| الثانية: 1067 كج·مول−1 | ||||||||||||||||||||||||||||
| الثالثة: 1850.3 كج·مول−1 | ||||||||||||||||||||||||||||
| نصف القطر الذري | 187 پم | |||||||||||||||||||||||||||
| نصف قطر تساهمي | 207±8 pm | |||||||||||||||||||||||||||
| متفرقات | ||||||||||||||||||||||||||||
| البنية البلورية | مسدس | |||||||||||||||||||||||||||
| الترتيب المغناطيسي | paramagnetic[1] | |||||||||||||||||||||||||||
| المقاومية الكهربائية | (r.t.) (α, poly) 615 nΩ·m | |||||||||||||||||||||||||||
| ناقلية حرارية | 13.4 W·m−1·K−1 | |||||||||||||||||||||||||||
| التمدد الحراري | (r.t.) (α, poly) 12.1 µm/(m·K) | |||||||||||||||||||||||||||
| سرعة الصوت (قضيب رفيع) | (20 °س) 2475 م·ث−1 | |||||||||||||||||||||||||||
| معامل ينگ | (α form) 36.6 گپا | |||||||||||||||||||||||||||
| معامل القص | (α form) 14.3 گپا | |||||||||||||||||||||||||||
| معامل الحجم | (α form) 27.9 گپا | |||||||||||||||||||||||||||
| نسبة پواسون | (α form) 0.280 | |||||||||||||||||||||||||||
| صلادة موس | 2.5 | |||||||||||||||||||||||||||
| صلادة ڤيكرز | 491 MPa | |||||||||||||||||||||||||||
| صلادة برينل | 363 مپا | |||||||||||||||||||||||||||
| رقم تسجيل كاس | 7439-91-0 | |||||||||||||||||||||||||||
| أكثر النظائر استقراراً | ||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر لانثانم | ||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||
اللانثانوم بالإنجليزية: Lanthanum ، هو عنصر كيميائي له الرمز La و العدد الذري 57 في الجدول الدوري.
اللنثانيوم عنصر فلزي ناعم، أبيض فضّي، يفسد بسرعة عند تعرضه للهواء. ويوجد اللنثانوم في خامات الأرض المعدنية النادرة مثل المونازيت والباستنازيت، ويمكن إنتاجه أيضاً في المفاعلات النّوويّة بوساطة انشطار اليورانيوم أو الثوريوم أو البلوتونيوم. وكان الكيميائي السويدي كارل گوستاف موساندر أول من تعرف على اللنثانم في عام 1839م. وكلمة لنثانم Lanthanum مشتقة من الكلمة اليونانية λανθανω [لانثانو] = يرقد مختبئاً.
يشكلُ اللنثانوم قسماً من خليط معدني يدعى معدن ميش يستعمل في صنع أحجار القداحة لإشعال لفائف التبغ. ويضاف أكسيد اللنثانم إلى الزجاج المستعمل في صناعة عدسات الكاميرا، وذلك من أجل زيادة قابليتها لكسر أشعة الضوء. العدد الذري للنثانم هو 57، ووزنه الذري هو 138,906، وينصهر في درجة 921°م، ويغلي في درجة 3,457°م.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص المميزة
الكيميائية
اللانثانم له حالتا أكسدة، +3 و +2، الأولى هي الأكثر استقراراً. فعلى سبيل المثال، LaH3 هو أكثر استقراراً من LaH2.[2] ويحترق اللانثانم بسهولة عند 150 °س ليشكل أكسيد اللانثانم الثلاثي lanthanum(III) oxide:
- 4 La + 3 O2 → 2 La2O3
إلا أنه عند تعرضه لهواء رطب عند درجة حرارة الغرفة، فإنه يشكل أكسيد مائي بارتفاع كبير في الحجم.[2]
اللانثانم موجب كهربائياً تماماً ويتفاعل ببطء مع الماء البارد وبسرعة كبيرة مع مع الماء الساخن ليشكل هيدروكسيد اللانثانم:
- 2 La (s) + 6 H2O (l) → 2 La(OH)3 (aq) + 3 H2 (g)
ويتفاعل فلز اللانثانم مع كل الهالوجينات. ويكون التفاعل قوياً إذا حدث فوق 200 °س:
- 2 La (s) + 3 F2 (g) → 2 LaF3 (s)
- 2 La (s) + 3 Cl2 (g) → 2 LaCl3 (s)
- 2 La (s) + 3 Br2 (g) → 2 LaBr3 (s)
- 2 La (s) + 3 I2 (g) → 2 LaI3 (s)
ويذوب اللانثانم بسهولة في حمض الكبريتيك المخفف ليشكل محاليل محتوية على أيونات La(III) التي تتواجد كمركبات [La(OH2)9]3+ :[3]
- 2 La(s) + 3 H2SO4 (aq) → 2 La3+(aq) + 3 SO2−4 (aq) + 3 H2 (g)
ويجتمع اللانثانم مع النيتروجين والكربون والكبريت والفسفور والبورون والسلنيوم والسيليكون والزرنيخ عند درجات حرارة مرتفعة، مشكلاً مركبات ثنائية.[2]
تواجده
انتاجه
 مقالة مفصلة: مونازيت
مقالة مفصلة: مونازيت
فلز اللانثانم يـُحصل عليه من أكسيده بتسخينه مع كلوريد الأمونيوم أو فلوريد الأمونيوم وحمض الهيدروفلوريك عند درجة حرارة 300-400 °س لانتاج الكلوريد أو الفلوريد:
- La2O3 + 6 NH4Cl → 2 LaCl3 + 6 NH3 + 3 H2O
هذا يتبعه اختزال مع قلويات أو فلزات أرضية قلوية في الفراغ أو في غلاف جوي من الأرگون:
- LaCl3 + 3 Li → La + 3 LiCl
Also pure lanthanum can be produced by electrolysis of molten mixture of anhydrous LaCl3 and NaCl or KCl at elevated temperatures.[2]
الإستخدامات
أول استخدام تاريخي لللانثانم كان في فتيل mantle المصباح الغازي. كارل أور فون ڤلسباخ استخدم خليط من 60% أكسيد المغنسيوم، 20% أكسيد اللانثانم و 20% أكسيد الإتريوم الذي سماه أكتينوفور Actinophor، وسجل براءة اختراعه في 1885. الفتائل الأصلية كانت تشتعل بضوء مشوب بالخضرة ولم تكن ناجحة تماماً، وشركته الأولى، التي بنت مصنعاً في أتسگرسدورف في 1887، أفلست في 1889.[4]
الاستخدامات العصرية للانثانم تتضمن:
- أحد المواد المستخدمة كمادة مصعدية في بطاريات هجين نيكل-فلز هي La(Ni3.6Mn0.4Al0.3Co0.7. ونتيجة للثمن الباهظ لاستخراج اللانتانويدات الأخرى فيجري استعمال بدلي هو معدن ميش المحتوي على أكثر من 50% لانثانم بدلاً من لانثانم نقي. والمركب هو مكون بين فلزي من النمط AB5.[5][6]
ولما كانت معظم السيارات الهجين تستعمل بطاريات هجين نيكل-فلز، فإن كميات هائلة من اللانثانم مطلوبة لانتاج السيارات الهجين. فبطارية نمطية للسيارة الهجين تويوتا پريوس تتطلب 10 إلى 15 كج (22-33 رطل) من اللانثانم. وبازدياد اندفاع المهندسين التكنولوجيا لرفع المسافة التي تقطعها الوقود، فإن ضعف هذه الكمية من اللانثانم يمكن أن تتطلبها السيارة. [7][8]
- سبائك الهيدروجين الاسفنجية قد تحتوي على اللانثانم. وهذه السبائك قادرة على اختزان حتى 400 ضعف لحجمهم من غاز الهيدروجين في عملية امتزاز عكسية. وتنطلق الطاقة الحرارية في كل مرة يحدث ذلك؛ ولذلك فهذه السبائك لها استخدامات محتملة في أنظمة الحفاظ على الطاقة.[9][10]
- معدن ميش Mischmetal، وهو سبيكة pyrophoric تستخدم في lighter flints، تحتوي 25% إلى 45% لانثانم.[9]
- أكسيد اللانثانم و سادس بوريد اللانثانم يـُستخدموا في الأنابيب المفرغة الإلكترونية كمواد مهبط ساخن مع انبعاثية قوية للإلكترونات. بلورات LaB6 تـُستخدم في مصادر انبعاث الإلكترونات الحرارية عالية الوهج، طويلة العمر for scanning electron microscopes and Hall effect thrusters.[11]
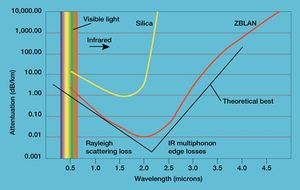
- فلوريد اللانثانم (LaF3) هو مكون أساسي في زجاج الفلوريد الثقيل، المسمى ZBLAN. هذا الزجاج له ناقلية أفضل في نطاق تحت الحمراء ولذلك يستعمل في أنظمة اتصالات الألياف الضوئية.[12]
- بروميد اللانثانم المشبع بالسريوم وكلوريد اللانثانم هم the recent inorganic scintillators which have a combination of high light yield, best energy resolution and fast response. Their high yield converts into superior energy resolution; moreover, the light output is very stable and quite high over a very wide range of temperatures, making it particularly attractive for high temperature applications. These scintillators are already widely used commercially في كاشفات النيوترونات أو آشعة گاما.[13]
- استخدامات الإضاءة الكربونية، وخصوصاً في صناعة السينما لإضاءة الاستوديوهات والعرض. هذه الاستخدامات تستهلك نحو 25% من المركبات المنتـَجة من المعدن الأرضي النادر.[9]
- La2O3 حسن مقاومة القلويات في الزجاج، ويستعمل في صناعة أنواع خاصة من الزجاج الضوئي، مثل الزجاج الممتص للآشعة تحت الحمراء، وكذلك في عدسات الكاميرات والتلسكوبات، بسبب معامل الانكسار العالي والتشتت المنخفض لأنواع زجاج العناصر الأرضية النادرة.[9] ويـُستعمل أكسيد اللانثانم أيضاً كمضاف لتنمية الحبيبات أثناء تحميص الطور السائل لنيتريد السليكون وثنائي بوريد الزركونيوم.[14]
- كميات صغيرة من اللانثانم تضاف إلى الصلب لتحسين مطاوعتها، ومقاومتها للصدم ومطيليتها. بينما اضافة اللانثانم إلى موليبدنم تخفض صلادته وحساسيته للتغيرات الحرارية.[9]
- كميات صغيرة من اللانثانم تتواجد في العديد من منجات حمامات السباحة لإزالة الفوسفاتات التي تغذي الطحالب.[15]
- مضاف أكسيد اللانثانم إلى التنگستن يستعمل في أقطاب لحام قوس الغاز تنگستن، كبديل للثوريوم المشع.[16][17]
- مركبات عديدة من اللانثانم وعناصر الأرض النادرة الأخرى (أكاسيد وكلوريدات، إلخ.) هم مكونات في تحفيزات مختلفة، مثل تكسير الپترول catalysts.[18]
- التأريخ الإشعاعي بواسطة لانثانم-باريوم يستخدم لتقدير عمر الصخور وخامات المعادن، بالرغم من أن التقنية ذات شعبية محدودة.[19]
- كربونات اللانثانم حصل على موافقة للاستعمال كدواء (Fosrenol, Shire Pharmaceuticals) لامتصاص الفوسفات الزائد في حالات المرحلة النهائية من الفشل الكلوي.[20]
- فلوريد اللانثانم يستعمل في طلاء المصباح الفوسفوري. مخلوطاً مع فلوريد الاوروپيوم، فإنها تستخدم في الغشاء البلوري لfluoride ion-selective electrodes.[2]
- Like horseradish peroxidase، يستخدم اللانثانم كمتتبع كثيف الإلكترونات في علم الأحياء الجزيئي.[21]
دوره الحيوي
اللانثانم ليس لده دور حيوي معروف. فالعنصر لا يـُمتص فموياً، وعند حقنه فإن التخلص منه يكون بطيء جداً. كربونات اللانثانم حصلت على موافقة بالاستخدام كـ medication Fosrenol لامتصاص الفوسفات الزائد في حالات المرحلة النهائية من الفشل الكلوي.[20]
While lanthanum has pharmacological effects on several receptors and ion channels, its specificity for the GABA receptor is unique among divalent cations. Lanthanum acts at the same modulatory site on the GABA receptor as zinc- a known negative allosteric modulator. The Lanthanum cation La3+ is a positive allosteric modulator at native and recombinant GABA receptors, increasing open channel time and decreasing desensitization in a subunit configuration dependent manner.[22]
الاحتياطات
يحتوي اللانثانم على مستوى منخفض إلى متوسط من السمية، ويجب التعامل معه بحرص. وفي الحيوانات، يؤدي الحقن بمحاليل اللانثانم إلى glycaemia، انخفاض ضغط الدم، وتدهور الطحال وتحورات كبدية.
اللنثانوم من المعادن النادرة أيضاً، يتواجد في المنازل في الأجهزة التى
يعتمد عليها الإنسان مثل التلفزيونات الملونة، مصابيح الفلوروسنت، المصابيح والزجاج الذى يوفر الطاقة. يوجد معدن اللنثانوم في الطبيعة بندرة، ويتزايد مع الأيام الاعتماد على هذا العنصر الفلزى لأنه يستخدم كعامل مساعد في الصناعة ولتلميع الزجاج.
معدن اللنثانوم خطيراً في بيئة العمل لاستنشاق الغازات والأبخرة المشبعة به في الهواء وهذا يسبب الصمامة الرئوية Lung embolism، صمامة الشريان الرئوى هو انسداد مفاجىء للتدفق الدموى في شريان الرئة، وهذا الانسداد قد تسببه التجلطات الدموية، ورم، السائل الأمينوسى، أو دهون في الشريان وخاصة على المدى الطويل بالتعرض له. يسبب معدن اللنثانوم السرطان للإنسان، وخاصة سرطان الرئة عند استنشاقه. يضر بكبد الإنسان عندما يتراكم في الجسم.[23]:
لم تصل نتائج من دراسات أُجريت عن تعرض الإنسان للإصابة بالتسمم عند تناول الأطعمة المشبعة به.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الهامش
- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics (PDF). CRC press. 2000. ISBN 0849304814.
- ^ أ ب ت ث ج خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةpatnaik - ^ "Chemical reactions of Lanthanum". Webelements. Retrieved 2009-06-06.
- ^ "Lighting". 11th edition of Encyclopedia Britannica (1911). Retrieved 2009-06-06.
- ^ "Inside the Nickel Metal Hydride Battery" (PDF). Retrieved 2009-06-06.
- ^ Tliha, M (2007). "AB5-type hydrogen storage alloy used as anodic materials in Ni-MH batteries". Journal of Alloys and Compounds. 436: 221. doi:10.1016/j.jallcom.2006.07.012.
- ^ "As hybrid cars gobble rare metals, shortage looms". Reuters 2009-08-31.
- ^ Bauerlein, P (2008). "Progress in high-power nickel–metal hydride batteries". Journal of Power Sources. 176: 547. doi:10.1016/j.jpowsour.2007.08.052.
- ^ أ ب ت ث ج C. R. Hammond (2000). The Elements, in Handbook of Chemistry and Physics 81th edition. CRC press. ISBN 0849304814.
- ^ Uchida, H (1999). "Hydrogen solubility in rare earth based hydrogen storage alloys". International Journal of Hydrogen Energy. 24: 871. doi:10.1016/S0360-3199(98)00161-X.
- ^ Jason D. Sommerville and Lyon B. King. "Effect of Cathode Position on Hall-Effect Thruster Performance and Cathode Coupling Voltage" ([dead link]). 43rd AIAA/ASME/SAE/ASEE Joint Propulsion Conference & Exhibit, 8 - 11 July 2007, Cincinnati, OH. Retrieved 2009-06-06.
- ^ Harrington, James A. "Infrared Fiber Optics" (PDF). Rutgers University.
- ^ "BrilLanCeTM Scintillators Performance Summary: Scintillation Products Technical Note" (PDF). Retrieved 2009-06-06.
- ^ Kim, K (2003). "The effect of lanthanum on the fabrication of ZrB2–ZrC composites by spark plasma sintering". Materials Characterization. 50: 31. doi:10.1016/S1044-5803(03)00055-X.
- ^ "Phosphate in swimming pools - the real cause of algae". Retrieved 2009-06-06.
- ^ Howard B. Cary (1995). Arc welding automation. CRC Press. p. 139. ISBN 0824796454.
- ^ Larry Jeffus. (2003). "Types of Tungsten". Welding : principles and applications. Clifton Park, N.Y.: Thomson/Delmar Learning. p. 350. ISBN 9781401810467.
- ^ C. K. Gupta, Nagaiyar Krishnamurthy (2004). Extractive metallurgy of rare earths. CRC Press. p. 441. ISBN 0415333407.
- ^ S. Nakai, A. Masuda, B. Lehmann (1988). "La-Ba dating of bastnaesite" (PDF). American Mineralogist. 7: 1111.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ أ ب "FDA approves Fosrenol(R) in end-stage renal disease (ESRD) patients". 28 October 2004. Retrieved 2009-06-06.
- ^ Chau YP, Lu KS (1995). "Investigation of the blood-ganglion barrier properties in rat sympathetic ganglia by using lanthanum ion and horseradish peroxidase as tracers". Acta Anatomica (Basel). 153 (2): 135–144. ISSN 0001-5180. PMID 8560966.
- ^ Boldyreva, A. A. (2005). "Lanthanum Potentiates GABA-Activated Currents in Rat Pyramidal Neurons of CA1 Hippocampal Field". Bulletin of Experimental Biology and Medicine. 140: 403. doi:10.1007/s10517-005-0503-z.
- ^ المعادن الثقيلة.. سموم بيئية، فيدو
انظر أيضا
المصادر
- Los Alamos National Laboratory - Lanthanum
- "The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium", by R.J. Callow, Pergamon Press 1967
- "Chemistry of the Lanthanons", by R.C. Vickery, Butterworths 1953
- "Nouveau Traite de Chimie Minerale, Vol. VII. Scandium, Yttrium, Elements des Terres Rares, Actinium", P. Pascal, Editor, Masson & Cie 1959
- "Extractive Metallurgy of Rare Earths", by C.K. Gupta and N. Krishnamurthy, CRC Press 2005
الكتب
- The Industrial Chemistry of the Lanthanons, Yttrium, Thorium and Uranium, by R.J. Callow, Pergamon Press 1967
- Extractive Metallurgy of Rare Earths, by C.K. Gupta and N. Krishnamurthy, CRC Press 2005
- Nouveau Traite de Chimie Minerale, Vol. VII. Scandium, Yttrium, Elements des Terres Rares, Actinium, P. Pascal, Editor, Masson & Cie 1959
- Chemistry of the Lanthanons, by R.C. Vickery, Butterworths 1953
وصلات خارجية
| الجدول الدوري | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | ||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Uub | Uut | Uuq | Uup | Uuh | Uus | Uuo | ||||||||||
| |||||||||||||||||||||||||||||||||||||||||