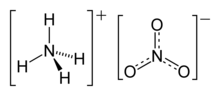
نترات الأمونيوم
| |
| |

| |
| الأسماء | |
|---|---|
| اسم أيوپاك
نترات الأمونيوم
| |
| Identifiers | |
| رقم CAS | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.026.680 |
| رقم RTECS |
|
| UNII | |
| UN number | 0222 – مع > 0.2% المواد القابلة للاشتعال 1942 – مع <= 0.2% المواد القابلة للاشتعال 2067 – الأسمدة 2426 – السوائل |
CompTox Dashboard (EPA)
|
|
| InChI | InChI={{{value}}} |
| SMILES | |
| الخصائص | |
| الصيغة الجزيئية | (NH4)(NO3) |
| كتلة مولية | 80.052 g/mol |
| المظهر | صلب أبيض/رمادي |
| الكثافة | 1.725 g/cm3 (20 °س) |
| نقطة الانصهار | |
| نقطة الغليان | |
| قابلية الذوبان في الماء | 118 g/100 ml (0 °س) 150 g/100 ml (20 °س) 297 g/100 ml (40 °س) 410 g/100 ml (60 °س) 576 g/100 ml (80 °س) 1024 g/100 ml (100 °س)[1] |
| البنية | |
| البنية البلورية | trigonal |
| بيانات متفجر | |
| حساسية الصدم | منخفض جداً |
| حساسية الاحتكاك | منخفض جداً |
| سرعة الانفجار | 5270 m/s |
| المخاطر | |
| خطر رئيسي | Explosive |
| NFPA 704 (معيـَّن النار) | |
| الجرعة أو التركيز القاتل (LD, LC): | |
LD50 (الجرعة الوسطى)
|
2085–5300 مگ/كگ (عن طريق الفم في الفئران والجرذان)[2] |
| مركبات ذا علاقة | |
أنيونات أخرى
|
نترات الأمونيوم |
كاتيونات أخرى
|
نترات الصوديوم نترات البوتاسيوم نترات هيدروكسيل الأمونيوم |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
نترات الأمونيوم، هو مركب كيميائي صيغته الكيميائية هي NH 4NO 3. وهو مادة صلبة بلورية بيضاء اللون وشديد الذوبان في الماء. يشيع استخدام نترات الأمونيوم في الزراعة كسماد غني بالنتروجين.[3] كما تتضمن استخداماته الرئيسية الأخرى كمادة لتحضير المتفجرات التي تستخدم في التعدين، التحجير، والإنشاءات المدنية. وهو مكون أساسي في ANFO (مزيج نترات الأمونيوم/زيت الوقود)، مادة متفجرة صناعية شائعة تشكل 80% من المتفجرات المستخدمة في أمريكا الشمالية؛ وتستخدم بتركيبات شبيهة في صنع العبوات الناسفة. توقفت الكثير من البلدان عن استخدام نترات الأمونيوم في التطبيقات الاستهلاكية نظراً للمخاوف المتعلقة بإحتمالية إساءة استخدامها.[4]
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
التواجد
تتواجد نترات الأمونيوم في الطبيعة كمعدن طبيعي (gwihabaite – نظير الأمونيوم من النتر، ومركبات نترات آخرى مثل نترات الصوديوم المعروفن بالنتريت) في المناطق الجافة في صحراء أتاكاما في تشيلي، وعادة ما يتواجد كقشرة على الأرض و/أو بجانب النترات الأخرى، الأيودات، ومعادن الهاليدات. في الماضي، كان يتم تعدين نترات الأمونيوم، لكن ما يقرب من 100% من المادة الكيميائية المستخدمة حالياً اصطناعية.
التحضير
يحضر مركب نترات الأمونيوم من تمرير غاز الأمونياك في حمض الآزوت (تركيز 42%)، مع العلم أن تفاعل التحضير هذا ناشر للحرارة.
التفاعلات
تتفاعل نترات الأمونيوم مع هيدروكسيدات الفلزات، وتطلق الأمونيا وتشكل نترات الفلزات القلوية:
- NH4NO3 + NaOH → NH3 + H2O + NaNO3
- NH4NO3 + KOH → NH3 + H2O + KNO3
تُنتج نترات الأمونيوم كلوريد الأمونيوم وأكسيد النتريك عند تفاعلها مع حمض الهيدروكلوريك:
- NH4NO3 + HCl → NH4Cl + HNO3
لا تترك نترات الأمونيوم أي بقايا عند تسخينها:
- NH4NO3 Δ→ N2O + 2H2O
كما تتشكل نترات الأمونيوم في الغلاف الجوي نتيجة انبعاثات NO، SO2 وNH3 وهي مكون ثانوي في PM10.[5]
الحالات البلورية
التحولات للحالات البلورية يحدث نتيجة تغير الظروف (درجة الحرارة، الضغط) المؤثرة على الخصائص الفيزيائية لنترات الأمونيوم. تم التعرف على الحالات البلورية التالية:
| النظام | درجة الحرارة (°س) | الطور | تغير الحجم (%) |
|---|---|---|---|
| > 169.6 | سائل | ||
| I | 169.6 إلى 125.2 | مكعب | −2.1 |
| II | 125.2 إلى 84.2 | tetragonal | +1.3 |
| III | 84.2 إلى 32.3 | α-rhombic | −3.6 |
| IV | 32.3 إلى −16.8 | β-rhombic | +2.9 |
| V | < −16.8 | tetragonal |
التطبيقات
الأسمدة
نترات الأمونيوم هو سماد هام بترتيب NPK 34-0-0 (34% نتروجين).[6] وهي نسبة أقل من تلك الموجودة في اليوريا (46-0-0)، مما يعطي نترات الأمونيوم قصوراً بسيطاً في النقل. تتميز نترات الأمونيوم عن اليوريا بأنها أكثر استقراراً ولا تفقد النتروجين بسرعة في الغلاف الجوي.
المتفجرات
كان التطور التالي في الأهمية بعد الديناميت والمتفجر الهلامي، حلول نترات الأمونيوم محل جزء من النتروگلسرين للحصول على منتج أكثر أماناً وأقل كلفة. وكان استخدام نترات الأمونيوم في صنع المتفجرات قد سجل عام 1867 من قبل كيميائيين آخرين في السويد، غير أن نوبل هو من صنع «ضروب الديناميت الممتاز» extra dynamites بإنتاج مزيج هلامي يحتوي على 20-60% نترات الأمونيوم.[7] وسعى كثيرون في الفترة بين عامي 1867 و1884 إلى تطوير مزيج نترات الأمونيوم الهلامي من دون نتائج مجدية؛ بسبب ميله لامتصاص الرطوبة غالباً. وفي عام 1885 توصل كيميائي أمريكي يدعى بنيمان R.S.Penniman إلى حل للمشكلة بتغليف نترات الأمونيوم بقليل من البارافين أو مادة مشابهة قبل استخدامه. وسرعان ما ظهرت بفضل هذا التطور أصناف عدة من ديناميت الأمونيا وشاع استخدامها. وبطل التغليف بعد أن تم التوصل إلى وسائل أكثر أماناً للتعامل مع مشكلة الرطوبة. وكل البلاد التي تستخرج الفحم من مناجم تحت الأرض تستخدم متفجرات من هذا النوع وفق ضوابط متفق عليها وتحت أسماء مختلفة. وتتصف هذه المتفجرات بضآلة كمية الحرارة التي تنشرها عند الانفجار، واحتواء معظمها على عامل تبريد مثل كلوريد الصوديوم (ملح الطعام) أو كلوريد الأمونيوم لمنع حرارة الانفجار من إشعال الغازات الموجودة تحت الأرض وغبار الفحم.
ونترات الأمونيوم مادة كيماوية مؤكسدة شديدة مما يسهل تنفيذ التفجيرات بواسطتها، إذ يمكن تفجيرها لدى تسخينها بشدة، او تحويلها إلى متفجرات شديدة في حالة استخدامها مع الوقود القابل للاحتراق، أو لدى وضعها مع المتفجرات الاخرى التي يراد زيادة قوتها التفجيرية. وتستخدم هذه المادة في المناجم، كما يستعملها مختلف جيوش العالم. ووفقا للتصنيفات المعتمدة من قبل ادارات الدفاع المدني، فان نترات الأمونيوم يمكن ادراجها ضمن المتفجرات التي تقترب من صنوف المتفجرات السريعة التي تتراوح السرعة الانفجارية لها بين 3000 وأكثر من 8500 متر في الثانية. والسرعة الانفجارية هي السرعة التي تنتقل بها موجة الانفجار داخل جزيئات المادة. وتقع السرعة الانفجارية لنترات الأمونيوم بين 2500 و2700م في الثانية، وللمقارنة تبلغ السرعة الانفجارية لمادة «تي. أن. تي» الشديدة الانفجار 6900 م/ثانية، بينما تتراوح بالنسبة للنتروجليسرين بين 7500 و8000 م/ثانية.[8]
خلطه بزيت الوقود
ANFO هو خليط يحتوي على 94% نترات الأمونيوم ("AN") و6% زيت الوقود ("FO") يستخدم على نطاق واسع كمادة صناعية شديدة الانفجار.[9] يستخدم في تعدين الفحم، المحاجر، وتعدين الفلزات، والإنشاءات المدنية في التطبيقات منخفضة الطلب، حيث تكون مزايا التكلفة المنخفضة لـ ANFO وسهولة الاستخدام أكثر من الفوائد التي تقدمها المتفجرات الصناعية التقليدية، مثل مقاومة الماء، وتوازن الأكسجين، وسرعة التفجير العالية، والأداء بأقطار صغيرة.[9]
الإرهاب
استخدمت متفجرات كانت نترات الأمونيوم مكون أساسي بها في تفجير سترلينگ هول في ماديسون، وسكنسن عام 1970، وكذلك في تفجير مدينة أوكلاهوما عام 1995، وتفجيرات دلهي 2011، تفجير أوسلو 2011، وتفجيرات حيدر آباد 2013.
في نوفمبر 2009، فرضت الحكومة الپاكستانية حظراً على أسمدة كبريتات الأمونيوم، نترات الأمونيوم، ونترات الأمونيوم-كالسيوم في تقسيم ملاكند - الذي يضم أضلع دير العليا، دير السفلى، سوات، چيترال، وملاكند في إقليم التخوم الشمالية الغربية في پاكستان، في أعقاب تقارير تفيد بأن هذه المواد الكيمياوية تستخدم من قبل المسلحين لصنع المتفجرات. نظراً لهذا الحظر، أصبح المتمردون يستخدمون كلوريد الپوتاسيوم - المادة التي تجعل الكبريت قابلاً للاشتعال- كمادة مفضلة لصنع المتفجرات.[10]
الاستخدامات المتخصصة
تستخدم نترات الأمونيوم في بعض الحقائب المقاومة للبرودة، وتنحل في الماء في التفاعلات الماصة للحرارة. كما كانت تستخدم مع أنواع "الوقود" المتفجرة الأخرى بشكل مستقل مثل نترات الگوانيدين،[11][12] كبديل رخيص (لكنه أقل استقراراً) عن 5-أمينوتترازول في نافخات الوسائد الهوائية التي تنتجها شركة تاكاتا، والتي تم سحبها من الأسواق لعدم السلامة بعدما أدت لمقتل 14 شخصاً.[13]
أظهر محلول نترات الأمونيوم مع حمض النتريك، الذي يسمى كاڤيا-ب، نتائج واعدة لاستخدامها في المركبات الفضائية كبديل أكثر نشاطًا للمضادات الحيوية الشائعة كثل الهيدرازين. أجري عدد من التجارب في الستينيات ولكن انتهى الأمر بعدم اعتماد المادة من قبل وكالة ناسا.
السلامة، التداول والتخزين
بيانات الصحة والسلامة معروضة في صحيفة بيانات السلامة المتاحة من قبل الموردين وهي متوافرة على الإنترنت.[14] رداً على العديد من الانفجارات التي أسفرت عن مقتل العديد من الأشخاص، أصدرت وكالات حماية البيئة الأمريكية (EPA) والصحة والسلامة المهنية (OSHA) ومكتب الكحول والتبغ والأسلحة النارية مبادئ توجيهية للسلامة.[15]
قد يتسبب التسخين أو أي مصدر إشعال في حدوث احتراق أو انفجار شديد.[16] تتفاعل نترات الأمونيوم مع المواد القابلة للاشتعال والاختزال لأنها مادة مؤكسدة قوية. على الرغم من أنها تستخدم بشكل أساسي لصناعة الأسمدة، إلا أنه يمكن استخدامها في تصنيع المتفجرات. كان تستخدم في بعض الأحيان لنسف الأرض لصنع أحواض المزارع.[17][18] كما تستخدم نترات الأمونيوم لتعديل معدل تفجير المتفجرات الأخرى، مثل ثلاثي نترو التولوين على شكل أماتول.
هناك العديد من إرشادات السلامة المتوافرة لتخزين وتداول نترات الأمونيوم.[19] يجب عدم تخزين نترات الأمونيوم بالقرب من مواد قابلة للاشتعال. نترات الأمونيوم غير متوافقة مع مواد معينة مثل الكلوريت، الأحماض المعدنية وكبريتيد الفلزات، يمكن أن يؤدي التلامس إلى تحلل قوي أو حتى عنيف.[20]
تبلغ الرطوبة النسبية الحرجة لنترات الأمونيوم 59.4%، الرطوبة الزائدة سوف تمتص من الغلاف الجوي. لذلك، من المهم تخزين نترات الأمونيوم في حاوية محكمة الإغلاق. خلاف ذلك، يمكن أن تتجمع في كتلة صلبة كبيرة. يمكن أن تمتص نترات الأمونيوم ما يكفي من الرطوبة للتسييل. مزج نترات الأمونيوم مع بعض الأسمدة الأخرى يمكن أن يقلل من الرطوبة النسبية الحرجة.[21]
أدت إمكانية استخدام المواد كمتفجرات إلى اتخاذ تدابير تنظيمية. على سبيل المثال، في أستراليا، في أغسطس 2005، دخلت لوائح البضائع الخطرة حيز التنفيذ لفرض الترخيص في التعامل مع هذه المواد.[22] يتم منح التراخيص فقط لمقدمي الطلبات (الصناعية) مع تطبيق الإجراءات الأمنية المناسبة لمنع أي إساءة استخدام.[23] يمكن أيضاً النظر في استخدامات إضافية مثل أغراض التعليم والبحث، ولكن الاستخدام الفردي لن يتم النظر فيه. لا يزال يتعين على الموظفين الذين لديهم تراخيص للتعامل مع المادة أن يخضعوا للإشراف من قبل الموظفين المصرح لهم ويطلب منهم اجتياز فحص الأمن والشرطة الوطنية قبل منح الترخيص.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
المخاطر الصحية
التعرض لفترات قصيرة لنترات الأمونيوم قد يتسبب في أعراض تتراوح بين التهيج البسيط إلى الغثيان، القيء، اضطراب الهضم، الصداع، الدوار وارتفاع ضغط الدم.[24]
| منطقة التعرض | مستوى الخطر |
|---|---|
| الطعام الداخل للمعدة | خطر متوسط |
| لمس الجلد | خطر متوسط (تهيج) |
| لمس العين | خطر متوسط |
| الاستنشاق | خطر متوسط |
التأثيرات على المدى الطويل
| أنواع التأثير | مستوى التأثير |
|---|---|
| تأثيرات مسرطنة | على الرغم من عدم توفر دراسات خاصة بنترات الأمونيوم، قد تختزل اختزال النترات إلى نتريت في الجسم، ويمكن للنتريتات المشكلة أن تتفاعل فيما بعد مع الأمينات لتشكيل مواد مسرطنة مشتبه بها ن-نتروسامين.[25] |
| تأثيرات الطفرات | بصفة عامة، تعتبر النترات والنتريتات سامة جينياً..[25] |
| تأثيرات تشوهية | لا يوجد |
| السمية التطورية | على الرغم من عدم تحديدها نترات الأمونيوم، فقد أظهرت بعض الدراسات وجود صلة بين العيوب الخلقية (خاصة تشوهات الأنبوب العصبي) ومياه الآبار الملوثة بالنترات. |
| التعرض لفترات طويلة | يسبب تلفاً للرئتين والأغشية المخاطية وقد يتسبب أيضاً في تلف الدم والجهاز الهضمي. قد يسبب الابتلاع المزمن للمادة أيضاً التهاب الكلى.[25] |
الكوارث
تتحلل نترات الأمونيوم في الغاز وأكسيد النيتروز وبخار الماء عند تسخينها (وليس رد فعل متفجر)؛ ومع ذلك، يمكن تحفيزها على التحلل المتفجر بواسطة التفجير. يمكن أن تشكل المخزونات الكبيرة من نترات الأمونيوم خطراً كبيراً لاندلاع حريق بسبب دعمها الأكسدة، وقد تنفجر أيضاً، كما حدث في كارثة تكساس سيتي عام 1947، مما أدى إلى تغييرات كبيرة في لوائح التخزين والتعامل معها.
هناك فئتان رئيسيتان من الحوادث التي أسفرت عن انفجارات نترات الأمونيوم هي:
- حدوث الانفجار بآلية الانتقال من الصدمة إلى التفجير. يحدث الاشتعال الأولي بواسطة شحن مادة متفجرة في الكتلة، أو بتفجير قذيفة يتم إلقائها على الكتلة، أو بتفجير خليط من مادة متفجرة على اتصال بالكتلة. ومن أمثلة ذلك: كريڤالد، مورگان (سايرڤيل، نيوجرزي حالياً)، أوپاو، وتسندرلو.
- يحدث التفجير نتيجة حريق ينتشر إلى نترات الأمونيوم نفسها (تكساس سيتي، برس، أوكدال)، أو بسبب مزيج من نترات الأمونيوم ومادة قابلة للاشتعال أثناء الحريق (رپونو، شيركوى، نادادورس). يجب أن يقتصر الحريق على درجة انتقال ناجحة من مرحلة الحريق إلى الانفجار (ظاهرة تعرف باسم "التحول من الانفجار إلى التفجير)"). نترات الأمونيوم هي مادة نقية ومضغوطة ومستقرة ويصعب إشعالها، وتوجد حالات عديدة لا تنفجر فيها نترات الأمونيوم حتى في حالة نشوب حريق.
انظر أيضاً
المصادر
- ^ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. p. 362. ISBN 1-903996-65-1.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ^ Ammonium nitrate sold by ton as U.S. regulation is stymied. – The Dallas Morning News
- ^ Int Panis, LLR (2008). "The Effect of Changing Background Emissions on External Cost Estimates for Secondary Particulates" (PDF). Open Environmental Sciences. 2: 47–53.
{{cite journal}}: Cite has empty unknown parameter:|month=(help) - ^ "Nutrient Content of Fertilizer Materials" (PDF). Archived from the original (PDF) on 2012-12-24. Retrieved 2012-06-27.
- ^ محمد وليد الجلاد. "المتفجرات". الموسوعة العربية. Retrieved 2013-11-29.
- ^ "«نترات الأمونيوم» المادة المفضلة لـ«القاعدة» في حرب الخراب والتدمير". جريدة الشرق الأوسط. 2004-04-01. Retrieved 2013-11-29.
- ^ أ ب Cook, Melvin A. (1974). The Science of Industrial Explosives. IRECO Chemicals. p. 1. ASIN B0000EGDJT.
- ^ Brook, Tom Vanden. "Afghan bomb makers shifting to new explosives for IEDs". USA TODAY.
- ^ {{{1}}} patent {{{2}}}
- ^ Airbag Compound Has Vexed Takata for Years – The New York Times
- ^ A Cheaper Airbag, and Takata’s Road to a Deadly Crisis. – The New York Times
- ^ "Ammonium nitrate MSDS".
- ^ Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate United States Environmental Protection Agency
- ^ Pradyot Patnaik (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ "Pothole pond" (PDF).
- ^ Progressive Farmer Magazine
- ^ "Storing and handling ammonium nitrate" (PDF).
- ^ "Chemical Engineering Transactions" (PDF). Archived from the original (PDF) on April 14, 2016.
- ^ Fertilizers Europe (2006). "Guidance for Compatibility of Fertilizer Blending Materials" (PDF).
- ^ "Dangerous Goods (HCDG) Regulations" (PDF).
- ^ Ammonium Nitrate-Regulating its use, Balancing Access & Protection from "Worksafe Victoria". Archived from the original on 2011-03-11.
- ^ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. ISBN 1-903996-65-1.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ^ أ ب ت خطأ استشهاد: وسم
<ref>غير صحيح؛ لا نص تم توفيره للمراجع المسماةMSDS
المراجع
- Properties: UNIDO and International Fertilizer Development Center (1998), Fertilizer Manual, Kluwer Academic Publishers, ISBN 0-7923-5032-4.
وصلات خارجية
- بطاقة السلامة الكيميائية العالمية 0216
- "Storing and Handling Ammonium Nitrate", United Kingdom Health and Safety Executive publication INDG230 (1986)
- Chemical Advisory: Safe Storage, Handling, and Management of Ammonium Nitrate United States Environmental Protection Agency
- Calculators: surface tensions, and densities, molarities and molalities of aqueous ammonium nitrate
| أملاح وأسترات أيون النترات | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO3)2 | B(NO3)4− | RONO2 | NO3− NH4NO3 |
O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO3)2 | Al(NO3)3 | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO3)2 | Sc(NO3)3 | Ti(NO3)4 | VO(NO3)3 | Cr(NO3)3 | Mn(NO3)2 | Fe(NO3)3 | Co(NO3)2, Co(NO3)3 |
Ni(NO3)2 | Cu(NO3)2 | Zn(NO3)2 | Ga(NO3)3 | Ge | As | Se | Br | Kr | ||
| RbNO3 | Sr(NO3)2 | Y | Zr(NO3)4 | Nb | Mo | Tc | Ru | Rh | Pd(NO3)2 | AgNO3 | Cd(NO3)2 | In | Sn | Sb | Te | I | XeFNO3 | ||
| CsNO3 | Ba(NO3)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(NO3)2, Hg(NO3)2 |
Tl(NO3)3 | Pb(NO3)2 | Bi(NO3)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO3)x | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(NO3)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
- Pages using Chembox with unknown parameters
- ECHA InfoCard ID from Wikidata
- Chemical articles with unknown parameter in Chembox
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- مركبات الأمونيوم
- نترات
- كيماويات متفجرة
- مؤكسدات الصواريخ
- مؤكسدات الألعاب النارية
- أيض النيتروجين
- محسنات التربة
- أسمدة غير عضوية
- عوامل مؤكسدة


