سرطان الغدة الدرقية اللبي
| سرطان الغدة الدرقية اللبي | |
|---|---|
| الأسماء الأخرى | MTC |
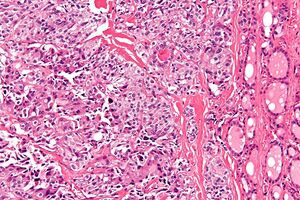 | |
| صورة مجهرية لسرطان الغدة الدرقية اللبي مع ترسب نشواني (يسار الصورة). تظهر أيضًا بصيلات الغدة الدرقية الطبيعية (يمين الصورة). H&E stain. | |
| التخصص | جراحة الأنف والأذن والحنجرة |
سرطان الغدة الدرقية اللبي (إنگليزية: Medullary thyroid cancer)، هو شكل من أشكال سرطان الغدة الدرقية الذي ينشأ من الخلايا المجاورة للجريب (الخلايا C) ، التي تنتج هرمون الكالسيتونين.[1] الأورام النخاعية هي ثالث أكثر أنواع سرطانات الغدة الدرقية شيوعًا وتشكل معًا حوالي 3٪ من جميع حالات سرطان الغدة الدرقية.[2] تم تمييز سرطان الغدة الدرقية اللبي لأول مرة في عام 1959.[3]
ما يقرب من 25٪ من حالات سرطان الغدة الدرقية النخاعية وراثية بطبيعتها ، وتسببها طفرة في الجين الورمي الأولي لمستقبلات بروتين التيروزين كيناز . عندما يحدث سرطان الغدة الدرقية اللبي من تلقاء نفسه يطلق عليه سرطان الغدة الدرقية النخاعي الفرادي (SMTC). يُلاحظ سرطان الغدة الدرقية اللبي لدى الأشخاص المصابين بأورام الغدد الصماء المتعددة من النوع 2A و 2B . عندما يحدث سرطان الغدة الدرقية اللبي بدون أورام الغدد الصماء الأخرى ، يطلق عليه سرطان الغدة الدرقية اللبي العائلي (FMTC).
الأعراض والعلامات
الأعراض السريرية الرئيسية لسرطان الغدة الدرقية اللبي النقيلي هو الإسهال . في بعض الأحيان يكون لدى المريض نوبات بيغ يحدث كلاهما بشكل خاص مع نقيلة في الكبد ، وقد يكون أي من الأعراض هو أول مظهر من مظاهر المرض. لا يمكن تمييز البيغ الذي يحدث في سرطان الغدة الدرقية اللبي عن ذلك المرتبط بالمتلازمة السرطاوية. في سرطان الغدة الدرقية اللبي، والتنظيف، والإسهال، والحكة (الحكة) كلها الناجمة عن مستويات مرتفعة من منتجات جين هرمون الكالسيتونين (الكالسيتونين أو ببتيد مرتبط بجين الكالسيتونين.[4] وبالمقارنة ، فإن البيغ والإسهال الذي لوحظ في المتلازمة السرطاوية ناتج عن ارتفاع مستويات السيروتونين المنتش.
قد ينتج عن سرطان الغدة الدرقية اللبي أيضًا عقيدة الغدة الدرقية وتضخم العقد الليمفاوية العنقية.[4]
تشمل مواقع انتشار سرطان الغدة الدرقية اللبي العقد الليمفاوية المحلية في الرقبة والعقد الليمفاوية في الجزء المركزي من الصدر ( المنصف ) والكبد والرئة والعظام. ينتشر إلى مواقع أخرى مثل الجلد أو الدماغ ولكنه يحدث ولكنه غير شائع.
علم الوراثة
تؤدي الطفرات (تغييرات الحمض النووي) في الجين الورمي الأولي لمستقبلات بروتين التيروزين كيناز ، الموجود على الكروموسوم 10 ، إلى التعبير عن مستقبلات بروتين التيروزين كيناز المتغيرة ، والتي يطلق عليها RET (إعادة الترتيب أثناء التعداء). تشارك `` مستقبلات بروتين التيروزين كيناز '' في تنظيم نمو الخلايا وتطورها ، وتعد طفرة السلالة الجرثومية مسؤولة عن جميع حالات سرطان الغدة الدرقية اللبي الوراثي أو العائلي تقريبًا. قد تكون طفرة السلالة الجرثومية مسؤولة أيضًا عن تطور فرط نشاط جارات الدرقية وورم القواتم . يتم توريث سرطان الغدة الدرقية اللبي الوراثي كصفة جسمية سائدة ، مما يعني أن كل طفل من أحد الوالدين المصاب لديه احتمال بنسبة 50٪ لوراثة الجين السرطاني الطافر مستقبلات بروتين التيروزين كيناز من الوالد المصاب. يتيح تحليل الحمض النووي التعرف على الأطفال الذين يحملون الجين الطافر ؛ يعتبر الاستئصال الجراحي للغدة الدرقية عند الأطفال الذين يحملون الجين الطافر علاجًا إذا تمت إزالة الغدة الدرقية بالكامل في سن مبكر قبل انتشار الورم. تتم إزالة أورام الغدة الجار درقية وورم القواتم عندما تسبب أعراضًا سريرية. يمثل سرطان الغدة الدرقية اللبي الوراثي أو أورام الغدد الصماء المتعددة (MEN2) ما يقرب من 25 ٪ من جميع سرطانات الغدة الدرقية اللبية.
خمسة وسبعون بالمائة من سرطان الغدة الدرقية اللبي يحدث في الأفراد الذين ليس لديهم تاريخ عائلي محدد ويتم وصفه بمصطلح "فرادي". الأفراد الذين يصابون بسرطان الغدة الدرقية اللبي المتقطع يميلون إلى أن يكونوا أكبر سناً ولديهم مرض أكثر انتشارًا في وقت العرض الأولي من أولئك الذين لديهم تاريخ عائلي (من المرجح أن يبدأ الفحص في سن مبكر في شكل وراثي). ما يقرب من 25-60 ٪ من سرطانات الغدة الدرقية اللبية الفرادية لها طفرة جسدية (واحدة تحدث داخل خلية واحدة "مجاور للجراب") من الجين الورمي الأولي لمستقبلات بروتين التيروزين كيناز يُفترض أن تكون هذه الطفرة هي الحدث البادئ ، على الرغم من أنه قد تكون هناك أسباب أخرى غير معروفة حتى الآن.
الدلالات
في حين أن زيادة تركيز الكالسيتونين في الدم ليس ضارًا ، إلا أنه مفيد كدلالة يمكن اختبارها في الدم.[5]
الدلالة الثانية ، المستضد السرطاني المضغي (CEA) ، التي تنتج أيضًا عن سرطان الغدة الدرقية اللبي ، في الدم وهو مفيد كمصل أو دلالة لورم الدم. بشكل عام ، يعتبر قياس مصل CEA أقل حساسية من الكالسيتونين في المصل للكشف عن وجود ورم ، ولكن له تقلبات أقل من دقيقة إلى دقيقة ، وبالتالي فهو مفيد كمؤشر لكتلة الورم.
التشخيص
يتم التشخيص بشكل أساسي عن طريق الشفط بالإبرة الدقيقة لآفة الغدة الدرقية لتمييزها عن الأنواع الأخرى من آفات الغدة الدرقية.[6] سيظهر الفحص المجهري سدى نشواني مع تضخم في الخلايا المجاورة للجريب.
العلاج
كانت الجراحة والعلاج الإشعاعي من العلاجات الرئيسية لسرطان الغدة الدرقية اللبي. يجب فحص مستوى البلازما من الميتانفرين قبل إجراء استئصال الغدة الدرقية الجراحي لتقييم وجود ورم القواتم حيث أن 25٪ من الأشخاص الذين يعانون من سرطان الغدة الدرقية اللبي لديهم الشكل الموروث من متلازمة MEN2A. يؤدي ورم القواتم غير المشخص إلى ارتفاع خطر الإصابة بأزمةفرط ضغط الدم وربما الوفاة أثناء العملية.
الجراحة
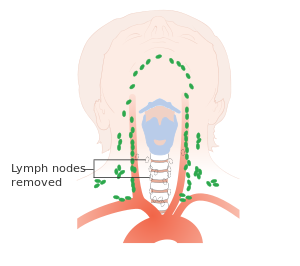
يعتبر استئصال الغدة الدرقية الكلي مع تشريح العنق الثنائي المعيار الذهبي لعلاج سرطان الغدة الدرقية اللبي ، وهو الوسيلة الأكثر تحديدًا لتحقيق الشفاء للمرضى دون وجود نقائل بعيدة أو تورط عقدي واسع النطاق. تشمل مخاطر الجراحة فقدان التحكم في الصوت ، أو تلف الأعصاب الذي لا يمكن إصلاحه ، أو الوفاة ، أو الحاجة إلى إجراء عملية ثانية لتنظيف ما تبقى من العقد الليمفاوية المريضة المتبقية إذا كانت خزعة العقدة الحارسة إيجابية لانتشار السرطان. يمكن أن تكون الجراحة المكثفة فعالة عندما يتم اكتشاف الحالة مبكرًا ، ولكن لا يزال هناك خطر من تكرارها ، خاصة في المرضى الذين يعانون من الغدد الليمفاوية الإيجابية المتعددة أو الغزو خارج المحفظة.[1][7] حوالي نصف المرضى لديهم ورم خبيث في العقد الليمفاوية الإقليمية في وقت التشخيص.[4]
نشرت الجمعية الأوروبية لجراحي الغدد الصماء توصيات لمعالجة هذه الحالة في ناقلات الجينات.[8] يعتمد توقيت الجراحة على نوع الطفرة الموجودة. بالنسبة لأولئك في المجموعة الأكثر خطورة ، يوصى بإجراء الجراحة في السنة الأولى من العمر. في الحالات الأقل خطورة ، قد تتأخر الجراحة حتى سن عشر سنوات ، ويعتمد التوقيت الدقيق على الطفرة وعوامل أخرى..
العلاج الإشعاعي
يوصى بالعلاج الإشعاعي الخارجي عندما يكون هناك خطر كبير من التكرار الموضعي ، حتى بعد العلاج الجراحي الأمثل.[9][10] في هذه الدراسة ، تمت مقارنة المرضى الذين عولجوا بأشعة الحزمة الخارجية مع مجموعة التحكم. كانت السيطرة على المرض بالإشعاع أفضل بكثير في المجموعة التي تلقت الإشعاع. كتب مؤلفو الدراسة [14]: "في 40 مريضًا عالي الخطورة (المرض المجهري المتبقي ، أو الغزو خارج الغدد ، أو تورط العقدة الليمفاوية) ، كان معدل الانتكاس المحلي / الإقليمي الخالي من الانتكاس 86 ٪ في 10 سنوات مع إشعاع الحزمة الخارجية بعد الجراحة (25) المرضى) ، و 52 ٪ لأولئك الذين لا يعانون من الإشعاع الخارجي بعد الجراحة (ع = 0.049). لتحسين السيطرة على الورم المحلي / الإقليمي ، نستمر بالتالي في تقديم النصح بالإشعاع الخارجي للمرضى المعرضين لخطر كبير من الانتكاس المحلي / الإقليمي"
على عكس سرطان الغدة الدرقية المتمايز الآخر ، لا يوجد دور للعلاج باليود المشع في مرض من النوع النخاع.[11]
مثبطات كيناز البروتين
أظهرت التجارب السريرية لمثبطات بروتين كينيز,[12]التي تمنع بروتينات كيناز غير الطبيعية المشاركة في تطوير ونمو الخلايا السرطانية النخاعية ، دليلًا واضحًا على الاستجابة في 10-30٪ من المرضى. في غالبية المستجيبين كان هناك انخفاض أقل من 30٪ في كتلة الورم ، ومع ذلك كانت الاستجابات دائمة. كانت الردود مستقرة لفترات تزيد عن 3 سنوات. تشمل الآثار الجانبية الرئيسية لهذه الفئة من الأدوية فرط ضغط الدم ، والغثيان ، والإسهال ، وبعض التشوهات الكهربائية القلبية ، ونوبات التخثر أو النزيف.
كان فانديتانيب ، الاسم التجاري كابريسلا ، أول دواء (أبريل 2011) تمت الموافقة عليه من قبل إدارة الغذاء والدواء الأمريكية (FDA) لعلاج سرطان الغدة الدرقية اللبي (النقيلي) في المرحلة المتأخرة في المرضى البالغين غير المؤهلين لإجراء الجراحة.[13]
حصل كابوزانتينيب ، الاسم التجاري كوميتريج ، على موافقة التسويق (نوفمبر 2012) من قبل إدارة الغذاء والدواء الأمريكية لهذا المؤشر..[14] تم تقييم كابوزانتينيب وهو مثبط قوي لـ مستقبلات بروتين التيروزين كيناز و MET و VEGF في تجربة مضبوطة بالدواء بالغفل مزدوجة التعمية. ثبت أنه يحسن البقاء على قيد الحياة بشكل عام لمدة 5 أشهر للفوج المعالج مقابل الدواء الغفل ، والذي لم يكن ذا دلالة إحصائية. ومع ذلك ، كان الكابوزانتينيب فعالًا بشكل خاص في المرضى الذين يعانون من طفرة RET M918T ، مما أدى إلى إطالة فترة البقاء على قيد الحياة لمدة عامين تقريبًا ، ومضاعفة البقاء على قيد الحياة مقابل المريض غير المعالج (4 سنوات مقابل عامين). يتطلب العلاج باستخدام كابوزانتينيب العديد من تقليل الجرعة للتخفيف من الآثار الجانبية. تم اقتراح أن تكون الجرعة التجريبية 140 كان ملجم مفرطًا ، خاصة في مرضى كتلة الجسم السفلية. تم جدولة التجارب الجارية لتحديد المزيد من أنظمة الجرعات المثلى. تم ملاحظة النشاط ، في الممارسة العملية بجرعات 1.2 ملغم / كغم.
مآل المرض
اعتمادًا على المصدر ، يبلغ معدل البقاء على قيد الحياة لمدة 5 سنوات لسرطان الغدة الدرقية النخاعي 80٪,[15] 83%[16] or 86%,[6] ومعدل البقاء على قيد الحياة لمدة 10 سنوات 75٪.[15]
من خلال مراحل السرطان الإجمالية في المراحل الأولى إلى الرابعة ، يكون معدل البقاء على قيد الحياة لمدة 5 سنوات 100٪ في المرحلة الأولى ، و 98٪ في المرحلة الثانية ، و 81٪ في المرحلة الثالثة ، و 28٪ في المرحلة الرابعة.[17] يكون تشخيص سرطان الغدة الدرقية اللبي أضعف من تشخيص سرطان الغدة الدرقية الجرابي والحليمي عندما ينتشر (ينتشر) خارج الغدة الدرقية.
تمت دراسة القيمة الإنذارية لقياس تركيزات الكالسيتونين والمستضد السرطاني المضغي (CEA) في الدم لدى 65 مريضًا من سرطان الغدة الدرقية اللبي لديهم مستويات غير طبيعية من الكالسيتونين بعد الجراحة (استئصال الغدة الدرقية الكلي وتشريح العقدة الليمفاوية)).[18] يرتبط المآل بالمعدل الذي يتضاعف فيه تركيز الكالسيتونين بعد الجراحة ، ويطلق عليه وقت مضاعفة الكالسيتونين (CDT) ، بدلاً من مستوى الكالسيتونين المطلق قبل أو بعد الجراحة::
- وقت مضاعفة الكالسيتونين أقل من 6 أشهر: نجا 3 مرضى من أصل 12 (25٪) لمدة 5 سنوات. يعيش مريض واحد من بين 12 (8٪) لمدة 10 سنوات. مات جميعهم في غضون 6 أشهر إلى 13.3 سنة.
- وقت مضاعفة الكالسيتونين بين 6 أشهر وسنتين: نجا 11 مريضا من أصل 12 (92٪) من 5 سنوات. عاش 3 مرضى من أصل 8 (37٪) لمدة 10 سنوات. نجا 4 مرضى من أصل 12 (25٪) حتى نهاية الدراسة.
- وقت مضاعفة الكالسيتونين أكثر من عامين: كان 41 مريضًا من أصل 41 (100٪) على قيد الحياة في نهاية الدراسة. من بين هؤلاء مريض واحد كان الكالسيتونين مستقرًا ، و 11 مريضًا لديهم مستويات منخفضة من الكالسيتونين.
كان وقت مضاعفة الكالسيتونين أفضل تنبؤ لبقاء سرطان الغدة الدرقية اللبي مقارنة بمستضد سرطاني مضغي[18] ولكن يوصى باتباع كلا الاختبارين.[9][19]
المصادر
- ^ أ ب Hu MI, Vassilopoulou-Sellin R, Lustig R, Lamont JP. "Thyroid and Parathyroid Cancers" in Pazdur R, Wagman LD, Camphausen KA, Hoskins WJ (Eds) Cancer Management: A Multidisciplinary Approach. 11 ed. 2008.
- ^ Stamatakos M, Paraskeva P, Stefanaki C, Katsaronis P, Lazaris A, Safioleas K, Kontzoglou K (January 2011). "Medullary thyroid carcinoma: The third most common thyroid cancer reviewed". Oncol Lett. 2 (1): 49–53. doi:10.3892/ol.2010.223. PMC 3412473. PMID 22870127.
- ^ Dionigi G, Bianchi V, Rovera F, et al. (2007). "Medullary thyroid carcinoma: surgical treatment advances". Expert Rev Anticancer Ther. 7 (6): 877–85. doi:10.1586/14737140.7.6.877. PMID 17555398.
- ^ أ ب ت Goldman, Lee (2011). Goldman's Cecil Medicine (24th ed.). Philadelphia: Elsevier Saunders. pp. e76. ISBN 978-1437727883.
- ^ Fragu P (2007). "Calcitonin's fantastic voyage: from hormone to marker of a genetic disorder". Gesnerus. 64 (1–2): 69–92. PMID 17982960.
- ^ أ ب National Cancer Institute > Medullary Thyroid Cancer Last Modified: 12/22/2010
- ^ Schlumberger M, Carlomagno F, Baudin E, Bidart JM, Santoro M (2008). "New therapeutic approaches to treat medullary thyroid carcinoma". Nat Clin Pract Endocrinol Metab. 4 (1): 22–32. doi:10.1038/ncpendmet0717. PMID 18084343.
- ^ Niederle B, Sebag F, Brauckhoff M (2013) Timing and extent of thyroid surgery for gene carriers of hereditary C cell disease-a consensus statement of the European Society of Endocrine Surgeons (ESES).Langenbecks Arch Surg
- ^ أ ب Thyroid Carcinoma. NCCN guidelines. http://www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf
- ^ Brierley J, Tsang R, Simpson WJ, Gospodarowicz M, Sutcliffe S, Panzarella T (1996). "Medullary thyroid cancer: analyses of survival and prognostic factors and the role of radiation therapy in local control". Thyroid. 6 (4): 305–10. doi:10.1089/thy.1996.6.305. PMID 8875751.
- ^ Quayle FJ, Moley JF (2005). "Medullary thyroid carcinoma: including MEN 2A and MEN 2B syndromes". J Surg Oncol. 89 (3): 122–9. doi:10.1002/jso.20184. PMID 15719378.
- ^ "American Thyroid Association - Thyroid Clinical Trials". Archived from the original on 2007-12-12. Retrieved 2007-12-21.
- ^ "FDA approves new treatment for rare form of thyroid cancer". Retrieved 7 April 2011.
- ^ "FDA approves Cometriq to treat rare type of thyroid cancer". Retrieved 29 November 2012.
- ^ أ ب Numbers from National Cancer Database in the US, from Page 10 in: F. Grünwald; Biersack, H. J.; Grںunwald, F. (2005). Thyroid cancer. Berlin: Springer. ISBN 978-3-540-22309-2.
- ^ Barbet, J.; Campion, L.; Kraeber-Bodere, F.; Chatal, J. -F.; Group, T. G. T. E. S. (2005). "Prognostic Impact of Serum Calcitonin and Carcinoembryonic Antigen Doubling-Times in Patients with Medullary Thyroid Carcinoma". Journal of Clinical Endocrinology & Metabolism. 90 (11): 6077–6084. doi:10.1210/jc.2005-0044. PMID 16091497.
- ^ cancer.org > Thyroid Cancer Archived أكتوبر 18, 2013 at the Wayback Machine By the American Cancer Society. In turn citing: AJCC Cancer Staging Manual (7th ed).
- ^ أ ب Barbet J, Campion L, Kraeber-Bodéré F, Chatal JF (2005). "Prognostic impact of serum calcitonin and carcinoembryonic antigen doubling-times in patients with medullary thyroid carcinoma". J. Clin. Endocrinol. Metab. 90 (11): 6077–84. doi:10.1210/jc.2005-0044. PMID 16091497.
- ^ ASCO SEP 3rd edition
وصلات خارجية
| Classification | |
|---|---|
| External resources |