غرواني
الغرواني أو الغرويد أو المبعثر الغروي إنگليزية: Colloid هو أحد انماط المزائج المتجانسة.
colloid is a mixture in which one substance consisting of microscopically dispersed insoluble particles is suspended throughout another substance. Some definitions specify that the particles must be dispersed in a liquid,[1] while others extend the definition to include substances like aerosols and gels. The term colloidal suspension refers unambiguously to the overall mixture (although a narrower sense of the word suspension is distinguished from colloids by larger particle size). A colloid has a dispersed phase (the suspended particles) and a continuous phase (the medium of suspension).

Since the definition of a colloid is so ambiguous, the International Union of Pure and Applied Chemistry (IUPAC) formalized a modern definition of colloids:
The term colloidal refers to a state of subdivision, implying that the molecules or polymolecular particles dispersed in a medium have at least in one direction a dimension roughly between 1 nanometre and 1 micrometre, or that in a system discontinuities are found at distances of that order. It is not necessary for all three dimensions to be in the colloidal range…Nor is it necessary for the units of a colloidal system to be discrete…The size limits given above are not rigid since they will depend to some extent on the properties under consideration.[2]
This IUPAC definition is particularly important because it highlights the flexibility inherent in colloidal systems. However, much of the confusion surrounding colloids arises from oversimplifications. IUPAC makes it clear that exceptions exist, and the definition should not be viewed as a rigid rule. D.H. Everett—the scientist who wrote the IUPAC definition—emphasized that colloids are often better understood through examples rather than strict definitions.[3]
Some colloids are translucent because of the Tyndall effect, which is the scattering of light by particles in the colloid. Other colloids may be opaque or have a slight color.
Colloidal suspensions are the subject of interface and colloid science. This field of study began in 1845 by Francesco Selmi,[4][5][6][7] who called them pseudosolutions, and expanded by Michael Faraday[8] and Thomas Graham, who coined the term colloid in 1861.[9]
تصنيف الغروانيات
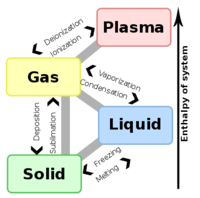
Colloids can be classified as follows:
| Medium/phase | Dispersed phase | |||
|---|---|---|---|---|
| Gas | Liquid | Solid | ||
| Dispersion medium |
Gas | No such colloids are known
Helium and xenon are known to be immiscible under certain conditions.[13][14] |
Liquid aerosol
Examples: fog, clouds, condensation, mist, steam, hair sprays |
Solid aerosol
Examples: smoke, ice cloud, atmospheric particulate matter |
| Liquid | Foam
Examples: whipped cream, shaving cream |
Emulsion or Liquid crystal
Examples: milk, mayonnaise, hand cream, latex, biological membranes, liquid biomolecular condensate |
Sol
Examples: pigmented ink, sediment, mud, precipitates, solid biomolecular condensate | |
| Solid | Solid foam
Examples: aerogel, floating soap, styrofoam, pumice |
Gel
Examples: agar, gelatin, jelly, gel-like biomolecular condensate |
Solid sol
Example: cranberry glass | |
Homogeneous mixtures with a dispersed phase in this size range may be called colloidal aerosols, colloidal emulsions, colloidal suspensions, colloidal foams, colloidal dispersions, or hydrosols.
Colloidal silica gel with light opalescence
Creams are semi-solid emulsions of oil and water. Oil-in-water creams are used for cosmetic purpose while water-in-oil creams for medicinal purpose
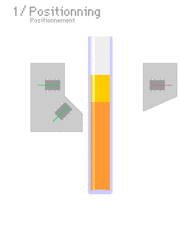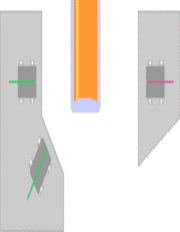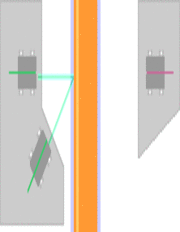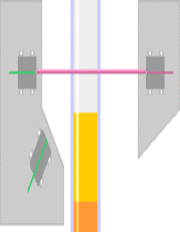
Tyndall effect in an opalite:
it scatters blue light making it appear blue from the side, but orange light shines through.
Opal is a gel in which water is dispersed in silica crystals.
شرح
لابد قبل الخوض في مجال الغرويات من التفريق بين المحاليل solutions والتبعثرات الغروية colloidal dispersions والمعلَّقات suspensions فهي جميعها مزائج. والمزيج هو أي شيء يتألف من مكوِّنين (عنصرين أو مركبين) أو أكثر بحيث تتحد المواد الداخلة في المزيج فيزيائياً أي تتحد هذه المواد من دون نسبة معينة، أي ليس لها تركيب معروف معيّن. وفي الواقع، عدد المزائج لايحصى لأنها لاتخضع لقانون النسب المعينة [ر: الاتحادات الكيميائية (قوانين ـ)]. فعلى سبيل المثال مزيج السكر العادي مع الماء يمكن أن يحضر بأي نسبة كانت، فالسكر له تركيب معين C12H22O11 والماء تركيبه معين أيضاً H2O، ولكن مزيج المادتين معاً يمكن أن يحضر بأي نسبة كانت، فقد يكون المحلول ممدداً بحيث يصعب الشعور بطعم السكر بالمحلول، أو يكون المحلول كثيفاً شديد الحلاوة. ومعظم الخواص الكيمياوية لمحلول السكر بالماء يمكن توقعها مع الأخذ بالحسبان الخواص الكيمياوية للسكر من جهة وللماء من جهة أخرى. أما بالنسبة للخواص الفيزيائية لمزائجهما فالأمر مختلف تماماً. إذ إن الخواص الفيزيائية للمزيج تتعلق بتآثر مكوِّناته.[15] والفرق الرئيسي بين المحاليل وبين التبعثرات الغروية وبين المعلَّقات يكمن في اختلاف حجم دقائق مكوّناتها.
المعلَّق مزيج فيه دقائق، واحدٌ أو أكثر من مكوِّناته كبير نسبياً أي يكون أحد أبعاده على الأقل أكبر من 100 نانومتر (100 نانومتر أو 100×10-9 متر)، مثال ذلك محلول الرمل الناعم في الماء. فإذا ترك المعلق، دون تحريكه أو خضه، ترسبت الدقائق الكبيرة بعد فترة طالت أو قصرت. ومعلقات المواد الصلبة في السوائل يمكن فصلها دوماً بعملية ترشيح عادية باستعمال ورق ترشيح أو بالمثـفِّلة cenrtifuge بفعل القوة النابذة. فالدم، على سبيل المثال، معلق للكريات الحمراء والبيضاء في البلازما.
تمثل التبعثرات الغروية حالة وسطية بين المحلول والمعلق، ومثال ذلك الجيلاتين، والحليب، والضباب، والبورسلين.
| الطور المتبَعثِر (شبيه بالمنحل) |
الوسط المبعثِر (شبيه بالمحِل) |
الاسم الشائع | أمثلة |
|---|---|---|---|
| صلب | صلب | حلالة صلبة | سبائك(خلائط) كثيرة (مثل الفولاذ) بعض الأحجار الكريمة الملونة المطاط المقسّ البورسلين ضروب البلاستيك |
| سائل | صلب | مستحلب صلب | الجبن الزبدة |
| غاز | صلب | الرغوة الصلبة | الإسفنج المطاط |
| صلب | سائل | حلالة أو هلام | الدهان الطين المانيزا |
| سائل | سائل | مستحلب | حليب المايونيز كريم الوجه |
| غاز | سائل | رغوة | كريم الحلاقة الرغوة التي تتشكل فوق البيرة |
| صلب | غاز | الرذاذ الصلب (دخان) | الغبار الدقائق الصلبة الصغيرة في الضباب الدخاني |
| سائل | غاز | إيروسول مائع | السحب الضباب بعض ملوثات الجو |
يتألف الغرواني من طورين منفصلين، طور مبعثر dispersed phase وطور مستمر continuous phase. يتألف الطور المبعثر من جزيئات دقيقة أو قطيرات موزعة ضمن الطور المستمر . قطر جزيئات الطور المبعثر بين 1 نانومتر و 1000 نانومتر على الأقل ضمن بعد واحد . المزائج المتجانسة ذات الطور المبعثر ضمن هذه القياسات تتراوح بين : مبعثرات غازية غروانية colloidal aerosols، أو مستحلبات غروانية colloidal emulsions أو رغوات غروانية colloidal foams أو مبعثرات غروانية colloidal dispersions. جزيئات أو قطيرات الطور المبعثر تتأثر بشكل كبير بكيمياء السطوح الموجودة في الغرويدات .
بسبب قياسات وأحجام الطور المبعثر يمكن ان يكون صعب القياس، كما ان تظهر الغروانيات على أنها محاليل، لذا فإن تمييز الغرويدات يتم أساسا بناء على خواصها وليس مظهرها. إذا كان الغرويد مكون من تبعثر جزيئات صلبة ضمن طور سائل فإن الجزيئات الصلبة لن تستطيع اجتياز غشاء غير نفوذ، في حين ان الأيونات أو الجزيئات المنحلة يمكنها ذلك ضمن المحلول: أي ان ما هو منحل يمكنه الانتشار عبر الغشاء في حين ما هو مبعثر لا يمكنه ذلك.
خواص التبعثرات الغروية
وجد توماس گراهام الكيميائي الاسكتلندي نحو عام 1860 أن مواد مثل الألبومين المأخوذ من البيض والنشاء والجلاتين والصمغ لا تنفذ في الماء إلا ببطء شديد، إذا ما قورنت مع السكر والملح. وتختلف هذه المواد بصورة رئيسية عن السكر والملح بقدرتها على النفوذ من خلال غشاء رقيق، فالسكر ينفذ خلال أنماط كثيرة من الأغشية، ولكن النشاء والألبومين والجلاتين لاتنفذ. وقد وجد غراهام، إضافة إلى ذلك، أن تلك المواد لايمكن بلورتها في حين يمكن بلورة السكر والملح من محاليلهما، ولهذا أطلق گراهامعلى هذه المحاليل اسم غروي colloid (وهي تعني صمغ باللغة اليونانية).
وقد وجد فيما بعد أنه يمكن بلورة بعض الغرويات من محاليلها بصعوبة، فليس هناك حدود واضحة فاصلة بين هذين النوعين المعلق والتبعثر الغروي. وعلى أي حال، هناك بعض الصفات التي تتميز بها الغرويات دون غيرها من المزائج:
- للمواد الغروية أوزان جزيئية عالية، ومثال ذلك خلايا الإنسان، والبروتينات كالهيموغلوبين التي لها أوزان جزيئية تقدر بالآلاف.
- دقائق الغروي كبيرة نسبياً، لذلك تبعثر الضوء المرئي عندما تبعثَر في المحِل فيبدو المحلول غائماً. وتدعى هذه الحادثة أثر تايندل Tyndall effect، ويلاحظ هذا الأثر في صباح ضبابي ورطب. ولهذا السبب، يصعب القيادة في الضباب بالليل، ولكن يخف هذا الفعل باستعمال مصابيح الضباب الصفراء، لأن طول موجة الضوء أطول من قطر الدقيقة ولهذا لا يتبعثر الضوء الأصفر في الضباب.
اكتشف روبرت براون عالم النبات الإنگليزي، باستعمال المجهر، أن الدقائق الصغيرة والمعلقة في السائل الغروي تتحرك باستمرار حركة عشوائية، وقد سميت هذه الحركة الحركة البراونية، نسبة له، وهي تنتج من اصطدامات الدقائق الغروية بجزيئات السائل المحيط، وتحول هذه الحركة دون تجمع هذه الدقائق وانفصالها عن المحلول الغروي.
إن معظم التبعثرات الغروية للصلب في سائل (أي الحلالات) sols تكون مشحونة بشحنة من نوع واحد (سالبة أو موجبة) ناتجة إما من ادمصاص (امتصاص على السطح) الأيونات أو بوجود مواقع مشحونة في الجزيئات المكوِّنة للدقائق. فهذه الشوارد المتماثلة الشحنة تتنافر بعضها مع بعض ولهذا لا تنمو إلى الوزن الذي يسمح لها بالانفصال عن محلولها. فحلالة أكسيد الحديد Fe2O3 (III) بالماء على سبيل المثال، تتثبت بفعل قوى التنافر الكهراكدي. وتتألف كل دقيقة غروية من عدد كبير من وحدات Fe2O3 المميهة. وتنجذب شوارد Fe+3 نحو مواقع موجودة على الدقيقة فتمنحها شحنة موجبة، (لا تدمص الشوارد الأخرى على السطح لأن شوارد Fe3+ تدمص انتقائياً على سطح الدقائق).
وقد درس ف. سيلمي الكيمائي الإيطالي، الغرويات اللاعضوية وبيّن أن بعض الأملاح، مثل كلوريد الفضة Ag Cl، تتجمع مثل المواد الغروية.
أما المستحلبات (جملة سائل في سائل) فمعظمها يثبَّت بإضافة مكوِّن ثالث هو عامل الاستحلاب، فالمايونيز، على سبيل المثال، هو مستحلب زيت في الماء، وهو مكون من زيت صالح للأكل، في محلول ممدد لحمض عضوي صالح للأكل، وهو يثبَّت بفعل بياض البيض، فجزيئات البروتين الموجودة في بياض البيض تقوم بدور جلدة حول القطرات المكروئية الزيتية.
نقنية مراقبة الاستقرار الغرواني
انظر أيضاً
- رذاذ
- Bacteriophage
- Colloid-facilitated transport
- Dispersion
- Eigencolloid
- Electrical double layer (EDL)
- مستحلب
- Entropic force
- Flocculation
- رغوة
- هلام
- Gum (botany)
- Hydrosol
- Interface
- Miscibility
- Micromeritics
- Nanoparticle
- Non-Newtonian fluid
- Peptization
- حلالة
- Sol-gel
- Streaming potential
- Superplasticizer
- Suspension
- Zeta potential
هوامش
- ^ Israelachvili, Jacob N. (2011). Intermolecular and surface forces (4rd ed.). Burlington, MA: Academic Press. ISBN 978-0-08-092363-5. OCLC 706803091.
- ^ International Union of Pure and Applied Chemistry. Subcommittee on Polymer Terminology; Jones, Richard G. (2009). Compendium of polymer terminology and nomenclature: IUPAC recommendations, 2008. Cambridge: Royal Society of Chemistry. ISBN 978-1-84755-942-5. OCLC 406528399.
- ^ Everett, Dogulas H. (1988). Basic Principles of Colloid Science. London: The Royal Society of Chemistry. ISBN 978-0-85186-443-3.
- ^ Selmi, Francesco "Studi sulla dimulsione di cloruro d'argento". Nuovi Annali delle Scienze Naturali di Bologna, 1845.
- ^ Selmi, Francesco, Studio intorno alle pseudo-soluzioni degli azzurri di Prussia ed alla influenza dei sali nel guastarle, Bologna: Tipi Sassi, 1847
- ^ Hatschek, Emil, The Foundations of Colloid Chemistry, A selection of early papers bearing on the subject, The British Association Committee on Colloid Chemistry, London, 1925
- ^ Selmi, Francesco - Sur le soufre pseudosoluble, sa pseudosolution e le soufre mou, Journal de Pharmacie et de Chimie, tome 21, 1852, Paris
- ^ Tweney, Ryan D. (2006). "Discovering Discovery: How Faraday Found the First Metallic Colloid". Perspectives on Science. 14: 97–121. doi:10.1162/posc.2006.14.1.97. S2CID 55882753.
- ^ "X. Liquid diffusion applied to analysis". Philosophical Transactions of the Royal Society of London. 151: 183–224. 1861. doi:10.1098/rstl.1861.0011. S2CID 186208563.. Page 183: "As gelatine appears to be its type, it is proposed to designate substances of the class as colloids, and to speak of their peculiar form of aggregation as the colloidal condition of matter."
- ^ أ ب Richard G. Jones; Edward S. Wilks; W. Val Metanomski; Jaroslav Kahovec; Michael Hess; Robert Stepto; Tatsuki Kitayama, eds. (2009). Compendium of Polymer Terminology and Nomenclature (IUPAC Recommendations 2008) (2nd ed.). RSC Publ. p. 464. ISBN 978-0-85404-491-7.
- ^ أ ب Stepto, Robert F. T. (2009). "Dispersity in polymer science (IUPAC Recommendations 2009)" (PDF). Pure and Applied Chemistry. 81 (2): 351–353. doi:10.1351/PAC-REC-08-05-02. S2CID 95122531. Archived (PDF) from the original on 2022-10-09.
- ^ Slomkowski, Stanislaw; Alemán, José V.; Gilbert, Robert G.; Hess, Michael; Horie, Kazuyuki; Jones, Richard G.; Kubisa, Przemyslaw; Meisel, Ingrid; Mormann, Werner; Penczek, Stanisław; Stepto, Robert F. T. (2011). "Terminology of polymers
and polymerization processes in dispersed systems (IUPAC Recommendations 2011)" (PDF). Pure and Applied Chemistry. 83 (12): 2229–2259. doi:10.1351/PAC-REC-10-06-03. S2CID 96812603. Archived (PDF) from the original on 2022-10-09. - ^ de Swaan Arons, J.; Diepen, G. A. M. (2010). "Immiscibility of gases. The system He-Xe: (Short communication)". Recueil des Travaux Chimiques des Pays-Bas. 82 (8): 806. doi:10.1002/recl.19630820810.
- ^ de Swaan Arons, J.; Diepen, G. A. M. (1966). "Gas—Gas Equilibria". J. Chem. Phys. 44 (6): 2322. Bibcode:1966JChPh..44.2322D. doi:10.1063/1.1727043.
- ^ غدير زيزفون. "الغرويات". الموسوعة العربية. Retrieved 2011-08-18.
المراجع
- روبرت. آ. ألبرتي وروبرت .ج. سيلبي، الكيمياء الفيزيائية، ترجمة حسن كلاوي ويحيى البزرة وفؤاد الصالح (المركز العربي للتعريب والتأليف والترجمة والنشر، دمشق 1996).
اقرأ أيضا
- قوة إنتروبية Entropic force