ميوجلوبين
| Myoglobin | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | myoglobinuniprot:P02144MB | ||||||||||||||||||||||||||||||||||||||||||||||||||
| External IDs | GeneCards: [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
الميوگلوبين أو خضاب العضل Myoglobin (يرمز له Mb أو MB)، هو پروتين مرتبط بالحديد والأكسجين داخل النسيج العضلي للفقاريات بصفة عامة وفي جميع الثدييات على وجه الخصوص. وهو مرتبط بالهيموگلوبين، الپروتين المرتبط بالحديد والأكسجين داخل الدم، وخاصة في خلايا الدم الحمراء. في البشر، لا يُعثر على الميوگلوبين في تيار الدم إلا عند إصابة العضلات. وهو نتيجة غير طبيعية، ويمكن اعتباره ذو صلة تشخيصية عند تواجده في الدم.[1]
الميوگلوبين هو الخضاب الحامل للأكسجين بصفة أساسية داخل الأنسجة العضلية.[2] التركيزات المرتفعة للميوگلوبين داخل الخلايا العضلية تسمح للعضيات بحبس أنفاسهم لفترة زمنية طويلة. الثدييات الغواصة مثل الحيتان والفقمات تمتلك عضلات ذات وفرة عالية من الميوگلوبين.[1] يوجد الميوگلوبين في عضلات النوع الأول والثاني إيه والثاني بي، لكن معظم النصوص المعنية بالميلوگلوبين موجودة في العضلة الملساء.
كان الميوگلوبين أول پروتين ذو بنية ثلاثية الأبعاد يتم الكشف عنها عن طريق دراسة البلورات بالأشعة السينية.[3] تم هذا الإنجاز عام 1858 بواسطة جون كندرو وزملائه.[4] من أجل هذا لاكتشاف، تشارك جون كندرو جائزة نوبل في الكيمياء 1962 مع ماكس پروتس.[5] بالرغم من كونه واحداً من أكثر الپروتينات المدروسة في علم الأحياء، إلا أن وظيفته الفسيولوجية لم تُقرر بعد بشكل قاطع: يمكن للفئران المهندسة وراثياً لتفقد الميوگلوبين أن تبقى حية وخصبة، لكنها لم تظهر العديد من التكيفات الخلوية والفسيولوجية للتغلب على هذه الخسارة. عن طريق رصد هذه التغيرات في الفئران مستنزفة-الميوگلوبين، فمن المفترض أن وظيفة الميوگلوبين المتعلقة بزيادة نقل الأكسجين إلى العضلات وتخزينه وكقَمامة لأنواع الأكسجين التفاعلية.[6]
في البشر، يحمل الميوگلوبين الرمز جين MB.[7]
يمكن للميوگلوبين أن يأخذ أشكال الأكسيهيموگلوبين (HbO2)، كربوكسيهيموگلوبين (HbCO)، وميثيموگلوبين (met-Hb)، وبشكل مشابه، يمكن للميوگلوبين أن يأخذ أشكال الأكسيميوگلوبين (MbO2)، الكربوكسيميوگلوبين (MbCO)، والميتميوگلوبين(met-Mb).
الاختلافات عن الهيموگلوبين
مثل الهيموگلوبين، فإن الميوگلوبين هو پروتين سيتوپلازمي يرتبط بالأكسجين على مجموعة الهيم. يستقر على مجموعة هيم واحدة فقط، بينما الهيموگلوبين يستقر على أربع مجموعات. بالرغم من أن مجموعة الهيم الموجودة فيه مماثلة لتلك الموجودة في الهيموگلوبين، إلا أن الميوگلوبين أكثر ميلاً للارتباط بالأكسجين عن الهيموگلوبين. هذا الاختلاف متعلق بدوره المختلف: فبينما يقوم الهيموگلوبين بنقل الأكسجين، فإن وظيفة الميوگلوبين هي تخزينه الأكسجين.
لون اللحم
يحتوي الميوگلوبين على الهيم، الخضاب المسئول عن اللون اللحوم الحمراء. تُحدد درجة احمرار اللحم جزئياً عن طريق درجة أكسدة الميوگلوبين. في اللحوم الطازجة تكون ذرة الحديد في حالة الأكسدة الحديدية (+2) الملزمة لجزيئ الأكسجين (O2).اللحوم المطهوة بالكامل تكون بنية اللحوم لأن جزيء الحديد يكون في حالة الأكسدة الحديدية (+3)، حيث يكون قد فقط إلكتروناً. إذا لم يتعرض اللحم إلى النيتريت، يظل محتفظاً بلونه الوردي لأن جزيء الحديد يكون مرتباطاً بأكسيد النيتريك. كذلك، تأخذ اللحوم المشوية اللون الوردي "حلقة الدخان" والذي ينتج عن ارتباط الحديد بجزيء أحادي أكسيد الكربون.[8] اللحوم النيئة المعبئة في جوء مشبع بأول أكسيد الكربون تظهر أيضاً نفس اللون الوردي "حلقة الدخان" لنفس الأسباب. ومن الجدير بالذكر أن سطح اللحم النيء يبدو وردي اللون، والذي عادة ما يكون مرتبطاً في ذهن المستهلك باللحم الطازج. ويقال أن هذا اللون الاصطناعي يمكنه الاستمرار لأكثر عن عام.[9] ورد بأن هورمل وكارگيل تستخدم عملية التعبئة تلك، وأن اللحم المعالج بهذه الطريقة مطروح في الأسواق منذ 2003.[10]
دوره في الأمراض
ينطلق الميوگلوبين من الأنسجة العضلية المصابة (انحلال الربيدات)، والتي تحتوي على تركيزات مرتفعة للغاية من الميوگلوبين. يتم تصفية الميوگلوبين المنطلق بواسطة الكلى لكنه يكون ساماً بالنسبة للظهارة الأنبوبية لاكلوية ويمكن أن يؤدي إلى الإصابة بالقصور الكلوي الحاد.[11] ليس الميوگلوبين نفسه هو المادة السامة (بديئة الذيفان) لكن الجزء ferrihemate الذي ينفصل عن الميوگلوبين في البيئات الحمضية (مثل، البول الحمضي، الأجسام الحالة).
يعتبر الميوگلوبين علامة حساسة لإصابة العضلات، مما يجعله علامة محتملة للنوبات القلبية لدى المرضى المصابين بألم الصدر.[12] ومع ذلك، فإن للميوگلوبين المرتفع نوعية منخفضة في حالات النوبات القلبية المزمنة وبالتالي كيناز الكرياتين، التروپونين القلبي، مرسمة كهربائية القلب، والعلامات السريرية التي ينبغي أخذها في الحسبان عند التشخيص.
التركيب والارتباط
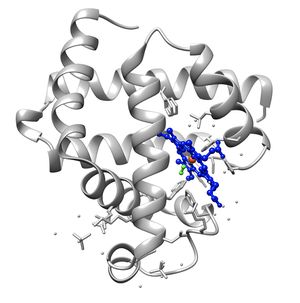
ينتمي الميوگلوبين إلى عائلة پروتينات الگلوبين الفرعية، ومثل الگلوبينات الأخرى، يتكون من ثمانية لوالب ألفا متصلة عن طريق حلقات. يحتوي الميوگلوبين البشري على 154 حمض أميني.[14]
النظائر الاصطناعية
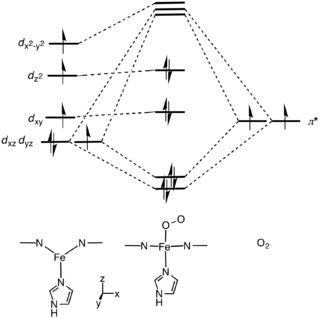
 A picket-fence porphyrin complex of Fe, with axial coordination sites occupied by methylimidazole (green) and dioxygen. The R groups flank the O2-binding site.
A picket-fence porphyrin complex of Fe, with axial coordination sites occupied by methylimidazole (green) and dioxygen. The R groups flank the O2-binding site.
انظر أيضاً
- سيتوگلوبين
- هيموگلوبين
- هيموپروتين
- نيروگلوبين
- فيتوگلوبين
- بيلة ميوگلوبينية - وجود ميوگلوبين في البول
- Ischemia-reperfusion injury of the appendicular musculoskeletal system
المصادر
- ^ أ ب Nelson DL, Cox MM (2000). Lehninger Principles of Biochemistry (3rd ed.). New York: Worth Publishers. p. 206. ISBN 0-7167-6203-X. (Google books link is the 2008 edition)
- ^ Ordway GA, Garry DJ (Sep 2004). "Myoglobin: an essential hemoprotein in striated muscle". The Journal of Experimental Biology. 207 (Pt 20): 3441–6. doi:10.1242/jeb.01172. PMID 15339940.
- ^ (U.S.) National Science Foundation: Protein Data Bank Chronology (Jan. 21, 2004). Retrieved 3.17.2010
- ^ Kendrew JC, Bodo G, Dintzis HM, Parrish RG, Wyckoff H, Phillips DC (Mar 1958). "A three-dimensional model of the myoglobin molecule obtained by x-ray analysis". Nature. 181 (4610): 662–6. Bibcode:1958Natur.181..662K. doi:10.1038/181662a0. PMID 13517261.
- ^ The Nobel Prize in Chemistry 1962
- ^ Garry DJ, Kanatous SB, Mammen PP (2007). "Molecular insights into the functional role of myoglobin". Advances in Experimental Medicine and Biology. 618: 181–93. doi:10.1007/978-0-387-75434-5_14. PMID 18269197.
- ^ Akaboshi E (1985). "Cloning of the human myoglobin gene". Gene. 33 (3): 241–9. doi:10.1016/0378-1119(85)90231-8. PMID 2989088.
- ^ McGee H (2004). On Food and Cooking: The Science and Lore of the Kitchen. New York: Scribner. p. 148. ISBN 0-684-80001-2.
- ^ Fraqueza MJ, Barreto AS (Sep 2011). "Gas mixtures approach to improve turkey meat shelf life under modified atmosphere packaging: the effect of carbon monoxide". Poultry Science. 90 (9): 2076–84. doi:10.3382/ps.2011-01366. PMID 21844276.
- ^ Associated Press (2007-10-30). "Meat companies defend use of carbon monoxide". Business. Minneapolis Star Tribune.
- ^ Naka T, Jones D, Baldwin I, Fealy N, Bates S, Goehl H, Morgera S, Neumayer HH, Bellomo R (Apr 2005). "Myoglobin clearance by super high-flux hemofiltration in a case of severe rhabdomyolysis: a case report". Critical Care. 9 (2): R90-5. doi:10.1186/cc3034. PMC 1175920. PMID 15774055.
{{cite journal}}: CS1 maint: unflagged free DOI (link) - ^ Weber M, Rau M, Madlener K, Elsaesser A, Bankovic D, Mitrovic V, Hamm C (Nov 2005). "Diagnostic utility of new immunoassays for the cardiac markers cTnI, myoglobin and CK-MB mass". Clinical Biochemistry. 38 (11): 1027–30. doi:10.1016/j.clinbiochem.2005.07.011. PMID 16125162.
- ^ Drago RS (1980). "Free radical reactions of transition metal systems". Coordination Chemistry Reviews. 32 (2): 97–110. doi:10.1016/S0010-8545(00)80372-0.
- ^ قالب:UniProt Full
قراءات إضافية
- Collman JP, Boulatov R, Sunderland CJ, Fu L (Feb 2004). "Functional analogues of cytochrome c oxidase, myoglobin, and hemoglobin". Chemical Reviews. 104 (2): 561–88. doi:10.1021/cr0206059. PMID 14871135.
- Reeder BJ, Svistunenko DA, Cooper CE, Wilson MT (Dec 2004). "The radical and redox chemistry of myoglobin and hemoglobin: from in vitro studies to human pathology". Antioxidants & Redox Signaling. 6 (6): 954–66. doi:10.1089/ars.2004.6.954. PMID 15548893.
- Schlieper G, Kim JH, Molojavyi A, Jacoby C, Laussmann T, Flögel U, Gödecke A, Schrader J (Apr 2004). "Adaptation of the myoglobin knockout mouse to hypoxic stress". American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 286 (4): R786-92. doi:10.1152/ajpregu.00043.2003. PMID 14656764.
- Takano T (Mar 1977). "Structure of myoglobin refined at 2-0 A resolution. II. Structure of deoxymyoglobin from sperm whale". Journal of Molecular Biology. 110 (3): 569–84. doi:10.1016/S0022-2836(77)80112-5. PMID 845960.
- Roy A, Sen S, Chakraborti AS (Feb 2004). "In vitro nonenzymatic glycation enhances the role of myoglobin as a source of oxidative stress". Free Radical Research. 38 (2): 139–46. doi:10.1080/10715160310001638038. PMID 15104207.
- Stewart JM, Blakely JA, Karpowicz PA, Kalanxhi E, Thatcher BJ, Martin BM (Mar 2004). "Unusually weak oxygen binding, physical properties, partial sequence, autoxidation rate and a potential phosphorylation site of beluga whale (Delphinapterus leucas) myoglobin". Comparative Biochemistry and Physiology B. 137 (3): 401–12. doi:10.1016/j.cbpc.2004.01.007. PMID 15050527.
- Wu G, Wainwright LM, Poole RK (2003). "Microbial globins". Advances in Microbial Physiology. Advances in Microbial Physiology. 47: 255–310. doi:10.1016/S0065-2911(03)47005-7. ISBN 9780120277476. PMID 14560666.
- Mirceta S, Signore AV, Burns JM, Cossins AR, Campbell KL, Berenbrink M (Jun 2013). "Evolution of mammalian diving capacity traced by myoglobin net surface charge". Science. 340 (6138): 1234192. doi:10.1126/science.1234192. PMID 23766330.. Also see Proteopedia article about this finding
وصلات خارجية
- Mendelian Inheritance in Man (OMIM) 160000 human genetics
- The Myoglobin Protein
- Protein Database featured molecule
- Which Cut Is Older? (It's a Trick Question) New York Times, February 21, 2006 article regarding meat industry use of carbon monoxide to keep meat looking red.
- Stores React to Meat Reports New York Times, March 1, 2006 article on the use of carbon monoxide to make meat appear fresh.