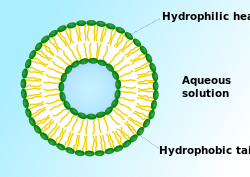
حويصلة الخلية
في علم الأحياء الخلوي، الحويصلة vesicle، هي فقاعة صغيرة داخل الخلية، وبالتالي فهيا إحدى أنوع العضيات الخلوية. وتكون الحويصلة مغلفة بطبقة ثنائية دهنية، وقد تتشكل طبيعياً، على سبيل المثال، أثناء عملية الإلتقام. بدلاً من ذلك، يمكن تحضيرها صناعياً، وفي هذه الحالة تسمى بالجسميات الشحمية. إذا ما كان هناك طبقة ثنائية دهنية فسفورية واحدة، تسمى حويصلات أحادية الرقائق؛ وفي حالة تعدد الطبقات تسمى متعددة الرقائق. الغشاء الذي يغلف الحويصلة مشابه لغشاء الپلازما، وقد تلتحم الحويصلات بغشاء الپلازما لتطلق محتواها خارج الخلية. كذلك قد تلتحم الحويصلات مع العضيات الخلوية الأخرى داخل الخلية.
تؤدي الحويصلات وظائف متنوعة. لأنها منفصلة عن العصارة الخلوية، فداخل الحويصلة قد يكون مختلف عن البيئة العصارية الخلوية. لهذا السبب، فالحويصلات أدة أساسية تستخدمها الخلية لتنظيم المواد الخلوية. ترتبط الحويصلات بالأيض، النقل، التحكم في الطفو،[1] وتخزين الإنزيمات. كذلك تعمل الحويصلات كحجرات تفاعل كيميائي.

في 2013، مُنحت جائزة نوبل للطب لجيمس روثمان، راندي شكمان وتوماس سودهوف لاسهاماتهم (المبني على أبحاثهم المبكرة، وعلى مشاهداتهم) حول بنية ووظيفة الحويصلات الخلوية،وخاصة في الخميائر وفي البشر، وشملت تلك الاسهامات معلومات عن كل جزء من الحويصلة وكيفية تجمعها. عندما يحدث خلل في الحويصلات الخلوية، التي تساعد في الحفاظ على التوازن داخل وخارج الأوعية الدموية والخلايا (بين المناطق خارج وداخل الأوعية الدموية وداخل وخارج الخلية، بالترتيب)، قد يؤدي ذلك إلى حدوث أمراض قد تكون خطيرة وعادة ما تكون مميتة. يعتقد أن هذا الخلل قد يساهم الإصابة بمرض ألزهايمر، السكري، بعذ الحالات الصرع التي يصعب علاجها، بعذ أنواع السرطانات والاضطرابات المناعية، وأمراض وعائية عصبية مؤكدة. من المرجح أن الحويصلات الخلوية قد تسبب، تؤثر، أو تجعل تلك الأمراض أكثر سوءاً.[3][4]
أنواع الحويصلات الخلوية

الفجوات العصارية
الفجوات العصارية هي حويصلات أغلب محتواها من الماء.
- الخلايا النباتية تشتهر بأنها تحتوي على فجوة مركزية كبيرة وسط الخلية التي تستخدم للتحكم الاسموزي وتغذية الغذاء.
- الفجوات المنقبضة توجد في أولانيات معينة، وخاصة في شعبة السوطيات. هذه الفوات تأخذ المياه من السيتوبلازم وتفرزه خارج الخلية لمنع الانفجار بسبب الضغط الاسموزي.
اليحلول
- اليحاليل لها دور في الهضم الخلوي. قد يأتي الغذاء من خارج الخلية إلى الحويصلات الغذائية عن طريق عملية تسمى الالتقام. هذه الحويصلات الغذائية تلتحم مع اليحاليل التي التحلل المحتويات ليتم استخدامها في الخلية. هذا الشكل من التغذية الخلوية يطلق عليه البلعمة.
- اليحاليل تستخدم أيضاً لتدمير العضيات الخلوية المعيبة أو التالفة في عملية تسمى الالتهام الذاتي. تلتحم هذه اليحاليل مع غشاء العضيات الخلوية التالفة، وتهضمها.
حويصلات النقل
- حويصلات النقل قد تنقل الجزيئيات بين المواقع داخل الخلية، على سبيل المثال، البروتينات القادمة من الشبكة الهيولية الباطنة إلى جهاز گولجي.
- البروتينات المُفرزة والملتصقة بالغشاء تصنع في الريبوسومات توجد في الشبكة الهيوليكة الباطنة. معظم هذه البرويتات تنضج في جهاز گولجي قبل أن تذهب لوجهتها الأخيرة والتي قد تكون اليحاليل، جسميات التأكسد، أو خارج الخلية. تسافر هذه البروتينات الموجودة بالخلية داخل حويصلات النقل.
الحويصلات الإفرازية
الحويصلات الإفرازية تحتوي على مواد مُفرزة من الخلية. تقوم الخلايا بإفراز المواد لأسباب كثيرة. منها التخلص من الفضلات. وقد يكون السبب الآخر مرتبط بوظيفة الخلية. في العضيات الأكبر، تكون بعض الخلايا متخصصة لإنتاج مواد كيميائية محددة. هذه المواد الكيمياوية تكون مخزنة في الحويصلات الإفرازية وتنطلق عند الحاجة.
أنواع الحويصلات الإفرازية
- الحويصلات المشبكية تقع في الطرف قبل المشبكي في الخلايا العصبية وتخزن الناقلات العصبية. عندما تأتي الإشارة إلى المحوار، تلتحم الحويصلات المشبكية مع غشاء الخلية لتطلق الناقل العصبي بحيث يتمكن الكشف عنه عن طريق جزيئات المستقبل في الخلية العصبية التالية.
- في الحيوانات يطلق جهاز الغدد الصماء الهرمونات داخل تيار الدم. هذه الهرمونات تُخزن داخل الحويصلات الإفرازية. مثال جيد على النسيج الصم يوجد في جزر لانگرهانس في البنكرياس. هذا النسيج يحتوي على أنواع كثيرة من الخلايا تعرف بالهرمونات التي تنتجها.
- الحويصلات الإفرازية تحمل الإنزيمات التي تستخدم لصنع جدار الخلية في خلايا النباتات، السوطيات، الفطريات، الجراثيم والعتائق وكذلك في الأنسجة خارج الخلية في الخلايا الحيوانية.
أنواع أخرى من الحويصلات
- الحويصلات الغازية التي تستخدمها العضيات الدقيقة مثل العتائق، الجراثيم والعوالق، ربما للتحكم في الهجرة الرأسية عن طريق تنظيم المحتوى الغازي ومن ثم الطفو، أو ربما لوضع الخلية في أفضل المواقع المواجهة لضوء الشمس.
- الحويصلات خارج الخلية تقع داخل الفضاء خارج الخلية. باستخدام المجهر الإلكتروني اكشفت تلك الحويصلات بشكل مستقل عام 1967 بواسطة هـ. كلارك أندرسون[5] وإرمانو بونوتشي.[6] هذه الحويصلات المشتقة من الخلية متخصصة في بدأ التمعدن الحيوي للأنسجة الخارجية لتحويلها إلى مجموعة متنوعة من الأنسجة، منها العظام، الغضاريف، العاج. أثناء عملية التكلس الطبيعية، يحدث تدفق كبير لأيونات الكالسيوم والفوسفات إلى الخلايا يرافق الاستموات الخلوي (مصممة وراثياً لتدمر نفسها) وتكوين حويصلة خارج الخلية. تدفق الكالسيوم يؤدي أيضاً إلى تكوين فسفاتيديل سيرين:مركبات كالسيوم:فوسفات في غشاء الپلازما الذي يتوسطه الپروتين ويسمى بالأنكسين. تنمو الحويصلات الخارجية من غشاء الپلازما عند مواقع التفاعل مع الأنسجة خارج الخلية. وبالتالي، تنتقل الحويصلات الخارجية إلى الأنسجة الخارجية الكالسيوم، الفوسفات، الدهون والأنكسينات والتي تعمل على تشكيل المعادن. هذه العمليات تتم بتنسيق دقيق، في مكان وزمان محدد، معدنة الأنسجة الخارجية تتم في حالة عدم وجود جهاز گولگي.
- الأجسام متعددة الحويصلات، هي حويصلة مرتبطة بالغشاء تحتوي على عدد صغير من الحويصلات.
تكوين وانتقال الحويصلات
| بيولوجيا الخلية | |
|---|---|
| الخلية الحيوانية | |
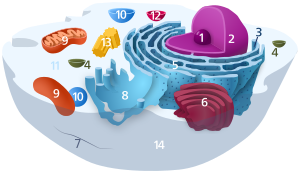 مكونات الخلية الحيوانية:
|
تنكون بعض الحويصلات عندما يأخذ الغشاء جزء من الشبكة الهيولية الباطنة أو جهاز گولگي. الحويصلات الأخرى تتكون عندما يحيط الغشاء الخلوي بجسم من خارج الخلية.
الإمساك بحمولة الجزيئات
يتطلب تجمع الحويصلات عدد من الأغطية لتحيط وترتبط بالبرويتات التي تم نقلها؛ ترتبط هذه البروتينات لغطاء الحويصلة. يوقع هذا كذلك بالعديد من الپروتينات عبر الغشائية، وتسمى بالمستقبلات المنقولة، والتي توقع بدورها بالجزئيات المنقولة.
غلاف الحويصلة
يعمل غلاف الحويصلة على نحت غشاء الخلية، واختيار بروتينات محددة لنقلها. يتم اختيار تلك البروتينات تبعاً لإشارات التصنيف. بهذه الطريقة تختار مجموعات أغلفة الحويصلة البروتيتات التي سيتم نقلها من غشاء الخلية وتنقلها إلى براعم الحويصلات الوليدة.
هناك ثلاث أنواع من أغلفة الحويصلات: الكلاثرين، COPI، وCOPII. غلاف الكالثرين يوجد في الحويصلات المتنقلة بين جهاز گولگي وغشاء الپلازما، جهاز گولگي واليحاليل، وغشاء الپلازما واليحاليل. الحويصلات المغلفة بCOPI مسئولة عن النقل العسكي من گولگي والشبكة الهيولية الباطنة، بينما الحويصلات المغلفة بCOPII مسئولة عن النقل من الشبكة الهيولية الباطنة إلى گولگي.
يعتقد أن غلاف الكلاثرين يتجمع استجابة لتنظيم پروتين جي. تتجمع وتتفرق أغلفة الحويصلات تبعاً ADP ribosylation factor (ARF) protein.
رسو الحويصلة
Surface markers called SNAREs identify the vesicle's cargo, and complementary SNAREs on the target membrane act to cause fusion of the vesicle and target membrane. Such v-SNARES are hypothesised to exist on the vesicle membrane, while the complementary ones on the target membrane are known as t-SNAREs.
Often SNAREs associated with vesicles or target membranes are instead classified as Qa, Qb, Qc, or R SNAREs owing to further variation than simply v- or t-SNAREs. An array of different SNARE complexes can be seen in different tissues and subcellular compartments, with 36 isoforms currently identified in humans.
Regulatory Rab proteins are thought to inspect the joining of the SNAREs. Rab protein is a regulatory GTP-binding protein, and controls the binding of these complementary SNAREs for a long enough time for the Rab protein to hydrolyse its bound GTP and lock the vesicle onto the membrane.
اندماج الحويصلة
Vesicle fusion can occur in one of two ways: full fusion or kiss-and-run fusion. Fusion requires the two membranes to be brought within 1.5 nm of each other. For this to occur water must be displaced from the surface of the vesicle membrane. This is energetically unfavorable, and evidence suggests that the process requires ATP, GTP, and acetyl-coA, fusion is also linked to budding, which is why the term budding and fusing arises.
الحويصلات في تنظيم المستقبلات
Membrane proteins serving as receptors are sometimes tagged for downregulation by the attachment of ubiquitin. After arriving an endosome via the pathway described above, vesicles begin to form inside the endosome, taking with them the membrane proteins meant for degradation; When the endosome either matures to become a lysosome or is united with one, the vesicles are completely degraded. Without this mechanism, only the extracellular part of the membrane proteins would reach the lumen of the lysosome, and only this part would be degraded.[7]
It is because of these vesicles that the endosome is sometimes known as a multivesicular body. The pathway to their formation is not completely understood; unlike the other vesicles described above, the outer surface of the vesicles is not in contact with the cytosol.
تحضير الحويصلة
الحويصلات المعزولة
Producing membrane vesicles is one of the methods to investigate various membranes of the cell. After the living tissue is crushed into suspension, various membranes form tiny closed bubbles. Big fragments of the crushed cells can be later discarded by low speed centrifugation and later the fraction of the known origin (plasmalemma, tonoplast, etc.) can be isolated by precise high-speed centrifugation in the density gradient. Using osmotic shock, it is possible temporarily open vesicles (filling in them with the required solution) and then centrifugate down again and resuspend in a different solution. Applying ionophores like valinomycin can create electrochemic gradients that are comparable to the gradients inside the living cell.
Vesicles are mainly used in two types of research:
- To find and later isolate membrane receptors that specifically bind hormones and various other important substances.[8]
- To investigate transport of various ions or other substances across the membrane of the given type.[9] While the transport can be easier investigated with patch clamp techniques, vesicles can also be isolated from objects for that the patch clamp is not applicable.
الحويصلات الاصطناعية
Phospholipid vesicles have also been studied in biochemistry. For such studies, a homogeneous phospholipid vesicle suspension can be prepared by sonication,[10] injection of a phospholipid solution into the aqueous buffer solution membranes.[11] In this way aqueous vesicle solutions can be prepared of different phospholipid composition, as well as different sizes of vesicles.
انظر أيضاً
- شبكة هيولية باطنة
- جهاز گولجي
- DODAB
- Endocytosis
- شبكة هيولية باطنة
- مواقع اتصال الغشاء
- أنبوب نانوي غشائي
- Micelle
- Spitzenkörper
- Synaptic vesicle
المصادر
- ^ Walsby AE (1994). "Gas vesicles". Microbiological reviews. 58 (1): 94–144. PMC 372955. PMID 8177173.
- ^ "Terminology of polymers and polymerization processes in dispersed systems (IUPAC Recommendations 2011)" (PDF). Pure and Applied Chemistry. 83 (12): 2229–2259. 2011. doi:10.1351/PAC-REC-10-06-03.
- ^ (CNN)
- ^ 2013 Nobel Prize in Physiology or Medicine, press release 2013-10-07
- ^ Anderson HC (1967). "Electron microscopic studies of induced cartilage development and calcification". J. Cell Biol. 35 (1): 81–101. doi:10.1083/jcb.35.1.81. PMC 2107116. PMID 6061727.
- ^ Bonucci E (1967). "Fine structure of early cartilage calcification". J. Ultrastruct. Res. 20 (1): 33–50. doi:10.1016/S0022-5320(67)80034-0. PMID 4195919.
- ^ Katzmann DJ, Odorizzi G, Emr SD (2002). "Receptor downregulation and multivesicular-body sorting" (PDF). Nat. Rev. Mol. Cell Biol. 3 (12): 893–905. doi:10.1038/nrm973. PMID 12461556.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Sidhu VK, Vorhölter FJ, Niehaus K, Watt SA (2008). "Analysis of outer membrane vesicle associated proteins isolated from the plant pathogenic bacterium Xanthomonas campestris pv. campestris". BMC Microbiol. 8: 87. doi:10.1186/1471-2180-8-87. PMC 2438364. PMID 18518965.
{{cite journal}}: CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ^ Scherer GG, Martiny-Baron G (1985). "K+ /H+ exchange transport in plantmembranevesicles is evidence for K+ transport". Plant Science. 41 (3): 161–8. doi:10.1016/0168-9452(85)90083-4.
- ^ Barenholz, Y.; Gibbes, D.; Litman, B. J.; Goll, J.; Thompson, T. E.; Carlson, F. D. (1977). "A simple method for the preparation of homogeneous phospholipid vesicles". Biochemistry. 16 (12): 2806. doi:10.1021/bi00631a035. PMID 889789.
- ^ Batzri S, Korn ED (1973). "Single bilayer liposomes prepared without sonication". Biochim. Biophys. Acta. 298 (4): 1015–9. doi:10.1016/0005-2736(73)90408-2. PMID 4738145.
{{cite journal}}: Unknown parameter|month=ignored (help)
قراءات إضافية
- Alberts, Bruce; et al. (1998). Molecular Biology of the Cell (Fourth ed.). New York: Garland. ISBN 0-8153-2971-7.
{{cite book}}: Explicit use of et al. in:|last2=(help)