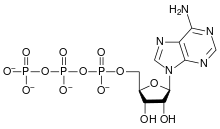
ثلاثي فوسفات الأدنوسين
| |
| |
| الأسماء | |
|---|---|
| اسم أيوپاكs
5-(6-aminopurin-9-yl)
-3,4-dihydroxy-oxolan-2-yl methoxy-hydroxy-phosphoryl oxy-hydroxy-phosphoryl oxyphosphonic acid | |
| Identifiers | |
| رقم CAS | |
| ECHA InfoCard | 100.000.258 |
CompTox Dashboard (EPA)
|
|
| الخصائص | |
| الصيغة الجزيئية | C10H16N5O13P3 |
| كتلة مولية | 507.181 g/mol |
| الحموضة (pKa) | 6.5 |
ما لم يُذكر غير ذلك، البيانات المعطاة للمواد في حالاتهم العيارية (عند 25 °س [77 °ف]، 100 kPa). | |
| مراجع الجدول | |
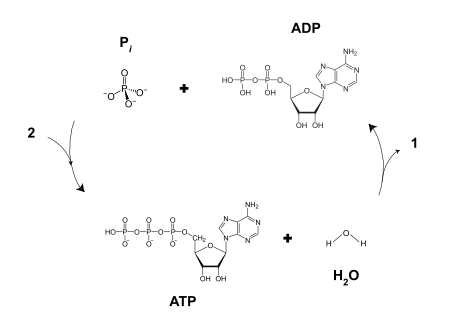
ثلاثي فوسفات الأدنوسين-5' Adenosine-5'-triphosphate (ATP) هو نيوكليوتيد متعدد الوظائف شديد الأهمية ك "عملة جزيئية" لنقل الطاقة داخل الخلية.[1] وفي هذا الدور, ينقل ATP الطاقة الكيميائية داخل الخلايا للأيض. ويتم انتاجه كمصدر للطاقة أثناء عمليات التمثيل الضوئي والتنفس الخلوي وتستهلكه الإنزيمات والعديد من العمليات الخلوية بما فيها biosynthetic reactions, motility وانقسام الخلية. وفي سبل signal transduction, يتم استخدام ATP ك substrate by kinases that phosphorylate الپروتينات والدهون, as well as by adenylate cyclase, التي تستعمل ATP لانتاج جزيء second messenger cyclic AMP.
ATP أو Adenosine triphosphate هو عبارة عن نيكليوتيد (Nucleotide) تختزن فيها الطاقة على شكل رابطة غنية بالطاقة بين مجموعة فوسفات غير عضوية (Inorganic Phosphate Pi)و مركب ADP. ويتكون مركب ATP عن طريق تفاعل ADP مع مجموعة الفوسفات P في وجود طاقة عالية ناتجة عن طاقة الوضع التي اكتسبتها الإلكترونات بعد الإثارة. ADP + P + Energy ---------> ATP
- ATP + H2O → ADP(hydrated) + Pi(hydrated) + H+(hydrated) ΔG˚ = -30.54 kJ/mol (−7.3 kcal/mol)
- ATP + H2O → AMP(hydrated) + PPi(hydrated) + H+(hydrated) ΔG˚ = -45.6 kJ/mol (−10.9 kcal/mol)
تحتاج الخلايا الحية، لتأمين القوة اللازمة لها من أجل القيام بوظائفها الأساسية، إلى الطاقة التي يوفرها المركب «ثلاثي فسفات الأدينوزين» ATP؛ وهي تحتاج إلى مقدار كبير من هذا المركب. وقد أماط الذين حصلوا على جائزة نوبل في الكيمياء عام 1997، اللثام عن تفاصيل دقيقة حول كيفية عمل المركب ATP وكيف يتجدد ويعاد تدويره.
توزعت جائزة نوبل في الكيمياء بين ثلاثة باحثين، فنال نصفها كل من D .P. بوير و E .J. ووكر عن بحوثهما حول كيفية قيام الإنزيم المعروف بـ « ATP synthase أ ت ف سنتاز ، بعمله محفزا إلى تشكيل ثلاثي فسفات الأدينوزين (ATP) منثنائي فسفات الأدينوزين (ADP).
إن تحول أحد هذين المركبين إلى الآخر وبالعكس، هو أمر أساسي من أجل استمرار تزويد الخلية بما تحتاج إليه من طاقة. فعند تحطم رابطة من روابط الفسفات العالية الطاقة في المركب ATP (وتحوله إلى المركب ADP)، يتحرر مقدار من الطاقة يعمل على إنجاز مهام مثل تقلص العضلات، أو نقل الأيونات عبر غشاء الخلية، أو اصطناع مركبات جديدة. وتحول الخلية ثانية المركب ADP إلى المركب ATP بإعادة تشكيل رابطة فسفات ثالثة فيه بمساعدة الإنزيم سنتاز ATP.
تركزت أبحاث بولز التي بدأها منذ الخمسينات، على دراسة آلية تشكل المركب ATP بمساعدة هذا الإنزيم الذي يتشكل من عدد من الوحدات الفرعية (3) التي عينها بوير، تقوم بعملها على نحو يشبه عمل دواليب المسننات، حيث ترتبط أولاً بالمركب ADP وبمجموعة فسفاتية، ثم تتمخض عن المركب ATP. وقد أسهمت جهود ووكر، لإيضاح البنية الثلاثية الأبعاد لهذا الإنزيم في التحقق من هذه الآلية بصورة حاسمة عام 1994.
أما نصف الجائزة الآخر، فكان من نصيب C .J. سكو لاكتشافه، عام 1957، إنزيم الأدينوزين ثلاثي الفسفاتاز المحفَّز بالصوديوم والبوتاسيوم (وهو إنزيم يحفز حلمهة ثلاثي فسفات الأدينوزين، ومختصره: Na+, K+-ATPase). يحطم هذا البروتين روابط المركب ATP، ويستخدم الطاقة المحررة لنقل أيونات الصوديوم و البوتاسيوم عبر الأغشية الخلوية محافظًَا على التوازن الذاتي داخل الخلية. لقد كان سكو باكتشافه هذا، أول من تعرف إنزيما يتحكم في حركة الأيونات عبر الغشاء الخلوي. وقد تم لاحقًا تعرّف ما صار يسمى «بالمضخة الأيونية» ion pump ، التي ما لبثت أن غدت هدف العاملين في الصناعة الدوائية بسبب دورها في تنظيم السيرورات الحيوية بصورة منهجية. فالعقاقير المستخدمة حاليًا في معالجة القرحة المعدية مثلاً، تعمل من خلال تدخلها بعمل المضخة الأيونية التي تتحكم في تحرير حمض كلور الماء وإطلاقه في المعدة.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
الخصائص الكيميائية
Salts of ATP can be isolated as colorless solids.[2]
ATP is stable in aqueous solutions between pH 6.8 and 7.4, in the absence of catalysts. At more extreme pHs, it rapidly hydrolyses to ADP and phosphate. Living cells maintain the ratio of ATP to ADP at a point ten orders of magnitude from equilibrium, with ATP concentrations fivefold higher than the concentration of ADP.[3][4] In the context of biochemical reactions, the P-O-P bonds are frequently referred to as high-energy bonds.[5]
The hydrolysis of ATP into ADP and inorganic phosphate releases 30.5 kJ/mol of enthalpy, with a change in free energy of 3.4 kJ/mol.[6] The energy released by cleaving either a phosphate (Pi) or pyrophosphate (PPi) unit from ATP at standard state of 1 M are:[7]
- ATP + H 2O → ADP + Pi ΔG° = −30.5 kJ/mol (−7.3 kcal/mol)
- ATP + H 2O → AMP + PPi ΔG° = −45.6 kJ/mol (−10.9 kcal/mol)
These abbreviated equations can be written more explicitly (R = adenosyl):
- [RO-P(O)2-O-P(O)2-O-PO3]4− + H 2O → [RO-P(O)2-O-PO3]3− + [PO4]3− + 2 H+
- [RO-P(O)2-O-P(O)2-O-PO3]4− + H 2O → [RO-PO3]2− + [O3P-O-PO3]4− + 2 H+
تنفس لاهوائي
- C6H12O6 2CH3CH(OH)COOH + 2 ATP
تجديد ATP بواسطة nucleoside diphosphate kinases
ATP can also be synthesized through several so-called "replenishment" reactions catalyzed by the enzyme families of nucleoside diphosphate kinases (NDKs), which use other nucleoside triphosphates as a high-energy phosphate donor, and the ATP:guanido-phosphotransferase family, which uses creatine.
انتاج ATP أثناء التمثيل الضوئي
which directly implies this equation:
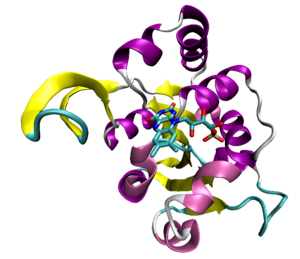
الارتباط بالپروتينات
انظر أيضاً
- Adenosine diphosphate (ADP)
- Adenosine monophosphate (AMP)
- Cyclic adenosine monophosphate (cAMP)
- ATPases
- ATP hydrolysis
- Citric acid cycle (also called the Krebs cycle or TCA cycle)
- Phosphagen
- Nucleotide exchange factor
- Mitochondria
- Photophosphorylation
المصادر
- ^ Knowles JR (1980). "Enzyme-catalyzed phosphoryl transfer reactions". Annu. Rev. Biochem. 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- ^ قالب:Merck13th
- ^ Ferguson, S. J.; Nicholls, David; Ferguson, Stuart (2002). Bioenergetics 3 (3rd ed.). San Diego, CA: Academic. ISBN 978-0-12-518121-1.
- ^ Berg, J. M.; Tymoczko, J. L.; Stryer, L. (2003). Biochemistry. New York, NY: W. H. Freeman. p. 376. ISBN 978-0-7167-4684-3.
- ^ Chance, B.; Lees, H.; Postgate, J. G. (1972). "The Meaning of "Reversed Electron Flow" and "High Energy Electron" in Biochemistry". Nature. 238 (5363): 330–331. doi:10.1038/238330a0. PMID 4561837.
- ^ Gajewski, E.; Steckler, D.; Goldberg, R. (1986). "Thermodynamics of the hydrolysis of adenosine 5′-triphosphate to adenosine 5′-diphosphate" (PDF). J. Biol. Chem. 261 (27): 12733–12737. PMID 3528161. Archived (PDF) from the original on 2007-09-27. Retrieved 2006-12-27.
- ^ Berg, Jeremy M.; Tymoczko, John L.; Stryer, Lubert (2007). Biochemistry (6th ed.). New York, NY: W. H. Freeman. p. 413. ISBN 978-0-7167-8724-2.
وصلات خارجية
- ECHA InfoCard ID from Wikidata
- Articles containing unverified chemical infoboxes
- Short description is different from Wikidata
- Articles with hatnote templates targeting a nonexistent page
- Articles that show a Medicine navs template
- Cellular respiration
- Exercise physiology
- Nucleotides
- Coenzymes
- كيمياء حيوية
- بذرة كيمياء



![{\displaystyle {\frac {cyt~c_{red}}{cyt~c_{ox}}}=\left({\frac {[NADH]}{[NAD]^{+}}}\right)^{\frac {1}{2}}\left({\frac {[ADP][P_{i}]}{[ATP]}}\right)K_{eq}}](https://www.marefa.org/api/rest_v1/media/math/render/svg/d328de9a1c0f26261ba3f87c6f7a25701a71f955)